2025中考九年级化学金属材料的性质与应用专题复习课件
文档属性
| 名称 | 2025中考九年级化学金属材料的性质与应用专题复习课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-05 19:17:44 | ||
图片预览











文档简介
(共37张PPT)
2025中考化学专题复习
金属材料的性质与应用
内容标准
1.知道大多数金属在自然界中是以金属矿物形式存在的,体会化学 方法在金属冶炼中的重要性。
2.知道金属具有一些共同的物理性质,通过实验探究等活动认识常见金属的主要化学性质及金属活动性顺序。
3.知道在金属中加入其他元素形成合金可以改变金属材料的性能。
4.了解金属、金属材料在生产生活和社会发展中的重要作用。
5.以铁生锈为例,了解防止金属腐蚀的常用方法。
6.了解废弃金属对环境的影响及金属回收再利用的价值。
课程简介
“金属材料的性质与应用”是初中化学的重要学习内容,也是中考常考知识点。本课程将从金属的物理性质、化学性质及实际应用三个方面展开,帮助学生建立对金属材料的系统认识。中考命题常结合生活实例(如铁锅生锈、铜制导线、铝合金门窗)考查金属特性及其应用原理。
学生常见问题
对金属共性的理解不全面(如仅关注导电性而忽略导热性、延展性);混淆金属的化学性质(如铁与稀盐酸、稀硫酸反应,但铜不反应);对金属锈蚀条件(如铁需同时接触水和氧气)及防护方法(刷漆、镀层)表述不准确;在生活应用题中难以将金属性质与实际用途(如铝制易拉罐、金制饰品)合理关联。复习需帮助学生梳理知识脉络,强化应用能力,提升解题技巧。
人教版
鲁科版
沪教版
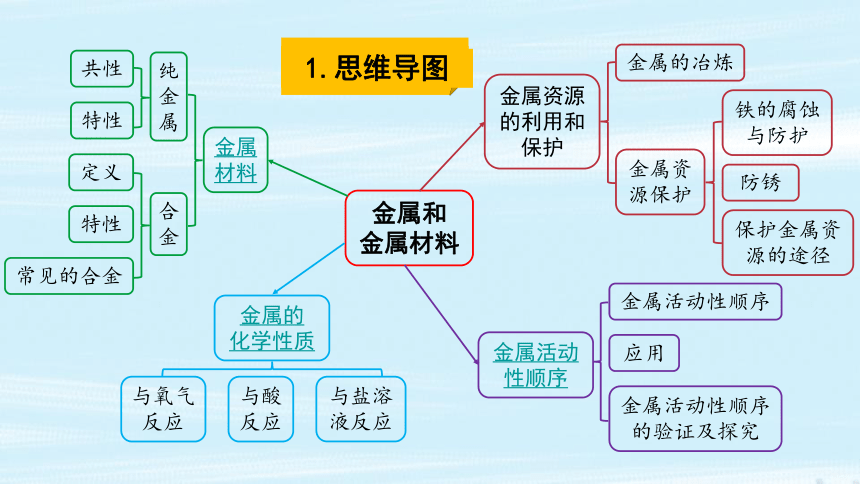
1.思维导图
2.考点梳理
3.真题精选
目 录
1.思维导图
金属和 金属材料
与酸反应
与盐溶液反应
与氧气反应
金属活动性顺序
金属活动性顺序 的验证及探究
应用
金属材料
金属的 化学性质
金属活动性顺序
金属资源的利用和保护
纯金属
合金
定义
常见的合金
共性
特性
特性
金属的冶炼
金属资源保护
铁的腐蚀与防护
防锈
保护金属资源的途径
一、金属材料
纯金属
共性
性质 有光泽 ________性 ________性 ________性
用途举例 银制作装饰品 铁制作炊具 铜制作导线 铝制作铝箔
颜色:铁、铝等大多数金属呈银白色,而铜呈______色,金呈
____色
特性
导热
导电
延展
红
黄
2.考点梳理
一、金属材料
a.抗腐蚀性能好,被广泛用于火箭、导弹和航天器等
b.与人体具有很好的相容性,可用来制造人造骨
合金
定义:在纯金属中加热熔合某些金属或非金属制得的具有金属特征的物质
特性:合金与组成它们的纯金属相比,强度更______、硬度更______、熔点
更______、抗腐蚀性更______
常见的合金
铁合金
生铁:含碳量2%~4.3%
钢:含碳量0.03%~2%
两者性能不同的主要原因是_____________
钛合金
其他合金:不锈钢、锰钢、黄铜、青铜、白铜、焊锡、硬铝、18K
黄金等
高
低
含碳量不同
大
强
二、金属的化学性质
与氧气
反应
通式:金属+氧气→金属氧化物
举例
铝:常温下,铝与氧气反应,表面生成一层____________________,从而
阻止铝进一步氧化;用化学方程式表示铝制品有很好的抗腐蚀性能的
原因:______________________
铁丝:_______________________(写化学方程式,后同),现象:________
_____________________________________________
铜丝:_______________________,现象:____________________
金:最不活泼,即使在高温时也不与氧气反应,即“真金不怕火炼”
致密的氧化铝薄膜
4Al+3O2 === 2Al2O3
3Fe+2O2 Fe3O4
2Cu+O2 2CuO
铜丝表面变黑
剧烈燃
烧,火星四射,生成黑色固体,放出大量的热
二、金属的化学性质
与酸
反应
通式:金属+酸(稀盐酸、稀硫酸)→盐+氢气
条件:金属在活动性顺序里必须排在氢之前
举例
铁:____________________________(稀硫酸),现象:_________________
__________________________________________
镁:__________________________(稀盐酸)
铝:________________________________(稀硫酸)
锌:__________________________(稀盐酸)
现象:固体逐渐溶解,有气泡产生
金属与酸反应的图像
Fe+H2SO4=== FeSO4+H2↑
固体逐渐溶解,有气泡产生,溶液由无色变为浅绿色
Mg+2HCl === MgCl2+H2↑
2Al+3H2SO4 === Al2(SO4)3+3H2↑
Zn+2HCl=== ZnCl2+H2↑
铁与硫酸铜:_____________________________,现象:_______________
________________________________
铜与硝酸银:_________________________________,现象:___________
___________________________________
铝与硫酸铜:_________________________________,现象:___________
_________________________________
二、金属的化学性质
与盐溶
液反应
通式:金属+盐→新盐+新金属
条件:在金属活动性顺序中,“前置后(K、Ca、Na除外),盐可溶”
举例
Fe+CuSO4 === FeSO4+Cu
铁表面有红色固体析出,溶液由蓝色变为浅绿色
Cu+2AgNO3 === Cu(NO3)2+2Ag
铜表面有银白色固体析出,溶液由无色变为蓝色
2Al+3CuSO4 === Al2(SO4)3+3Cu
铝表面有红色固体析出,溶液由蓝色变为无色
三、金属活动性顺序
金属活动性顺序:
a.判断某些置换反应能否发生:位于_________前面的金属能置换出稀盐酸、
稀硫酸中的氢;位于________的金属能把位于_______的金属从它们的化合物溶液里置换出来(K、Ca、Na除外)
b.判断金属与盐溶液反应后滤液、滤渣的成分
c.金属活动性顺序的验证及探究
应用
Al
Fe
Cu
Ag
强
减弱
氢(或H)
前面
后面
四、金属资源的利用和保护
金属资源保护
铁的腐蚀与防护
铁钉生锈的实质:铁钉与空气中的______________等发生化学反应生成
铁锈(主要成分是Fe2O3·xH2O)
铁钉生锈条件的探究
除铁锈方法
物理方法:用砂纸打磨等
化学方法:用_________________除去,发生反应的化学方程
式为________________________________________
____________________________________________
氧气和水蒸气
稀硫酸(或稀盐酸)
(或Fe2O3+6HCl === 2FeCl3+3H2O,与前一空对应)
Fe2O3+3H2SO4 === Fe2(SO4)3+3H2O
a.防止金属腐蚀;
b.回收利用废旧金属;
c.有计划、合理地开采金属矿物;
d.寻找金属的代用品等
四、金属资源的利用和保护
金属资源保护
防锈
原理:隔绝_______________或_______________________
措施
保持铁制品表面洁净干燥,如用过的菜刀擦干净
在铁制品表面涂保护膜,如_______________、_______________等
改变铁的内部结构,制成合金,如不锈钢等
保护金属资源的途径
空气(或氧气)
水蒸气(与前一空可互换)
涂油(合理即可)
刷漆(合理即可)
3.真题精选
(2024 威海)14.应用广泛的金属(13分)
(1)国宝中的金属
国宝“鎏金铁芯铜龙”是以铁铸造内芯,铁上包铜,外层鎏金(鎏金是一种金属加工工艺,经过鎏金处理后,金属表面会覆盖一层金)。整个龙身飞扬舒展,反映了唐代高超的铸造工艺。
①国宝历经千年,出土后表面仍金光灿灿,原因是______。
②工业上以赤铁矿为原料炼铁,原理是______(用化学方程式表示)。
③《淮南万毕术》中记载“曾青得铁则化为铜,外化而内不化”,“曾青”即硫酸铜溶液,该炼铜反应的原理是______(用化学方程式表示),反应中有效作用的微粒为______(用符号表示)。“外化而内不化”的原因是______。
(2)生活中的金属
铝制易拉罐主要由铝合金制成,除铝外,还含有锌、铜、硅等。
①请用化学方法证明:罐体的金属材料是铝合金而不是纯铝(提供药品:已打磨的罐体金属片,其 他仪器、药品自选)。 你的方案及预期现象是______。
②合金与纯金属相比较,性质存在差异。对比分析图1,从微观角度解释原因______(答两条)。
③合金中元素的配比不同会导致性能有差异。根据实际需求,罐盖硬度应大于罐体硬度。结合图2分析,生产易拉罐时,罐盖中铜元素的含量应______(填“大于”“小于”或“等于”)罐体中铜元素的含量。
3.真题精选
④为比较铝、铜、锌的金属活动性,进行下图实验,则a、b、c可以选用的物质是______。
(3)航天中的金属
中国航天事业的成就令世界瞩目,火箭是航天飞行器的运载工具。
①运载火箭外壳材料也为铝合金。铝合金做外壳材料,具备的优良性能是______(答一条)。
②运载火箭固体推进剂的主要组分为高氯酸铵和铝粉。其中高氯酸铵(NH4ClO4)是供氧剂,氯元素的化合价是______。铝粉燃烧的化学方程式______,反应过程中能量转化形式是______。
3.真题精选
3.真题精选
(2024 济南市)
1. 中华传统文化中包含很多化学知识。下列对文献内容解释错误的是
( )
A. 《神农本草经》记载“水银…熔化(加热)还复为丹”——水银指金属汞
B. 《天工开物》:“每金七厘,造方寸金一千片”——金的延展性强
C. “千淘万漉虽辛苦,吹尽狂沙始到金”——金在自然界以单质形式存在
D. 《吕氏春秋》:“金(指铜)柔锡柔,合两柔则刚”——铜锡合金的硬度比铜、锡小
D
实战训练
2. 下列物质:①MgSO4、②FeCl3、③CuSO4、④ZnCl2,能够通过金属与稀盐酸或稀硫酸反应生成的是( )
A. ①② B. ③④ C. ②③ D. ①④
3. 波尔多液由硫酸铜、生石灰加水配制而成。在烧杯中加入少量波尔多液,向其中加入过量稀盐酸,待溶液澄清后,再放入一个表面光亮的铁钉,下列实验现象或结论错误的是( )
A. 铁钉表面有红色固体析出 B. 铁钉表面有金属钙析出
C. 有无色气泡放出 D. 该实验说明铁的金属活动性比铜的强
D
B
4. 锰 (Mn)在钢铁、电池等领域有广泛应用,其金属活动性介于锌和铁之间。以下对金属锰化学性质的预测,不合理的是( )
A. 能在氧气中燃烧
B. 能与氢氧化钠溶液反应
C. 能与稀盐酸反应
D. 能与硫酸铜溶液反应
B
5. 废旧手机中含有贵金属金 (Au),如图是回收Au的简略流程图,下列说法错误的是( )
A. 粉碎可以增大反应物的接触面积,加快反应速率
B. 滤液 a中的阳离子是 Fe2+和 Zn2+
C. 在滤液 b中加入过量的氢
氧化钠溶液,会产生蓝色沉淀
D. 由上述过程可知,Zn、Au、
Cu三种金属的活动性顺序为
Zn>Cu>Au
B
6. 非遗项目“打铁花”不仅有“火树银花落,万点星辰开”的古老浪漫,而且蕴含着丰富的化学原理。
(1)“打铁花”就是将生铁熔化后的铁水打向空中,形成铁花。请用化学方程式表示其中的主要原理________________________。
(2)表演者将铁水打得又高又散的主要原因是________________________
_____________。
(3)从合金的性质角度分析:打铁花用生铁而不用纯铁的依据是________
_______。
3Fe+2O2 Fe3O4
增大铁与氧气的接触面积,
使反应更充分
生铁熔
点更低
7. 小明同学对金属的有关化学性质进行梳理和总结。请完成下列问题。
(1)如图1,将一锌片投入稀硫酸中, 观察到的现象是________________,该反应过程溶液中增加的粒子是_______(用符号表示),溶液的pH_____
_____(填“逐渐减小” “逐渐增大”或“不变”),反应的化学方程式为__________________________。
图1
锌表面产生气泡
Zn2+
逐渐
增大
Zn+H2SO4===ZnSO4+H2↑
(2)图2是将铜丝插入硝酸银溶液中反应的微观示意图,从微观粒子变化的角度分析该反应的实质是_______________________________________
_______,反应过程中溶液的质量变化是_______(填“增大”“减小”或“不变”)。
图2
铜原子变成铜离子,银离子变成银原子(合
理即可)
减小
8. 下列各组药品不能验证铁、铜、银三种金属活动性强弱的是( )
A. CuSO4溶液 Fe Ag
B. FeSO4溶液 稀H2SO4 Cu Ag
C. AgNO3溶液 稀H2SO4 Fe Cu
D. AgNO3溶液 FeSO4溶液 Cu
B
9. 向含有硝酸银和硝酸铜的废液中加入一定质量的锌粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得滤渣的质量与加入锌粉的质量相等。下列说法不正确的是( )
A. 滤液可能呈蓝色
B. 滤渣中至少含有两种物质
C. 向滤渣中滴加稀盐酸,一定没有气泡产生
D. 向滤液中滴加稀盐酸,一定没有白色沉淀生成
C
10. 《天工开物》中对钢铁冶炼过程有如下记载。有关说法正确的是( )
A. “垦土拾锭”:铁元素是地壳中含量最高的金属元素
B. “淘洗铁砂”:铁矿石(主要成分为Fe2O3)能溶于水
C. “生熟炼铁”:冶炼铁过程中发生了化学变化
D. “锤锻成钢”:生铁高温锻打成钢,碳元素含量升高
C
11. 用CO还原CuO时,向装置中通入CO,一段时间后加热。
(1)可观察到硬质玻璃管中发生的现象为_____________________。
(2)该实验中对尾气进行处理的目的是_________________。
黑色固体逐渐变成红色
防止CO污染空气
拓展设问
(3)装置中发生反应的化学方程式为________________________。
(4)若将CO换为木炭进行实验,反应结束后,发现试管中仍有少量黑色固体粉末,可能是木炭和氧化铜中的一种
或两种,小组同学取黑色粉末,向其中加
入足量稀盐酸,观察到_________________
____________,说明黑色固体粉末是氧化铜。
CO+CuO Cu+CO2
黑色粉末全部溶解,
溶液变为蓝色
12.回收废旧金属:
【咨询专家】同学们与专家交流,了解到处理金属垃圾时首先要进行分类,然后按照不同金属的性质进行直接改造或回炉重铸。
【设计实验】为实现资源再利用,节约成本。化学小组的同学从某化工厂收集到排放的废液,欲从该废液
中(主要含ZnSO4、FeSO4和CuSO4)
回收金属铜和铁,并设计实验流程
如图所示。
(1)流程中的试剂X是______(填试剂名称)。
锌粉
(2)步骤②中加入过量稀硫酸时观察到的现象是______________________
___________________。
(3)步骤③中发生反应的化学方程式
为____________________________
___________________________。
(4)该流程的价值在于___________
_____________________________。
部分固体溶解,有气泡产
生,溶液变成浅绿色
Zn+FeSO4===ZnSO4+Fe(或
Zn+H2SO4 ===ZnSO4+H2↑)
节约金属资
源,实现废物再利用(合理即可)
备考建议
1.构建思维导图,强化知识网络
2.规范答题语言,避免细节失分
3.模拟实战,限时训练
4.高频错题,重点突破
5.关注热点、教材变化点
谢谢大家
2025中考化学专题复习
金属材料的性质与应用
内容标准
1.知道大多数金属在自然界中是以金属矿物形式存在的,体会化学 方法在金属冶炼中的重要性。
2.知道金属具有一些共同的物理性质,通过实验探究等活动认识常见金属的主要化学性质及金属活动性顺序。
3.知道在金属中加入其他元素形成合金可以改变金属材料的性能。
4.了解金属、金属材料在生产生活和社会发展中的重要作用。
5.以铁生锈为例,了解防止金属腐蚀的常用方法。
6.了解废弃金属对环境的影响及金属回收再利用的价值。
课程简介
“金属材料的性质与应用”是初中化学的重要学习内容,也是中考常考知识点。本课程将从金属的物理性质、化学性质及实际应用三个方面展开,帮助学生建立对金属材料的系统认识。中考命题常结合生活实例(如铁锅生锈、铜制导线、铝合金门窗)考查金属特性及其应用原理。
学生常见问题
对金属共性的理解不全面(如仅关注导电性而忽略导热性、延展性);混淆金属的化学性质(如铁与稀盐酸、稀硫酸反应,但铜不反应);对金属锈蚀条件(如铁需同时接触水和氧气)及防护方法(刷漆、镀层)表述不准确;在生活应用题中难以将金属性质与实际用途(如铝制易拉罐、金制饰品)合理关联。复习需帮助学生梳理知识脉络,强化应用能力,提升解题技巧。
人教版
鲁科版
沪教版
1.思维导图
2.考点梳理
3.真题精选
目 录
1.思维导图
金属和 金属材料
与酸反应
与盐溶液反应
与氧气反应
金属活动性顺序
金属活动性顺序 的验证及探究
应用
金属材料
金属的 化学性质
金属活动性顺序
金属资源的利用和保护
纯金属
合金
定义
常见的合金
共性
特性
特性
金属的冶炼
金属资源保护
铁的腐蚀与防护
防锈
保护金属资源的途径
一、金属材料
纯金属
共性
性质 有光泽 ________性 ________性 ________性
用途举例 银制作装饰品 铁制作炊具 铜制作导线 铝制作铝箔
颜色:铁、铝等大多数金属呈银白色,而铜呈______色,金呈
____色
特性
导热
导电
延展
红
黄
2.考点梳理
一、金属材料
a.抗腐蚀性能好,被广泛用于火箭、导弹和航天器等
b.与人体具有很好的相容性,可用来制造人造骨
合金
定义:在纯金属中加热熔合某些金属或非金属制得的具有金属特征的物质
特性:合金与组成它们的纯金属相比,强度更______、硬度更______、熔点
更______、抗腐蚀性更______
常见的合金
铁合金
生铁:含碳量2%~4.3%
钢:含碳量0.03%~2%
两者性能不同的主要原因是_____________
钛合金
其他合金:不锈钢、锰钢、黄铜、青铜、白铜、焊锡、硬铝、18K
黄金等
高
低
含碳量不同
大
强
二、金属的化学性质
与氧气
反应
通式:金属+氧气→金属氧化物
举例
铝:常温下,铝与氧气反应,表面生成一层____________________,从而
阻止铝进一步氧化;用化学方程式表示铝制品有很好的抗腐蚀性能的
原因:______________________
铁丝:_______________________(写化学方程式,后同),现象:________
_____________________________________________
铜丝:_______________________,现象:____________________
金:最不活泼,即使在高温时也不与氧气反应,即“真金不怕火炼”
致密的氧化铝薄膜
4Al+3O2 === 2Al2O3
3Fe+2O2 Fe3O4
2Cu+O2 2CuO
铜丝表面变黑
剧烈燃
烧,火星四射,生成黑色固体,放出大量的热
二、金属的化学性质
与酸
反应
通式:金属+酸(稀盐酸、稀硫酸)→盐+氢气
条件:金属在活动性顺序里必须排在氢之前
举例
铁:____________________________(稀硫酸),现象:_________________
__________________________________________
镁:__________________________(稀盐酸)
铝:________________________________(稀硫酸)
锌:__________________________(稀盐酸)
现象:固体逐渐溶解,有气泡产生
金属与酸反应的图像
Fe+H2SO4=== FeSO4+H2↑
固体逐渐溶解,有气泡产生,溶液由无色变为浅绿色
Mg+2HCl === MgCl2+H2↑
2Al+3H2SO4 === Al2(SO4)3+3H2↑
Zn+2HCl=== ZnCl2+H2↑
铁与硫酸铜:_____________________________,现象:_______________
________________________________
铜与硝酸银:_________________________________,现象:___________
___________________________________
铝与硫酸铜:_________________________________,现象:___________
_________________________________
二、金属的化学性质
与盐溶
液反应
通式:金属+盐→新盐+新金属
条件:在金属活动性顺序中,“前置后(K、Ca、Na除外),盐可溶”
举例
Fe+CuSO4 === FeSO4+Cu
铁表面有红色固体析出,溶液由蓝色变为浅绿色
Cu+2AgNO3 === Cu(NO3)2+2Ag
铜表面有银白色固体析出,溶液由无色变为蓝色
2Al+3CuSO4 === Al2(SO4)3+3Cu
铝表面有红色固体析出,溶液由蓝色变为无色
三、金属活动性顺序
金属活动性顺序:
a.判断某些置换反应能否发生:位于_________前面的金属能置换出稀盐酸、
稀硫酸中的氢;位于________的金属能把位于_______的金属从它们的化合物溶液里置换出来(K、Ca、Na除外)
b.判断金属与盐溶液反应后滤液、滤渣的成分
c.金属活动性顺序的验证及探究
应用
Al
Fe
Cu
Ag
强
减弱
氢(或H)
前面
后面
四、金属资源的利用和保护
金属资源保护
铁的腐蚀与防护
铁钉生锈的实质:铁钉与空气中的______________等发生化学反应生成
铁锈(主要成分是Fe2O3·xH2O)
铁钉生锈条件的探究
除铁锈方法
物理方法:用砂纸打磨等
化学方法:用_________________除去,发生反应的化学方程
式为________________________________________
____________________________________________
氧气和水蒸气
稀硫酸(或稀盐酸)
(或Fe2O3+6HCl === 2FeCl3+3H2O,与前一空对应)
Fe2O3+3H2SO4 === Fe2(SO4)3+3H2O
a.防止金属腐蚀;
b.回收利用废旧金属;
c.有计划、合理地开采金属矿物;
d.寻找金属的代用品等
四、金属资源的利用和保护
金属资源保护
防锈
原理:隔绝_______________或_______________________
措施
保持铁制品表面洁净干燥,如用过的菜刀擦干净
在铁制品表面涂保护膜,如_______________、_______________等
改变铁的内部结构,制成合金,如不锈钢等
保护金属资源的途径
空气(或氧气)
水蒸气(与前一空可互换)
涂油(合理即可)
刷漆(合理即可)
3.真题精选
(2024 威海)14.应用广泛的金属(13分)
(1)国宝中的金属
国宝“鎏金铁芯铜龙”是以铁铸造内芯,铁上包铜,外层鎏金(鎏金是一种金属加工工艺,经过鎏金处理后,金属表面会覆盖一层金)。整个龙身飞扬舒展,反映了唐代高超的铸造工艺。
①国宝历经千年,出土后表面仍金光灿灿,原因是______。
②工业上以赤铁矿为原料炼铁,原理是______(用化学方程式表示)。
③《淮南万毕术》中记载“曾青得铁则化为铜,外化而内不化”,“曾青”即硫酸铜溶液,该炼铜反应的原理是______(用化学方程式表示),反应中有效作用的微粒为______(用符号表示)。“外化而内不化”的原因是______。
(2)生活中的金属
铝制易拉罐主要由铝合金制成,除铝外,还含有锌、铜、硅等。
①请用化学方法证明:罐体的金属材料是铝合金而不是纯铝(提供药品:已打磨的罐体金属片,其 他仪器、药品自选)。 你的方案及预期现象是______。
②合金与纯金属相比较,性质存在差异。对比分析图1,从微观角度解释原因______(答两条)。
③合金中元素的配比不同会导致性能有差异。根据实际需求,罐盖硬度应大于罐体硬度。结合图2分析,生产易拉罐时,罐盖中铜元素的含量应______(填“大于”“小于”或“等于”)罐体中铜元素的含量。
3.真题精选
④为比较铝、铜、锌的金属活动性,进行下图实验,则a、b、c可以选用的物质是______。
(3)航天中的金属
中国航天事业的成就令世界瞩目,火箭是航天飞行器的运载工具。
①运载火箭外壳材料也为铝合金。铝合金做外壳材料,具备的优良性能是______(答一条)。
②运载火箭固体推进剂的主要组分为高氯酸铵和铝粉。其中高氯酸铵(NH4ClO4)是供氧剂,氯元素的化合价是______。铝粉燃烧的化学方程式______,反应过程中能量转化形式是______。
3.真题精选
3.真题精选
(2024 济南市)
1. 中华传统文化中包含很多化学知识。下列对文献内容解释错误的是
( )
A. 《神农本草经》记载“水银…熔化(加热)还复为丹”——水银指金属汞
B. 《天工开物》:“每金七厘,造方寸金一千片”——金的延展性强
C. “千淘万漉虽辛苦,吹尽狂沙始到金”——金在自然界以单质形式存在
D. 《吕氏春秋》:“金(指铜)柔锡柔,合两柔则刚”——铜锡合金的硬度比铜、锡小
D
实战训练
2. 下列物质:①MgSO4、②FeCl3、③CuSO4、④ZnCl2,能够通过金属与稀盐酸或稀硫酸反应生成的是( )
A. ①② B. ③④ C. ②③ D. ①④
3. 波尔多液由硫酸铜、生石灰加水配制而成。在烧杯中加入少量波尔多液,向其中加入过量稀盐酸,待溶液澄清后,再放入一个表面光亮的铁钉,下列实验现象或结论错误的是( )
A. 铁钉表面有红色固体析出 B. 铁钉表面有金属钙析出
C. 有无色气泡放出 D. 该实验说明铁的金属活动性比铜的强
D
B
4. 锰 (Mn)在钢铁、电池等领域有广泛应用,其金属活动性介于锌和铁之间。以下对金属锰化学性质的预测,不合理的是( )
A. 能在氧气中燃烧
B. 能与氢氧化钠溶液反应
C. 能与稀盐酸反应
D. 能与硫酸铜溶液反应
B
5. 废旧手机中含有贵金属金 (Au),如图是回收Au的简略流程图,下列说法错误的是( )
A. 粉碎可以增大反应物的接触面积,加快反应速率
B. 滤液 a中的阳离子是 Fe2+和 Zn2+
C. 在滤液 b中加入过量的氢
氧化钠溶液,会产生蓝色沉淀
D. 由上述过程可知,Zn、Au、
Cu三种金属的活动性顺序为
Zn>Cu>Au
B
6. 非遗项目“打铁花”不仅有“火树银花落,万点星辰开”的古老浪漫,而且蕴含着丰富的化学原理。
(1)“打铁花”就是将生铁熔化后的铁水打向空中,形成铁花。请用化学方程式表示其中的主要原理________________________。
(2)表演者将铁水打得又高又散的主要原因是________________________
_____________。
(3)从合金的性质角度分析:打铁花用生铁而不用纯铁的依据是________
_______。
3Fe+2O2 Fe3O4
增大铁与氧气的接触面积,
使反应更充分
生铁熔
点更低
7. 小明同学对金属的有关化学性质进行梳理和总结。请完成下列问题。
(1)如图1,将一锌片投入稀硫酸中, 观察到的现象是________________,该反应过程溶液中增加的粒子是_______(用符号表示),溶液的pH_____
_____(填“逐渐减小” “逐渐增大”或“不变”),反应的化学方程式为__________________________。
图1
锌表面产生气泡
Zn2+
逐渐
增大
Zn+H2SO4===ZnSO4+H2↑
(2)图2是将铜丝插入硝酸银溶液中反应的微观示意图,从微观粒子变化的角度分析该反应的实质是_______________________________________
_______,反应过程中溶液的质量变化是_______(填“增大”“减小”或“不变”)。
图2
铜原子变成铜离子,银离子变成银原子(合
理即可)
减小
8. 下列各组药品不能验证铁、铜、银三种金属活动性强弱的是( )
A. CuSO4溶液 Fe Ag
B. FeSO4溶液 稀H2SO4 Cu Ag
C. AgNO3溶液 稀H2SO4 Fe Cu
D. AgNO3溶液 FeSO4溶液 Cu
B
9. 向含有硝酸银和硝酸铜的废液中加入一定质量的锌粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得滤渣的质量与加入锌粉的质量相等。下列说法不正确的是( )
A. 滤液可能呈蓝色
B. 滤渣中至少含有两种物质
C. 向滤渣中滴加稀盐酸,一定没有气泡产生
D. 向滤液中滴加稀盐酸,一定没有白色沉淀生成
C
10. 《天工开物》中对钢铁冶炼过程有如下记载。有关说法正确的是( )
A. “垦土拾锭”:铁元素是地壳中含量最高的金属元素
B. “淘洗铁砂”:铁矿石(主要成分为Fe2O3)能溶于水
C. “生熟炼铁”:冶炼铁过程中发生了化学变化
D. “锤锻成钢”:生铁高温锻打成钢,碳元素含量升高
C
11. 用CO还原CuO时,向装置中通入CO,一段时间后加热。
(1)可观察到硬质玻璃管中发生的现象为_____________________。
(2)该实验中对尾气进行处理的目的是_________________。
黑色固体逐渐变成红色
防止CO污染空气
拓展设问
(3)装置中发生反应的化学方程式为________________________。
(4)若将CO换为木炭进行实验,反应结束后,发现试管中仍有少量黑色固体粉末,可能是木炭和氧化铜中的一种
或两种,小组同学取黑色粉末,向其中加
入足量稀盐酸,观察到_________________
____________,说明黑色固体粉末是氧化铜。
CO+CuO Cu+CO2
黑色粉末全部溶解,
溶液变为蓝色
12.回收废旧金属:
【咨询专家】同学们与专家交流,了解到处理金属垃圾时首先要进行分类,然后按照不同金属的性质进行直接改造或回炉重铸。
【设计实验】为实现资源再利用,节约成本。化学小组的同学从某化工厂收集到排放的废液,欲从该废液
中(主要含ZnSO4、FeSO4和CuSO4)
回收金属铜和铁,并设计实验流程
如图所示。
(1)流程中的试剂X是______(填试剂名称)。
锌粉
(2)步骤②中加入过量稀硫酸时观察到的现象是______________________
___________________。
(3)步骤③中发生反应的化学方程式
为____________________________
___________________________。
(4)该流程的价值在于___________
_____________________________。
部分固体溶解,有气泡产
生,溶液变成浅绿色
Zn+FeSO4===ZnSO4+Fe(或
Zn+H2SO4 ===ZnSO4+H2↑)
节约金属资
源,实现废物再利用(合理即可)
备考建议
1.构建思维导图,强化知识网络
2.规范答题语言,避免细节失分
3.模拟实战,限时训练
4.高频错题,重点突破
5.关注热点、教材变化点
谢谢大家
同课章节目录
