吉林省通化市梅河口市第五中学2024-2025学年高三下学期模拟预测化学试卷(含答案)
文档属性
| 名称 | 吉林省通化市梅河口市第五中学2024-2025学年高三下学期模拟预测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-05 22:41:53 | ||
图片预览



文档简介
高三化学
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Mg 24 Al 27 S 32 Cl 35.5 Ca 40 Fe 56
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.白山黑水,山美水美人更美,东北这片神奇的黑土地蕴含着无尽的魅力。下列化学知识描述正确的是
A.“雪使山长白,冰消作四江。人参三百里,貂鼠一千双。”人参能够补气强身,安神益智。用人参泡酒或煮汤,属于液-液萃取。
B.“暗河潺潺流溶洞,钟乳石挂如珠帘。”九曲本溪水洞入已经被认证为世界最长水溶洞,其喀斯特地貌的形成过程中涉及到的化学变化只有。
C.“去年元夜时,花市灯如昼。”长春灯会上,那些霓虹灯呈现五彩斑斓的颜色与原子核外电子的跃迁有关,属于吸收光谱。
D.“天苍苍,野茫茫,风吹草低见牛羊。”青草的主要成分水解后可得到葡萄糖。
2.下列化学用语表述错误的是
A.中子数为21的钾的核素符号:
B.HF中的键示意图:
C.某激发态O原子的轨道表示式:
D.用电子式表示的形成过程:
3.下列装置或操作能达到实验目的的是
A.图①:将硫酸铜溶液蒸干制胆矾 B.图②:制备碳酸氢钠
C.图③:检验装置气密性 D.图④:向容量瓶转移溶液
4.下列关于物质结构与性质,用途的说法错误的是
A.Mg有强还原性,可用于钢铁的电化学防护
B.的键能强于,的热稳定性比的高
C.分子中既有氨基又有羧基,是一种两性化合物
D.通过引入有机基团转化为低熔点、易挥发的
5.下列离子方程式正确的是
A.溶液中通入过量
B.向中投入固体:
C.溶于氢碘酸:
D.向硫酸氢钠溶液滴加溶液至完全沉淀:
6.下列反应对应的离子方程式书写正确的是( )
A.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
B.向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2OH2↑+Cl2↑+2OH-
D.将1molCl2通入含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
7.某药物中间体的结构如图,下列说法错误的是
A.分子中有4种官能团
B.分子中有3个手性碳原子
C.此物质有顺反异构体
D.1mol该物质最多消耗3mol
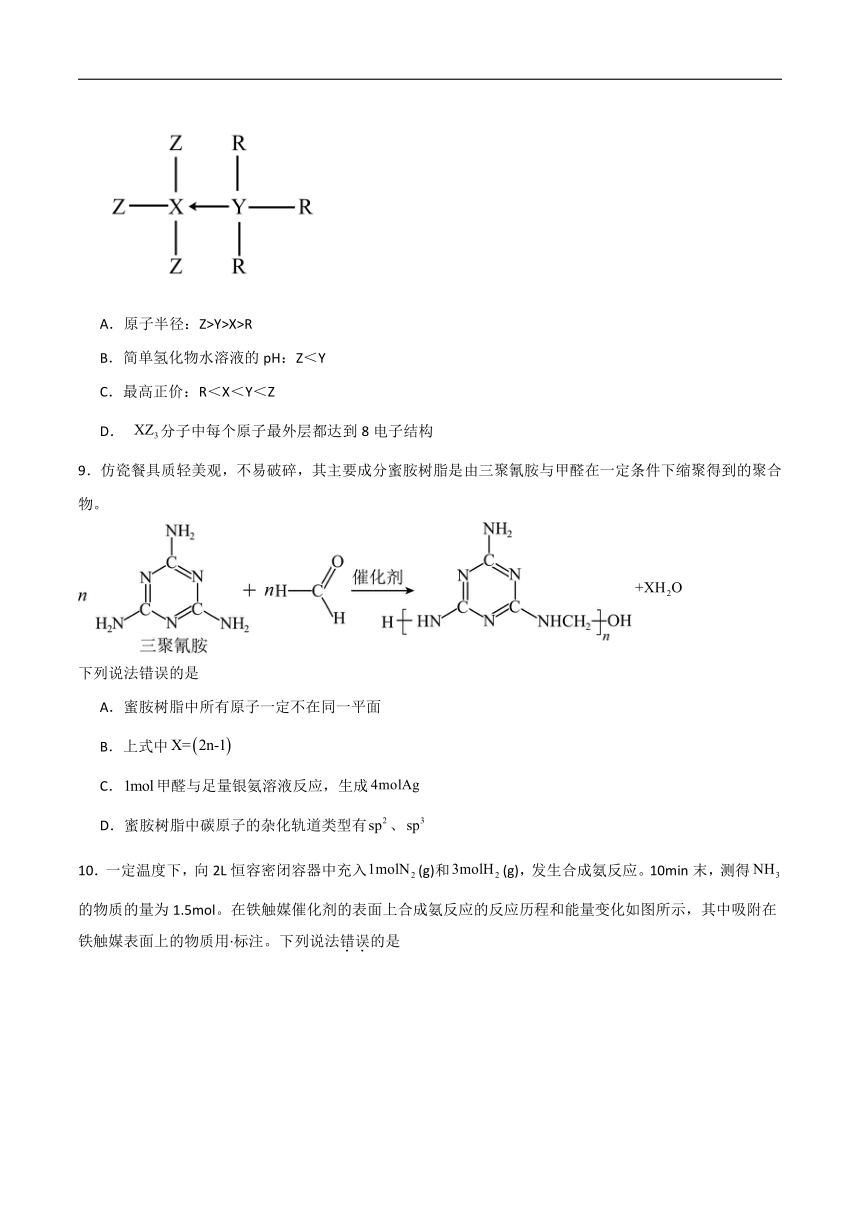
8.短周期主族元素R、X、Y、Z的原子序数依次增大,由这四种元素组成的某化合物的结构式如图所示(←表示单原子提供2个电子形成配位键)。R、X、Y原子最外层电子数之和等于Z原子的电子数。下列说法正确的是
A.原子半径:Z>Y>X>R
B.简单氢化物水溶液的pH:Z<Y
C.最高正价:R<X<Y<Z
D. 分子中每个原子最外层都达到8电子结构
9.仿瓷餐具质轻美观,不易破碎,其主要成分蜜胺树脂是由三聚氰胺与甲醛在一定条件下缩聚得到的聚合物。
下列说法错误的是
A.蜜胺树脂中所有原子一定不在同一平面
B.上式中
C.甲醛与足量银氨溶液反应,生成
D.蜜胺树脂中碳原子的杂化轨道类型有、
10.一定温度下,向2L恒容密闭容器中充入(g)和(g),发生合成氨反应。10min末,测得的物质的量为1.5mol。在铁触媒催化剂的表面上合成氨反应的反应历程和能量变化如图所示,其中吸附在铁触媒表面上的物质用·标注。下列说法错误的是
A.催化剂能改变反应历程和活化能,影响化学反应速率
B.对总反应速率影响最小的步骤的活化能为
C.10min时,
D.内,
11.如图所示,甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是
A.甲池通入CH3OH的电极反应式为CH3OH+6e-+2H2O=CO+8H+
B.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
C.甲池中消耗224 mL(标准状况)O2,此时丙池中理论上产生1.16 g 固体
D.若将乙池电解质溶液换成AgNO3溶液,则可以实现在石墨棒上镀银
12.用硫铁矿(主要成分为FeS2)、软锰矿(主要成分为MnO2)制取高纯度MnO2的工艺流程如图:
下列说法错误的是
A.“酸浸”过程反应的离子方程式为:2FeS2+3MnO2+12H+=4S+3Mn2++2Fe3++6H2O
B.“焙烧”过程中的氧化剂与还原剂的物质的量之比为1∶2
C.锰元素参与了3个氧化还原反应
D.“氧化”过程中将Mn(II)转化为Mn(IV)的氧化剂可选用H2O2
13.某化合物晶胞中相邻的4个As形成四面体结构,晶胞结构如图。下列说法错误的是
A.该化合物的化学式为
B.距离原子最近的原子数目是4
C.元素位于元素周期表中区
D.该晶体的密度为
14.一定条件下,存在可逆反应:。起始状态Ⅰ中有A(s)、B(s)和C(g),经如下图所示过程达到各平衡状态,状态Ⅰ和Ⅲ的固体质量相等。
下列叙述正确的是
A.容器内压强:
B.平衡常数:
C.若体积V(Ⅲ)=2V(Ⅰ),则
D.逆反应的速率:
15.室温下,HR、、三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示、、]随溶液pH变化的关系如图所示。已知相同条件下的溶解度:,下列说法正确的是
A.蒸干溶液可生成晶体 B.X点横坐标为8.2
C.室温下,为 D.调节HR溶液时:
第II卷(非选择题 共55分)
二、非选择题,共4题,共55分。(除标注外,每空2分。)
16.(12分)ZnSO4是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为,还含有少量:、、、、、PbO,、CdO和)制备流程如下:
已知:常温下,部分金属阳离子沉淀的pH如下表。
金属阳离子
开始沉淀pH 6.2 7.4 2.2 7.7 9.1 8.1 3.4
沉淀完全pH 8.2 8.9 3.2 9.7 11.1 10.1 4.7
(1)过滤获得的滤渣①的主要成分为SiO2、CaSO4、PbSO4、 。
(2)加入KMnO4溶液后过滤可以得到和两种沉淀,Fe2+发生反应的离子方程式为 ,常温下,此时溶液pH仍为5,则溶液残留的微量Fe3+的浓度约为 mol/L,
(3)脱完钙和镁之后的ZnSO4滤液中含有少量的K2SO4,ZnSO4的溶解度曲线如图。由滤液④获得的具体操作为:加热浓缩至330K,当 时, ,洗涤烘干。
(4)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有 个,
②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为 。
17.(15分)三氯化钛是一种重要的工业材料,常用于还原偶联反应和烯烃定向聚合的催化剂。实验室常用高温还原制备,实验装置如图所示(部分夹持和加热装置略)。
已知:I.常温下为深紫色固体,是一种强还原剂,易水解;
II.常温下为无色液体,沸点为136℃,易水解。
回答下列问题:
(1)制备。(i)检验装置气密性;(ii)将盛有与碳粉的瓷舟置于管式炉中,打开、,关闭,由口通入;(iii)一段时间后管式炉开始加热,加热至700℃发生反应。
①操作(ii)中先通入一段时间的原因是 。
②管式炉中有生成,发生反应的化学方程式为 ;装置D中碱石灰的作用是 。
(2)制备。(iv)当中液体不再滴下时,停止加热,关闭、,打开,由口先通入一段时间的;(V)加热反应器至1000 1100℃,反应一段时间后,停止加热,继续通入至冷却,关闭。反应器中得到深紫色固体。
①仪器G的名称为 。
②图示装置有一处缺陷会影响产品质量,应如何改进 。
(3)滴定法测定产品纯度。取产品溶于稀盐酸配成待测液,量取于锥形瓶中,用标准液进行滴定。
①产品用稀盐酸溶解配制待测液的原因为 。
②若用做指示剂,判断滴定终点的现象为 ;平行滴定三次,消耗溶液的平均体积为,则产品纯度为 。
18.研究的综合利用具有重要的意义。
Ⅰ.催化重整制氢气
一种与催化重整制取的过程如图1所示。在反应管中加入和催化剂,先通入,待步骤Ⅰ完成后,再将以一定流速通入,并控制温度为,进行步骤Ⅱ。
(1)写出步骤Ⅱ中发生主要反应的化学方程式:________________________________。
(2)步骤Ⅱ中还存在少量副反应:,测得出口处和的流量随时间变化如图2所示。
①时出口处气体流量略高于的原因是_____________________________。
②反应进行后,反应管中仍残留较多,但流量迅速降低,流量升高,可能的原因是_____________________________________________。
Ⅱ.用于烟气脱硝
(3)烟气脱硝相关反应如下:
反应Ⅰ
反应Ⅱ
反应Ⅲ
①反应Ⅲ的___________。
②反应Ⅰ和反应II的平衡常数分别为、,则相同温度下反应Ⅲ的K=___________(用、表示)。
(4)模拟烟气脱硝:一定条件下,将、和按匀速通过催化脱硝反应器,测得去除率和转化率随反应温度的变化如图3所示。
①当温度低于时,的去除率随温度升高而升高,可能原因是_______________________________________________。
②当温度高于时,的去除率随温度升高而降低,可能原因是______________________________________________________。
19.奥司他韦(化合物G)是目前治疗流感的最常用药物之一,其合成方法很多。最近某大学在60min内完成5步反应,并且总收率达到15%,完美地完成了奥司他韦(化合物G)一锅法全合成,其合成路线如下(略去部分试剂和条件,忽略立体化学)。
已知;
HWE反应:
(其中为烃基,为烃基或)
回答下列问题;
(1)A中含氧官能团名称是__________,B的结构简式是__________,
反应①是在三种催化剂(其一为甲酸)共同的作用下发生的,反应的立体选择性非常好,甲酸分子中碳原子的杂化方式是____________________;
(2)D为丙烯酸乙酯衍生物。丙烯酸乙酯有多种同分异构体,同时满足下列条件的有__________种(不考虑立体异构);
①具有与丙烯酸乙酯相同的官能团②核磁共振氢谱有三组峰,且峰面积之比为
其中一种发生水解反应能生成甲醇,其系统命名为__________,写出用其合成有机玻璃(PMMA)的化学方程式_____________________________________;
(3)化合物N可用作医药合成中间体。参考反应②(Michael和HWE的一个串联反应),设计化合物N的合成路线如下(部分反应条件已略去),其中M的结构简式为__________。
(4)反应⑤的反应类型为__________,奥司他韦(化合物G)有__________个手性碳原子。
参考答案
DCDDD CBBBD CDCCB
16.(1) 、
(2)
(3)当析出大量晶体时(1分) 趁热过滤(1分)
(4) 4 正四面体
17.排出装置中的空气,防止对实验造成影响
吸收多余
(2)球形冷凝管(1分) 应在与之间加一个干燥装置
(3)抑制水解 加入最后半滴溶液,溶液颜色突变为红色,且半分钟内不恢复原来的颜色 77.25%
18.答案:(1)(2分)
(2)步骤Ⅱ主反应生成的与的物质的量相等,副反应消耗同时生成(2分);分解生成C和,使浓度降低,生成的C覆盖在催化剂表面,使活性降低(2分)
(3)(2分);(2分)
(4)温度低于,催化剂活性增强和温度升高共同使脱硝反应速率加快(2分);高于时,与氧气发生燃烧,参加脱硝反应的量减少,使脱硝反应速率减慢(2分)
解析:(1)步骤Ⅱ中反应物是碳酸钙和甲烷,发生反应生成氧化钙、CO和氢气,主要反应的化学方程式:;
(2)①步骤Ⅱ反应化学方程式:生成与的物质的量相等,步骤Ⅱ中还存在少量副反应:生成CO,则时出口处气体流量略高于的原因是:步骤Ⅱ主反应生成的与的物质的量相等,副反应消耗同时生成;
②反应进行后,反应管中仍残留较多,但流量迅速降低,流量升高,可能的原因是:分解生成C和,使浓度降低,生成的C覆盖在催化剂表面,使活性降低;
(3)①根据盖斯定律,反应I-反应II可得反应Ⅲ,则反应Ⅲ的;
②反应I-反应II可得反应Ⅲ,两式相减则平衡常数相除,则相同温度下反应Ⅲ的;
(4)①当温度低于时,催化剂活性较佳,且温度逐渐升高反应速率加快,因此的去除率随温度升高而升高,可能原因是:温度低于,催化剂活性增强和温度升高共同使脱硝反应速率加快;
②当温度高于时,反应物加入氧气,能与甲烷发生燃烧反应,使甲烷的量减少,反应物浓度减小,使脱硝反应速率减慢,的去除率随温度升高而降低,可能原因是:高于时,与氧气发生燃烧,参加脱硝反应的量减少,使脱硝反应速率减慢。
19.答案:(1)酰胺基、硝基;或(2分);(1分)
(2)2(具体物质为、)(2分);甲基丙烯酸甲酯(2分);(2分)
(3)(2分)
(4)还原反应(2分);3(2分)
解析:(1)根据A的结构,可知其含氧官能团为酰胺基、硝基;A与B发生加成反应生成C,根据A、C结构,可知B的结构为或;根据甲酸结构简式HCOOH,可知其碳原子形成碳氧双键,故碳原子的杂化方式为;
故答案为:酰胺基、硝基;或;;
(2)丙烯酸乙酯的结构简式为,满足条件的丙烯酸乙酯的同分异构体结构中含有碳碳双键、酯基及2个不对称位置的甲基,故其结构有、,共2种;其中能发生水解反应生成甲醇的是,其系统命名为甲基丙烯酸甲酯;甲基丙烯酸甲酯结构中含有碳碳双键,一定条件下发生加聚反应生成高聚物,即有机玻璃(PMMA),化学反应方程式为;
故答案为:2;甲基丙烯酸甲酯;;
(3)反应②C结构中含有醛基,与D发生反应的生成物中该醛基碳原子与酯基碳的邻位碳原子形成碳碳双键,HWE反应中的反应物之一结构中含有羰基,该碳原子在生成物中也是与酯基碳的邻位碳原子形成碳碳双键,由此可知被氧化的M中含有羰基,结合N的结构中含有的碳碳双键,故M结构为;
故答案为:;
(4)根据F的结构及G的结构可知,该反应原理是使F结构中的硝基转化为氨基,故反应⑤反应类型为还原反应;结构中标有*的碳原子为手性碳原子,故有3个;
故答案为:还原反应;3。
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Mg 24 Al 27 S 32 Cl 35.5 Ca 40 Fe 56
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
1.白山黑水,山美水美人更美,东北这片神奇的黑土地蕴含着无尽的魅力。下列化学知识描述正确的是
A.“雪使山长白,冰消作四江。人参三百里,貂鼠一千双。”人参能够补气强身,安神益智。用人参泡酒或煮汤,属于液-液萃取。
B.“暗河潺潺流溶洞,钟乳石挂如珠帘。”九曲本溪水洞入已经被认证为世界最长水溶洞,其喀斯特地貌的形成过程中涉及到的化学变化只有。
C.“去年元夜时,花市灯如昼。”长春灯会上,那些霓虹灯呈现五彩斑斓的颜色与原子核外电子的跃迁有关,属于吸收光谱。
D.“天苍苍,野茫茫,风吹草低见牛羊。”青草的主要成分水解后可得到葡萄糖。
2.下列化学用语表述错误的是
A.中子数为21的钾的核素符号:
B.HF中的键示意图:
C.某激发态O原子的轨道表示式:
D.用电子式表示的形成过程:
3.下列装置或操作能达到实验目的的是
A.图①:将硫酸铜溶液蒸干制胆矾 B.图②:制备碳酸氢钠
C.图③:检验装置气密性 D.图④:向容量瓶转移溶液
4.下列关于物质结构与性质,用途的说法错误的是
A.Mg有强还原性,可用于钢铁的电化学防护
B.的键能强于,的热稳定性比的高
C.分子中既有氨基又有羧基,是一种两性化合物
D.通过引入有机基团转化为低熔点、易挥发的
5.下列离子方程式正确的是
A.溶液中通入过量
B.向中投入固体:
C.溶于氢碘酸:
D.向硫酸氢钠溶液滴加溶液至完全沉淀:
6.下列反应对应的离子方程式书写正确的是( )
A.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
B.向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2OH2↑+Cl2↑+2OH-
D.将1molCl2通入含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2
7.某药物中间体的结构如图,下列说法错误的是
A.分子中有4种官能团
B.分子中有3个手性碳原子
C.此物质有顺反异构体
D.1mol该物质最多消耗3mol
8.短周期主族元素R、X、Y、Z的原子序数依次增大,由这四种元素组成的某化合物的结构式如图所示(←表示单原子提供2个电子形成配位键)。R、X、Y原子最外层电子数之和等于Z原子的电子数。下列说法正确的是
A.原子半径:Z>Y>X>R
B.简单氢化物水溶液的pH:Z<Y
C.最高正价:R<X<Y<Z
D. 分子中每个原子最外层都达到8电子结构
9.仿瓷餐具质轻美观,不易破碎,其主要成分蜜胺树脂是由三聚氰胺与甲醛在一定条件下缩聚得到的聚合物。
下列说法错误的是
A.蜜胺树脂中所有原子一定不在同一平面
B.上式中
C.甲醛与足量银氨溶液反应,生成
D.蜜胺树脂中碳原子的杂化轨道类型有、
10.一定温度下,向2L恒容密闭容器中充入(g)和(g),发生合成氨反应。10min末,测得的物质的量为1.5mol。在铁触媒催化剂的表面上合成氨反应的反应历程和能量变化如图所示,其中吸附在铁触媒表面上的物质用·标注。下列说法错误的是
A.催化剂能改变反应历程和活化能,影响化学反应速率
B.对总反应速率影响最小的步骤的活化能为
C.10min时,
D.内,
11.如图所示,甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是
A.甲池通入CH3OH的电极反应式为CH3OH+6e-+2H2O=CO+8H+
B.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
C.甲池中消耗224 mL(标准状况)O2,此时丙池中理论上产生1.16 g 固体
D.若将乙池电解质溶液换成AgNO3溶液,则可以实现在石墨棒上镀银
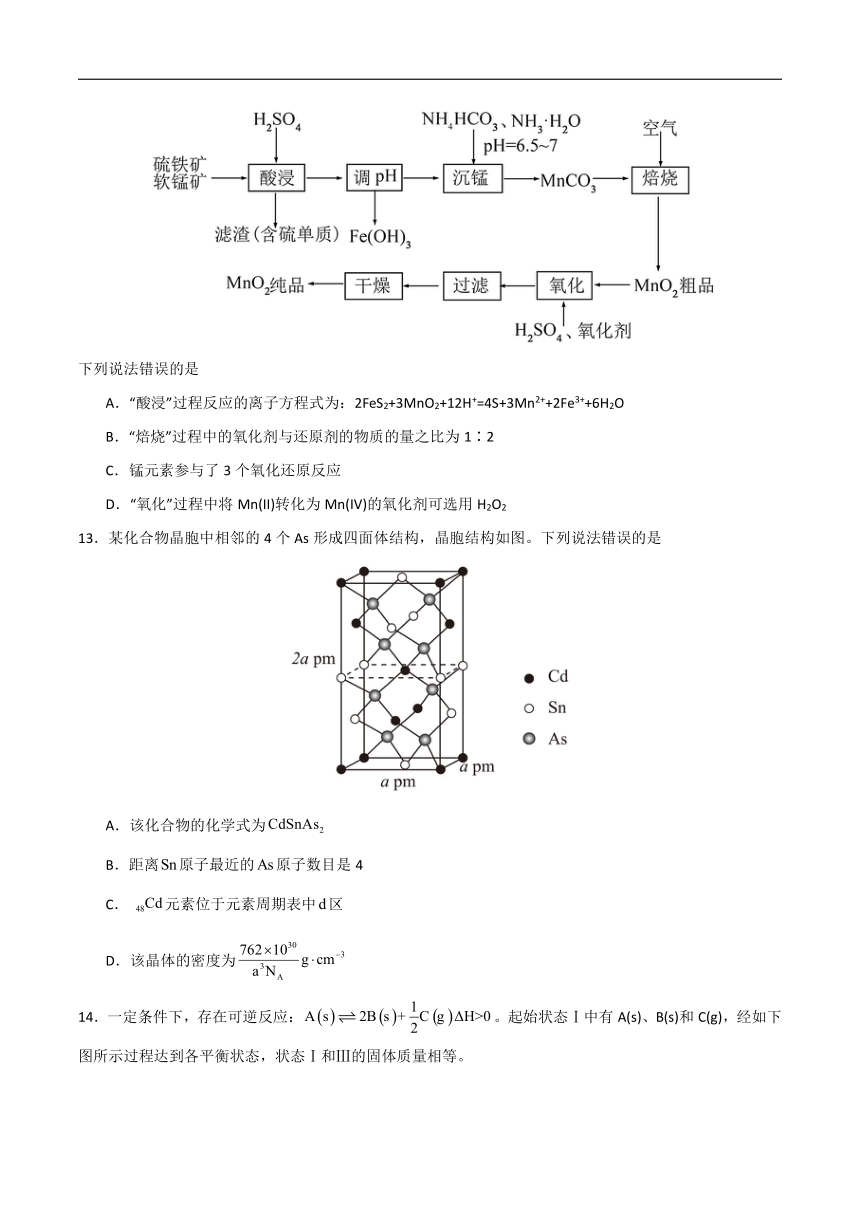
12.用硫铁矿(主要成分为FeS2)、软锰矿(主要成分为MnO2)制取高纯度MnO2的工艺流程如图:
下列说法错误的是
A.“酸浸”过程反应的离子方程式为:2FeS2+3MnO2+12H+=4S+3Mn2++2Fe3++6H2O
B.“焙烧”过程中的氧化剂与还原剂的物质的量之比为1∶2
C.锰元素参与了3个氧化还原反应
D.“氧化”过程中将Mn(II)转化为Mn(IV)的氧化剂可选用H2O2
13.某化合物晶胞中相邻的4个As形成四面体结构,晶胞结构如图。下列说法错误的是
A.该化合物的化学式为
B.距离原子最近的原子数目是4
C.元素位于元素周期表中区
D.该晶体的密度为
14.一定条件下,存在可逆反应:。起始状态Ⅰ中有A(s)、B(s)和C(g),经如下图所示过程达到各平衡状态,状态Ⅰ和Ⅲ的固体质量相等。
下列叙述正确的是
A.容器内压强:
B.平衡常数:
C.若体积V(Ⅲ)=2V(Ⅰ),则
D.逆反应的速率:
15.室温下,HR、、三份溶液中分别加入等物质的量浓度的NaOH溶液,pM[p表示负对数,M表示、、]随溶液pH变化的关系如图所示。已知相同条件下的溶解度:,下列说法正确的是
A.蒸干溶液可生成晶体 B.X点横坐标为8.2
C.室温下,为 D.调节HR溶液时:
第II卷(非选择题 共55分)
二、非选择题,共4题,共55分。(除标注外,每空2分。)
16.(12分)ZnSO4是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,木材和皮革的保存剂。由菱锌矿(主要成分为,还含有少量:、、、、、PbO,、CdO和)制备流程如下:
已知:常温下,部分金属阳离子沉淀的pH如下表。
金属阳离子
开始沉淀pH 6.2 7.4 2.2 7.7 9.1 8.1 3.4
沉淀完全pH 8.2 8.9 3.2 9.7 11.1 10.1 4.7
(1)过滤获得的滤渣①的主要成分为SiO2、CaSO4、PbSO4、 。
(2)加入KMnO4溶液后过滤可以得到和两种沉淀,Fe2+发生反应的离子方程式为 ,常温下,此时溶液pH仍为5,则溶液残留的微量Fe3+的浓度约为 mol/L,
(3)脱完钙和镁之后的ZnSO4滤液中含有少量的K2SO4,ZnSO4的溶解度曲线如图。由滤液④获得的具体操作为:加热浓缩至330K,当 时, ,洗涤烘干。
(4)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有 个,
②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为 。
17.(15分)三氯化钛是一种重要的工业材料,常用于还原偶联反应和烯烃定向聚合的催化剂。实验室常用高温还原制备,实验装置如图所示(部分夹持和加热装置略)。
已知:I.常温下为深紫色固体,是一种强还原剂,易水解;
II.常温下为无色液体,沸点为136℃,易水解。
回答下列问题:
(1)制备。(i)检验装置气密性;(ii)将盛有与碳粉的瓷舟置于管式炉中,打开、,关闭,由口通入;(iii)一段时间后管式炉开始加热,加热至700℃发生反应。
①操作(ii)中先通入一段时间的原因是 。
②管式炉中有生成,发生反应的化学方程式为 ;装置D中碱石灰的作用是 。
(2)制备。(iv)当中液体不再滴下时,停止加热,关闭、,打开,由口先通入一段时间的;(V)加热反应器至1000 1100℃,反应一段时间后,停止加热,继续通入至冷却,关闭。反应器中得到深紫色固体。
①仪器G的名称为 。
②图示装置有一处缺陷会影响产品质量,应如何改进 。
(3)滴定法测定产品纯度。取产品溶于稀盐酸配成待测液,量取于锥形瓶中,用标准液进行滴定。
①产品用稀盐酸溶解配制待测液的原因为 。
②若用做指示剂,判断滴定终点的现象为 ;平行滴定三次,消耗溶液的平均体积为,则产品纯度为 。
18.研究的综合利用具有重要的意义。
Ⅰ.催化重整制氢气
一种与催化重整制取的过程如图1所示。在反应管中加入和催化剂,先通入,待步骤Ⅰ完成后,再将以一定流速通入,并控制温度为,进行步骤Ⅱ。
(1)写出步骤Ⅱ中发生主要反应的化学方程式:________________________________。
(2)步骤Ⅱ中还存在少量副反应:,测得出口处和的流量随时间变化如图2所示。
①时出口处气体流量略高于的原因是_____________________________。
②反应进行后,反应管中仍残留较多,但流量迅速降低,流量升高,可能的原因是_____________________________________________。
Ⅱ.用于烟气脱硝
(3)烟气脱硝相关反应如下:
反应Ⅰ
反应Ⅱ
反应Ⅲ
①反应Ⅲ的___________。
②反应Ⅰ和反应II的平衡常数分别为、,则相同温度下反应Ⅲ的K=___________(用、表示)。
(4)模拟烟气脱硝:一定条件下,将、和按匀速通过催化脱硝反应器,测得去除率和转化率随反应温度的变化如图3所示。
①当温度低于时,的去除率随温度升高而升高,可能原因是_______________________________________________。
②当温度高于时,的去除率随温度升高而降低,可能原因是______________________________________________________。
19.奥司他韦(化合物G)是目前治疗流感的最常用药物之一,其合成方法很多。最近某大学在60min内完成5步反应,并且总收率达到15%,完美地完成了奥司他韦(化合物G)一锅法全合成,其合成路线如下(略去部分试剂和条件,忽略立体化学)。
已知;
HWE反应:
(其中为烃基,为烃基或)
回答下列问题;
(1)A中含氧官能团名称是__________,B的结构简式是__________,
反应①是在三种催化剂(其一为甲酸)共同的作用下发生的,反应的立体选择性非常好,甲酸分子中碳原子的杂化方式是____________________;
(2)D为丙烯酸乙酯衍生物。丙烯酸乙酯有多种同分异构体,同时满足下列条件的有__________种(不考虑立体异构);
①具有与丙烯酸乙酯相同的官能团②核磁共振氢谱有三组峰,且峰面积之比为
其中一种发生水解反应能生成甲醇,其系统命名为__________,写出用其合成有机玻璃(PMMA)的化学方程式_____________________________________;
(3)化合物N可用作医药合成中间体。参考反应②(Michael和HWE的一个串联反应),设计化合物N的合成路线如下(部分反应条件已略去),其中M的结构简式为__________。
(4)反应⑤的反应类型为__________,奥司他韦(化合物G)有__________个手性碳原子。
参考答案
DCDDD CBBBD CDCCB
16.(1) 、
(2)
(3)当析出大量晶体时(1分) 趁热过滤(1分)
(4) 4 正四面体
17.排出装置中的空气,防止对实验造成影响
吸收多余
(2)球形冷凝管(1分) 应在与之间加一个干燥装置
(3)抑制水解 加入最后半滴溶液,溶液颜色突变为红色,且半分钟内不恢复原来的颜色 77.25%
18.答案:(1)(2分)
(2)步骤Ⅱ主反应生成的与的物质的量相等,副反应消耗同时生成(2分);分解生成C和,使浓度降低,生成的C覆盖在催化剂表面,使活性降低(2分)
(3)(2分);(2分)
(4)温度低于,催化剂活性增强和温度升高共同使脱硝反应速率加快(2分);高于时,与氧气发生燃烧,参加脱硝反应的量减少,使脱硝反应速率减慢(2分)
解析:(1)步骤Ⅱ中反应物是碳酸钙和甲烷,发生反应生成氧化钙、CO和氢气,主要反应的化学方程式:;
(2)①步骤Ⅱ反应化学方程式:生成与的物质的量相等,步骤Ⅱ中还存在少量副反应:生成CO,则时出口处气体流量略高于的原因是:步骤Ⅱ主反应生成的与的物质的量相等,副反应消耗同时生成;
②反应进行后,反应管中仍残留较多,但流量迅速降低,流量升高,可能的原因是:分解生成C和,使浓度降低,生成的C覆盖在催化剂表面,使活性降低;
(3)①根据盖斯定律,反应I-反应II可得反应Ⅲ,则反应Ⅲ的;
②反应I-反应II可得反应Ⅲ,两式相减则平衡常数相除,则相同温度下反应Ⅲ的;
(4)①当温度低于时,催化剂活性较佳,且温度逐渐升高反应速率加快,因此的去除率随温度升高而升高,可能原因是:温度低于,催化剂活性增强和温度升高共同使脱硝反应速率加快;
②当温度高于时,反应物加入氧气,能与甲烷发生燃烧反应,使甲烷的量减少,反应物浓度减小,使脱硝反应速率减慢,的去除率随温度升高而降低,可能原因是:高于时,与氧气发生燃烧,参加脱硝反应的量减少,使脱硝反应速率减慢。
19.答案:(1)酰胺基、硝基;或(2分);(1分)
(2)2(具体物质为、)(2分);甲基丙烯酸甲酯(2分);(2分)
(3)(2分)
(4)还原反应(2分);3(2分)
解析:(1)根据A的结构,可知其含氧官能团为酰胺基、硝基;A与B发生加成反应生成C,根据A、C结构,可知B的结构为或;根据甲酸结构简式HCOOH,可知其碳原子形成碳氧双键,故碳原子的杂化方式为;
故答案为:酰胺基、硝基;或;;
(2)丙烯酸乙酯的结构简式为,满足条件的丙烯酸乙酯的同分异构体结构中含有碳碳双键、酯基及2个不对称位置的甲基,故其结构有、,共2种;其中能发生水解反应生成甲醇的是,其系统命名为甲基丙烯酸甲酯;甲基丙烯酸甲酯结构中含有碳碳双键,一定条件下发生加聚反应生成高聚物,即有机玻璃(PMMA),化学反应方程式为;
故答案为:2;甲基丙烯酸甲酯;;
(3)反应②C结构中含有醛基,与D发生反应的生成物中该醛基碳原子与酯基碳的邻位碳原子形成碳碳双键,HWE反应中的反应物之一结构中含有羰基,该碳原子在生成物中也是与酯基碳的邻位碳原子形成碳碳双键,由此可知被氧化的M中含有羰基,结合N的结构中含有的碳碳双键,故M结构为;
故答案为:;
(4)根据F的结构及G的结构可知,该反应原理是使F结构中的硝基转化为氨基,故反应⑤反应类型为还原反应;结构中标有*的碳原子为手性碳原子,故有3个;
故答案为:还原反应;3。
同课章节目录
