计算题典型题型 押题练 2025年中考化学三轮复习备考
文档属性
| 名称 | 计算题典型题型 押题练 2025年中考化学三轮复习备考 |  | |
| 格式 | docx | ||
| 文件大小 | 669.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-05 11:59:50 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
计算题典型题型 押题练
2025年中考化学三轮复习备考
一、计算题
1.哪吒脚踏风火轮,手持火尖枪,神通广大,是人人喜爱的神话人物。传说中火尖枪由铁、碳及少量其他非金属元素制成的合金打造而成。为了测定火尖枪合金中铁的质量分数,某化学兴趣小组的同学进行了如下实验:取5.7g该合金粉末放入烧杯中,然后向其中逐滴加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。
(1)合金属于 (填“金属材料”或“非金属材料”)
(2)火尖枪合金中铁的质量分数。(结果保留一位小数)
2.2025年是中国AI科技企业的腾飞之年,以Deepseek、宇树科技、海思半导体等企业在世界科技的舞台上风光无限。AI科技的发展离不开“芯片算力”的加持,在芯片生产中常用到作为等离子蚀刻气对硅基晶片进行蚀刻,生产的主要反应为:,请回答下列问题:
(1)已知为一种盐,写出其含有的阴离子符号 。
(2)要生产142克蚀刻气,至少需要的质量为多少?(写出计算步骤)
3.“化学氧自救呼吸器”中的主要成分为超氧化钾,其供氧原理是超氧化钾与二氧化碳反应产生氧气,该反应的化学方程式为。
(1)中碳和氧元素的质量比 。
(2)计算每消耗28.4g超氧化钾可以生成多少克氧气。(写出计算过程)
4.过氧化钠()是一种供氧剂,与水反应的化学方程式为: 。将的不纯的(只含有杂质)加入到水中,恰好完全反应,所得溶液质量为。请计算:
(1)生成氧气的质量为 ;
(2)反应后所得溶液中溶质的质量分数为多少?(写出计算过程,计算结果保留至0.1%)
(3)所得溶液稀释成溶质质量分数为10%的溶液,需加水的质量为?(写出计算过程)
5.实验室现有一瓶失去标签的氢氧化钠溶液(没有变质),某化学课外活动小组为测定该溶液溶质的质量分数进行了下图所示的实验(注:滴入酚酞试液的质量忽略不计)。
(1)实验过程中,锥形瓶内溶液的会逐渐 (填“变大”或“变小”)。
(2)通过计算确定该瓶氢氧化钠溶液的溶质质量分数(写出完整计算过程)。
6.兴趣小组为了测定某黄铜样品中锌的质量分数,取一定量黄铜样品放入烧杯中,再取400克稀硫酸均分四次加入烧杯中,充分反应,实验数据如下:
第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 100 100 100 100
剩余固体的质量(g) 13.5 7 4 4
(1)黄铜中铜的质量分数 ;
(2)第二次加入稀硫酸反应后所得溶液溶质质量分数。(结果保留)
7.菱铁矿的主要成分是,小米同学称取10.0g菱铁矿样品,把80g稀盐酸分四次加入样品中,菱铁矿中杂质不与稀盐酸反应,测得实验数据见下表:
实验序号 第1次 第2次 第3次 第4次
加入盐酸质量/g 20.0 20.0 20.0 20.0
剩余固体质量/g 7.1 4.2 3.0 M
(1)发生的化学反应方程式为 ;
(2) ;
(3)菱铁矿样品中的质量是 ;
(4)实验中所用稀盐酸的溶质质量分数是 (结果精确到0.1%)。
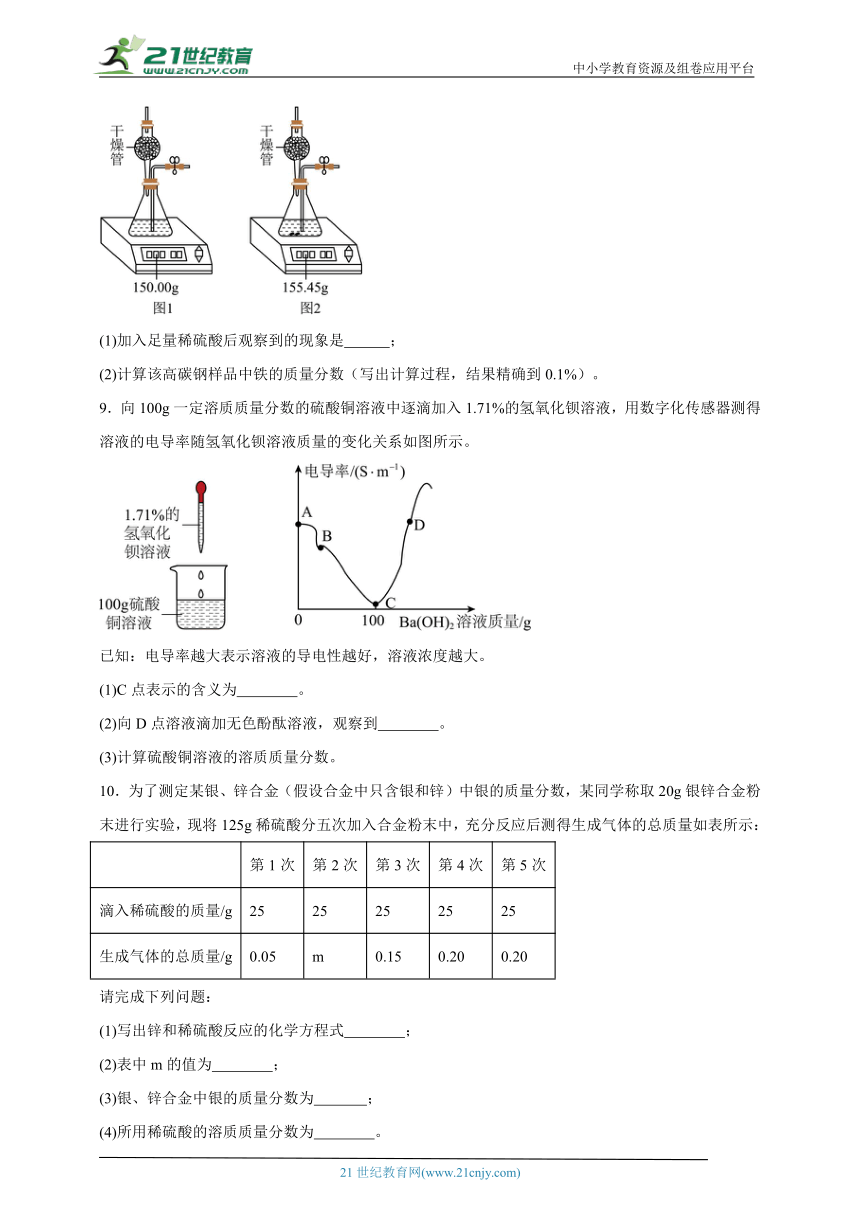
8.测定某高碳钢样品(主要成分是铁和碳)的含铁量,化学小组进行了如下实验:先向装置中加入足量稀硫酸后称量,示数如图1;再加入5.65g样品粉末,充分反应后鼓入干燥的空气排尽氢气,立刻称量,示数如图2。(提示:样品中所含杂质不与酸反应)
(1)加入足量稀硫酸后观察到的现象是 ;
(2)计算该高碳钢样品中铁的质量分数(写出计算过程,结果精确到0.1%)。
9.向100g一定溶质质量分数的硫酸铜溶液中逐滴加入1.71%的氢氧化钡溶液,用数字化传感器测得溶液的电导率随氢氧化钡溶液质量的变化关系如图所示。
已知:电导率越大表示溶液的导电性越好,溶液浓度越大。
(1)C点表示的含义为 。
(2)向D点溶液滴加无色酚酞溶液,观察到 。
(3)计算硫酸铜溶液的溶质质量分数。
10.为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次 第2次 第3次 第4次 第5次
滴入稀硫酸的质量/g 25 25 25 25 25
生成气体的总质量/g 0.05 m 0.15 0.20 0.20
请完成下列问题:
(1)写出锌和稀硫酸反应的化学方程式 ;
(2)表中m的值为 ;
(3)银、锌合金中银的质量分数为 ;
(4)所用稀硫酸的溶质质量分数为 。
11.某中学化学学习小组的同学们在实验室用过氧化氢溶液制取氧气,并用如图所示方法测定过氧化氢溶液的溶质质量分数。
请完成下列分析及计算:
(1)实验产生氧气的质量是 g。
(2)求过氧化氢溶液的溶质质量分数(写出计算过程)。
12.合金常用来制造机械零件、仪表和日用品。为测定某黄铜(铜锌合金)中锌的质量分数,某化学小组进行了如图所示实验。
请分析并计算:
(1)生成氢气的总质量为 g。
(2)烧杯中剩余固体为 。
(3)计算该黄铜中锌的质量分数。
13.高纯碳酸钙被广泛应用于生产精密电子陶瓷、医药等。工业上利用氯化钙溶液制取高纯碳酸钙的原理为。
(1)现需制取150kg高纯碳酸钙,理论上需要溶质质量分数为11.1%的氯化钙溶液的质量是多少(写出计算过程)?
(2)为提高吸收率,需先向氯化钙溶液中通入,这样做的原因是 。
14.现有混有氢氧化钠的碳酸钠样品,取一定量的该样品,逐滴加入稀盐酸,反应中产生的气体的质量与稀盐酸的用量关系如图所示:
(1)反应中产生的气体的质量是 g。
(2)滴加的稀盐酸中溶质的质量分数。
15.同学们想知道实验室制取二氧化碳的剩余固体混合物(其成分是不溶于水也不反应的杂质、碳酸钙和氯化钙)中碳酸钙的质量,做了如下实验:
(1)发生反应的化学方程式为 ;
(2)反应生成氯化钙的质量是 ;
(3)若恒温蒸发掉 水,可以使最终所得溶液溶质质量分数为10%;
(4)化学小组同学取石灰石(杂质不与酸反应,也不溶于水)于烧杯中,向烧杯中加入200g稀盐酸恰好完全反应,反应后称得烧杯中物质的质量为211.2g。则加入的稀盐酸的溶质质量分数为 。
参考答案
1.(1)金属材料
(2)解:设火尖枪合金中铁的质量分数为x
答:火尖枪合金中铁的质量分数为98.2%。
【详解】(1)金属材料包括纯金属以及它们的合金,所以合金属于金属材料。
(2)火尖枪由铁、碳及少量其他非金属元素制成的合金打造而成,加入稀硫酸,只有铁能与稀硫酸发生反应,化学方程式为;根据图像,最终产生氢气的质量为0.2g,据此计算,见答案。
2.(1)
(2)解:设至少需要的质量为x
答:至少需要的质量为。
【详解】(1)由铵根离子和氟离子构成,氟离子带一个单位负电荷,属于阴离子,离子符号的书写,将数字和正负号标在元素符号的右上角,先写数字,后标正负号,数值为1,省略不写,离子符号为:F-;
(2)见答案。
3.(1)1:4
(2)解:设每消耗28.4g超氧化钾可以生成氧气的质量为x。
答:每消耗28.4g超氧化钾可以生成9.6克氧气。
【详解】(1)中碳和氧元素的质量比。
(2)详解见答案。
4.(1)3.2g
(2)解:设参加反应的过氧化钠的质量为x,生成氢氧化钠的质量为y,则
x=15.6g
y=16g
反应后所得溶液中溶质的质量为
反应后所得溶液中溶质的质量分数为
答:反应后所得溶液中溶质的质量分数为19.2%。
(3)设需加水的质量为z
z=96g
答:需加水的质量为96g。
【详解】(1)根据质量守恒定律,反应后减少的质量为生成氧气的质量,为:19.6g+87.6g-104g=3.2g;
(2)过程见答案;
(3)稀释前后,溶质的质量不变,过程见答案。
5.(1)变小
(2)解:设该瓶氢氧化钠溶液的溶质质量分数为x
恰好完全反应时消耗稀盐酸的质量为
x=10%
答:该瓶氢氧化钠溶液的溶质质量分数为10%。
【详解】(1)氢氧化钠溶液呈碱性,pH>7 ,逐滴加入稀盐酸,盐酸与氢氧化钠发生中和反应:,随着反应进行,氢氧化钠逐渐减少,碱性减弱,所以锥形瓶内溶液的pH会逐渐变小。
(2)根据图像,烧碱溶液的质量为,溶液恰好变为无色,即恰好完全反应时,消耗稀盐酸的质量为,据此计算,见答案。
6.(1)20%
(2)解:由图表可知,第二次加入稀硫酸固体减少的质量13.5g-7g=6.5g,第三次加入稀硫酸固体继续减少,说明第二加入硫酸样品中的锌没有完全反应,即第一次反应的锌的质量也是6.5g,即前两次加入稀硫酸反应的锌的质量为6.5+6.5g=13g,可设反应生成的硫酸锌质量为y,生成氢气质量为z。
则第二次加入稀硫酸后所得溶液溶质质量分数为
答:第二次加入稀硫酸反应后所得溶液溶质质量分数15.1%。
【详解】(1)由图表可知,黄铜中铜的质量为4g,第二次加入稀硫酸固体减少的质量13.5g-7g=6.5g,第三次加入稀硫酸固体继续减少,说明第二加入硫酸样品中的锌没有完全反应,即第一次反应的锌的质量也是6.5g,故黄铜样品的质量是6.5g+13.5g=20g,则黄铜中铜的质量分数=。
(2)详解见答案。
7.(1)FeCO3+2HCl=FeCl2+CO2↑+ H2O
(2)3.0
(3)7.0g
(4)9.1%
【详解】(1)稀盐酸和碳酸亚铁反应生成氯化铁、二氧化碳和水,反应的化学方程式为:FeCO3+2HCl=FeCl2+CO2↑+ H2O;
(2)第1次加入20.0g稀盐酸反应FeCO3质量为:10.0g-7.1g=2.9g;
第2次加入20.0g稀盐酸反应FeCO3质量为:7.1g-4.2g=2.9g;
第3次加入20.0g稀盐酸反应FeCO3质量为:4.2g-3.0g=1.2g,此时FeCO3已完全反应,则杂质的质量,即M=3.0;
(3)FeCO3的质量为10.0g-3.0g=7.0g;
(4)第1次加入20.0g稀盐酸反应FeCO3质量为:10.0g-7.1g=2.9g,设20.0g稀盐酸中HCl的质量为x,
x=1.825g,
实验中所用稀盐酸的溶质质量分数为×100%≈9.1%。
8.(1)产生大量气泡,固体部分溶解
(2)解:设高碳钢样品中铁的质量为x
高碳钢样品中铁的质量分数=
答:高碳钢样品中铁的质量分数为99.1%。
【详解】(1)高碳钢样品中的铁会与稀硫酸反应,碳不与稀硫酸反应。所以加入足量稀硫酸后观察到的现象是:产生大量气泡,固体部分溶解。
(2)过程见答案。
9.(1)硫酸铜与氢氧化钡恰好完全反应,此时溶液中离子浓度最小,电导率最低
(2)溶液变红
(3)解:设硫酸铜溶液的溶质质量分数为x
x=1.6%
答:硫酸铜溶液的溶质质量分数为1.6%。
【详解】(1)硫酸铜溶液中存在Cu2+和,氢氧化钡溶液中存在Ba2+和OH-,反应的化学方程式为。随着氢氧化钡溶液加入,离子不断结合成沉淀,溶液中离子浓度减小,电导率降低。C 点电导率最低,意味着此时硫酸铜与氢氧化钡恰好完全反应,溶液中几乎没有自由移动的离子。
(2)C 点二者恰好完全反应,D 点是继续滴加氢氧化钡溶液后的点,此时溶液中含有过量的氢氧化钡,氢氧化钡溶液呈碱性,无色酚酞溶液遇碱性溶液会变红。
(3)根据图像,恰好完全反应时消耗100g Ba(OH)2溶液,据此计算,见答案。
10.(1)
(2)0.10
(3)67.5%
(4)9.8%
【详解】(1)锌与稀硫酸反应生成硫酸锌和氢气,化学方程式为;
(2)锌与稀硫酸反应生成硫酸锌和氢气,银与稀硫酸不反应,称取20g银锌合金粉末进行实验,将125g稀硫酸分五次加入合金粉末中,由表格数据可知,第1次加入25g稀硫酸生成气体质量为0.05g,第4次加入25g稀硫酸生成气体质量为,说明每25g稀硫酸完全反应生成0.05g氢气,则第2次加入25g稀硫酸生成气体的总质量为,故m的值为0.10;
(3)由表格数据可知,第5次加入25g稀硫酸生成气体的质量为,说明第4次加入25g稀硫酸时锌与稀硫酸恰好完全反应,则生成氢气的总质量为0.20g,设锌的质量为x,
则银锌合金中银的质量分数为;
(4)由第(2)小问分析可知,每25g稀硫酸完全反应生成0.05g氢气,设所用稀硫酸的溶质质量分数为y,
答:所用稀硫酸的溶质质量分数为9.8%。
11.(1)1.6
(2)设过氧化氢溶液中H2O2的质量为x。
x=3.4g
溶质质量分数=×100%=3.4%
答:过氧化氢溶质质量分数为3.4%。
【详解】(1)过氧化氢在二氧化锰的催化下分解生成氧气和水,根据质量守恒定律,实验产生氧气的质量为400.0g-398.4g=1.6g;
(2)见答案。
12.(1)0.2
(2)铜/Cu
(3)设黄铜中锌的质量分数为x。
x= 65%。
答:该黄铜中锌的质量分数为65%。
【详解】(1)根据质量守恒定律,反应前后物质的总质量不变。反应前物质的总质量为黄铜样品质量10g与稀硫酸质量100g之和,即10g+50g=60g;反应后烧杯中物质总质量为59.8g。则生成氢气的质量=60g 59.8g=0.2g;
(2)金属活动性Zn>H>Cu,则锌能与稀硫酸反应生成硫酸锌与氢气,黄铜是铜锌合金,锌能与稀硫酸反应,铜不与稀硫酸反应。所以反应后烧杯中剩余固体为铜;
(3)见答案。
13.(1)解:设需要溶质质量分数为11.1%的氯化钙溶液的质量为x。
答:制取150kg高纯碳酸钙,理论上需要溶质质量分数为11.1%的氯化钙溶液的质量是1500kg。
(2)先通入使溶液呈碱性,有利于吸收
【详解】(1)见答案;
(2)为提高吸收率,需先向氯化钙溶液中通入,这样做的原因是先通入使溶液呈碱性,CO2溶于水形成酸性溶液,有利于吸收。
14.(1)2.2
(2)解:由图可知,生成气体消耗的盐酸的质量=30g 10g=20g
设稀盐酸中溶质的质量分数为x
=
x=18.25%
答:稀盐酸中溶质的质量分数为18.25%。
【详解】(1)由图可知,反应中产生的气体的质量是2.2g,故填2.2。
(2)见答案。
15.(1)
(2)11.1g
(3)5.7
(4)7.3%
【详解】(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为.
(2)反应前固体混合物和稀盐酸溶液的质量和为26.1g+100g=126.1g,反应后减少的质量为生成的二氧化碳的质量,故生成二氧化碳的质量为:126.1g-5g-116.7g=4.4g,设,反应生成氯化钙的质量是x。
反应生成氯化钙的质量是11.1g。
(3)由(2)可知,滤液中的溶质氯化钙的质量为11.1g,蒸发溶剂前后溶质的质量不变,设蒸发掉的水的质量为y。
故恒温蒸发掉水的质量为5.7g。
(4)根据质量守恒定律,反应生成二氧化碳的质量为20g+200g-211.2g=8.8g,设加入的稀盐酸的溶质质量分数为z。
故加入的稀盐酸的溶质质量分数为7.3%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
计算题典型题型 押题练
2025年中考化学三轮复习备考
一、计算题
1.哪吒脚踏风火轮,手持火尖枪,神通广大,是人人喜爱的神话人物。传说中火尖枪由铁、碳及少量其他非金属元素制成的合金打造而成。为了测定火尖枪合金中铁的质量分数,某化学兴趣小组的同学进行了如下实验:取5.7g该合金粉末放入烧杯中,然后向其中逐滴加入稀硫酸,产生氢气的质量与加入稀硫酸的质量关系如图所示。
(1)合金属于 (填“金属材料”或“非金属材料”)
(2)火尖枪合金中铁的质量分数。(结果保留一位小数)
2.2025年是中国AI科技企业的腾飞之年,以Deepseek、宇树科技、海思半导体等企业在世界科技的舞台上风光无限。AI科技的发展离不开“芯片算力”的加持,在芯片生产中常用到作为等离子蚀刻气对硅基晶片进行蚀刻,生产的主要反应为:,请回答下列问题:
(1)已知为一种盐,写出其含有的阴离子符号 。
(2)要生产142克蚀刻气,至少需要的质量为多少?(写出计算步骤)
3.“化学氧自救呼吸器”中的主要成分为超氧化钾,其供氧原理是超氧化钾与二氧化碳反应产生氧气,该反应的化学方程式为。
(1)中碳和氧元素的质量比 。
(2)计算每消耗28.4g超氧化钾可以生成多少克氧气。(写出计算过程)
4.过氧化钠()是一种供氧剂,与水反应的化学方程式为: 。将的不纯的(只含有杂质)加入到水中,恰好完全反应,所得溶液质量为。请计算:
(1)生成氧气的质量为 ;
(2)反应后所得溶液中溶质的质量分数为多少?(写出计算过程,计算结果保留至0.1%)
(3)所得溶液稀释成溶质质量分数为10%的溶液,需加水的质量为?(写出计算过程)
5.实验室现有一瓶失去标签的氢氧化钠溶液(没有变质),某化学课外活动小组为测定该溶液溶质的质量分数进行了下图所示的实验(注:滴入酚酞试液的质量忽略不计)。
(1)实验过程中,锥形瓶内溶液的会逐渐 (填“变大”或“变小”)。
(2)通过计算确定该瓶氢氧化钠溶液的溶质质量分数(写出完整计算过程)。
6.兴趣小组为了测定某黄铜样品中锌的质量分数,取一定量黄铜样品放入烧杯中,再取400克稀硫酸均分四次加入烧杯中,充分反应,实验数据如下:
第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 100 100 100 100
剩余固体的质量(g) 13.5 7 4 4
(1)黄铜中铜的质量分数 ;
(2)第二次加入稀硫酸反应后所得溶液溶质质量分数。(结果保留)
7.菱铁矿的主要成分是,小米同学称取10.0g菱铁矿样品,把80g稀盐酸分四次加入样品中,菱铁矿中杂质不与稀盐酸反应,测得实验数据见下表:
实验序号 第1次 第2次 第3次 第4次
加入盐酸质量/g 20.0 20.0 20.0 20.0
剩余固体质量/g 7.1 4.2 3.0 M
(1)发生的化学反应方程式为 ;
(2) ;
(3)菱铁矿样品中的质量是 ;
(4)实验中所用稀盐酸的溶质质量分数是 (结果精确到0.1%)。
8.测定某高碳钢样品(主要成分是铁和碳)的含铁量,化学小组进行了如下实验:先向装置中加入足量稀硫酸后称量,示数如图1;再加入5.65g样品粉末,充分反应后鼓入干燥的空气排尽氢气,立刻称量,示数如图2。(提示:样品中所含杂质不与酸反应)
(1)加入足量稀硫酸后观察到的现象是 ;
(2)计算该高碳钢样品中铁的质量分数(写出计算过程,结果精确到0.1%)。
9.向100g一定溶质质量分数的硫酸铜溶液中逐滴加入1.71%的氢氧化钡溶液,用数字化传感器测得溶液的电导率随氢氧化钡溶液质量的变化关系如图所示。
已知:电导率越大表示溶液的导电性越好,溶液浓度越大。
(1)C点表示的含义为 。
(2)向D点溶液滴加无色酚酞溶液,观察到 。
(3)计算硫酸铜溶液的溶质质量分数。
10.为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次 第2次 第3次 第4次 第5次
滴入稀硫酸的质量/g 25 25 25 25 25
生成气体的总质量/g 0.05 m 0.15 0.20 0.20
请完成下列问题:
(1)写出锌和稀硫酸反应的化学方程式 ;
(2)表中m的值为 ;
(3)银、锌合金中银的质量分数为 ;
(4)所用稀硫酸的溶质质量分数为 。
11.某中学化学学习小组的同学们在实验室用过氧化氢溶液制取氧气,并用如图所示方法测定过氧化氢溶液的溶质质量分数。
请完成下列分析及计算:
(1)实验产生氧气的质量是 g。
(2)求过氧化氢溶液的溶质质量分数(写出计算过程)。
12.合金常用来制造机械零件、仪表和日用品。为测定某黄铜(铜锌合金)中锌的质量分数,某化学小组进行了如图所示实验。
请分析并计算:
(1)生成氢气的总质量为 g。
(2)烧杯中剩余固体为 。
(3)计算该黄铜中锌的质量分数。
13.高纯碳酸钙被广泛应用于生产精密电子陶瓷、医药等。工业上利用氯化钙溶液制取高纯碳酸钙的原理为。
(1)现需制取150kg高纯碳酸钙,理论上需要溶质质量分数为11.1%的氯化钙溶液的质量是多少(写出计算过程)?
(2)为提高吸收率,需先向氯化钙溶液中通入,这样做的原因是 。
14.现有混有氢氧化钠的碳酸钠样品,取一定量的该样品,逐滴加入稀盐酸,反应中产生的气体的质量与稀盐酸的用量关系如图所示:
(1)反应中产生的气体的质量是 g。
(2)滴加的稀盐酸中溶质的质量分数。
15.同学们想知道实验室制取二氧化碳的剩余固体混合物(其成分是不溶于水也不反应的杂质、碳酸钙和氯化钙)中碳酸钙的质量,做了如下实验:
(1)发生反应的化学方程式为 ;
(2)反应生成氯化钙的质量是 ;
(3)若恒温蒸发掉 水,可以使最终所得溶液溶质质量分数为10%;
(4)化学小组同学取石灰石(杂质不与酸反应,也不溶于水)于烧杯中,向烧杯中加入200g稀盐酸恰好完全反应,反应后称得烧杯中物质的质量为211.2g。则加入的稀盐酸的溶质质量分数为 。
参考答案
1.(1)金属材料
(2)解:设火尖枪合金中铁的质量分数为x
答:火尖枪合金中铁的质量分数为98.2%。
【详解】(1)金属材料包括纯金属以及它们的合金,所以合金属于金属材料。
(2)火尖枪由铁、碳及少量其他非金属元素制成的合金打造而成,加入稀硫酸,只有铁能与稀硫酸发生反应,化学方程式为;根据图像,最终产生氢气的质量为0.2g,据此计算,见答案。
2.(1)
(2)解:设至少需要的质量为x
答:至少需要的质量为。
【详解】(1)由铵根离子和氟离子构成,氟离子带一个单位负电荷,属于阴离子,离子符号的书写,将数字和正负号标在元素符号的右上角,先写数字,后标正负号,数值为1,省略不写,离子符号为:F-;
(2)见答案。
3.(1)1:4
(2)解:设每消耗28.4g超氧化钾可以生成氧气的质量为x。
答:每消耗28.4g超氧化钾可以生成9.6克氧气。
【详解】(1)中碳和氧元素的质量比。
(2)详解见答案。
4.(1)3.2g
(2)解:设参加反应的过氧化钠的质量为x,生成氢氧化钠的质量为y,则
x=15.6g
y=16g
反应后所得溶液中溶质的质量为
反应后所得溶液中溶质的质量分数为
答:反应后所得溶液中溶质的质量分数为19.2%。
(3)设需加水的质量为z
z=96g
答:需加水的质量为96g。
【详解】(1)根据质量守恒定律,反应后减少的质量为生成氧气的质量,为:19.6g+87.6g-104g=3.2g;
(2)过程见答案;
(3)稀释前后,溶质的质量不变,过程见答案。
5.(1)变小
(2)解:设该瓶氢氧化钠溶液的溶质质量分数为x
恰好完全反应时消耗稀盐酸的质量为
x=10%
答:该瓶氢氧化钠溶液的溶质质量分数为10%。
【详解】(1)氢氧化钠溶液呈碱性,pH>7 ,逐滴加入稀盐酸,盐酸与氢氧化钠发生中和反应:,随着反应进行,氢氧化钠逐渐减少,碱性减弱,所以锥形瓶内溶液的pH会逐渐变小。
(2)根据图像,烧碱溶液的质量为,溶液恰好变为无色,即恰好完全反应时,消耗稀盐酸的质量为,据此计算,见答案。
6.(1)20%
(2)解:由图表可知,第二次加入稀硫酸固体减少的质量13.5g-7g=6.5g,第三次加入稀硫酸固体继续减少,说明第二加入硫酸样品中的锌没有完全反应,即第一次反应的锌的质量也是6.5g,即前两次加入稀硫酸反应的锌的质量为6.5+6.5g=13g,可设反应生成的硫酸锌质量为y,生成氢气质量为z。
则第二次加入稀硫酸后所得溶液溶质质量分数为
答:第二次加入稀硫酸反应后所得溶液溶质质量分数15.1%。
【详解】(1)由图表可知,黄铜中铜的质量为4g,第二次加入稀硫酸固体减少的质量13.5g-7g=6.5g,第三次加入稀硫酸固体继续减少,说明第二加入硫酸样品中的锌没有完全反应,即第一次反应的锌的质量也是6.5g,故黄铜样品的质量是6.5g+13.5g=20g,则黄铜中铜的质量分数=。
(2)详解见答案。
7.(1)FeCO3+2HCl=FeCl2+CO2↑+ H2O
(2)3.0
(3)7.0g
(4)9.1%
【详解】(1)稀盐酸和碳酸亚铁反应生成氯化铁、二氧化碳和水,反应的化学方程式为:FeCO3+2HCl=FeCl2+CO2↑+ H2O;
(2)第1次加入20.0g稀盐酸反应FeCO3质量为:10.0g-7.1g=2.9g;
第2次加入20.0g稀盐酸反应FeCO3质量为:7.1g-4.2g=2.9g;
第3次加入20.0g稀盐酸反应FeCO3质量为:4.2g-3.0g=1.2g,此时FeCO3已完全反应,则杂质的质量,即M=3.0;
(3)FeCO3的质量为10.0g-3.0g=7.0g;
(4)第1次加入20.0g稀盐酸反应FeCO3质量为:10.0g-7.1g=2.9g,设20.0g稀盐酸中HCl的质量为x,
x=1.825g,
实验中所用稀盐酸的溶质质量分数为×100%≈9.1%。
8.(1)产生大量气泡,固体部分溶解
(2)解:设高碳钢样品中铁的质量为x
高碳钢样品中铁的质量分数=
答:高碳钢样品中铁的质量分数为99.1%。
【详解】(1)高碳钢样品中的铁会与稀硫酸反应,碳不与稀硫酸反应。所以加入足量稀硫酸后观察到的现象是:产生大量气泡,固体部分溶解。
(2)过程见答案。
9.(1)硫酸铜与氢氧化钡恰好完全反应,此时溶液中离子浓度最小,电导率最低
(2)溶液变红
(3)解:设硫酸铜溶液的溶质质量分数为x
x=1.6%
答:硫酸铜溶液的溶质质量分数为1.6%。
【详解】(1)硫酸铜溶液中存在Cu2+和,氢氧化钡溶液中存在Ba2+和OH-,反应的化学方程式为。随着氢氧化钡溶液加入,离子不断结合成沉淀,溶液中离子浓度减小,电导率降低。C 点电导率最低,意味着此时硫酸铜与氢氧化钡恰好完全反应,溶液中几乎没有自由移动的离子。
(2)C 点二者恰好完全反应,D 点是继续滴加氢氧化钡溶液后的点,此时溶液中含有过量的氢氧化钡,氢氧化钡溶液呈碱性,无色酚酞溶液遇碱性溶液会变红。
(3)根据图像,恰好完全反应时消耗100g Ba(OH)2溶液,据此计算,见答案。
10.(1)
(2)0.10
(3)67.5%
(4)9.8%
【详解】(1)锌与稀硫酸反应生成硫酸锌和氢气,化学方程式为;
(2)锌与稀硫酸反应生成硫酸锌和氢气,银与稀硫酸不反应,称取20g银锌合金粉末进行实验,将125g稀硫酸分五次加入合金粉末中,由表格数据可知,第1次加入25g稀硫酸生成气体质量为0.05g,第4次加入25g稀硫酸生成气体质量为,说明每25g稀硫酸完全反应生成0.05g氢气,则第2次加入25g稀硫酸生成气体的总质量为,故m的值为0.10;
(3)由表格数据可知,第5次加入25g稀硫酸生成气体的质量为,说明第4次加入25g稀硫酸时锌与稀硫酸恰好完全反应,则生成氢气的总质量为0.20g,设锌的质量为x,
则银锌合金中银的质量分数为;
(4)由第(2)小问分析可知,每25g稀硫酸完全反应生成0.05g氢气,设所用稀硫酸的溶质质量分数为y,
答:所用稀硫酸的溶质质量分数为9.8%。
11.(1)1.6
(2)设过氧化氢溶液中H2O2的质量为x。
x=3.4g
溶质质量分数=×100%=3.4%
答:过氧化氢溶质质量分数为3.4%。
【详解】(1)过氧化氢在二氧化锰的催化下分解生成氧气和水,根据质量守恒定律,实验产生氧气的质量为400.0g-398.4g=1.6g;
(2)见答案。
12.(1)0.2
(2)铜/Cu
(3)设黄铜中锌的质量分数为x。
x= 65%。
答:该黄铜中锌的质量分数为65%。
【详解】(1)根据质量守恒定律,反应前后物质的总质量不变。反应前物质的总质量为黄铜样品质量10g与稀硫酸质量100g之和,即10g+50g=60g;反应后烧杯中物质总质量为59.8g。则生成氢气的质量=60g 59.8g=0.2g;
(2)金属活动性Zn>H>Cu,则锌能与稀硫酸反应生成硫酸锌与氢气,黄铜是铜锌合金,锌能与稀硫酸反应,铜不与稀硫酸反应。所以反应后烧杯中剩余固体为铜;
(3)见答案。
13.(1)解:设需要溶质质量分数为11.1%的氯化钙溶液的质量为x。
答:制取150kg高纯碳酸钙,理论上需要溶质质量分数为11.1%的氯化钙溶液的质量是1500kg。
(2)先通入使溶液呈碱性,有利于吸收
【详解】(1)见答案;
(2)为提高吸收率,需先向氯化钙溶液中通入,这样做的原因是先通入使溶液呈碱性,CO2溶于水形成酸性溶液,有利于吸收。
14.(1)2.2
(2)解:由图可知,生成气体消耗的盐酸的质量=30g 10g=20g
设稀盐酸中溶质的质量分数为x
=
x=18.25%
答:稀盐酸中溶质的质量分数为18.25%。
【详解】(1)由图可知,反应中产生的气体的质量是2.2g,故填2.2。
(2)见答案。
15.(1)
(2)11.1g
(3)5.7
(4)7.3%
【详解】(1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为.
(2)反应前固体混合物和稀盐酸溶液的质量和为26.1g+100g=126.1g,反应后减少的质量为生成的二氧化碳的质量,故生成二氧化碳的质量为:126.1g-5g-116.7g=4.4g,设,反应生成氯化钙的质量是x。
反应生成氯化钙的质量是11.1g。
(3)由(2)可知,滤液中的溶质氯化钙的质量为11.1g,蒸发溶剂前后溶质的质量不变,设蒸发掉的水的质量为y。
故恒温蒸发掉水的质量为5.7g。
(4)根据质量守恒定律,反应生成二氧化碳的质量为20g+200g-211.2g=8.8g,设加入的稀盐酸的溶质质量分数为z。
故加入的稀盐酸的溶质质量分数为7.3%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
