吉林省通化市梅河口市第五中学2024-2025学年高二下学期5月期中化学试卷(含答案)
文档属性
| 名称 | 吉林省通化市梅河口市第五中学2024-2025学年高二下学期5月期中化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 979.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-06 01:29:46 | ||
图片预览


文档简介
高二化学期中试题
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Cr-52 Zr-91
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1. 化学科学在科技强国中发挥着重要作用。下列有关叙述正确的是
A. “天舟六号”货运飞船太阳能电池板主要材料为晶体硅,是一种分子晶体
B. 新能源汽车领域使用的高导热率的氮化铝陶瓷属于新型金属材料
C “长征七号”使用碳纤维材料减轻火箭质量,碳纤维属于有机高分子材料
D. 朱雀二号遥二液氧甲烷运载火箭发射成功,甲烷是含有极性键的非极性分子
2. 下列化学用语或图示表达不正确的是
A. SO2的VSEPR模型: B. 顺-2-丁烯的结构简式:
C. 2-甲基戊烷的键线式: D. 乙烯分子中π键的形成:
3. 结构决定性质是化学学科的重要观念。下列叙述错误的是
A. 沸点:CH3COOH>HCOOCH3,主要与CH3COOH是极性分子有关
B. MgO的熔点高于NaCl的熔点
C. 冠醚识别碱金属离子,与微粒直径有关
D. 配位能力NH3大于H2O,向中加过量氨水可生成
4. 下列说法错误的是
A. 可用溴水鉴别苯、苯酚、己烯、酒精
B. 所有卤代烃都能发生消去反应生成相应的烯烃
C. 溴苯中含有少量Br2,可通过加入NaOH溶液,再用分液的方法分离
D. 红外光谱仪、核磁共振仪、X-射线衍射都可用于分析有机化合物的分子结构
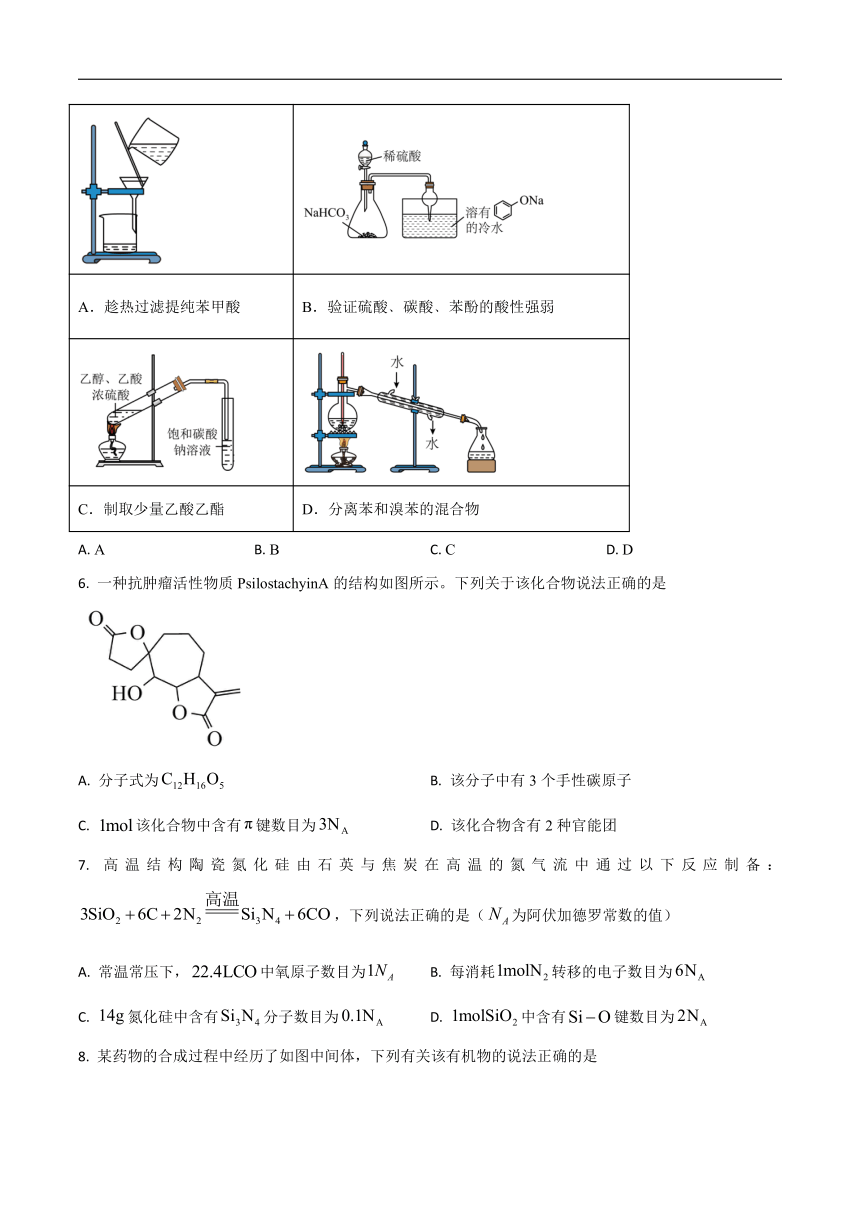
5. 下列实验装置不能达到实验目的的是
A.趁热过滤提纯苯甲酸 B.验证硫酸﹑碳酸﹑苯酚的酸性强弱
C.制取少量乙酸乙酯 D.分离苯和溴苯的混合物
A. A B. B C. C D. D
6. 一种抗肿瘤活性物质PsilostachyinA的结构如图所示。下列关于该化合物说法正确的是
A. 分子式为 B. 该分子中有3个手性碳原子
C. 该化合物中含有键数目为 D. 该化合物含有2种官能团
7. 高温结构陶瓷氮化硅由石英与焦炭在高温的氮气流中通过以下反应制备:,下列说法正确的是(为阿伏加德罗常数的值)
A. 常温常压下,中氧原子数目为 B. 每消耗转移的电子数目为
C. 氮化硅中含有分子数目为 D. 中含有键数目为
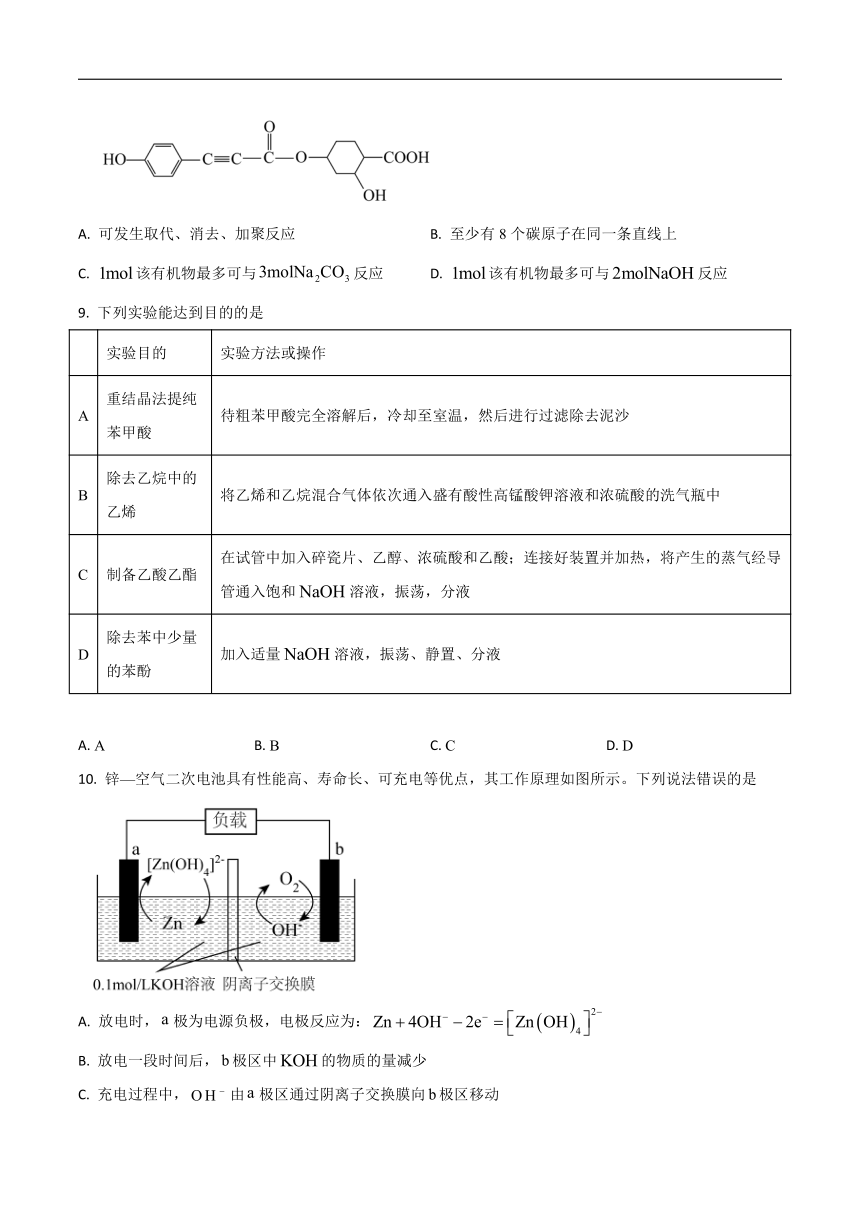
8. 某药物的合成过程中经历了如图中间体,下列有关该有机物的说法正确的是
A. 可发生取代、消去、加聚反应 B. 至少有8个碳原子在同一条直线上
C. 该有机物最多可与反应 D. 该有机物最多可与反应
9. 下列实验能达到目的的是
实验目的 实验方法或操作
A 重结晶法提纯苯甲酸 待粗苯甲酸完全溶解后,冷却至室温,然后进行过滤除去泥沙
B 除去乙烷中的乙烯 将乙烯和乙烷混合气体依次通入盛有酸性高锰酸钾溶液和浓硫酸的洗气瓶中
C 制备乙酸乙酯 在试管中加入碎瓷片、乙醇、浓硫酸和乙酸;连接好装置并加热,将产生的蒸气经导管通入饱和溶液,振荡,分液
D 除去苯中少量的苯酚 加入适量溶液,振荡、静置、分液
A. A B. B C. C D. D
10. 锌—空气二次电池具有性能高、寿命长、可充电等优点,其工作原理如图所示。下列说法错误的是
A. 放电时,极为电源负极,电极反应为:
B. 放电一段时间后,极区中的物质的量减少
C. 充电过程中,由极区通过阴离子交换膜向极区移动
D. 充电过程中,极产生(标准状况)时,极有生成
11. 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z原子核外最外层电子数是X核外电子数的一半。下列叙述不正确的是
A. WZ形成的晶体为离子晶体
B. 元素第一电离能的顺序为XC. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中原子均满足8电子稳定结构
12. 已知常温下溶液中CH3COOH和CH3COO-物质的量分数与pH的关系如图所示。下列说法正确的是
A. 图中曲线I表示的是CH3COO-
B. 常温下,Ka(CH3COOH)=1×10-4.7
C. 0.1mol L-1CH3COONa溶液中存在等式:c(Na+)+c(CH3COO-)=0.2mol L-1
D. 常温下,浓度均为0.1mol L-1的CH3COOH和CH3COONa混合溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
13. 硝酸废水是指含有硝酸或硝酸盐的废水,具有强酸性和强氧化性,能够氧化水中的有机物或无机物,使其变为难以降解或有毒的物质。工业上利用铝粉(掺少量炭粉)处理酸性污水中的硝酸盐,脱硝率达到94%,其原理如图所示。下列说法错误的是
A. 微电池中铝为负极,发生氧化反应
B. 正极反应式为
C. 当铝量一定时,污水中等氧化剂含量越高,脱硝率越低
D. 5.4g铝粉完全反应时理论上转移0.6mol电子
14. 下列“类比”结果正确的是
A. N2分子中存在NN键,化学性质稳定,则 的化学性质稳定
B. SO2的空间构型为V 形,则O3的空间构型也为V 形
C. 聚乙烯不能使溴水褪色,则聚乙炔也不能使溴水褪色
D. 甲苯能使酸性高锰酸钾溶液褪色,则苯的同系物(除苯)都能使酸性高锰酸钾溶液褪色
二、解答题
15.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子有 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 ,有关的离子方程式为 。
(3)取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明液中肯定有 , 有关的离子方程式为 。
(4)原溶液可能大量存在的阴离子是下列的 。
A.Cl- B. C.
16.碳酸锰()俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以为原料制备少量并研究其性质,由制备的实验流程:
已知:难溶于水、乙醇,潮湿的易被空气氧化。
请回答下列问题:
(1)仪器A的名称为 。
(2)在烧瓶中加入一定量的固体,滴加硫酸酸化的溶液,其反应的离子方程式 ,反应过程中随时间的变化曲线如图2所示,则tmin时,迅速增大的原因是 。
(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的溶液充分反应生成。生成的化学方程式为 。
(4)实验结束后,将装置A中的混合物过滤,用 洗涤滤渣,再低温烘干,即得到干燥的固体。
(5)已知既具有氧化性也具有还原性,某同学用(一般用30%)溶液代替草酸,请问是否可行?原因是: 。
(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量 (写出表达式)
17.碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
(1)某有机物的结构简式为,该有机物分子中采取杂化的原子对应元素的电负性由大到小的顺序为 。
(2)乙二胺分子中氮原子杂化类型为 。
(3)中阳离子的中心原子的价层电子对数为 ,该物质中不含有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.σ键 E.π键
(4)的空间结构为 ,其中心原子的杂化轨道类型为 。
18.(1)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(2)As4O6的分子结构如图所示,其中As原子的杂化方式为 。
(3)AlH4-中,Al原子的轨道杂化方式为 ;列举与AlH4-空间构型相同的一种离子和一种分子: 、 (填化学式)。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Br-Sn-Br的键角 120°(填“>”“<”或“=”)。
DCABD CBADB BBBB
15.(1)Cu2+、Fe3+
(2) Ag+ Ag++Cl-=AgCl↓
(3) Mg2+ H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓
(4)B
16.(1)三颈烧瓶
(2) 反应产生的对反应具有催化作用
(3)
(4)乙醇
(5)不行,过量的过氧化氢可能会氧化
(6)
17.(1) (2)杂化 (3)4 CE (4)三角锥形 杂化
18.(1)3∶1 sp2 (2)sp3 (3)sp3 NH4+ CH4 (4)sp2 <
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Al-27 S-32 Cl-35.5 Cr-52 Zr-91
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1. 化学科学在科技强国中发挥着重要作用。下列有关叙述正确的是
A. “天舟六号”货运飞船太阳能电池板主要材料为晶体硅,是一种分子晶体
B. 新能源汽车领域使用的高导热率的氮化铝陶瓷属于新型金属材料
C “长征七号”使用碳纤维材料减轻火箭质量,碳纤维属于有机高分子材料
D. 朱雀二号遥二液氧甲烷运载火箭发射成功,甲烷是含有极性键的非极性分子
2. 下列化学用语或图示表达不正确的是
A. SO2的VSEPR模型: B. 顺-2-丁烯的结构简式:
C. 2-甲基戊烷的键线式: D. 乙烯分子中π键的形成:
3. 结构决定性质是化学学科的重要观念。下列叙述错误的是
A. 沸点:CH3COOH>HCOOCH3,主要与CH3COOH是极性分子有关
B. MgO的熔点高于NaCl的熔点
C. 冠醚识别碱金属离子,与微粒直径有关
D. 配位能力NH3大于H2O,向中加过量氨水可生成
4. 下列说法错误的是
A. 可用溴水鉴别苯、苯酚、己烯、酒精
B. 所有卤代烃都能发生消去反应生成相应的烯烃
C. 溴苯中含有少量Br2,可通过加入NaOH溶液,再用分液的方法分离
D. 红外光谱仪、核磁共振仪、X-射线衍射都可用于分析有机化合物的分子结构
5. 下列实验装置不能达到实验目的的是
A.趁热过滤提纯苯甲酸 B.验证硫酸﹑碳酸﹑苯酚的酸性强弱
C.制取少量乙酸乙酯 D.分离苯和溴苯的混合物
A. A B. B C. C D. D
6. 一种抗肿瘤活性物质PsilostachyinA的结构如图所示。下列关于该化合物说法正确的是
A. 分子式为 B. 该分子中有3个手性碳原子
C. 该化合物中含有键数目为 D. 该化合物含有2种官能团
7. 高温结构陶瓷氮化硅由石英与焦炭在高温的氮气流中通过以下反应制备:,下列说法正确的是(为阿伏加德罗常数的值)
A. 常温常压下,中氧原子数目为 B. 每消耗转移的电子数目为
C. 氮化硅中含有分子数目为 D. 中含有键数目为
8. 某药物的合成过程中经历了如图中间体,下列有关该有机物的说法正确的是
A. 可发生取代、消去、加聚反应 B. 至少有8个碳原子在同一条直线上
C. 该有机物最多可与反应 D. 该有机物最多可与反应
9. 下列实验能达到目的的是
实验目的 实验方法或操作
A 重结晶法提纯苯甲酸 待粗苯甲酸完全溶解后,冷却至室温,然后进行过滤除去泥沙
B 除去乙烷中的乙烯 将乙烯和乙烷混合气体依次通入盛有酸性高锰酸钾溶液和浓硫酸的洗气瓶中
C 制备乙酸乙酯 在试管中加入碎瓷片、乙醇、浓硫酸和乙酸;连接好装置并加热,将产生的蒸气经导管通入饱和溶液,振荡,分液
D 除去苯中少量的苯酚 加入适量溶液,振荡、静置、分液
A. A B. B C. C D. D
10. 锌—空气二次电池具有性能高、寿命长、可充电等优点,其工作原理如图所示。下列说法错误的是
A. 放电时,极为电源负极,电极反应为:
B. 放电一段时间后,极区中的物质的量减少
C. 充电过程中,由极区通过阴离子交换膜向极区移动
D. 充电过程中,极产生(标准状况)时,极有生成
11. 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z原子核外最外层电子数是X核外电子数的一半。下列叙述不正确的是
A. WZ形成的晶体为离子晶体
B. 元素第一电离能的顺序为X
D. 该新化合物中原子均满足8电子稳定结构
12. 已知常温下溶液中CH3COOH和CH3COO-物质的量分数与pH的关系如图所示。下列说法正确的是
A. 图中曲线I表示的是CH3COO-
B. 常温下,Ka(CH3COOH)=1×10-4.7
C. 0.1mol L-1CH3COONa溶液中存在等式:c(Na+)+c(CH3COO-)=0.2mol L-1
D. 常温下,浓度均为0.1mol L-1的CH3COOH和CH3COONa混合溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
13. 硝酸废水是指含有硝酸或硝酸盐的废水,具有强酸性和强氧化性,能够氧化水中的有机物或无机物,使其变为难以降解或有毒的物质。工业上利用铝粉(掺少量炭粉)处理酸性污水中的硝酸盐,脱硝率达到94%,其原理如图所示。下列说法错误的是
A. 微电池中铝为负极,发生氧化反应
B. 正极反应式为
C. 当铝量一定时,污水中等氧化剂含量越高,脱硝率越低
D. 5.4g铝粉完全反应时理论上转移0.6mol电子
14. 下列“类比”结果正确的是
A. N2分子中存在NN键,化学性质稳定,则 的化学性质稳定
B. SO2的空间构型为V 形,则O3的空间构型也为V 形
C. 聚乙烯不能使溴水褪色,则聚乙炔也不能使溴水褪色
D. 甲苯能使酸性高锰酸钾溶液褪色,则苯的同系物(除苯)都能使酸性高锰酸钾溶液褪色
二、解答题
15.某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子有 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 ,有关的离子方程式为 。
(3)取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明液中肯定有 , 有关的离子方程式为 。
(4)原溶液可能大量存在的阴离子是下列的 。
A.Cl- B. C.
16.碳酸锰()俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以为原料制备少量并研究其性质,由制备的实验流程:
已知:难溶于水、乙醇,潮湿的易被空气氧化。
请回答下列问题:
(1)仪器A的名称为 。
(2)在烧瓶中加入一定量的固体,滴加硫酸酸化的溶液,其反应的离子方程式 ,反应过程中随时间的变化曲线如图2所示,则tmin时,迅速增大的原因是 。
(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的溶液充分反应生成。生成的化学方程式为 。
(4)实验结束后,将装置A中的混合物过滤,用 洗涤滤渣,再低温烘干,即得到干燥的固体。
(5)已知既具有氧化性也具有还原性,某同学用(一般用30%)溶液代替草酸,请问是否可行?原因是: 。
(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量 (写出表达式)
17.碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
(1)某有机物的结构简式为,该有机物分子中采取杂化的原子对应元素的电负性由大到小的顺序为 。
(2)乙二胺分子中氮原子杂化类型为 。
(3)中阳离子的中心原子的价层电子对数为 ,该物质中不含有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.σ键 E.π键
(4)的空间结构为 ,其中心原子的杂化轨道类型为 。
18.(1)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(2)As4O6的分子结构如图所示,其中As原子的杂化方式为 。
(3)AlH4-中,Al原子的轨道杂化方式为 ;列举与AlH4-空间构型相同的一种离子和一种分子: 、 (填化学式)。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Br-Sn-Br的键角 120°(填“>”“<”或“=”)。
DCABD CBADB BBBB
15.(1)Cu2+、Fe3+
(2) Ag+ Ag++Cl-=AgCl↓
(3) Mg2+ H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓
(4)B
16.(1)三颈烧瓶
(2) 反应产生的对反应具有催化作用
(3)
(4)乙醇
(5)不行,过量的过氧化氢可能会氧化
(6)
17.(1) (2)杂化 (3)4 CE (4)三角锥形 杂化
18.(1)3∶1 sp2 (2)sp3 (3)sp3 NH4+ CH4 (4)sp2 <
同课章节目录
