(8)晶体类型判断 高二化学人教版(2019)选择性必修二期末易错题集训(含解析)
文档属性
| 名称 | (8)晶体类型判断 高二化学人教版(2019)选择性必修二期末易错题集训(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 537.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-07 10:17:16 | ||
图片预览




文档简介
(8)晶体类型判断—高二化学人教版(2019)选择性必修二期末易错题集训
【易错点分析】易因混淆不同晶体的构成微粒、作用力及物理性质特征,出现晶体类型判断错误,如将分子晶体与原子晶体的硬度、熔沸点混淆,误判含金属元素的晶体为离子晶体而忽略金属晶体,或未依据化学键类型及晶体特性区分离子晶体、分子晶体和原子晶体,在根据物质性质或结构推断晶体类型的题目中频繁出错。
1.某化合物M的晶胞如图,下列说法不正确的是( )
A.该化合物化学式为,属于分子晶体
B.与Al之间的作用力为配位键
C.该化合物不稳定,受热易分解
D.∠Cl-Al-Cl键角比较:
2.类比和推理是中学化学学习的重要方法,下列推测合理的是( )
A 冰晶体中分子采用非密堆积 氨晶体中分子也采用非密堆积
B 晶体是分子晶体 晶体也是分子晶体
C 分子为正四面体形,键角为 分子也是正四面体形,键角也是
D 呈直线形,中心原子采用sp杂化 也呈直线形,中心原子也采用sp杂化
A.A B.B C.C D.D
3.下列物质所属晶体类型分类正确的是( )
共价晶体 分子晶体 离子晶体 金属晶体
A 石墨 绿矾 铝
B 氮化硼 干冰 氟化钠 铯
C 无定形碳 氯化氢 氯化铵 铂
D 白磷 乙醇 碱式碳酸铜 汞
A.A B.B C.C D.D
4.氨硼烷()分子结构和乙烷相似,是一种固体储氢材料。下列说法错误的是( )
A.键角:
B.固体氨硼烷为分子晶体
C.B元素位于元素周期表第二周期第IIA族
D.分子中N原子与B原子间形成了配位键
5.氮和氧是构建化合物的常见元素,某的晶胞如图。
下列说法不正确的是( )
A.该氮氧化物中N都呈价
B.该晶体中氮原子的杂化方式有两种
C.与足量红棕色气体反应生成的化学方程式为:
D.晶体类型是分子晶体
6.类比和推理是中学化学学习的重要方法,下列推测合理的是( )
A 冰晶体中分子采用非密堆积 氨晶体中分子也采用非密堆积
B 晶体是分子晶体 晶体也是分子晶体
C 分子为正四面体形,键角为109°28′ 分子也是正四面体形,键角也是109°28′
D 15-冠-5(冠醚)能通过配位键识别 12-冠-4(冠醚)也能通过配位键识别
A.A B.B C.C D.D
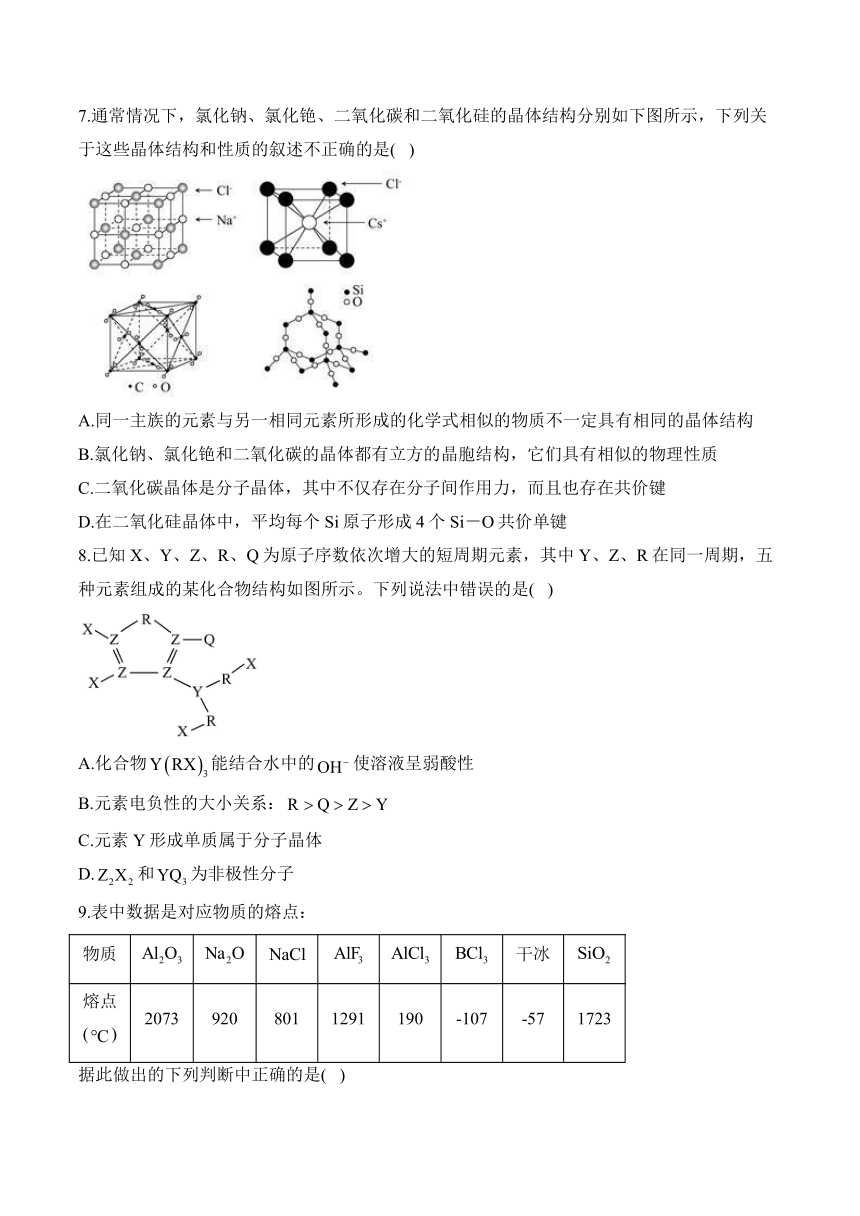
7.通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
8.已知X、Y、Z、R、Q为原子序数依次增大的短周期元素,其中Y、Z、R在同一周期,五种元素组成的某化合物结构如图所示。下列说法中错误的是( )
A.化合物能结合水中的使溶液呈弱酸性
B.元素电负性的大小关系:
C.元素Y形成单质属于分子晶体
D.和为非极性分子
9.表中数据是对应物质的熔点:
物质 干冰
熔点() 2073 920 801 1291 190 -107 -57 1723
据此做出的下列判断中正确的是( )
A.铝的化合物的晶体都是离子晶体
B.表中只有干冰和是分子晶体
C.同族元素的氧化物一定形成相同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X的某种单质在自然界硬度最大,Y在空气中含量最高,短周期中Z的金属性最强,W的周期数与主族序数相等。下列有关说法错误的是( )
A.第一电离能:WB.原子半径:YC.属于共价晶体
D.W的最高价氧化物对应的水化物具有两性
11.短周期元素X、Y、M原子半径依次减小,M与X、Y位于不同周期,它们组成的某离子液体阳离子结构如图所示。下列有关说法错误的是( )
A.X元素的单质,既可能是共价晶体,也可能是分子晶体
B.Y的简单氢化物既可溶于水,又可溶于甲醇
C.X的简单氢化物的空间结构为正四面体
D.X、Y均可与O形成原子个数比1∶2的酸性氧化物
12.将酞菁、钴酞菁、三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。已知酞菁分子中所有原子共平面,钴酞菁是由酞菁分子失去两个氢原子后与钴离子形成的配合物,气态通常以二聚体的形式存在,酞菁、钴酞菁以及二聚体的分子结构如下图所示。下列说法正确的是( )
A.酞菁分子内氮原子的杂化方式有两种
B.钴酞菁分子中,钴元素的化合价为+4
C.二聚体中Al的杂化轨道类型为
D.的熔点为1090℃,的熔点为192℃,两种物质属于不同的晶体类型
13.下列晶体中,化学键种类相同,晶体类型也相同的是( )
A.与 B.与 C.与 D.与
14.下列叙述中正确的有几项( )
①熔融状态能导电的化合物是离子化合物
②原子间以极性键结合而成的分子必定是极性分子
③在水中的溶解度比在水中的溶解度大
④极性分子中一定不含有非极性键
⑤分别与钠反应时,后者的反应更剧烈
⑥缺角的氯化钠晶体在饱和氯化钠溶液中慢慢变为完美的立方体块
⑦有共价键的晶体一定是共价晶体
A.2 B.3 C.4 D.5
15.SnO在微电子、气体传感器等应用方面潜力巨大。常见的型-SnO具有层状结构,熔点超过1000K,晶胞结构如下所示,晶胞边夹角均为90°。科研人员利用液态金属剥离法,克服了范德华力,实现了单层原子级厚度的SnO超薄二维材料的大面积制备。
下列说法正确的是( )
A.该晶体中可能含有共价键成分,晶体类型为共价晶体
B.该晶体中与Sn原子最近且距离相等的O原子有3个
C.该晶体中Sn原子构成的四面体空腔可容纳等小分子
D.制得的超薄二维材料具有共轭大键体系,可以导电
16.下列有关晶体结构的说法错误的是( )
A.金刚石、石墨为共价晶体,NaCl为离子晶体,干冰为分子晶体
B.金刚石、NaCl、石墨、干冰的配位数分别为4、6、3、12
C.金刚石、石墨、干冰晶体中C原子的杂化方式分别为、、sp
D.金刚石、NaCl、干冰的晶胞均属于立方晶胞
答案以及解析
1.答案:D
解析:A.根据晶胞结构,8个Al,24个Cl,8个,该化合物化学式为,属于分子晶体,A正确;
B.提供孤电子对,Al提供空轨道,与Al之间的作用力为配位键,B正确;
C.半径较小,空间阻碍大,配位键弱,且加热时易挥发,故受热易分解,C正确;
D.中Al为杂化,AlCl3中Al为杂化,∠Cl-Al-Cl键角比较:,D错误;
故选D。
2.答案:A
解析:A.冰晶体中水分子采用非密堆积,是因为冰晶体内部水分子间形成氢键的缘故;由此类比,因为氨分子间也可以形成氢键,所以氨晶体中氨分子也采用非密堆积,A正确;
B.二氧化硅晶体为共价晶体,B错误;
C.分子是正四面体形,结构为,键角为,C错误;
D.中心原子价层电子对数为2+=5,采用杂化,D错误;
故选A。
3.答案:B
解析:A.1个分子由60个碳原子构成,再由分子构成晶体,属于分子晶体,石墨为混合晶体,选项A错误;
B.氨化硼硬度大,熔点高,是共价晶体,干冰即的固态,属于分子晶体,氟化钠是离子化合物,属于离子晶体,金属铯是金属晶体,B正确;
C.无定形碳是由许多极其微小的、和石墨结构相似的晶体无秩序地排列起来而组成的,属于过渡晶体,C错误;
D.白磷分子由4个磷原子构成,再由分子构成白磷,是分子晶体,D错误;
本题选B。
4.答案:C
解析:A.二者的氮原子价层电子对数均为4,均为杂化,中N原子含有1个孤电子对,中的N原子不含有孤电子对,因为孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力,所以中H—N—H的键角大于中H—N—H的键角,故A正确;
B.氨硼烷为氨分子与硼化氢分子通过配位键形成的熔沸点低的分子晶体,故B正确;
C.硼为第5号元素,因此位于元素周期表中第二周期第ⅢA族,故C错误;
D.氨分子中具有孤对电子的氮原子能与硼化氢分子中具有空轨道的硼原子通过形成配位键而反应生成氨硼烷,故D正确;
故答案选C。
5.答案:D
解析:根据晶胞中N原子和O原子的结合可知,晶胞中存在2种微粒,一种为:;一种为:,则晶体类型为:离子晶体,据此分析解答。
A.晶体中,O元素的化合价为价,根据化合物中正负化合价代数和为0原则,得到N元素化合价为价,A正确;
B.根据分析,在中的孤对电子为,则微粒VSEPR模型为直线形,中心N原子杂化类型为:;在中的孤对电子为,则微粒VSEPR模型为平面三角形,中心N原子杂化类型为:,B正确;
C.具有强氧化性,在将氧化为时,还有生成,反应的化学方程式为:,C正确;
D.根据分析,晶体类型为:离子晶体,D错误;
故答案为:D。
6.答案:A
解析:A.冰晶体中水分子采用非密堆积,是因为冰晶体内部水分子间形成氢键的缘故;由此类比,因为氨分子间也可以形成氢键,所以氨晶体中氨分子也采用非密堆积,A正确;
B.二氧化硅晶体为共价晶体,B错误;
C.分子是正四面体形,结构为,键角为60°,C错误;
D.12-冠-4(冠醚)的空腔直径较小,不能识别,D错误;
故选A。
7.答案:B
解析:和的化学式相似,但其晶体结构不同,A项正确;
二氧化碳为分子晶体,氯化钠和氯化铯为离子晶体,所以物理性质不同,B错误;
二氧化碳为分子晶体,分子间存在分子间作用力,而分子内部碳原子和氧原子间形成共价键C正确;
根据二氧化硅的结构可判断D项正确。
答案选B。
8.答案:C
解析:由题干信息可知,X、Y、Z、R、Q为原子序数依次增大的短周期元素,其中Y、Z、R在同一周期,则X为第一周期元素即为H,Q为第3周期元素,结合化合物结构式可知,Y形成3个共价键,Z形成4个共价键,R形成2个共价键,Q形成1个共价键,即Y为B,Z为C,R为O,Q为Cl,据此分析解题。
A.由分析可知,Y为B、R为O、X为H,化合物即为,由于B中存在空轨道能够接受中的孤电子对形成配位键,即能结合水中的使溶液呈弱酸性,A正确;
B.非金属性越强,电负性越大:电负性:,B正确;
C.由分析可知,Y为B,元素Y形成单质为晶体硼,属于共价晶体,C错误;
D.为,其结构对称,是直线形分子,属于非极性分子,为其中B的价层电子对数是,无孤对电子,平面三角形结构,也是非极性分子,D正确;
故选C。
9.答案:D
解析:A.根据上述分析,氯化铝为分子晶体,故A错误;
B.氯化铝、氯化硼、干冰为分子晶体,故B错误;
C.C、Si属于同主族,干冰为分子晶体,二氧化硅为原子晶体,故C错误;
D.氯化钠与氟化铝都是离子晶体,故D正确;
答案为D。
10.答案:C
解析:根据题中信息,X的某种单质在自然界硬度最大,则X的单质为金刚石;Y在空气中含量最高,则Y的单质为氮气;短周期中Z的金属性最强,则为金属钠;W的周期数与主族序数相等,则为铝。可知X、Y、Z、W分别是碳、氮、钠、铝,据此解答。
A.第一电离能CB.电子层数越多,半径越大,电子层数相同,核电荷数越大,半径越小,得原子半径:NC.由金属和非金属构成,属于离子晶体,故C错误;
D.W的最高价氧化物对应的水化物,具有两性,故D正确;
答案选C。
11.答案:D
解析:根据该阳离子中各原子成键数目可知,M为第ⅠA族或第ⅦA族元素,X为第ⅣA族元素,Y为第ⅤA族元素,X、Y可形成双键,可知X为C,再结合“X、Y、M原子半径依次减小,M与X、Y位于不同周期”推知,X、Y、M依次为C、N、H,以此分析;
A.C元素可形成多种单质,既可能是共价晶体:金刚石,也可能是分子晶体:C60,A项正确;
B.N的简单氢化物与间均可形成氢键,所以既可溶于水,又可溶于甲醇,B项正确;
C.X的简单氢化物为,空间结构为正四面体,C项正确;
D.是酸性氧化物,不是酸性氧化物,D项错误;
故答案为:D。
12.答案:D
解析:A.由题目信息可知,酞菁分子中所有原子共平面,则酞菁分子中的N原子的杂化方式均为,其中③号N原子分别与2个碳原子和1个氢原子形成σ键,剩下一对电子未参与p轨道的杂化,参与形成了大π键,而①②号N原子的杂化轨道类型为杂化,孤电子对参与杂化,孤电子对为杂化轨道的电子,剩余一个单电子参与形成大π键,故③号N原子的p轨道能提供一对电子,A错误;
B.根据题图可知,由酞菁分子形成配合物钴酞菁时,酞菁分子中失去了两个带正电荷的H原子,使③号N原子各带一个单位负电荷,为保证钴酞菁整体呈现电中性,则应该是+2价钴离子与之配合形成钴酞菁分子,B错误;
C.根据形成的二聚体结构可知每个Al和4个Cl成键,杂化轨道类型为杂化,C错误;
D.的熔点为1090℃,的熔点为192℃,的熔点远高于的熔点,前者属于离子晶体,后者属于分子晶体,两种物质属于不同的晶体类型,D正确;
故选D。
13.答案:C
解析:A.和中都只存在共价键,但是共价晶体、是分子晶体,A错误;
B.NaCl中存在离子键,是离子晶体,而HCl只存在共价键,是分子晶体,B错误;
C.CO与NO均只存在共价键,均为分子晶体,C正确;
D.中存在共价键,由分子构成的,为分子晶体,KCl中只存在离子键,为离子晶体,D错误;
故选C。
14.答案:C
解析:①熔融状态能导电的化合物,说明含有可自由移动的离子,说明该化合物为离子化合物,①正确;
②原子间以极性键结合而成的分子不一定是极性分子,如原子间以极性键结合,却是非极性分子,②错误;
③是极性分子,是非极性分子。根据“相似相溶”原理,在水中的溶解度比更大,③正确;
④极性分子中可能含有非极性键。例如(极性分子)含有O-O非极性键,④错误;
⑤电负性F>C>H,的羟基极性强于,因此二者与钠反应,后者反应更剧烈,⑤正确;
⑥缺角的NaCl晶体在饱和溶液中会通过溶解-结晶平衡修复为完整立方体,体现晶体的自范性,⑥正确;
⑦含共价键的晶体不一定是共价晶体。例如NaOH晶体含离子键和共价键,但属于离子晶体,⑦错误;
正确的选项为①、③、⑤、⑥,共4项,对应选项C。
15.答案:C
解析:根据题干“常见的型-SnO具有层状结构”,并且“利用液态金属剥离法,克服了范德华力,实现了单层原子级厚度的SnO超薄二维材料的大面积制备”,可以推测该品体中不仅含有化学键,还有类似石墨的层间范德华力,属于混合品体,A错误;
由晶胞的平移对称性可知,该晶体中与Sn原子最近且距离相等的O原子有4个,B错误;C正确;
共轭大键体系需要所有原子共平面且参与共轭的p轨道互相平行且重叠,该晶体中的层状结构不能满足以上条件,D错误。
16.答案:A
解析:石墨为混合型晶体,故A错误;根据晶胞图可得金刚石、NaCl、石墨、干冰的配位数分别为4、6、3、12,故B正确;金刚石中C原子均形成4个化学键,为杂化,石墨为平面结构,为杂化,干冰分子中OCO为直线形,为sp杂化,故C正确;根据晶胞图可看出金刚石、NaCl、干冰的晶胞均属于立方晶胞,故D正确。
【易错点分析】易因混淆不同晶体的构成微粒、作用力及物理性质特征,出现晶体类型判断错误,如将分子晶体与原子晶体的硬度、熔沸点混淆,误判含金属元素的晶体为离子晶体而忽略金属晶体,或未依据化学键类型及晶体特性区分离子晶体、分子晶体和原子晶体,在根据物质性质或结构推断晶体类型的题目中频繁出错。
1.某化合物M的晶胞如图,下列说法不正确的是( )
A.该化合物化学式为,属于分子晶体
B.与Al之间的作用力为配位键
C.该化合物不稳定,受热易分解
D.∠Cl-Al-Cl键角比较:
2.类比和推理是中学化学学习的重要方法,下列推测合理的是( )
A 冰晶体中分子采用非密堆积 氨晶体中分子也采用非密堆积
B 晶体是分子晶体 晶体也是分子晶体
C 分子为正四面体形,键角为 分子也是正四面体形,键角也是
D 呈直线形,中心原子采用sp杂化 也呈直线形,中心原子也采用sp杂化
A.A B.B C.C D.D
3.下列物质所属晶体类型分类正确的是( )
共价晶体 分子晶体 离子晶体 金属晶体
A 石墨 绿矾 铝
B 氮化硼 干冰 氟化钠 铯
C 无定形碳 氯化氢 氯化铵 铂
D 白磷 乙醇 碱式碳酸铜 汞
A.A B.B C.C D.D
4.氨硼烷()分子结构和乙烷相似,是一种固体储氢材料。下列说法错误的是( )
A.键角:
B.固体氨硼烷为分子晶体
C.B元素位于元素周期表第二周期第IIA族
D.分子中N原子与B原子间形成了配位键
5.氮和氧是构建化合物的常见元素,某的晶胞如图。
下列说法不正确的是( )
A.该氮氧化物中N都呈价
B.该晶体中氮原子的杂化方式有两种
C.与足量红棕色气体反应生成的化学方程式为:
D.晶体类型是分子晶体
6.类比和推理是中学化学学习的重要方法,下列推测合理的是( )
A 冰晶体中分子采用非密堆积 氨晶体中分子也采用非密堆积
B 晶体是分子晶体 晶体也是分子晶体
C 分子为正四面体形,键角为109°28′ 分子也是正四面体形,键角也是109°28′
D 15-冠-5(冠醚)能通过配位键识别 12-冠-4(冠醚)也能通过配位键识别
A.A B.B C.C D.D
7.通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
8.已知X、Y、Z、R、Q为原子序数依次增大的短周期元素,其中Y、Z、R在同一周期,五种元素组成的某化合物结构如图所示。下列说法中错误的是( )
A.化合物能结合水中的使溶液呈弱酸性
B.元素电负性的大小关系:
C.元素Y形成单质属于分子晶体
D.和为非极性分子
9.表中数据是对应物质的熔点:
物质 干冰
熔点() 2073 920 801 1291 190 -107 -57 1723
据此做出的下列判断中正确的是( )
A.铝的化合物的晶体都是离子晶体
B.表中只有干冰和是分子晶体
C.同族元素的氧化物一定形成相同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
10.短周期主族元素X、Y、Z、W的原子序数依次增大,X的某种单质在自然界硬度最大,Y在空气中含量最高,短周期中Z的金属性最强,W的周期数与主族序数相等。下列有关说法错误的是( )
A.第一电离能:W
D.W的最高价氧化物对应的水化物具有两性
11.短周期元素X、Y、M原子半径依次减小,M与X、Y位于不同周期,它们组成的某离子液体阳离子结构如图所示。下列有关说法错误的是( )
A.X元素的单质,既可能是共价晶体,也可能是分子晶体
B.Y的简单氢化物既可溶于水,又可溶于甲醇
C.X的简单氢化物的空间结构为正四面体
D.X、Y均可与O形成原子个数比1∶2的酸性氧化物
12.将酞菁、钴酞菁、三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。已知酞菁分子中所有原子共平面,钴酞菁是由酞菁分子失去两个氢原子后与钴离子形成的配合物,气态通常以二聚体的形式存在,酞菁、钴酞菁以及二聚体的分子结构如下图所示。下列说法正确的是( )
A.酞菁分子内氮原子的杂化方式有两种
B.钴酞菁分子中,钴元素的化合价为+4
C.二聚体中Al的杂化轨道类型为
D.的熔点为1090℃,的熔点为192℃,两种物质属于不同的晶体类型
13.下列晶体中,化学键种类相同,晶体类型也相同的是( )
A.与 B.与 C.与 D.与
14.下列叙述中正确的有几项( )
①熔融状态能导电的化合物是离子化合物
②原子间以极性键结合而成的分子必定是极性分子
③在水中的溶解度比在水中的溶解度大
④极性分子中一定不含有非极性键
⑤分别与钠反应时,后者的反应更剧烈
⑥缺角的氯化钠晶体在饱和氯化钠溶液中慢慢变为完美的立方体块
⑦有共价键的晶体一定是共价晶体
A.2 B.3 C.4 D.5
15.SnO在微电子、气体传感器等应用方面潜力巨大。常见的型-SnO具有层状结构,熔点超过1000K,晶胞结构如下所示,晶胞边夹角均为90°。科研人员利用液态金属剥离法,克服了范德华力,实现了单层原子级厚度的SnO超薄二维材料的大面积制备。
下列说法正确的是( )
A.该晶体中可能含有共价键成分,晶体类型为共价晶体
B.该晶体中与Sn原子最近且距离相等的O原子有3个
C.该晶体中Sn原子构成的四面体空腔可容纳等小分子
D.制得的超薄二维材料具有共轭大键体系,可以导电
16.下列有关晶体结构的说法错误的是( )
A.金刚石、石墨为共价晶体,NaCl为离子晶体,干冰为分子晶体
B.金刚石、NaCl、石墨、干冰的配位数分别为4、6、3、12
C.金刚石、石墨、干冰晶体中C原子的杂化方式分别为、、sp
D.金刚石、NaCl、干冰的晶胞均属于立方晶胞
答案以及解析
1.答案:D
解析:A.根据晶胞结构,8个Al,24个Cl,8个,该化合物化学式为,属于分子晶体,A正确;
B.提供孤电子对,Al提供空轨道,与Al之间的作用力为配位键,B正确;
C.半径较小,空间阻碍大,配位键弱,且加热时易挥发,故受热易分解,C正确;
D.中Al为杂化,AlCl3中Al为杂化,∠Cl-Al-Cl键角比较:,D错误;
故选D。
2.答案:A
解析:A.冰晶体中水分子采用非密堆积,是因为冰晶体内部水分子间形成氢键的缘故;由此类比,因为氨分子间也可以形成氢键,所以氨晶体中氨分子也采用非密堆积,A正确;
B.二氧化硅晶体为共价晶体,B错误;
C.分子是正四面体形,结构为,键角为,C错误;
D.中心原子价层电子对数为2+=5,采用杂化,D错误;
故选A。
3.答案:B
解析:A.1个分子由60个碳原子构成,再由分子构成晶体,属于分子晶体,石墨为混合晶体,选项A错误;
B.氨化硼硬度大,熔点高,是共价晶体,干冰即的固态,属于分子晶体,氟化钠是离子化合物,属于离子晶体,金属铯是金属晶体,B正确;
C.无定形碳是由许多极其微小的、和石墨结构相似的晶体无秩序地排列起来而组成的,属于过渡晶体,C错误;
D.白磷分子由4个磷原子构成,再由分子构成白磷,是分子晶体,D错误;
本题选B。
4.答案:C
解析:A.二者的氮原子价层电子对数均为4,均为杂化,中N原子含有1个孤电子对,中的N原子不含有孤电子对,因为孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力,所以中H—N—H的键角大于中H—N—H的键角,故A正确;
B.氨硼烷为氨分子与硼化氢分子通过配位键形成的熔沸点低的分子晶体,故B正确;
C.硼为第5号元素,因此位于元素周期表中第二周期第ⅢA族,故C错误;
D.氨分子中具有孤对电子的氮原子能与硼化氢分子中具有空轨道的硼原子通过形成配位键而反应生成氨硼烷,故D正确;
故答案选C。
5.答案:D
解析:根据晶胞中N原子和O原子的结合可知,晶胞中存在2种微粒,一种为:;一种为:,则晶体类型为:离子晶体,据此分析解答。
A.晶体中,O元素的化合价为价,根据化合物中正负化合价代数和为0原则,得到N元素化合价为价,A正确;
B.根据分析,在中的孤对电子为,则微粒VSEPR模型为直线形,中心N原子杂化类型为:;在中的孤对电子为,则微粒VSEPR模型为平面三角形,中心N原子杂化类型为:,B正确;
C.具有强氧化性,在将氧化为时,还有生成,反应的化学方程式为:,C正确;
D.根据分析,晶体类型为:离子晶体,D错误;
故答案为:D。
6.答案:A
解析:A.冰晶体中水分子采用非密堆积,是因为冰晶体内部水分子间形成氢键的缘故;由此类比,因为氨分子间也可以形成氢键,所以氨晶体中氨分子也采用非密堆积,A正确;
B.二氧化硅晶体为共价晶体,B错误;
C.分子是正四面体形,结构为,键角为60°,C错误;
D.12-冠-4(冠醚)的空腔直径较小,不能识别,D错误;
故选A。
7.答案:B
解析:和的化学式相似,但其晶体结构不同,A项正确;
二氧化碳为分子晶体,氯化钠和氯化铯为离子晶体,所以物理性质不同,B错误;
二氧化碳为分子晶体,分子间存在分子间作用力,而分子内部碳原子和氧原子间形成共价键C正确;
根据二氧化硅的结构可判断D项正确。
答案选B。
8.答案:C
解析:由题干信息可知,X、Y、Z、R、Q为原子序数依次增大的短周期元素,其中Y、Z、R在同一周期,则X为第一周期元素即为H,Q为第3周期元素,结合化合物结构式可知,Y形成3个共价键,Z形成4个共价键,R形成2个共价键,Q形成1个共价键,即Y为B,Z为C,R为O,Q为Cl,据此分析解题。
A.由分析可知,Y为B、R为O、X为H,化合物即为,由于B中存在空轨道能够接受中的孤电子对形成配位键,即能结合水中的使溶液呈弱酸性,A正确;
B.非金属性越强,电负性越大:电负性:,B正确;
C.由分析可知,Y为B,元素Y形成单质为晶体硼,属于共价晶体,C错误;
D.为,其结构对称,是直线形分子,属于非极性分子,为其中B的价层电子对数是,无孤对电子,平面三角形结构,也是非极性分子,D正确;
故选C。
9.答案:D
解析:A.根据上述分析,氯化铝为分子晶体,故A错误;
B.氯化铝、氯化硼、干冰为分子晶体,故B错误;
C.C、Si属于同主族,干冰为分子晶体,二氧化硅为原子晶体,故C错误;
D.氯化钠与氟化铝都是离子晶体,故D正确;
答案为D。
10.答案:C
解析:根据题中信息,X的某种单质在自然界硬度最大,则X的单质为金刚石;Y在空气中含量最高,则Y的单质为氮气;短周期中Z的金属性最强,则为金属钠;W的周期数与主族序数相等,则为铝。可知X、Y、Z、W分别是碳、氮、钠、铝,据此解答。
A.第一电离能C
D.W的最高价氧化物对应的水化物,具有两性,故D正确;
答案选C。
11.答案:D
解析:根据该阳离子中各原子成键数目可知,M为第ⅠA族或第ⅦA族元素,X为第ⅣA族元素,Y为第ⅤA族元素,X、Y可形成双键,可知X为C,再结合“X、Y、M原子半径依次减小,M与X、Y位于不同周期”推知,X、Y、M依次为C、N、H,以此分析;
A.C元素可形成多种单质,既可能是共价晶体:金刚石,也可能是分子晶体:C60,A项正确;
B.N的简单氢化物与间均可形成氢键,所以既可溶于水,又可溶于甲醇,B项正确;
C.X的简单氢化物为,空间结构为正四面体,C项正确;
D.是酸性氧化物,不是酸性氧化物,D项错误;
故答案为:D。
12.答案:D
解析:A.由题目信息可知,酞菁分子中所有原子共平面,则酞菁分子中的N原子的杂化方式均为,其中③号N原子分别与2个碳原子和1个氢原子形成σ键,剩下一对电子未参与p轨道的杂化,参与形成了大π键,而①②号N原子的杂化轨道类型为杂化,孤电子对参与杂化,孤电子对为杂化轨道的电子,剩余一个单电子参与形成大π键,故③号N原子的p轨道能提供一对电子,A错误;
B.根据题图可知,由酞菁分子形成配合物钴酞菁时,酞菁分子中失去了两个带正电荷的H原子,使③号N原子各带一个单位负电荷,为保证钴酞菁整体呈现电中性,则应该是+2价钴离子与之配合形成钴酞菁分子,B错误;
C.根据形成的二聚体结构可知每个Al和4个Cl成键,杂化轨道类型为杂化,C错误;
D.的熔点为1090℃,的熔点为192℃,的熔点远高于的熔点,前者属于离子晶体,后者属于分子晶体,两种物质属于不同的晶体类型,D正确;
故选D。
13.答案:C
解析:A.和中都只存在共价键,但是共价晶体、是分子晶体,A错误;
B.NaCl中存在离子键,是离子晶体,而HCl只存在共价键,是分子晶体,B错误;
C.CO与NO均只存在共价键,均为分子晶体,C正确;
D.中存在共价键,由分子构成的,为分子晶体,KCl中只存在离子键,为离子晶体,D错误;
故选C。
14.答案:C
解析:①熔融状态能导电的化合物,说明含有可自由移动的离子,说明该化合物为离子化合物,①正确;
②原子间以极性键结合而成的分子不一定是极性分子,如原子间以极性键结合,却是非极性分子,②错误;
③是极性分子,是非极性分子。根据“相似相溶”原理,在水中的溶解度比更大,③正确;
④极性分子中可能含有非极性键。例如(极性分子)含有O-O非极性键,④错误;
⑤电负性F>C>H,的羟基极性强于,因此二者与钠反应,后者反应更剧烈,⑤正确;
⑥缺角的NaCl晶体在饱和溶液中会通过溶解-结晶平衡修复为完整立方体,体现晶体的自范性,⑥正确;
⑦含共价键的晶体不一定是共价晶体。例如NaOH晶体含离子键和共价键,但属于离子晶体,⑦错误;
正确的选项为①、③、⑤、⑥,共4项,对应选项C。
15.答案:C
解析:根据题干“常见的型-SnO具有层状结构”,并且“利用液态金属剥离法,克服了范德华力,实现了单层原子级厚度的SnO超薄二维材料的大面积制备”,可以推测该品体中不仅含有化学键,还有类似石墨的层间范德华力,属于混合品体,A错误;
由晶胞的平移对称性可知,该晶体中与Sn原子最近且距离相等的O原子有4个,B错误;C正确;
共轭大键体系需要所有原子共平面且参与共轭的p轨道互相平行且重叠,该晶体中的层状结构不能满足以上条件,D错误。
16.答案:A
解析:石墨为混合型晶体,故A错误;根据晶胞图可得金刚石、NaCl、石墨、干冰的配位数分别为4、6、3、12,故B正确;金刚石中C原子均形成4个化学键,为杂化,石墨为平面结构,为杂化,干冰分子中OCO为直线形,为sp杂化,故C正确;根据晶胞图可看出金刚石、NaCl、干冰的晶胞均属于立方晶胞,故D正确。
同课章节目录
