河北省“五个一”名校联盟2025届高三下学期4月第二次联考化学试卷 (含答案)
文档属性
| 名称 | 河北省“五个一”名校联盟2025届高三下学期4月第二次联考化学试卷 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-06 12:11:18 | ||
图片预览


文档简介
河北省五个一名校联盟2025届高三下学期第二次模拟考试化学试题
一、单选题
1.河北省的考古发掘成果展示了河北悠久而辉煌的历史。下列文物属于金属材料制品的是
A.西汉错金博山炉 B.元青花云龙纹食盒
C.骨笛 D.宋海棠花式玛瑙碗
A.A B.B C.C D.D
2.下列化学用语或图示表达错误的是
A.的电子式:
B.分子的空间结构模型:
C.的名称:2-甲基-2-丁烯
D.基态Cu原子的价层电子轨道表示式:
3.化学之美,外美于现象,内美于原理。下列说法错误的是
A.清晨树林里梦幻般的光束源于丁达尔效应
B.降温后水结冰形成晶莹剔透的晶体,氢键数目增加
C.节日燃放的五颜六色的烟花与原子吸收光谱的原理相同
D.缺角的氯化钠晶体在饱和溶液中变为完美的立方体
4.除去下列物质中括号内的杂质,所选用的试剂或方法正确的是
A.溶液:插入铜片,过滤
B.乙酰苯胺():将混合物溶于乙醇后,重结晶
C.溶液:通入过量,充分反应后过滤
D.硬脂酸钠(甘油):加入过量的浓氯化钠溶液,盐析、过滤
5.连二亚硫酸钠(),又称保险粉,具有很强的还原性,其水溶液能被空气中的氧气氧化:。代表阿伏加德罗常数的值。下列说法正确的是
A.消耗,转移的电子数为
B.分子中含有的中子数为
C.的溶液中,数目为
D.的溶液中含有的数目为
6.化学知识繁杂,充分利用类比、迁移等方法有助于学习化学。下列类比、迁移正确的是
A.HF的分子间氢键强度大于水的分子间氢键,因此HF的沸点更高
B.聚乙烯不能使溴水褪色,则聚乙炔也不能使溴水褪色
C.与能反应生成S,则与NO能在一定条件下反应生成
D.的溶解度小于,则的溶解度也小于
7.已知:、、、、为原子序数依次增大的短周期主族元素,和同主族。由上述元素形成的化合物可用于治疗心脑血管疾病,其结构如图所示,下列说法正确的是
A.简单氢化物沸点:
B.由、、三种元素形成的化合物可能为离子化合物
C.化合物中所有原子均满足8电子稳定结构
D.最高价氧化物对应水化物的酸性:
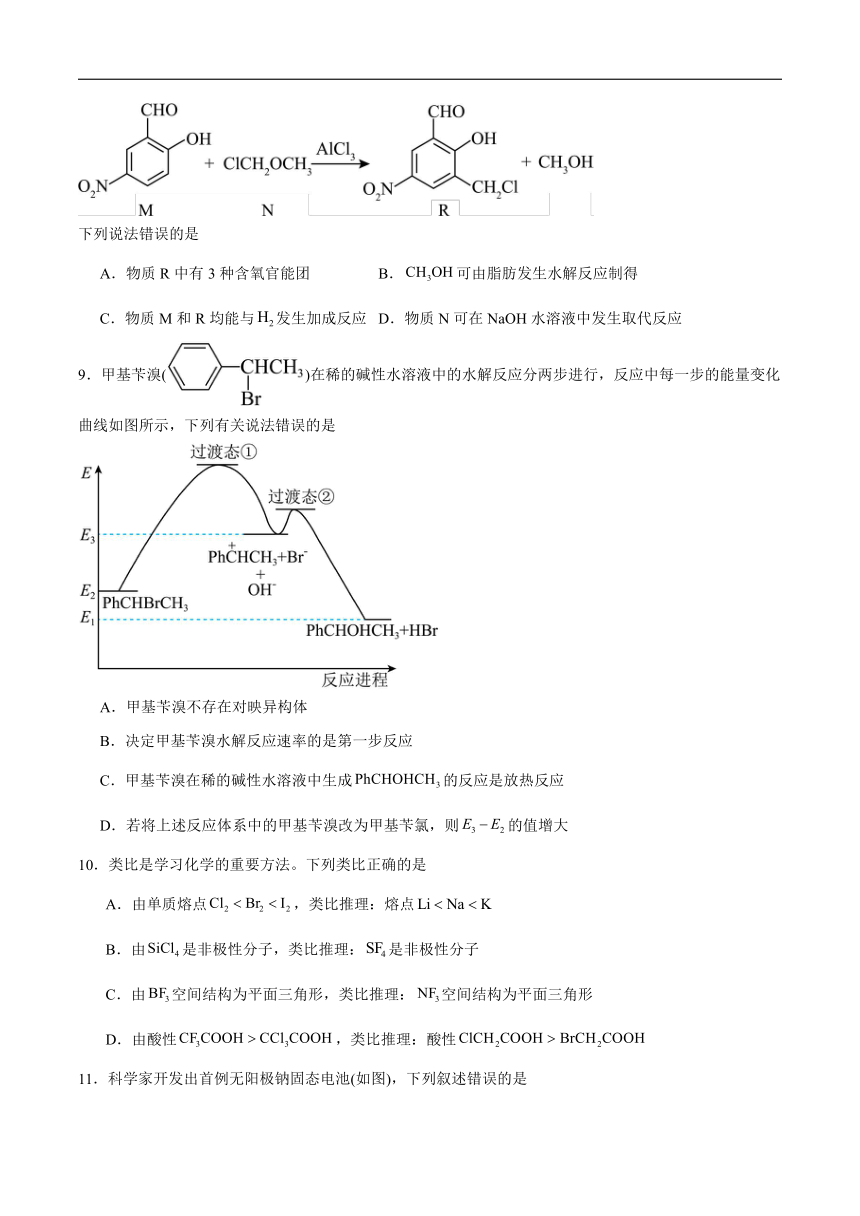
8.傅-克酰基化反应在制备上很有价值,工业生产及实验室常用它来制备芳香酮。有机物M经傅-克酰基化转化为R的反应原理如图:
下列说法错误的是
A.物质R中有3种含氧官能团 B.可由脂肪发生水解反应制得
C.物质M和R均能与发生加成反应 D.物质N可在NaOH水溶液中发生取代反应
9.甲基苄溴()在稀的碱性水溶液中的水解反应分两步进行,反应中每一步的能量变化曲线如图所示,下列有关说法错误的是
A.甲基苄溴不存在对映异构体
B.决定甲基苄溴水解反应速率的是第一步反应
C.甲基苄溴在稀的碱性水溶液中生成的反应是放热反应
D.若将上述反应体系中的甲基苄溴改为甲基苄氯,则的值增大
10.类比是学习化学的重要方法。下列类比正确的是
A.由单质熔点,类比推理:熔点
B.由是非极性分子,类比推理:是非极性分子
C.由空间结构为平面三角形,类比推理:空间结构为平面三角形
D.由酸性,类比推理:酸性
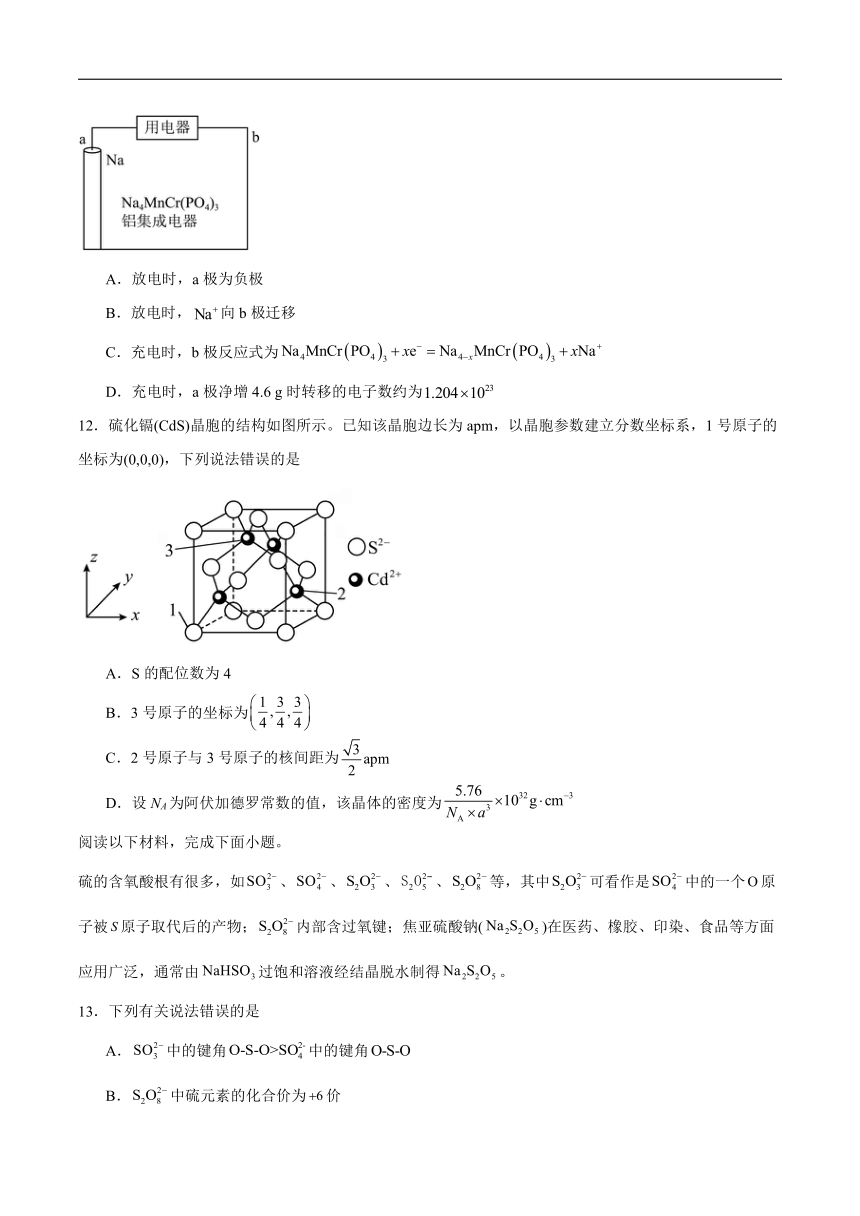
11.科学家开发出首例无阳极钠固态电池(如图),下列叙述错误的是
A.放电时,a极为负极
B.放电时,向b极迁移
C.充电时,b极反应式为
D.充电时,a极净增4.6 g时转移的电子数约为
12.硫化镉(CdS)晶胞的结构如图所示。已知该晶胞边长为apm,以晶胞参数建立分数坐标系,1号原子的坐标为(0,0,0),下列说法错误的是
A.S的配位数为4
B.3号原子的坐标为
C.2号原子与3号原子的核间距为
D.设NA为阿伏加德罗常数的值,该晶体的密度为
阅读以下材料,完成下面小题。
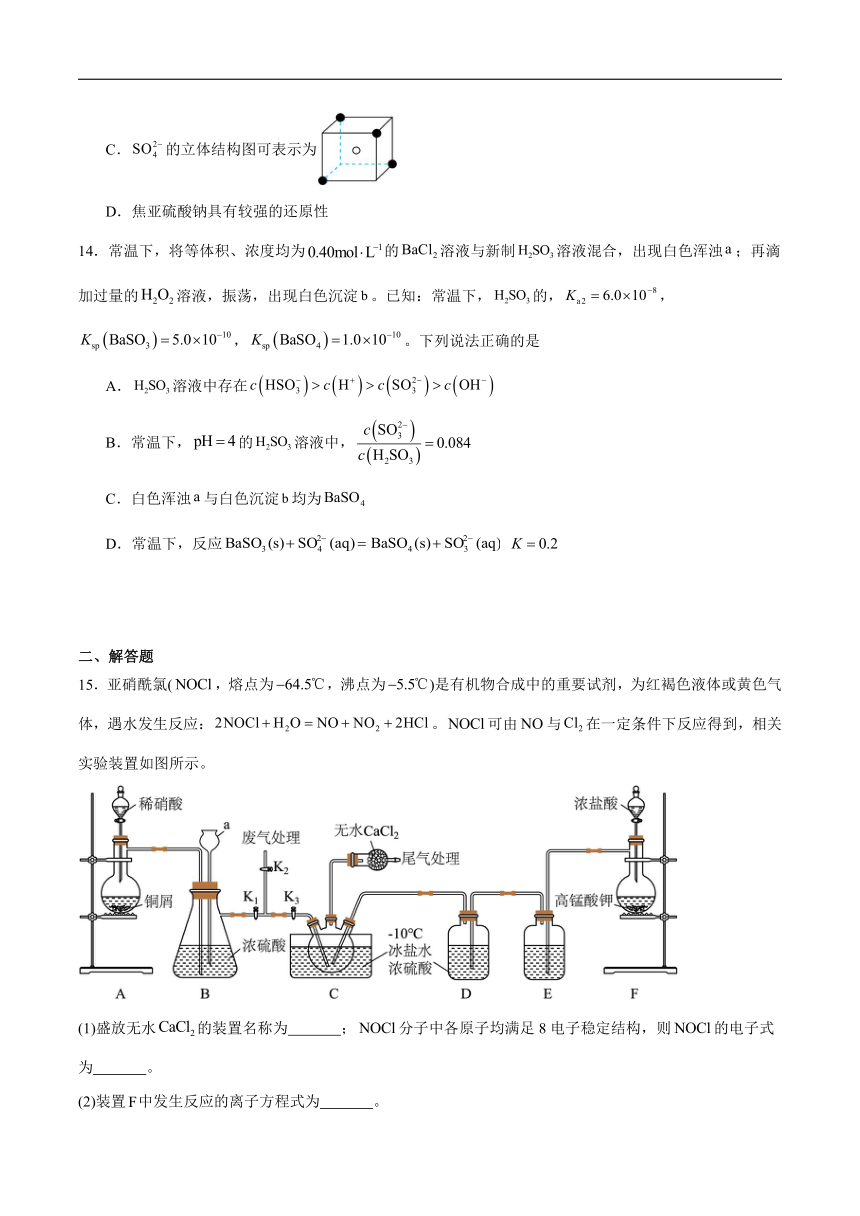
硫的含氧酸根有很多,如、、、、等,其中可看作是中的一个原子被原子取代后的产物;内部含过氧键;焦亚硫酸钠()在医药、橡胶、印染、食品等方面应用广泛,通常由过饱和溶液经结晶脱水制得。
13.下列有关说法错误的是
A.中的键角中的键角
B.中硫元素的化合价为价
C.的立体结构图可表示为
D.焦亚硫酸钠具有较强的还原性
14.常温下,将等体积、浓度均为的溶液与新制溶液混合,出现白色浑浊;再滴加过量的溶液,振荡,出现白色沉淀。已知:常温下,的,,,。下列说法正确的是
A.溶液中存在
B.常温下,的溶液中,
C.白色浑浊与白色沉淀均为
D.常温下,反应
二、解答题
15.亚硝酰氯(,熔点为,沸点为)是有机物合成中的重要试剂,为红褐色液体或黄色气体,遇水发生反应:。可由与在一定条件下反应得到,相关实验装置如图所示。
(1)盛放无水的装置名称为 ;分子中各原子均满足8电子稳定结构,则的电子式为 。
(2)装置中发生反应的离子方程式为 。
(3)制备:
①排、中的空气:先打开、、中的 。关闭、、中的 :打开中分液漏斗活塞。滴入适量稀硝酸,中出现红棕色,待红棕色消失后关闭,可观察到中 (填现象),停止滴加稀硝酸。
②通反应气体:打开中分液漏斗的活塞,当中三口烧瓶内 (填现象)时,再通入。
(4)纯度的测定(设杂质不参与反应):
a.称量中所得液体溶于水,配制成溶液、取出于锥形瓶中;
b.加入溶液(过量);
c.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
d.加入几滴溶液作指示剂,用标准溶液滴定过量的溶液,重复实验操作三次,消耗标准溶液的体积平均为。[已知,]
①滴定过程中应控制溶液的,理由是 。
②的纯度为 。(保留三位有效数字)
③在滴定终点时,若仰视读数,会导致测得的的纯度 (填“偏高”“偏低”或“无影响”)。
16.是制造钒铁合金的原料。从废钒催化剂(含以及不溶于酸的杂质)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,其工艺流程如图:
已知:①“酸浸”时,转化为。
②具有氧化性。
回答下列问题:
(1)基态钒原子的价层电子排布式为 。
(2)写出“还原”时发生反应的离子方程式: 。
(3)将“还原”后含的溶液进行“萃取”和“反萃取”提纯,制得钒酸盐,原理为,经“萃取”和“反萃取”后,钒的总回收率为90%,则“还原”时消耗的和“氧化”时消耗的的物质的量之比为 。
(4)“沉钒”过程会析出晶体。
①需要加入过量,目的是 。
②以沉钒率(沉淀中钒的质量和废钒催化剂中钒的质量之比)表示钒的回收率,沉钒率与沉淀温度的关系如图所示,温度高于80℃时沉钒率下降的原因是 。
(5)取进行煅烧获得,过程中减少的质量()随温度变化的曲线如图所示。
①写出C到D过程中发生反应的化学方程式: 。
②煅烧时不断鼓入空气的目的是 。
17.油气开采、石油化工、煤化工等工业废气中普遍含有,需要回收处理并加以利用。
(1)查阅文献知,对的处理主要有两种方法。
①克劳斯工艺。已知反应:
反应Ⅰ:
反应Ⅱ:
则反应 。
②催化重整法处理。可以用作脱除的催化剂,脱除过程如图所示。
脱除时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度分析其原因; 。
(2)向某密闭容器中充入一定量的气体,发生热分解反应 ,分解的平衡转化率随温度和压强的变化情况如图所示。
①某温度下恒容密闭容器中。反应物的转化率达到最大值的依据是 (填标号)。
a.气体的压强不再发生变化 b.气体的密度不再发生变化 c. d.和的物质的量之和保持不变
②、和中压强最大的是 。
(3)在、条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等。
①的平衡转化率为 ,平衡常数 。
②工业上,通常在等温、等压条件下将与的混合气体通入反应器,发生热分解反应,达到平衡状态后,若继续向反应器中通入,的平衡转化率会 (填“增大”“减小”或“不变”),利用平衡常数与浓度商的关系说明理由: 。
18.一种以乙醛酸()为原料合成高分子的路线如图。
(1)化合物的官能团名称为 。
(2)化合物的化学名称是 ,的反应类型为 。
(3)关于上述示意图中的相关物质及转化。下列说法正确的有_______。
A.化合物易溶于水,可能是因为其分子能与水分子形成氢键
B.化合物到的转化中,有键的断裂和形成
C.化合物只有1个手性碳原子,化合物有2个手性碳原子
D.化合物既能发生加聚反应,又能发生缩聚反应
(4)是一种多肽化合物,写出的结构简式: 。
(5)是的同分异构体,则符合下列条件的有 种。
①含苯环且苯环上有两个取代基
②与溶液可发生显色反应
③属于氨基酸
(6)参照上述合成路线,设计以苄基氯()为主要原料制备的合成路线(其他原料、试剂任选)。
①最后一步反应的化学方程式为 (不需注明反应条件)。
②第一步反应的化学方程式为 (注明反应条件)。
参考答案
1.A
2.C
3.C
4.D
5.B
6.C
7.B
8.B
9.A
10.D
11.C
12.C
13.A 14.B
15.(1) 球形干燥管
(2)
(3) K1、K2 K3 锥形瓶中液面下降,长颈漏斗内液面上升 充满黄绿色气体
(4) 防止三价铁水解 92.2 偏低
16.(1)
(2)
(3)10:3
(4) 利用同离子效应,促进晶体的析出,提高沉钒率 的水解程度增大,浓度减小(若答到“温度升高,溶解度增大”亦可)
(5) (或) 防止还原(或防止氧化)
17.(1) -314 硫化氢中H带正电,S带负电,氧化铁中Fe带正电,O带负电;图甲吸附方式为同种电性微粒靠近,图乙吸附方式为不同电性微粒靠近,不同电性微粒靠近时,吸附能力强
(2) ac
(3) 50% 5 增大 等温等压通入,体积增大,各物质分压减小,,平衡正向移动,转化率增大
18.(1)醛基和羧基
(2) 苯甲醛 加成反应
(3)AD
(4)
(5)12
(6)
一、单选题
1.河北省的考古发掘成果展示了河北悠久而辉煌的历史。下列文物属于金属材料制品的是
A.西汉错金博山炉 B.元青花云龙纹食盒
C.骨笛 D.宋海棠花式玛瑙碗
A.A B.B C.C D.D
2.下列化学用语或图示表达错误的是
A.的电子式:
B.分子的空间结构模型:
C.的名称:2-甲基-2-丁烯
D.基态Cu原子的价层电子轨道表示式:
3.化学之美,外美于现象,内美于原理。下列说法错误的是
A.清晨树林里梦幻般的光束源于丁达尔效应
B.降温后水结冰形成晶莹剔透的晶体,氢键数目增加
C.节日燃放的五颜六色的烟花与原子吸收光谱的原理相同
D.缺角的氯化钠晶体在饱和溶液中变为完美的立方体
4.除去下列物质中括号内的杂质,所选用的试剂或方法正确的是
A.溶液:插入铜片,过滤
B.乙酰苯胺():将混合物溶于乙醇后,重结晶
C.溶液:通入过量,充分反应后过滤
D.硬脂酸钠(甘油):加入过量的浓氯化钠溶液,盐析、过滤
5.连二亚硫酸钠(),又称保险粉,具有很强的还原性,其水溶液能被空气中的氧气氧化:。代表阿伏加德罗常数的值。下列说法正确的是
A.消耗,转移的电子数为
B.分子中含有的中子数为
C.的溶液中,数目为
D.的溶液中含有的数目为
6.化学知识繁杂,充分利用类比、迁移等方法有助于学习化学。下列类比、迁移正确的是
A.HF的分子间氢键强度大于水的分子间氢键,因此HF的沸点更高
B.聚乙烯不能使溴水褪色,则聚乙炔也不能使溴水褪色
C.与能反应生成S,则与NO能在一定条件下反应生成
D.的溶解度小于,则的溶解度也小于
7.已知:、、、、为原子序数依次增大的短周期主族元素,和同主族。由上述元素形成的化合物可用于治疗心脑血管疾病,其结构如图所示,下列说法正确的是
A.简单氢化物沸点:
B.由、、三种元素形成的化合物可能为离子化合物
C.化合物中所有原子均满足8电子稳定结构
D.最高价氧化物对应水化物的酸性:
8.傅-克酰基化反应在制备上很有价值,工业生产及实验室常用它来制备芳香酮。有机物M经傅-克酰基化转化为R的反应原理如图:
下列说法错误的是
A.物质R中有3种含氧官能团 B.可由脂肪发生水解反应制得
C.物质M和R均能与发生加成反应 D.物质N可在NaOH水溶液中发生取代反应
9.甲基苄溴()在稀的碱性水溶液中的水解反应分两步进行,反应中每一步的能量变化曲线如图所示,下列有关说法错误的是
A.甲基苄溴不存在对映异构体
B.决定甲基苄溴水解反应速率的是第一步反应
C.甲基苄溴在稀的碱性水溶液中生成的反应是放热反应
D.若将上述反应体系中的甲基苄溴改为甲基苄氯,则的值增大
10.类比是学习化学的重要方法。下列类比正确的是
A.由单质熔点,类比推理:熔点
B.由是非极性分子,类比推理:是非极性分子
C.由空间结构为平面三角形,类比推理:空间结构为平面三角形
D.由酸性,类比推理:酸性
11.科学家开发出首例无阳极钠固态电池(如图),下列叙述错误的是
A.放电时,a极为负极
B.放电时,向b极迁移
C.充电时,b极反应式为
D.充电时,a极净增4.6 g时转移的电子数约为
12.硫化镉(CdS)晶胞的结构如图所示。已知该晶胞边长为apm,以晶胞参数建立分数坐标系,1号原子的坐标为(0,0,0),下列说法错误的是
A.S的配位数为4
B.3号原子的坐标为
C.2号原子与3号原子的核间距为
D.设NA为阿伏加德罗常数的值,该晶体的密度为
阅读以下材料,完成下面小题。
硫的含氧酸根有很多,如、、、、等,其中可看作是中的一个原子被原子取代后的产物;内部含过氧键;焦亚硫酸钠()在医药、橡胶、印染、食品等方面应用广泛,通常由过饱和溶液经结晶脱水制得。
13.下列有关说法错误的是
A.中的键角中的键角
B.中硫元素的化合价为价
C.的立体结构图可表示为
D.焦亚硫酸钠具有较强的还原性
14.常温下,将等体积、浓度均为的溶液与新制溶液混合,出现白色浑浊;再滴加过量的溶液,振荡,出现白色沉淀。已知:常温下,的,,,。下列说法正确的是
A.溶液中存在
B.常温下,的溶液中,
C.白色浑浊与白色沉淀均为
D.常温下,反应
二、解答题
15.亚硝酰氯(,熔点为,沸点为)是有机物合成中的重要试剂,为红褐色液体或黄色气体,遇水发生反应:。可由与在一定条件下反应得到,相关实验装置如图所示。
(1)盛放无水的装置名称为 ;分子中各原子均满足8电子稳定结构,则的电子式为 。
(2)装置中发生反应的离子方程式为 。
(3)制备:
①排、中的空气:先打开、、中的 。关闭、、中的 :打开中分液漏斗活塞。滴入适量稀硝酸,中出现红棕色,待红棕色消失后关闭,可观察到中 (填现象),停止滴加稀硝酸。
②通反应气体:打开中分液漏斗的活塞,当中三口烧瓶内 (填现象)时,再通入。
(4)纯度的测定(设杂质不参与反应):
a.称量中所得液体溶于水,配制成溶液、取出于锥形瓶中;
b.加入溶液(过量);
c.向其中加入少量硝基苯,使沉淀表面被有机物覆盖;
d.加入几滴溶液作指示剂,用标准溶液滴定过量的溶液,重复实验操作三次,消耗标准溶液的体积平均为。[已知,]
①滴定过程中应控制溶液的,理由是 。
②的纯度为 。(保留三位有效数字)
③在滴定终点时,若仰视读数,会导致测得的的纯度 (填“偏高”“偏低”或“无影响”)。
16.是制造钒铁合金的原料。从废钒催化剂(含以及不溶于酸的杂质)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,其工艺流程如图:
已知:①“酸浸”时,转化为。
②具有氧化性。
回答下列问题:
(1)基态钒原子的价层电子排布式为 。
(2)写出“还原”时发生反应的离子方程式: 。
(3)将“还原”后含的溶液进行“萃取”和“反萃取”提纯,制得钒酸盐,原理为,经“萃取”和“反萃取”后,钒的总回收率为90%,则“还原”时消耗的和“氧化”时消耗的的物质的量之比为 。
(4)“沉钒”过程会析出晶体。
①需要加入过量,目的是 。
②以沉钒率(沉淀中钒的质量和废钒催化剂中钒的质量之比)表示钒的回收率,沉钒率与沉淀温度的关系如图所示,温度高于80℃时沉钒率下降的原因是 。
(5)取进行煅烧获得,过程中减少的质量()随温度变化的曲线如图所示。
①写出C到D过程中发生反应的化学方程式: 。
②煅烧时不断鼓入空气的目的是 。
17.油气开采、石油化工、煤化工等工业废气中普遍含有,需要回收处理并加以利用。
(1)查阅文献知,对的处理主要有两种方法。
①克劳斯工艺。已知反应:
反应Ⅰ:
反应Ⅱ:
则反应 。
②催化重整法处理。可以用作脱除的催化剂,脱除过程如图所示。
脱除时需先进行吸附。按图乙方式进行吸附,其吸附能力比按图甲强,请从结构角度分析其原因; 。
(2)向某密闭容器中充入一定量的气体,发生热分解反应 ,分解的平衡转化率随温度和压强的变化情况如图所示。
①某温度下恒容密闭容器中。反应物的转化率达到最大值的依据是 (填标号)。
a.气体的压强不再发生变化 b.气体的密度不再发生变化 c. d.和的物质的量之和保持不变
②、和中压强最大的是 。
(3)在、条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等。
①的平衡转化率为 ,平衡常数 。
②工业上,通常在等温、等压条件下将与的混合气体通入反应器,发生热分解反应,达到平衡状态后,若继续向反应器中通入,的平衡转化率会 (填“增大”“减小”或“不变”),利用平衡常数与浓度商的关系说明理由: 。
18.一种以乙醛酸()为原料合成高分子的路线如图。
(1)化合物的官能团名称为 。
(2)化合物的化学名称是 ,的反应类型为 。
(3)关于上述示意图中的相关物质及转化。下列说法正确的有_______。
A.化合物易溶于水,可能是因为其分子能与水分子形成氢键
B.化合物到的转化中,有键的断裂和形成
C.化合物只有1个手性碳原子,化合物有2个手性碳原子
D.化合物既能发生加聚反应,又能发生缩聚反应
(4)是一种多肽化合物,写出的结构简式: 。
(5)是的同分异构体,则符合下列条件的有 种。
①含苯环且苯环上有两个取代基
②与溶液可发生显色反应
③属于氨基酸
(6)参照上述合成路线,设计以苄基氯()为主要原料制备的合成路线(其他原料、试剂任选)。
①最后一步反应的化学方程式为 (不需注明反应条件)。
②第一步反应的化学方程式为 (注明反应条件)。
参考答案
1.A
2.C
3.C
4.D
5.B
6.C
7.B
8.B
9.A
10.D
11.C
12.C
13.A 14.B
15.(1) 球形干燥管
(2)
(3) K1、K2 K3 锥形瓶中液面下降,长颈漏斗内液面上升 充满黄绿色气体
(4) 防止三价铁水解 92.2 偏低
16.(1)
(2)
(3)10:3
(4) 利用同离子效应,促进晶体的析出,提高沉钒率 的水解程度增大,浓度减小(若答到“温度升高,溶解度增大”亦可)
(5) (或) 防止还原(或防止氧化)
17.(1) -314 硫化氢中H带正电,S带负电,氧化铁中Fe带正电,O带负电;图甲吸附方式为同种电性微粒靠近,图乙吸附方式为不同电性微粒靠近,不同电性微粒靠近时,吸附能力强
(2) ac
(3) 50% 5 增大 等温等压通入,体积增大,各物质分压减小,,平衡正向移动,转化率增大
18.(1)醛基和羧基
(2) 苯甲醛 加成反应
(3)AD
(4)
(5)12
(6)
同课章节目录
