1.2.1原电池的工作原理(教学课件)(共29张PPT)—高中化学鲁科版(2019)选择性必修一
文档属性
| 名称 | 1.2.1原电池的工作原理(教学课件)(共29张PPT)—高中化学鲁科版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 33.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-08 21:26:16 | ||
图片预览








文档简介
(共29张PPT)
化学反应与能量转化
第一章
1.2化学能转化为电能——电池
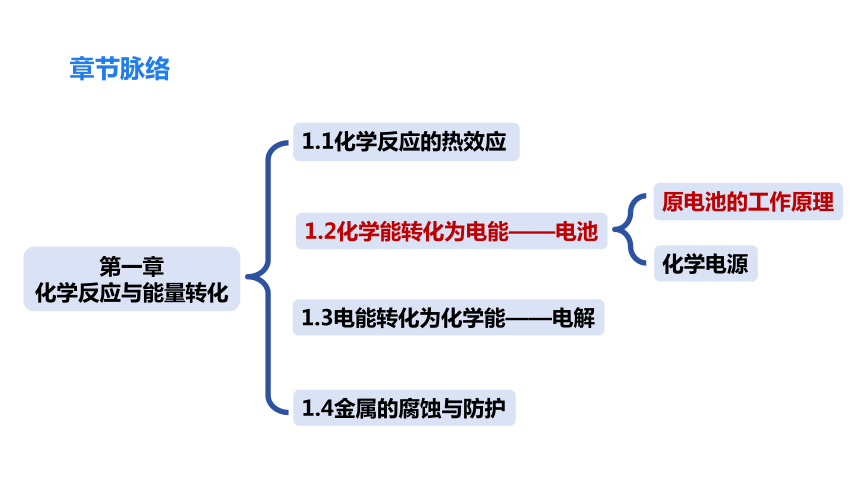
章节脉络
化学电源
原电池的工作原理
第一章
化学反应与能量转化
1.2化学能转化为电能——电池
1.1化学反应的热效应
1.3电能转化为化学能——电解
1.4金属的腐蚀与防护
原电池的工作原理
核心素养目标
1. 宏观辨识与微观探析
能从宏观现象准确识别原电池装置,理解化学能转化为电能的过程;从微观层面剖析电子转移、离子迁移及电极反应本质,解释原电池工作的内在逻辑。
2. 证据推理与模型认知
通过实验现象及数据,推理原电池正负极的判断依据和电极反应规律;构建原电池的结构模型,掌握氧化还原反应与电子定向移动的关系,运用模型分析不同体系原电池的工作原理及能量转化机制。
3. 科学探究与创新意识
针对原电池效率、稳定性等问题,能设计探究实验优化电极材料、电解质溶液或电池结构;关注新型电池的前沿成果,尝试从原电池原理出发,提出改进传统电池性能或开发新型电池的创新思路,培养实践与创新能力。
学习重难点
重点:
1. 理解原电池的构成条件,能准确判断原电池的正负极。
2. 掌握原电池的工作原理,包括电极反应、电子和离子的移动方向,会书写电极反应式和总反应式。
3. 熟知常见原电池的工作原理及应用。
难点:
1. 从微观角度理解原电池中电子转移、离子迁移的过程及二者协同工作机制。
2. 掌握复杂体系中原电池电极反应式的书写及总反应式的推导。
课前导入
为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?它们在工作时,装置中发生了什么变化?
原电池
PART 01
原电池
①两极:一般为两种活泼性不同的导体
(或一种金属与非金属导体,石墨)
②一液:电解质溶液或熔融电解质
(酒精、蔗糖、CCl4不是电解质)
③一线:用导线相连(或直接接触),形成闭合回路
④一反应:自发的氧化还原反应
定义
构成条件
负极:较活泼的金属
正极:较不活泼的金属、石墨等
将化学能直接转化为电能的装置。
原电池
在电池中,氧化反应和还原反应是在两个电极分别进行的。每个电极或是发生失去电子的变化——氧化,或是发生获得电子的变化——还原,分别相当于氧化还原反应的一半,这种反应常称为半反应。
电极及电池反应
①半反应
②电极反应
③电池反应
在电极上进行的半反应。
电池的两个电极反应组成电池的总反应。
原电池
原电池的工作原理
电极反应 负极:失去电子,发生氧化反应
正极:得到电子,发生还原反应
电子流向 由负极经过导线流向正极
电流方向 由正极经过导线流向负极
离子移动方向 阳离子向正极移动,阴离子向负极移动
原电池
G
e-
e-
电子由负极流向正极
负极
正极
氧化反应
还原反应
阳离子移动方向→
←阴离子移动方向
电解质溶液
原理
电流由正极流向负极
外电路
内电路
原电池
原电池正、负极的判断
原电池
原电池电极反应式的书写
(1)一般电极反应式的书写:
①按照负极发生氧化反应,正极发生还原反应,分析化合价,结合溶液的性质,确定写出正、负电极的反应物与产物。
②在反应式的左边写出得失电子数,并加以配平,电极反应式要遵守电荷守恒、质量守恒、电子得失守恒等。
③把两个电极的电极反应式相加与总电池反应对照,验证书写是否正确。
(2)复杂电极反应式的书写:
复杂电极反应式=电池总反应式-较简单一极电极的反应式
原电池
CuSO4溶液
Zn
Cu
A
稀硫酸
Fe
Fe
B
NaOH溶液
Mg
Al
E
稀硫酸
稀硫酸
Zn
Cu
F
纯酒精
Fe
C
G
KOH溶液
D
H2
O2
Pt
Pt
NaCl溶液
Fe
C
C
【课堂练习】1、以下哪些装置可以形成原电池?
铜锌原电池
PART 02
铜锌原电池
实验探究 —— 探秘铜锌原电池
你认为图中所示装置是否能够构成原电池将化学能转化成电能?请说明理由。
铜锌原电池
铜锌原电池
检流计的指针发生偏转,锌片逐渐溶解,锌片、铜片上均有红色固体析出,CuSO 溶液的颜色逐渐变浅
宏观现象
锌原子失去电子被氧化成Zn2+进入溶液,失去的电子通过导线流向铜片,CuSO4溶液中的Cu2+在铜片上获得电子,被还原成铜沉积在铜片上,从而构成闭合回路,产生电流。
微观解释
铜锌原电池
e-
e-
电子流向:
负极 → 正极
电流方向:
正极 → 负极
锌片:
Zn-2e- = Zn2+
铜片:
2H++2e- = H2↑
失电子,
氧化反应
得电子,
还原反应
电子不下水
离子不上岸
总反应:
Zn+2H+ = Zn2++H2↑
阳离子(+):向正极,
阴离子(-) : 向负极。
离子移动:
铜锌原电池
e-
e-
检流计的指针发生偏转,左边烧杯中的锌片逐渐溶解,右边烧杯中的铜片上有红色固体析出,CuSO4溶液的颜色逐渐变浅。
宏观现象
铜锌原电池
微观解释
锌原子失去电子被氧化成Zn2+进入溶液,失去的电子通过导线流向铜片,CuSO4溶液中的Cu2+在铜片上获得电子,被还原成铜沉积在铜片上;随着反应的进行,左边烧杯溶液中的Zn2+增大,右边烧杯溶液中的Cu2+减小,则盐桥中的阴离子(如Cl-)进入ZnSO4溶液,阳离子(如K+)进入CuSO4溶液,从而构成闭合回路,产生电流
e-
e-
铜锌原电池
课堂小结
铜锌原电池
原电池
定义
构成条件
电极及电池反应
原电池的工作原理
单池原电池
双池原电池
原电池正、负极的判断
原电池电池反应式的书写
D
随堂训练
1. 某学习小组的同学查阅相关资料知氧化性: ,设计了盐桥式的原电池,如图。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是( )
A. 甲烧杯的溶液中发生还原反应
B. 乙烧杯中发生的电极反应为:
C. 外电路的电流方向是从 b 到 a
D. 电池工作时,盐桥中的 移向乙烧杯
随堂训练
2.如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法不正确的是( )
A. X极是电源正极,Y极是电源负极
B.Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐减小
D.a极的电极反应式为2Cl--2e-=Cl2↑
B
随堂训练
3.判断正误
(1)理论上说,任何自发的氧化还原反应都可设计成原电池。( )
(2)在原电池中,发生氧化反应的一极一定是负极。( )
(3)用Mg、Al分别作为电极,用NaOH溶液作为电解液构成的原电池,
Mg为正极。( )
(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正
极移动。( )
(5)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率
高。( )
(6)原电池放电时,外电路中电流由负极流向正极。( )
随堂训练
4.分析下图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg是负极,③④中Fe是负极
B.②中Mg是正极,电极反应为6H2O+6e- === 6OH-+3H2↑
C.③中Fe是负极,电极反应为Fe-2e- === Fe2+
D.④中Cu是正极,电极反应为2H++2e- === H2↑
B
随堂训练
5.判断下列装置的正负极,并写出电极方程式?
负极:
正极:
总反应式:
Mg - 2e-===Mg2+
2H+ + 2e-===H2↑
2H+ + Mg===H2↑+Mg2+
负极:
正极:
总反应式:
2Al + 2OH- + 2H2O===2AlO2 + 3H2↑
-
2Al + 8OH--6e-===2AlO2 + 4H2O
-
6H2O + 6e-===6OH- + 3H2↑
随堂训练
6.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 。
(3)外电路中的电子是从 极流向 极。
Cu-2e-=Cu2+
Cu
AgNO3溶液
正
2Ag++2e-=2Ag
负(Cu)
正(Ag)
谢谢观看
化学反应与能量转化
第一章
1.2化学能转化为电能——电池
章节脉络
化学电源
原电池的工作原理
第一章
化学反应与能量转化
1.2化学能转化为电能——电池
1.1化学反应的热效应
1.3电能转化为化学能——电解
1.4金属的腐蚀与防护
原电池的工作原理
核心素养目标
1. 宏观辨识与微观探析
能从宏观现象准确识别原电池装置,理解化学能转化为电能的过程;从微观层面剖析电子转移、离子迁移及电极反应本质,解释原电池工作的内在逻辑。
2. 证据推理与模型认知
通过实验现象及数据,推理原电池正负极的判断依据和电极反应规律;构建原电池的结构模型,掌握氧化还原反应与电子定向移动的关系,运用模型分析不同体系原电池的工作原理及能量转化机制。
3. 科学探究与创新意识
针对原电池效率、稳定性等问题,能设计探究实验优化电极材料、电解质溶液或电池结构;关注新型电池的前沿成果,尝试从原电池原理出发,提出改进传统电池性能或开发新型电池的创新思路,培养实践与创新能力。
学习重难点
重点:
1. 理解原电池的构成条件,能准确判断原电池的正负极。
2. 掌握原电池的工作原理,包括电极反应、电子和离子的移动方向,会书写电极反应式和总反应式。
3. 熟知常见原电池的工作原理及应用。
难点:
1. 从微观角度理解原电池中电子转移、离子迁移的过程及二者协同工作机制。
2. 掌握复杂体系中原电池电极反应式的书写及总反应式的推导。
课前导入
为满足人们生产和生活水平不断提高的需要,性能优异的新型电池相继出现,如锌银电池、锂电池、燃料电池等。那么,电池究竟是一种什么样的装置?它们在工作时,装置中发生了什么变化?
原电池
PART 01
原电池
①两极:一般为两种活泼性不同的导体
(或一种金属与非金属导体,石墨)
②一液:电解质溶液或熔融电解质
(酒精、蔗糖、CCl4不是电解质)
③一线:用导线相连(或直接接触),形成闭合回路
④一反应:自发的氧化还原反应
定义
构成条件
负极:较活泼的金属
正极:较不活泼的金属、石墨等
将化学能直接转化为电能的装置。
原电池
在电池中,氧化反应和还原反应是在两个电极分别进行的。每个电极或是发生失去电子的变化——氧化,或是发生获得电子的变化——还原,分别相当于氧化还原反应的一半,这种反应常称为半反应。
电极及电池反应
①半反应
②电极反应
③电池反应
在电极上进行的半反应。
电池的两个电极反应组成电池的总反应。
原电池
原电池的工作原理
电极反应 负极:失去电子,发生氧化反应
正极:得到电子,发生还原反应
电子流向 由负极经过导线流向正极
电流方向 由正极经过导线流向负极
离子移动方向 阳离子向正极移动,阴离子向负极移动
原电池
G
e-
e-
电子由负极流向正极
负极
正极
氧化反应
还原反应
阳离子移动方向→
←阴离子移动方向
电解质溶液
原理
电流由正极流向负极
外电路
内电路
原电池
原电池正、负极的判断
原电池
原电池电极反应式的书写
(1)一般电极反应式的书写:
①按照负极发生氧化反应,正极发生还原反应,分析化合价,结合溶液的性质,确定写出正、负电极的反应物与产物。
②在反应式的左边写出得失电子数,并加以配平,电极反应式要遵守电荷守恒、质量守恒、电子得失守恒等。
③把两个电极的电极反应式相加与总电池反应对照,验证书写是否正确。
(2)复杂电极反应式的书写:
复杂电极反应式=电池总反应式-较简单一极电极的反应式
原电池
CuSO4溶液
Zn
Cu
A
稀硫酸
Fe
Fe
B
NaOH溶液
Mg
Al
E
稀硫酸
稀硫酸
Zn
Cu
F
纯酒精
Fe
C
G
KOH溶液
D
H2
O2
Pt
Pt
NaCl溶液
Fe
C
C
【课堂练习】1、以下哪些装置可以形成原电池?
铜锌原电池
PART 02
铜锌原电池
实验探究 —— 探秘铜锌原电池
你认为图中所示装置是否能够构成原电池将化学能转化成电能?请说明理由。
铜锌原电池
铜锌原电池
检流计的指针发生偏转,锌片逐渐溶解,锌片、铜片上均有红色固体析出,CuSO 溶液的颜色逐渐变浅
宏观现象
锌原子失去电子被氧化成Zn2+进入溶液,失去的电子通过导线流向铜片,CuSO4溶液中的Cu2+在铜片上获得电子,被还原成铜沉积在铜片上,从而构成闭合回路,产生电流。
微观解释
铜锌原电池
e-
e-
电子流向:
负极 → 正极
电流方向:
正极 → 负极
锌片:
Zn-2e- = Zn2+
铜片:
2H++2e- = H2↑
失电子,
氧化反应
得电子,
还原反应
电子不下水
离子不上岸
总反应:
Zn+2H+ = Zn2++H2↑
阳离子(+):向正极,
阴离子(-) : 向负极。
离子移动:
铜锌原电池
e-
e-
检流计的指针发生偏转,左边烧杯中的锌片逐渐溶解,右边烧杯中的铜片上有红色固体析出,CuSO4溶液的颜色逐渐变浅。
宏观现象
铜锌原电池
微观解释
锌原子失去电子被氧化成Zn2+进入溶液,失去的电子通过导线流向铜片,CuSO4溶液中的Cu2+在铜片上获得电子,被还原成铜沉积在铜片上;随着反应的进行,左边烧杯溶液中的Zn2+增大,右边烧杯溶液中的Cu2+减小,则盐桥中的阴离子(如Cl-)进入ZnSO4溶液,阳离子(如K+)进入CuSO4溶液,从而构成闭合回路,产生电流
e-
e-
铜锌原电池
课堂小结
铜锌原电池
原电池
定义
构成条件
电极及电池反应
原电池的工作原理
单池原电池
双池原电池
原电池正、负极的判断
原电池电池反应式的书写
D
随堂训练
1. 某学习小组的同学查阅相关资料知氧化性: ,设计了盐桥式的原电池,如图。盐桥中装有琼脂与饱和K2SO4溶液。下列叙述中正确的是( )
A. 甲烧杯的溶液中发生还原反应
B. 乙烧杯中发生的电极反应为:
C. 外电路的电流方向是从 b 到 a
D. 电池工作时,盐桥中的 移向乙烧杯
随堂训练
2.如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法不正确的是( )
A. X极是电源正极,Y极是电源负极
B.Cu电极上增重6.4 g时,b极产生4.48 L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐减小
D.a极的电极反应式为2Cl--2e-=Cl2↑
B
随堂训练
3.判断正误
(1)理论上说,任何自发的氧化还原反应都可设计成原电池。( )
(2)在原电池中,发生氧化反应的一极一定是负极。( )
(3)用Mg、Al分别作为电极,用NaOH溶液作为电解液构成的原电池,
Mg为正极。( )
(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正
极移动。( )
(5)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率
高。( )
(6)原电池放电时,外电路中电流由负极流向正极。( )
随堂训练
4.分析下图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg是负极,③④中Fe是负极
B.②中Mg是正极,电极反应为6H2O+6e- === 6OH-+3H2↑
C.③中Fe是负极,电极反应为Fe-2e- === Fe2+
D.④中Cu是正极,电极反应为2H++2e- === H2↑
B
随堂训练
5.判断下列装置的正负极,并写出电极方程式?
负极:
正极:
总反应式:
Mg - 2e-===Mg2+
2H+ + 2e-===H2↑
2H+ + Mg===H2↑+Mg2+
负极:
正极:
总反应式:
2Al + 2OH- + 2H2O===2AlO2 + 3H2↑
-
2Al + 8OH--6e-===2AlO2 + 4H2O
-
6H2O + 6e-===6OH- + 3H2↑
随堂训练
6.依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 。
(3)外电路中的电子是从 极流向 极。
Cu-2e-=Cu2+
Cu
AgNO3溶液
正
2Ag++2e-=2Ag
负(Cu)
正(Ag)
谢谢观看
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
