1.1.1化学反应的反应热 化学反应的内能变化与焓变(教学课件)(共32张PPT)—高中化学鲁科版(2019)选择性必修一
文档属性
| 名称 | 1.1.1化学反应的反应热 化学反应的内能变化与焓变(教学课件)(共32张PPT)—高中化学鲁科版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 29.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-08 21:30:52 | ||
图片预览









文档简介
(共32张PPT)
化学反应与能量转化
第一章
1.1化学反应的热效应
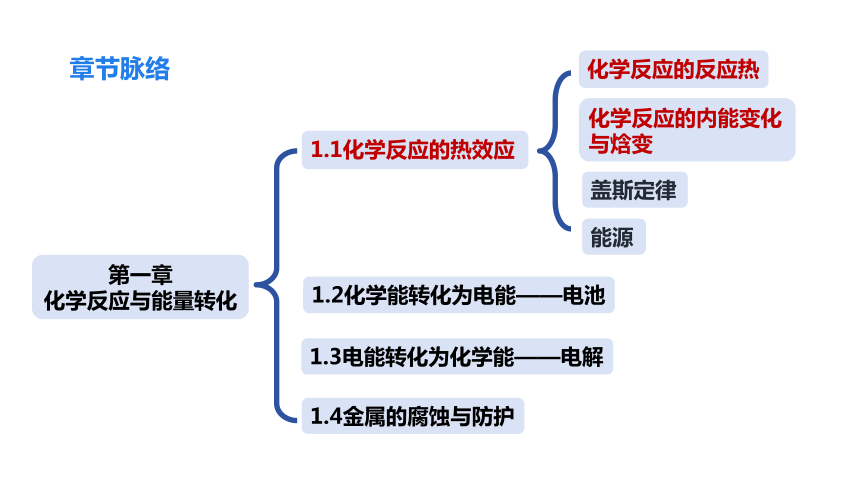
章节脉络
能源
化学反应的内能变化与焓变
化学反应的反应热
第一章
化学反应与能量转化
1.2化学能转化为电能——电池
1.1化学反应的热效应
1.3电能转化为化学能——电解
1.4金属的腐蚀与防护
盖斯定律
化学反应的反应热
化学反应的内能变化与焓变
核心素养目标
1. 宏观辨识与微观探析
能从物质具有的能量、化学键的断裂和形成等角度了解放热反应和吸热反应。能从宏观和微观相结合的视角分析与解释生活中的现象。
2. 证据推理与模型认知
能从宏观和微观结合上收集证据,分析化学变化中能量吸收或释放的原因。
3. 科学探究与创新意识
聚焦化学反应热效应的定量测量及能源应用,尝试对反应条件)、能量转化路径进行创新改进,结合学科前沿激发探究精神与实践创新能力。
学习重难点
重点:
1. 深入理解反应热的概念,精准区分放热反应与吸热反应,熟知常见的放热、吸热反应类型。
2. 全面掌握化学反应的内能变化 U与焓变 H 的概念,牢记 U = Q + W、 H = H(反应产物) - H(反应物)等表达式及物理意义,准确理解恒压条件下焓变与反应热的关系。
难点:
1. 对于涉及多种能量变化形式(如伴随做功、热传递等)的复杂化学反应,综合考虑各因素对反应热的影响,准确判断内能变化与焓变。
课前导入
铝粉与铁的氧化物的反应(放热)
氯化铵与氢氧化钙的反应(吸热)
在生产和生活中,人们广泛利用着化学反应释放的热能。为了有效地利用一些化学反应释放的热能或通过提供热能来维持有关化学反应的正常进行,人们必须定量地了解化学反应释放或吸收的热能。
应如何定量地描述一个化学反应释放或吸收的热能呢?用什么方法可以准确地测量一个化学反应释放或吸收的热量呢?
化学反应的反应热
PART 01
化学反应的反应热
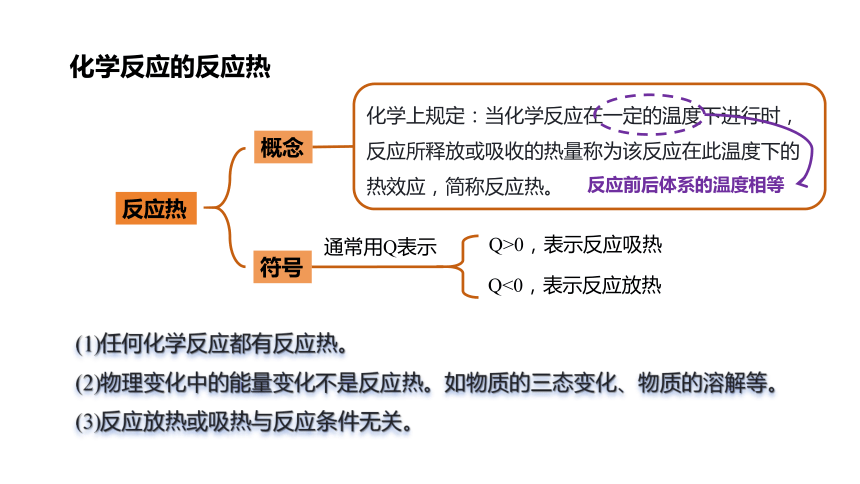
反应热
概念
符号
通常用Q表示
Q>0,表示反应吸热
Q<0,表示反应放热
化学上规定:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
反应前后体系的温度相等
(1)任何化学反应都有反应热。
(2)物理变化中的能量变化不是反应热。如物质的三态变化、物质的溶解等。
(3)反应放热或吸热与反应条件无关。
化学反应的反应热
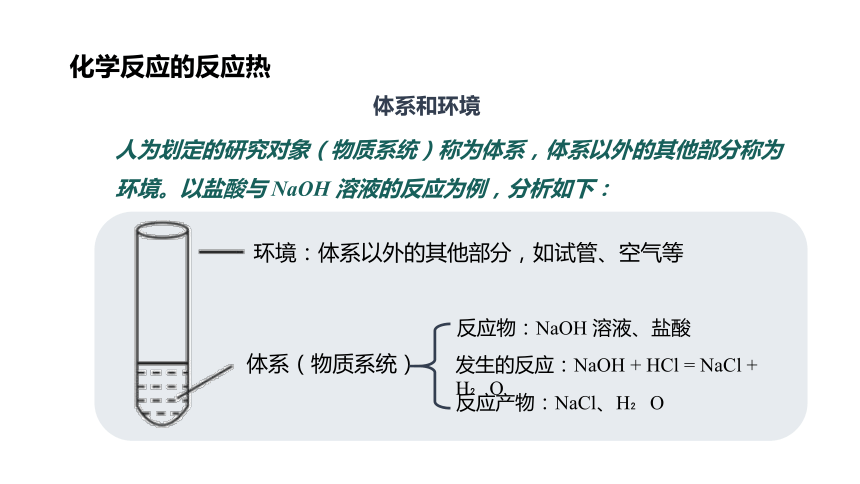
体系和环境
人为划定的研究对象(物质系统)称为体系,体系以外的其他部分称为环境。以盐酸与 NaOH 溶液的反应为例,分析如下:
环境:体系以外的其他部分,如试管、空气等
体系(物质系统)
反应物:NaOH 溶液、盐酸
发生的反应:NaOH + HCl = NaCl + H O
反应产物:NaCl、H O
化学反应的反应热
反应热的测定
反应热数值的获得方法
反应热的数值可以通过实验测得,也可以通过理论计算求得。
反应热测定的仪器和方法
用于测定反应热的仪器——量热计
如图所示为简易量热计示意图
外筒:起保温作用
搅拌器:使反应物迅速混合,使反应充分进行,保持体系的温度均匀
内筒:反应容器
反应物
温度计:测量反应前后溶液的温度
化学反应的反应热
将反应物加入内筒并搅拌使之迅速反应,测量反应前后溶液温度的变化值。
测定方法
计算公式
Q = -C(T2-T1)
式中:C表示溶液及量热计的热容;
T1、T2分别表示反应前和反应后体系的温度。
减少热量散失
化学反应的反应热
(1) 热力学温度(T)与摄氏温度(t)之间的关系为T(K) = t(℃) + 273.15。
(2) 热容(C)与比热容(c)的关系:比热容 = 。
由此可知Q = -C(T2-T1) = -mc(T2-T1)。简称比热,单位为kJ·K-1·kg-1
(3) 常温下,液态水的比热为4.18 kJ·K-1·kg-1。
单位为J·K-1
简称比热,单位为kJ·K-1·kg-1
化学反应的反应热
实验探究 —— 测定中和反应的反应热
利用简易量热计按照以下步骤可测得室温下中和反应的反应热。
1.向量热计内筒中加入1.0 mol·L-1的盐酸100 mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。
2.向250 mL的烧杯中加入1.0 mol·L-1的NaOH溶液100 mL,调节其温度,使之与量热计中盐酸的温度相同。
3.快速地将烧杯中的碱液倒入量热计中,盖好杯盖,匀速搅拌,记录体系达到的最高温度T2。
4.近似认为溶液的比热等于水的比热,根据溶液温度升高的数值计算此中和反应的反应热。
化学反应的反应热
化学反应的反应热
在上述实验中,参加反应的物质都是强酸或强碱,它们在水中是完全电离的,因此从本质上来说,它们之间所发生的都是溶液中的H+和OH-结合生成水的反应。
由于上述三个实验中所用溶液的体积是相同的,溶液中H+和OH-的浓度也是相同的,反应又都在室温下进行,因此这三个反应的反应热也是相同的。
化学反应的内能变化与焓变
PART 02
化学反应的内能变化与焓变
含义
符号
影响因素
化学反应的内能变化
内能
体系内物质所含各种微观粒子的能量总和
U
物质的种类、数量及聚集状态
体系的温度和压强
微观粒子的能量包括分子的平动、转动、振动,电子运动,原子核运动等各种形式运动的动能,以及微观粒子之间相互作用的势能。
化学反应的内能变化与焓变
化学反应中内能的变化△U = U(反应产物) - U(反应物)。
化学反应的能量变化与内能的关系
化学反应的能量变化是由反应前后物质所具有的内能不同而引起的。
U(反应产物)>U(反应物),反应吸收能量
U(反应产物)化学反应的内能变化与焓变
化学反应体系与环境进行能量交换的形式——热和功
除热能外,体系与环境之间交换的其他形式的能(如电能、光能、机械能等)都称为功,用符号W表示。
体系做功 体系没有做功
U = Q + W U = Q
Q>0,反应吸热;Q<0,反应放热; W>0,环境对体系做功;W<0,体系对环境做功 化学反应的内能变化与焓变
化学反应的焓变
焓变与放热反应、吸热反应的关系
对于一个化学反应,反应产物的焓与反应物的焓之差称为反应焓变,符号是 H。
概念
数学表达式
H = H(反应产物) - H(反应物)
常用单位
kJ/mol(或kJ·mol-1)
焓变与反应热的关系
在等压条件下进行的化学反应,其反应热等于反应的焓变,即Qp = H,如敞口容器中进行的化学反应。
化学反应的内能变化与焓变
反应类型 放热反应 吸热反应
图像
焓变( H) H<0,反应体系向环境中放热 H>0,反应体系向环境中吸热
释放热量的化学反应
吸收热量的化学反应
化学反应的内能变化与焓变
H的计算方法
H = 反应产物的总能量 - 反应物的总能量。
H = 反应物中的化学键断裂吸收的总能量 - 反应产物中的化学键形成释放的总能量。
关键是正确判断出每种物质中存在的化学键的种类和个数
H = U + pV
式中:U为内能,p为压强,V为体积。
化学反应的内能变化与焓变
把一个化学反应中物质的变化和反应的焓变同时表示出 来的化学方程式称为热化学方程式。
热化学方程式
定义
意义
热化学方程式既表明了化学反应中的物质变化,又表明了化学反应中的能量变化。
物质变化
能量变化
缺一不可
化学反应的内能变化与焓变
书写热化学方程式的方法
写出符合质量守恒定律的化学方程式
注明物质的聚集状态
热化学方程式中各物质化学式前的系数只表示物质的量。因此,它可以用整数或分数表示。
书写热化学方程式时必须注明各物质的聚集状态,因为物质发生状态变化时也伴随着能量的变化。一般用英文字母g、l和s分别表示气态、液态和固态,水溶液中的溶质则用aq表示。
气体反应物和难溶反应物不能标“↑”“↓”
化学反应的内能变化与焓变
用 H表示化学反应的焓变
注明反应的温度和压强
放热反应的 H取负值,吸热反应的 H取正值; H的单位常用kJ· mol-1; H应与化学方程式中各物质化学式前的系数对应。
因为反应的温度和压强不同,其 H也不同。对于298 K、101 kPa条件下进行的反应,可以不注明。
化学式相同的同素异形体除注明聚集状态外还需注明其名称 (因为结构不同,物质具有的能量不同 ),如金刚石应表示为“ C (s,金刚石)”。
化学反应的内能变化与焓变
化学方程式 热化学方程式
系数 只能是整数,表示微粒的个数及物质的物质的量 既可以是整数,也可以是分数,只表示各物质的物质的量
聚集状态 不需要注明 必须在化学式后注明
“↑”“↓” 需要注明 不需要注明
反应条件 需要注明 不用注明除温度和压强之外的其他反应条件,如 “加热”“高温” 等
H 无 有,注明正负号及单位
意义 表明了化学反应中的物质变化 既表明了化学反应中的物质变化,又表明了化学反应中的能量变化
课堂小结
化学反应的内能变化与焓变
化学反应的反应热
反应热
反应热的测定
测定中和反应的反应热实验
化学反应的内能变化
化学反应的焓变
热化学方程式
随堂训练
1.下列说法正确的是( )
A. 在化学反应中发生物质变化的同时,一定发生能量变化
B. Q > 0表示放热反应,Q < 0表示吸热反应
C. 反应热是1 mol物质参加反应时的能量变化
D. 体系的温度升高一定是放热反应造成的,体系的温度降低一定是吸热反应造成的
A
随堂训练
2.下列有关叙述正确的是( )
A. 测定中和反应的反应热时,为了使反应均匀进行,可以向酸(碱)溶液中分几次加入碱(酸)溶液
B. 若用50 mL 0.50mol·L-1 NaOH溶液分别与50 mL 0.50 mol·L-1 盐酸和50 mL 0.50 mol·L-1 H2SO4溶液充分反应,测得的两反应的反应热不相等
C. 测定中和反应的反应热时,可以用稀硫酸与稀NaOH溶液反应
D. 为了简化装置,中和反应的反应热测定实验中的搅拌器可以用温度计代替
C
随堂训练
3. 下列说法不正确的是( )
A. 反应产物的总能量大于反应物的总能量时, H > 0
B. 反应放热时 H < 0,反应吸热时 H > 0
C. 任何条件下,化学反应的焓变都等于化学反应的反应热
D. 在一定条件下,某化学反应是吸热反应还是放热反应,由反应产物的总焓与反应物的总焓之差决定
C
随堂训练
4. 已知:H2(g) + F2(g) =2HF(g) H = - 270kJ·mol-1,下列说法正确的是( )
A. 在相同条件下,1 mol H2(g)与1mol F2(g)的能量总和大于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2mol HF(l)放出的热量小于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图表示
A
谢谢观看
化学反应与能量转化
第一章
1.1化学反应的热效应
章节脉络
能源
化学反应的内能变化与焓变
化学反应的反应热
第一章
化学反应与能量转化
1.2化学能转化为电能——电池
1.1化学反应的热效应
1.3电能转化为化学能——电解
1.4金属的腐蚀与防护
盖斯定律
化学反应的反应热
化学反应的内能变化与焓变
核心素养目标
1. 宏观辨识与微观探析
能从物质具有的能量、化学键的断裂和形成等角度了解放热反应和吸热反应。能从宏观和微观相结合的视角分析与解释生活中的现象。
2. 证据推理与模型认知
能从宏观和微观结合上收集证据,分析化学变化中能量吸收或释放的原因。
3. 科学探究与创新意识
聚焦化学反应热效应的定量测量及能源应用,尝试对反应条件)、能量转化路径进行创新改进,结合学科前沿激发探究精神与实践创新能力。
学习重难点
重点:
1. 深入理解反应热的概念,精准区分放热反应与吸热反应,熟知常见的放热、吸热反应类型。
2. 全面掌握化学反应的内能变化 U与焓变 H 的概念,牢记 U = Q + W、 H = H(反应产物) - H(反应物)等表达式及物理意义,准确理解恒压条件下焓变与反应热的关系。
难点:
1. 对于涉及多种能量变化形式(如伴随做功、热传递等)的复杂化学反应,综合考虑各因素对反应热的影响,准确判断内能变化与焓变。
课前导入
铝粉与铁的氧化物的反应(放热)
氯化铵与氢氧化钙的反应(吸热)
在生产和生活中,人们广泛利用着化学反应释放的热能。为了有效地利用一些化学反应释放的热能或通过提供热能来维持有关化学反应的正常进行,人们必须定量地了解化学反应释放或吸收的热能。
应如何定量地描述一个化学反应释放或吸收的热能呢?用什么方法可以准确地测量一个化学反应释放或吸收的热量呢?
化学反应的反应热
PART 01
化学反应的反应热
反应热
概念
符号
通常用Q表示
Q>0,表示反应吸热
Q<0,表示反应放热
化学上规定:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。
反应前后体系的温度相等
(1)任何化学反应都有反应热。
(2)物理变化中的能量变化不是反应热。如物质的三态变化、物质的溶解等。
(3)反应放热或吸热与反应条件无关。
化学反应的反应热
体系和环境
人为划定的研究对象(物质系统)称为体系,体系以外的其他部分称为环境。以盐酸与 NaOH 溶液的反应为例,分析如下:
环境:体系以外的其他部分,如试管、空气等
体系(物质系统)
反应物:NaOH 溶液、盐酸
发生的反应:NaOH + HCl = NaCl + H O
反应产物:NaCl、H O
化学反应的反应热
反应热的测定
反应热数值的获得方法
反应热的数值可以通过实验测得,也可以通过理论计算求得。
反应热测定的仪器和方法
用于测定反应热的仪器——量热计
如图所示为简易量热计示意图
外筒:起保温作用
搅拌器:使反应物迅速混合,使反应充分进行,保持体系的温度均匀
内筒:反应容器
反应物
温度计:测量反应前后溶液的温度
化学反应的反应热
将反应物加入内筒并搅拌使之迅速反应,测量反应前后溶液温度的变化值。
测定方法
计算公式
Q = -C(T2-T1)
式中:C表示溶液及量热计的热容;
T1、T2分别表示反应前和反应后体系的温度。
减少热量散失
化学反应的反应热
(1) 热力学温度(T)与摄氏温度(t)之间的关系为T(K) = t(℃) + 273.15。
(2) 热容(C)与比热容(c)的关系:比热容 = 。
由此可知Q = -C(T2-T1) = -mc(T2-T1)。简称比热,单位为kJ·K-1·kg-1
(3) 常温下,液态水的比热为4.18 kJ·K-1·kg-1。
单位为J·K-1
简称比热,单位为kJ·K-1·kg-1
化学反应的反应热
实验探究 —— 测定中和反应的反应热
利用简易量热计按照以下步骤可测得室温下中和反应的反应热。
1.向量热计内筒中加入1.0 mol·L-1的盐酸100 mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。
2.向250 mL的烧杯中加入1.0 mol·L-1的NaOH溶液100 mL,调节其温度,使之与量热计中盐酸的温度相同。
3.快速地将烧杯中的碱液倒入量热计中,盖好杯盖,匀速搅拌,记录体系达到的最高温度T2。
4.近似认为溶液的比热等于水的比热,根据溶液温度升高的数值计算此中和反应的反应热。
化学反应的反应热
化学反应的反应热
在上述实验中,参加反应的物质都是强酸或强碱,它们在水中是完全电离的,因此从本质上来说,它们之间所发生的都是溶液中的H+和OH-结合生成水的反应。
由于上述三个实验中所用溶液的体积是相同的,溶液中H+和OH-的浓度也是相同的,反应又都在室温下进行,因此这三个反应的反应热也是相同的。
化学反应的内能变化与焓变
PART 02
化学反应的内能变化与焓变
含义
符号
影响因素
化学反应的内能变化
内能
体系内物质所含各种微观粒子的能量总和
U
物质的种类、数量及聚集状态
体系的温度和压强
微观粒子的能量包括分子的平动、转动、振动,电子运动,原子核运动等各种形式运动的动能,以及微观粒子之间相互作用的势能。
化学反应的内能变化与焓变
化学反应中内能的变化△U = U(反应产物) - U(反应物)。
化学反应的能量变化与内能的关系
化学反应的能量变化是由反应前后物质所具有的内能不同而引起的。
U(反应产物)>U(反应物),反应吸收能量
U(反应产物)
化学反应体系与环境进行能量交换的形式——热和功
除热能外,体系与环境之间交换的其他形式的能(如电能、光能、机械能等)都称为功,用符号W表示。
体系做功 体系没有做功
U = Q + W U = Q
Q>0,反应吸热;Q<0,反应放热; W>0,环境对体系做功;W<0,体系对环境做功 化学反应的内能变化与焓变
化学反应的焓变
焓变与放热反应、吸热反应的关系
对于一个化学反应,反应产物的焓与反应物的焓之差称为反应焓变,符号是 H。
概念
数学表达式
H = H(反应产物) - H(反应物)
常用单位
kJ/mol(或kJ·mol-1)
焓变与反应热的关系
在等压条件下进行的化学反应,其反应热等于反应的焓变,即Qp = H,如敞口容器中进行的化学反应。
化学反应的内能变化与焓变
反应类型 放热反应 吸热反应
图像
焓变( H) H<0,反应体系向环境中放热 H>0,反应体系向环境中吸热
释放热量的化学反应
吸收热量的化学反应
化学反应的内能变化与焓变
H的计算方法
H = 反应产物的总能量 - 反应物的总能量。
H = 反应物中的化学键断裂吸收的总能量 - 反应产物中的化学键形成释放的总能量。
关键是正确判断出每种物质中存在的化学键的种类和个数
H = U + pV
式中:U为内能,p为压强,V为体积。
化学反应的内能变化与焓变
把一个化学反应中物质的变化和反应的焓变同时表示出 来的化学方程式称为热化学方程式。
热化学方程式
定义
意义
热化学方程式既表明了化学反应中的物质变化,又表明了化学反应中的能量变化。
物质变化
能量变化
缺一不可
化学反应的内能变化与焓变
书写热化学方程式的方法
写出符合质量守恒定律的化学方程式
注明物质的聚集状态
热化学方程式中各物质化学式前的系数只表示物质的量。因此,它可以用整数或分数表示。
书写热化学方程式时必须注明各物质的聚集状态,因为物质发生状态变化时也伴随着能量的变化。一般用英文字母g、l和s分别表示气态、液态和固态,水溶液中的溶质则用aq表示。
气体反应物和难溶反应物不能标“↑”“↓”
化学反应的内能变化与焓变
用 H表示化学反应的焓变
注明反应的温度和压强
放热反应的 H取负值,吸热反应的 H取正值; H的单位常用kJ· mol-1; H应与化学方程式中各物质化学式前的系数对应。
因为反应的温度和压强不同,其 H也不同。对于298 K、101 kPa条件下进行的反应,可以不注明。
化学式相同的同素异形体除注明聚集状态外还需注明其名称 (因为结构不同,物质具有的能量不同 ),如金刚石应表示为“ C (s,金刚石)”。
化学反应的内能变化与焓变
化学方程式 热化学方程式
系数 只能是整数,表示微粒的个数及物质的物质的量 既可以是整数,也可以是分数,只表示各物质的物质的量
聚集状态 不需要注明 必须在化学式后注明
“↑”“↓” 需要注明 不需要注明
反应条件 需要注明 不用注明除温度和压强之外的其他反应条件,如 “加热”“高温” 等
H 无 有,注明正负号及单位
意义 表明了化学反应中的物质变化 既表明了化学反应中的物质变化,又表明了化学反应中的能量变化
课堂小结
化学反应的内能变化与焓变
化学反应的反应热
反应热
反应热的测定
测定中和反应的反应热实验
化学反应的内能变化
化学反应的焓变
热化学方程式
随堂训练
1.下列说法正确的是( )
A. 在化学反应中发生物质变化的同时,一定发生能量变化
B. Q > 0表示放热反应,Q < 0表示吸热反应
C. 反应热是1 mol物质参加反应时的能量变化
D. 体系的温度升高一定是放热反应造成的,体系的温度降低一定是吸热反应造成的
A
随堂训练
2.下列有关叙述正确的是( )
A. 测定中和反应的反应热时,为了使反应均匀进行,可以向酸(碱)溶液中分几次加入碱(酸)溶液
B. 若用50 mL 0.50mol·L-1 NaOH溶液分别与50 mL 0.50 mol·L-1 盐酸和50 mL 0.50 mol·L-1 H2SO4溶液充分反应,测得的两反应的反应热不相等
C. 测定中和反应的反应热时,可以用稀硫酸与稀NaOH溶液反应
D. 为了简化装置,中和反应的反应热测定实验中的搅拌器可以用温度计代替
C
随堂训练
3. 下列说法不正确的是( )
A. 反应产物的总能量大于反应物的总能量时, H > 0
B. 反应放热时 H < 0,反应吸热时 H > 0
C. 任何条件下,化学反应的焓变都等于化学反应的反应热
D. 在一定条件下,某化学反应是吸热反应还是放热反应,由反应产物的总焓与反应物的总焓之差决定
C
随堂训练
4. 已知:H2(g) + F2(g) =2HF(g) H = - 270kJ·mol-1,下列说法正确的是( )
A. 在相同条件下,1 mol H2(g)与1mol F2(g)的能量总和大于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2mol HF(l)放出的热量小于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图表示
A
谢谢观看
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
