2.2.2反应条件对化学平衡的影响(教学课件)(共29张PPT)—高中化学鲁科版(2019)选择性必修一
文档属性
| 名称 | 2.2.2反应条件对化学平衡的影响(教学课件)(共29张PPT)—高中化学鲁科版(2019)选择性必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-08 21:33:58 | ||
图片预览








文档简介
(共29张PPT)
化学反应的方向、限度与速率
第二章
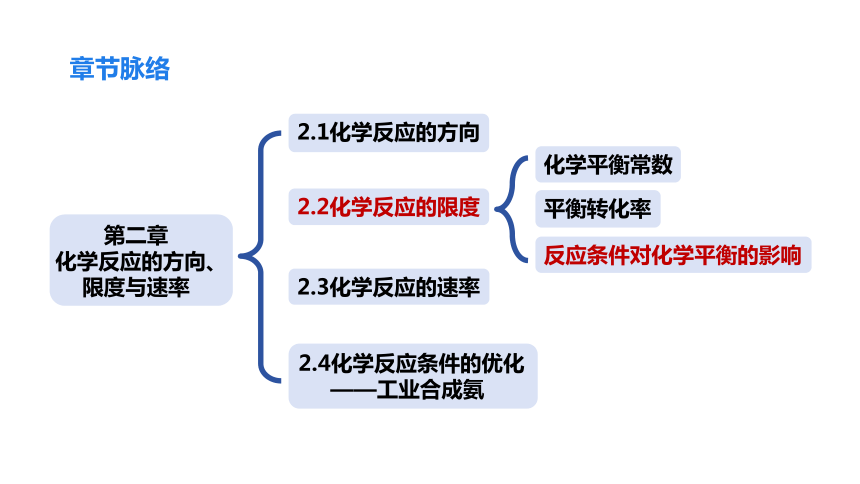
2.2化学反应的限度
章节脉络
化学平衡常数
平衡转化率
第二章
化学反应的方向、
限度与速率
2.2化学反应的限度
2.1化学反应的方向
2.3化学反应的速率
2.4化学反应条件的优化
——工业合成氨
反应条件对化学平衡的影响
反应条件对化学平衡的影响
核心素养目标
1. 宏观辨识与微观探析
能从宏观层面观察浓度、压强、温度改变时化学平衡体系的颜色变化、气体体积变化等现象,精准判断平衡移动方向;从微观角度理解外界条件改变导致正逆反应速率变化的本质原因,建立系统认知。
2. 证据推理与模型认知
通过实验数据和现象,推理浓度、压强、温度对化学平衡的影响规律,构建基于勒夏特列原理的平衡移动分析模型;能运用该模型预测复杂体系中多条件同时改变时平衡的移动方向,理解平衡移动与物质浓度、转化率之间的定量关系。
3. 科学探究与创新意识
树立绿色化学理念,增强合理调控反应条件、减少环境污染的社会责任感,推动可持续发展。
学习重难点
重点:
1. 掌握浓度、压强、温度对化学平衡移动的影响规律,能运用勒夏特列原理分析外界条件改变时平衡移动的方向。
2. 理解催化剂对化学反应速率和化学平衡的作用机制,明确催化剂只改变化学反应速率,不影响化学平衡状态。
难点:
1. 深入理解压强对化学平衡移动的影响本质,尤其是反应前后气体分子数不变的反应以及有固体、液体参与的反应中,压强改变对平衡影响的特殊性。
2. 分析多种条件同时改变时,化学平衡移动的综合结果,判断平衡移动方向与各物质浓度、转化率的变化趋势。
课前导入
初始浓度 /(mol·L-1) 平衡转化率 / % c始 (H2) c始 (CO2) α(H2) α(CO2)
A 0.0100 0.0100 60 60
B 0.0120 0.0100 54 65
C 0.0080 0.0100 66 53
对于1200℃时的反应 H2(g) + CO2(g) H2O(g) + CO(g),观察、分析表中数据,你能得出什么结论?
增大氢气在原料气中的浓度,可使二氧化碳的平衡转化率提高;同理,增大二氧化碳在原料气中的浓度,可使氢气的平衡转化率提高。
还有其他影响平衡转化率的因素吗?
温度对化学平衡的影响
PART 01
温度对化学平衡的影响
定义:化学平衡是在一定条件下建立起来的。受温度、压强或浓度变化的影响,化学反应由一种平衡状态变为另一种平衡状态的过程,称为化学平衡移动。
化学平衡移动的原因:反应条件的改变,使正、逆反应速率发生,平衡混合物中各组分的含量发生相应的。
实验探究 —— 温度对化学平衡的影响
某化学反应 mA(g)+nB(g) pC(g)+qD(g) 的ΔH > 0。温度、浓度或压强改变时,化学平衡状态是否会改变?如果发生改变,化学平衡将向哪个方向移动?说明预测理由。
温度变化 反应焓变ΔH 平衡常数K 温度变化 反应焓变ΔH 平衡常数K
升高 >0 增大 降低 >0 减小
<0 减小 <0 增大
温度对化学平衡的影响
实验探究 —— 温度对化学平衡的影响
实验目的
探究温度、浓度对化学平衡的影响。
实验用品
装有二氧化氮-四氧化二氮混合气体的装置,1 mol·L-1 FeCl3 溶液,0.01 mol·L-1 FeCl3 溶液,1 mol·L-1 KSCN溶液,0.01 mol·L-1 KSCN溶液,铁粉,冰水混合物,热水;烧杯,试管,胶头滴管。
温度对化学平衡的影响
室温
冷水
热水
温度对二氧化氮-四氧化二氮平衡体系的影响
升高温度时,颜色加深,二氧化氮浓度增大,即化学平衡向吸热方向移动,当体系颜色不再改变时表明在新的温度下体系达到新的平衡状态。
降低温度时,体系颜色变浅,表明平衡向放热方向移动。
实验结果证实,
升高温度,化学平衡向吸热方向移动;
降低温度,化学平衡向放热方向移动。
温度对化学平衡的影响
研究表明,温度对化学平衡的影响是通过改变化学平衡常数实现的:升高温度使吸热反应的平衡常数 K 增大,平衡向吸热反应方向移动;降低温度使放热反应的平衡常数 K 增大,平衡向放热反应方向移动。
反应2NO2(g) N2O4(g)在不同温度下的平衡常数
T/ K K/ (mol-1·L)
298 6.80
333 0.601
由表可知,升高温度时该放热反应的平衡常数 K 减小,引起平衡逆向移动。
温度对化学平衡的影响
反应焓变 温度变化 平衡常数K 移动方向
ΔH < 0 (放热反应) 升高 变小
降低 变大
ΔH >0 (吸热反应) 升高 变大
降低 变小
吸热方向(逆向)
放热方向(正向)
吸热方向(正向)
放热方向(逆向)
温度对化学平衡的影响
浓度对化学平衡的影响
PART 02
一定温度下平衡状态
温度一定时,反应 aA+bB cC+dD的平衡常数是一个定值。
增大反应物浓度
减小反应产物浓度
减小反应物浓度
增大反应产物浓度
Q减小
Q<K
平衡正向移动
Q减小
Q<K
平衡正向移动
Q增大
Q>K
平衡逆向移动
Q增大
Q>K
平衡逆向移动
浓度对化学平衡的影响
Q
K
Q
K
Q
K
Q < K
Q = K
Q > K
平衡右移
平衡左移
Q和K 的相对大小与平衡移动的关系示意图
反应物浓度增大
或反应产物浓度减小时
反应物浓度减小
或反应产物浓度增大时
平衡状态
浓度对化学平衡的影响
温度对化学平衡的影响是通过改变化学平衡常数实现的。
升高温度
K 增大
平衡向吸热反应方向移动
吸热反应:
降低温度
K 增大
平衡向放热反应方向移动
放热反应:
任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。
浓度对化学平衡的影响
压强对化学平衡的影响
PART 03
研究发现,对于有气态物质参与的反应,在一定温度下,增大体系压强,各气态物质的浓度也同等倍数增大。
Δυg = 0 P↑ Q = K 化学平衡状态不变
Δυg < 0 P↑ Q < K 化学平衡向化学方程式中气态物质化学式前
系数减小的方向移动
Δυg > 0 P↑ Q > K 化学平衡向气态物质系数减小的方向移动
压强对化学平衡的影响
Δυg =(气态反应产物系数之和)-(气态反应物系数之和)
压强对化学平衡的影响
压强对化学平衡的影响
压强对化学平衡的影响
历史上,勒·夏特列曾经提出了一个经验性的“平衡移动原理”:如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向减弱这个改变的方向移动。例如,增大反应体系中反应物的浓度,平衡向消耗反应物的方向移动;增大平衡体系的压强,平衡向气态物质分子数减小的方向移动;升高温度,平衡向吸热方向移动;等等。后人将这一经验规律称为“勒·夏特列原理”。
后来的研究表明,在均相、封闭体系中,只改变平衡体系中的一个条件时,勒·夏特列原理对平衡移动的分析与实际相符。
勒·夏特列原理
课堂小结
浓度对化学平衡的影响
反应条件对化
学平衡的影响
温度对化学平衡的影响
定义
浓度变化和平衡移动
计算
Q与K的相对大小与平衡移动的关系
化学平衡移动的原因
温度对化学平衡影响的实验
压强改变与系数变化的关系
结论
压强对化学平衡的影响
随堂训练
1. 在密闭容器中,反应:xA(g)+yB(g)??zC(g),在一定条件下达到平衡状态,保持温度不变,改变下列条件,分析解答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入He气,则平衡________移动。
(3)若保持压强不变,通入He气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,恒容条件下充入He气,则平衡________移动。
正反应
不
x+y<z
不
随堂训练
2. 在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO,若向新制氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A. H+浓度减小,HClO浓度减小
B. H+浓度增大,HClO浓度增大
C. H+浓度减小,HClO浓度增大
D. H+浓度增大,HClO浓度减小
C
随堂训练
3. 对于密闭容器中的可逆反应:mX(g)+nY(s) pZ(g) ΔH<0,达化学平衡后,改变条件,下列表达不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其他条件不变,升高温度,化学平衡一定发生移动
C
随堂训练
4. 密闭容器中,反应2X(g)===Y(g)+Z(s)已达到平衡,下列叙述正确的是( )
A.若升高温度,X(g)的浓度增大,则正反应为吸热反应
B.若容器体积不变,在平衡混合物中加入少量Z(s),则平
衡向左移动
C.压强变化对该平衡没有影响
D.若容器体积不变,加入氦气平衡不移动
D
随堂训练
5. 在固定体积的密闭容器中发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0,达到化学平衡状态且其他条件不变时,下列说法不正确的是( )
A.如果升高温度,平衡混合物的颜色加深
B.如果降低温度,平衡正向移动
C.如果降低温度,K减小
D.不论是升高温度还是降低温度,混合气体的密度均不变
C
谢谢观看
化学反应的方向、限度与速率
第二章
2.2化学反应的限度
章节脉络
化学平衡常数
平衡转化率
第二章
化学反应的方向、
限度与速率
2.2化学反应的限度
2.1化学反应的方向
2.3化学反应的速率
2.4化学反应条件的优化
——工业合成氨
反应条件对化学平衡的影响
反应条件对化学平衡的影响
核心素养目标
1. 宏观辨识与微观探析
能从宏观层面观察浓度、压强、温度改变时化学平衡体系的颜色变化、气体体积变化等现象,精准判断平衡移动方向;从微观角度理解外界条件改变导致正逆反应速率变化的本质原因,建立系统认知。
2. 证据推理与模型认知
通过实验数据和现象,推理浓度、压强、温度对化学平衡的影响规律,构建基于勒夏特列原理的平衡移动分析模型;能运用该模型预测复杂体系中多条件同时改变时平衡的移动方向,理解平衡移动与物质浓度、转化率之间的定量关系。
3. 科学探究与创新意识
树立绿色化学理念,增强合理调控反应条件、减少环境污染的社会责任感,推动可持续发展。
学习重难点
重点:
1. 掌握浓度、压强、温度对化学平衡移动的影响规律,能运用勒夏特列原理分析外界条件改变时平衡移动的方向。
2. 理解催化剂对化学反应速率和化学平衡的作用机制,明确催化剂只改变化学反应速率,不影响化学平衡状态。
难点:
1. 深入理解压强对化学平衡移动的影响本质,尤其是反应前后气体分子数不变的反应以及有固体、液体参与的反应中,压强改变对平衡影响的特殊性。
2. 分析多种条件同时改变时,化学平衡移动的综合结果,判断平衡移动方向与各物质浓度、转化率的变化趋势。
课前导入
初始浓度 /(mol·L-1) 平衡转化率 / % c始 (H2) c始 (CO2) α(H2) α(CO2)
A 0.0100 0.0100 60 60
B 0.0120 0.0100 54 65
C 0.0080 0.0100 66 53
对于1200℃时的反应 H2(g) + CO2(g) H2O(g) + CO(g),观察、分析表中数据,你能得出什么结论?
增大氢气在原料气中的浓度,可使二氧化碳的平衡转化率提高;同理,增大二氧化碳在原料气中的浓度,可使氢气的平衡转化率提高。
还有其他影响平衡转化率的因素吗?
温度对化学平衡的影响
PART 01
温度对化学平衡的影响
定义:化学平衡是在一定条件下建立起来的。受温度、压强或浓度变化的影响,化学反应由一种平衡状态变为另一种平衡状态的过程,称为化学平衡移动。
化学平衡移动的原因:反应条件的改变,使正、逆反应速率发生,平衡混合物中各组分的含量发生相应的。
实验探究 —— 温度对化学平衡的影响
某化学反应 mA(g)+nB(g) pC(g)+qD(g) 的ΔH > 0。温度、浓度或压强改变时,化学平衡状态是否会改变?如果发生改变,化学平衡将向哪个方向移动?说明预测理由。
温度变化 反应焓变ΔH 平衡常数K 温度变化 反应焓变ΔH 平衡常数K
升高 >0 增大 降低 >0 减小
<0 减小 <0 增大
温度对化学平衡的影响
实验探究 —— 温度对化学平衡的影响
实验目的
探究温度、浓度对化学平衡的影响。
实验用品
装有二氧化氮-四氧化二氮混合气体的装置,1 mol·L-1 FeCl3 溶液,0.01 mol·L-1 FeCl3 溶液,1 mol·L-1 KSCN溶液,0.01 mol·L-1 KSCN溶液,铁粉,冰水混合物,热水;烧杯,试管,胶头滴管。
温度对化学平衡的影响
室温
冷水
热水
温度对二氧化氮-四氧化二氮平衡体系的影响
升高温度时,颜色加深,二氧化氮浓度增大,即化学平衡向吸热方向移动,当体系颜色不再改变时表明在新的温度下体系达到新的平衡状态。
降低温度时,体系颜色变浅,表明平衡向放热方向移动。
实验结果证实,
升高温度,化学平衡向吸热方向移动;
降低温度,化学平衡向放热方向移动。
温度对化学平衡的影响
研究表明,温度对化学平衡的影响是通过改变化学平衡常数实现的:升高温度使吸热反应的平衡常数 K 增大,平衡向吸热反应方向移动;降低温度使放热反应的平衡常数 K 增大,平衡向放热反应方向移动。
反应2NO2(g) N2O4(g)在不同温度下的平衡常数
T/ K K/ (mol-1·L)
298 6.80
333 0.601
由表可知,升高温度时该放热反应的平衡常数 K 减小,引起平衡逆向移动。
温度对化学平衡的影响
反应焓变 温度变化 平衡常数K 移动方向
ΔH < 0 (放热反应) 升高 变小
降低 变大
ΔH >0 (吸热反应) 升高 变大
降低 变小
吸热方向(逆向)
放热方向(正向)
吸热方向(正向)
放热方向(逆向)
温度对化学平衡的影响
浓度对化学平衡的影响
PART 02
一定温度下平衡状态
温度一定时,反应 aA+bB cC+dD的平衡常数是一个定值。
增大反应物浓度
减小反应产物浓度
减小反应物浓度
增大反应产物浓度
Q减小
Q<K
平衡正向移动
Q减小
Q<K
平衡正向移动
Q增大
Q>K
平衡逆向移动
Q增大
Q>K
平衡逆向移动
浓度对化学平衡的影响
Q
K
Q
K
Q
K
Q < K
Q = K
Q > K
平衡右移
平衡左移
Q和K 的相对大小与平衡移动的关系示意图
反应物浓度增大
或反应产物浓度减小时
反应物浓度减小
或反应产物浓度增大时
平衡状态
浓度对化学平衡的影响
温度对化学平衡的影响是通过改变化学平衡常数实现的。
升高温度
K 增大
平衡向吸热反应方向移动
吸热反应:
降低温度
K 增大
平衡向放热反应方向移动
放热反应:
任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。
浓度对化学平衡的影响
压强对化学平衡的影响
PART 03
研究发现,对于有气态物质参与的反应,在一定温度下,增大体系压强,各气态物质的浓度也同等倍数增大。
Δυg = 0 P↑ Q = K 化学平衡状态不变
Δυg < 0 P↑ Q < K 化学平衡向化学方程式中气态物质化学式前
系数减小的方向移动
Δυg > 0 P↑ Q > K 化学平衡向气态物质系数减小的方向移动
压强对化学平衡的影响
Δυg =(气态反应产物系数之和)-(气态反应物系数之和)
压强对化学平衡的影响
压强对化学平衡的影响
压强对化学平衡的影响
历史上,勒·夏特列曾经提出了一个经验性的“平衡移动原理”:如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向减弱这个改变的方向移动。例如,增大反应体系中反应物的浓度,平衡向消耗反应物的方向移动;增大平衡体系的压强,平衡向气态物质分子数减小的方向移动;升高温度,平衡向吸热方向移动;等等。后人将这一经验规律称为“勒·夏特列原理”。
后来的研究表明,在均相、封闭体系中,只改变平衡体系中的一个条件时,勒·夏特列原理对平衡移动的分析与实际相符。
勒·夏特列原理
课堂小结
浓度对化学平衡的影响
反应条件对化
学平衡的影响
温度对化学平衡的影响
定义
浓度变化和平衡移动
计算
Q与K的相对大小与平衡移动的关系
化学平衡移动的原因
温度对化学平衡影响的实验
压强改变与系数变化的关系
结论
压强对化学平衡的影响
随堂训练
1. 在密闭容器中,反应:xA(g)+yB(g)??zC(g),在一定条件下达到平衡状态,保持温度不变,改变下列条件,分析解答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入He气,则平衡________移动。
(3)若保持压强不变,通入He气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,恒容条件下充入He气,则平衡________移动。
正反应
不
x+y<z
不
随堂训练
2. 在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO,若向新制氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A. H+浓度减小,HClO浓度减小
B. H+浓度增大,HClO浓度增大
C. H+浓度减小,HClO浓度增大
D. H+浓度增大,HClO浓度减小
C
随堂训练
3. 对于密闭容器中的可逆反应:mX(g)+nY(s) pZ(g) ΔH<0,达化学平衡后,改变条件,下列表达不正确的是( )
A.增大压强,化学平衡不一定发生移动
B.通入氦气,化学平衡不一定发生移动
C.增加X或Y的物质的量,化学平衡一定发生移动
D.其他条件不变,升高温度,化学平衡一定发生移动
C
随堂训练
4. 密闭容器中,反应2X(g)===Y(g)+Z(s)已达到平衡,下列叙述正确的是( )
A.若升高温度,X(g)的浓度增大,则正反应为吸热反应
B.若容器体积不变,在平衡混合物中加入少量Z(s),则平
衡向左移动
C.压强变化对该平衡没有影响
D.若容器体积不变,加入氦气平衡不移动
D
随堂训练
5. 在固定体积的密闭容器中发生反应:H2(g)+Br2(g) 2HBr(g) ΔH<0,达到化学平衡状态且其他条件不变时,下列说法不正确的是( )
A.如果升高温度,平衡混合物的颜色加深
B.如果降低温度,平衡正向移动
C.如果降低温度,K减小
D.不论是升高温度还是降低温度,混合气体的密度均不变
C
谢谢观看
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
