浙教版(2024)科学七下期末复习:第2章实验探究题(含解析)
文档属性
| 名称 | 浙教版(2024)科学七下期末复习:第2章实验探究题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 584.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-07 09:53:08 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
七下期末复习:第2章实验探究题
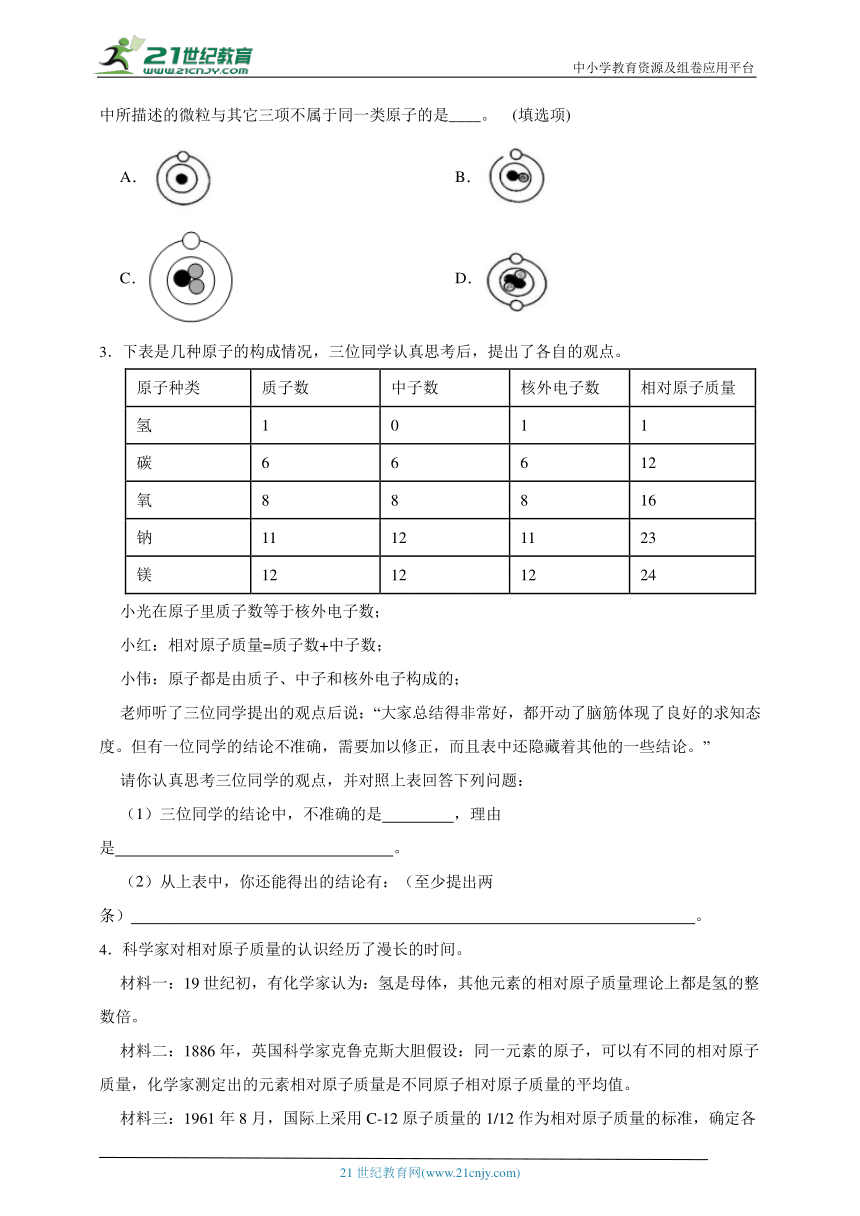
1.小科通过微信公众号“胜哥课程”观看了《电解水的微观解释》,对相关知识有了深刻的理
解。如图是电解水的简易装置和电解水生成的气体体积与时间的关系图。试回答下列问题。
(1)若甲试管中生成B气体,b应接电源的 极。
(2)把带火星的木条放入B气体中能看到的现象是 。
(3)图Ⅲ表示水电解的微观变化过程,其正确的顺序是 (填序号)。
(4)根据电解水微观示意图,下列叙述正确的是____。
A.理论上实验结束后甲、乙两支试管排出水的质量之比为2:1
B.从宏观上分析:该实验能证明水由氢气和氧气组成
C.水分解的过程中,氢原子和氧原子数都没发生变化
D.水电解的文字表达式:水 通直流电 2个氢原子+1个氧原子
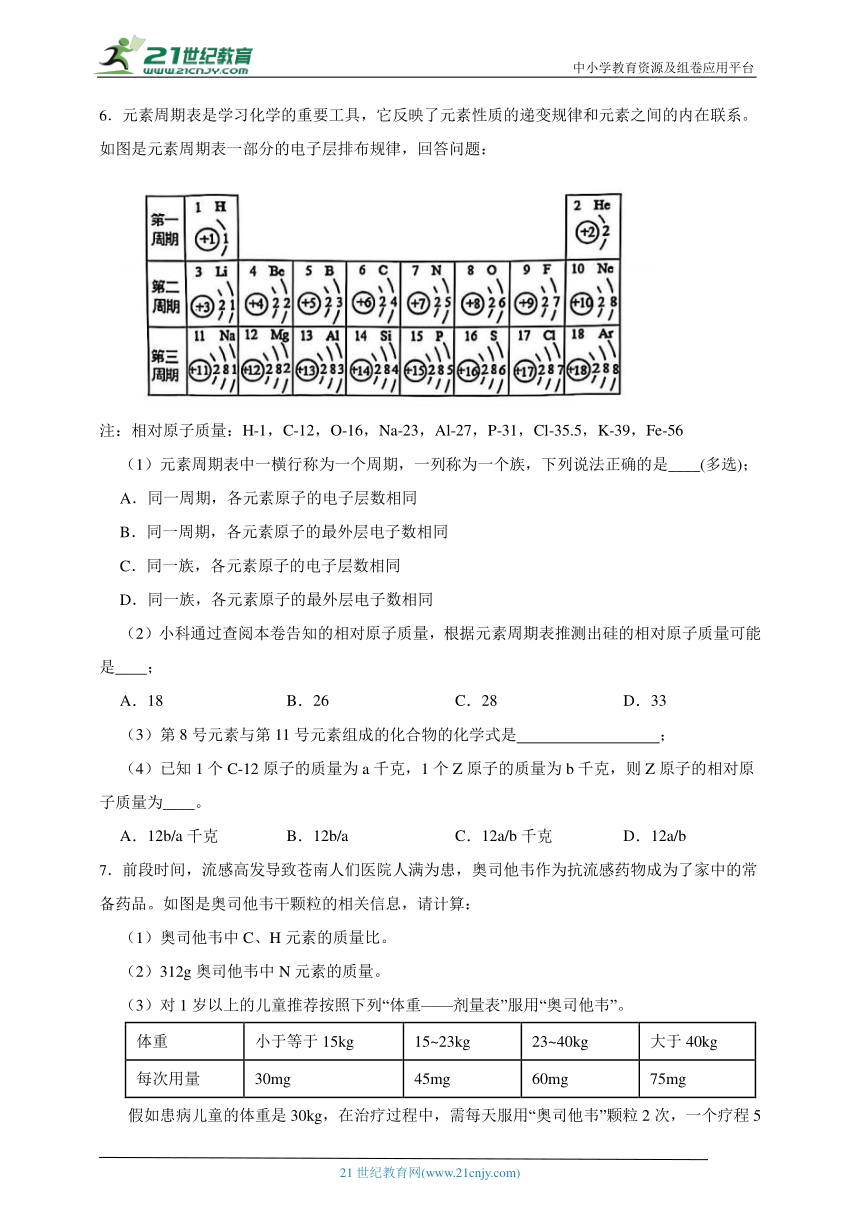
2.为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
现象1:大多数α粒子能穿透金箔而不改变原来运动方向; 现象2:少部分α粒子改变原来的运动方向: 现象3:极少数α粒子被弹了回来。
(1)请分析现象3的原因 。
(2)根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是 点(用字母表示)。
(3)卢瑟福构建了核式原子结构模型,若以①、●和③分别代表电子、质子与中子,则下图中所描述的微粒与其它三项不属于同一类原子的是____。 (填选项)
A. B.
C. D.
3.下表是几种原子的构成情况,三位同学认真思考后,提出了各自的观点。
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
钠 11 12 11 23
镁 12 12 12 24
小光在原子里质子数等于核外电子数;
小红:相对原子质量=质子数+中子数;
小伟:原子都是由质子、中子和核外电子构成的;
老师听了三位同学提出的观点后说:“大家总结得非常好,都开动了脑筋体现了良好的求知态度。但有一位同学的结论不准确,需要加以修正,而且表中还隐藏着其他的一些结论。”
请你认真思考三位同学的观点,并对照上表回答下列问题:
(1)三位同学的结论中,不准确的是 ,理由是 。
(2)从上表中,你还能得出的结论有:(至少提出两条) 。
4.科学家对相对原子质量的认识经历了漫长的时间。
材料一:19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量,化学家测定出的元素相对原子质量是不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用C-12原子质量的1/12作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是该元素所有同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)下列元素的相对原子质量不支持材料一的是____。
A.O﹣16 B.Cl﹣35.5 C.Ag﹣108
(2)在克鲁克斯的假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是 。
(3)根据材料三,现发现氖的同位素在自然界中分布如图,根据上述资料,列出氖元素的相对原子质量的计算式子: 。
(4)结合以上材料及所学知识,判断下列说法正确的是____。
A.19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值
B.只要方法正确、仪器精确,实验结果就不会存在误差
C.若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准
D.元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素都有同位素原子
5.1932年LinusPauling提出电负性(其值用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小.他假定F的电负性为4,并通过热化学方法建立了其它元素的电负性.LinusPauling建立的部分元素的电负性如下:
H:2.1
Li:1.0 Be:1.5 N:3.0 O:3.5 F:4.0
Na:0.9 Mg:1.2 P:2.1 S:2.5 Cl:3.0
K:0.8 Ca:1.0 As:2.0 Se:2.4 Br:2.8
Rb:0.7 Sr:1.0 Sb:1.9 Te:? I:2.3
Cs:0.6 Ba:0.9 Bi:1.8 Po:2.0 At:2.2
回答下列问题:
(1)写出元素电负性在上表中同一横行的递变规律: .
(2)预测Te元素x的取值范围 .
(3)大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物.根据此经验规律,KBr物质 (填“是”或“不是”)离子化合物.
6.元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,回答问题:
注:相对原子质量:H-1,C-12,O-16,Na-23,Al-27,P-31,Cl-35.5,K-39,Fe-56
(1)元素周期表中一横行称为一个周期,一列称为一个族,下列说法正确的是____(多选);
A.同一周期,各元素原子的电子层数相同
B.同一周期,各元素原子的最外层电子数相同
C.同一族,各元素原子的电子层数相同
D.同一族,各元素原子的最外层电子数相同
(2)小科通过查阅本卷告知的相对原子质量,根据元素周期表推测出硅的相对原子质量可能是____;
A.18 B.26 C.28 D.33
(3)第8号元素与第11号元素组成的化合物的化学式是 ;
(4)已知1个C-12原子的质量为a千克,1个Z原子的质量为b千克,则Z原子的相对原子质量为____。
A.12b/a千克 B.12b/a C.12a/b千克 D.12a/b
7.前段时间,流感高发导致苍南人们医院人满为患,奥司他韦作为抗流感药物成为了家中的常备药品。如图是奥司他韦干颗粒的相关信息,请计算:
(1)奥司他韦中C、H元素的质量比。
(2)312g奥司他韦中N元素的质量。
(3)对1岁以上的儿童推荐按照下列“体重——剂量表”服用“奥司他韦”。
体重 小于等于15kg 15~23kg 23~40kg 大于40kg
每次用量 30mg 45mg 60mg 75mg
假如患病儿童的体重是30kg,在治疗过程中,需每天服用“奥司他韦”颗粒2次,一个疗程5天,那么该患儿一个疗程共服用多少包?
8.光合作用释放的氧气来自原料CO2还是H2O呢?科学家鲁宾和卡门曾对这个问题进行了研究,在实验中他们利用18O作为标记物,制备了三份相同浓度的碳酸氢盐溶液,三份溶液的碳酸氢盐和水都含有不同的18O百分比,将小球藻放入这三种溶液并光照,然后分析产生的氧,得出结论:光合作用产生的氧来自水。资料:
I.中子数为8的氧原子可用16O来表示,18O是表示中子数为10的氧原子;自然界的氧气在标准状况下的密度为1.43千克/米3,其中16O占99.76%(可视为100%)
Ⅱ.碳酸氢盐给小球藻的光合作用提供全部的CO2,而且不产生水。
Ⅲ.在相同的温度和压强下,相同体积的气体具有相同的分子数。
(1)16O、标记物18O都属于氧元素,其位置大致在元素周期表的 方。
(2)鲁宾和卡门通过测生成氧气的密度来确定氧气中18O含量。若有一瓶氧气,只含18O和16O,且个数比为1:1,结合材料,计算在标准状况下该瓶氧气的密度是 千克/米3。
9.元素周期表是学习和研究科学的重要工具, 经历了 100 多年的不断发展和完善,如图是元素周期表的一段发展史。
(1) 表一是元素周期表的一部分, 迈耶尔和门捷列夫都提到了这部分, 只是门捷列夫更为完善, F 元素的化合价与 相似。
(2) 表二是八音律表的一部分, 按照纽兰兹的理论, 请找出与 元素性质相似的元素, 它与氧元素形成化合物的化学式 。
(3) 分析上述科学史料, 下列观点正确的有____(可多选)
A.研究复杂的现象往往需要寻找规律
B.科学家在研究元素周期规律时, 不需要借助任何技术
C.如果当时门捷列夫没有发现元素周期表, 以后就不会再有人发现了
D.随着科学的进步, 新的元素陆续会被发现
E.纽兰兹的八音律理论中没有稀有气体元素, 说明他的理论完全错误
10.“胜哥”收集了一些微粒的资料,请你和他一起根据表格数据回答下列问题。
微粒名称 质子数 中子数 电子数 带电性
A 14 14 14 不带电
B 26 30 24 带2个单位正电荷
C 14 14 16
D 14 16 14 不带电
(1)表格中属于互为同位素的是 。
(2)根据表格信息写出微粒C的符号 。
(3)比较C与D两种微粒,其中质量较大的是 。
11.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于对元素的化合价不再“感冒”。下面是小科对元素化合价的部分探究过程。
【提出问题】元素正负化合价有何规律[
推测一:金属元素在化合物中都显正价;
推测二:非金属元素在化合物中只有负价。
【举例及分析】
(1)NaCl、CuO、Fe2O3中金属元素化合价分别为+1、+2,+3,其他金属在化合物中也都显正价,推测一正确。金属都显正价的可能原因是 。(从电子得失角度回答)
(2)H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4,说明推测二 (填“成立”或“不成立”)。
(3)HCl、H2S、CH4中氯、硫、碳元素的化合价分别为-1、-2、-4。
(4)通过上述探究过程可知:金属元素在化合物中通常显正价,而非金属元素与氧化合时常显正价,与氢化合时常显 价。
答案解析部分
1.【答案】(1)负
(2)木条复燃
(3)2、 1、 3
(4)C
【知识点】水的组成和主要性质
【解析】【分析】(1)生成氢气的体积大约是氧气体积的2倍,正极生成氧气,负极生成氢气;
(2)根据氧气的检验方法分析解答;
(3)根据化学变化的本质解答;
(4)A.根据对水的电解实验的现象的认识判断;
B.根据质量守恒定律分析;
C.根据化学变化的本质判断;
D.根据反应物、反应条件和生成物,确定反应的文字表达式。
【解答】 (1)在电解水实验中,“正氧负氢”,且生成氢气和氧气的体积比约为2:1。图Ⅰ中一中产生气体比甲多,故乙中产生氢气,甲中产生氧气,则b应接电源的负极。
(2)由图Ⅱ可知,A气体的体积约是B气体体积的2倍,所以A氢气,B是氧气。B气体是氧气,氧气具有助燃性,能使带火星的木条复燃,所以把带火星的木条放入B气体中能看到的现象是带火星的木条复燃。
(3)水电解的微观变化过程是水分子先分裂成氢原子和氧原子,然后氢原子重新组合成氢分子,氧原子重新组合成氧分子,所以正确的顺序是②①③。
(4)A.电解水时生成氢气和氧气的体积比约为 2:1,根据m=ρV同温同压下,氢气和氧气的密度不同),理论上实验结束后甲、乙两支试管排出水的质量之比不是 2:1,故A错误;
B.从宏观上分析,该实验能证明水由氢元素和氧元素组成,而不是由氢气和氧气组成,氢气和氧气是水分解的产物,故B错误;
C.根据质量守恒定律,化学反应前后原子的种类和数目不变,水分解的过程中,氢原子和氧原子数都没发生变化,故C正确;
D.水电解的文字表达式为:,故D错误。
故选C。
2.【答案】(1)原子核很小且质量很大
(2)A
(3)D
【知识点】原子的构成;原子结构的探索过程
【解析】【分析】 (1)根据原子结构分析解答;原子的质量主要集中在原子核上,核外有一个非常大的空间,原子不是个实心球体分析;
(2)根据原子结构分析解答;原子的质量主要集中在原子核上,核外有一个非常大的空间,原子不是个实心球体分析;
(3)根据决定原子所属类别的因素是原子核中的质子数进行分析。
【解答】 (1)在现象3中,有极少数α粒子被弹了回来,说明向着它质量大得多,且带有同种电荷的粒子运动,即原子核很小且质量很大;
(2)绝大多数α粒子穿过后方向不变即α粒子偏转角度为0,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的,故图乙中A点能说明原子内部绝大部分是空的;
(3)同一类原子中原子核中的质子数相同;A、B、C、D中的质子数分别为1、1、1、2,故选项中描述的微粒不属于同一类原子的是D。
3.【答案】小伟;氢原子只有质子、电子,没有中子;不同原子的质子数不同;同一原子质子数不一定等于中子数等(合理即可)
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)根据表中数据可知相对原子质量与质子数以及中子数的关系,质子数与电子数的关系,也可知道原子中可以没有中子。
(2)由表中数据可知,有的原子质子数等于中子数,有的原子不是,说明质子数与中子数可能相同,可能不相同。
【解答】(1)小伟:原子都是由质子、中子和核外电子构成的。结论不正确,因为根据图表中数据氢原子中只有质子,没有中子。
故答案为小伟;氢原子只有质子、电子,没有中子。
(2)从上表中,观察得出的结论有:①从氢、碳、氧、钠、镁原子的质子数分析得出结论:不同原子的质子数不同;
②从氢原子的质子数为1,中子数为0,钠原子的质子数为11,中子数为12,可得出结论:同一种原子,质子数不一定等于中子数;
③从钠原子的中子数为12,镁原子的中子数也为12,可得出结论:不同种的原子,中子数可能相同;
④从有的原子有中子,有的原子(氢原子)没有中子分析可得出结论:原子中可能不含有中子;
⑤从各原子的相对原子质量分析可得出结论:不同原子其相对原子质量不同。
故答案为不同原子的质子数不同;同一原子质子数不一定等于中子数等(合理即可)。
4.【答案】(1)B
(2)中子数
(3)21×a%+22×b%+20×c%
(4)C;D
【知识点】相对原子质量
【解析】【分析】(1)根据题意,氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,进行分析解答。
(2)根据同种元素的原子的核内质子数相同,进行分析解答。
(3)根据题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,进行分析解答。
(4)根据资料内容,结合所学知识,进行分析判断。
【解答】(1)19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,元素的相对原子质量不支持材料一的是Cl-35.5。
(2)同种元素的原子的核内质子数相同,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是中子数。
(3)由题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,氖元素的相对原子质量的计算式子为21×a%+22×b%+20×c%
(4)A.19世纪初,以氢为母体的相对原子质量标准是错误的,但它对科学的发展是有价值的,故选项说法错误。
B.即使方法正确、仪器精确,实验结果也会存在误差,故选项说法错误。
C.随着科学的发展,若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准,故选项说法正确。
D.某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子,故选项说法正确。
5.【答案】(1)同一横行中从左到右元素电负性逐渐增大
(2)2.0≤x≤2.4
(3)是
【知识点】元素周期表
【解析】【分析】(1)根据表格内的数据进行分析解答;
(2)根据表格内的数据及金属活动性顺序进行分析解答;
(3)根据Br与K的电负性差值判断。
【解答】(1)由表格内的数据可知,同一横行中从左到右元素电负性逐渐增大;
(2)由表中数据可知,一般情况下,同周期自左而右电负性增大,同主族自上而下电负性降低,Te元素x的取值范围介于Se和Po之间,Te元素x的取值范围是:2.0≤x≤2.4;
(3)Br的电负性为2.8,K的电负性为0.8,两种元素的x值相差为2,大于1.7,所以物质KBr是离子化合物。
6.【答案】(1)A;D
(2)C
(3)Na2O或者Na2O2
(4)B
【知识点】元素周期表;化学式的书写及意义;元素化合价的规则与计算;相对原子质量
【解析】【分析】(1)根据题中所给原子的额外电子排布图进行分析。
(2)由所给的相对原子质量可知,原子序数越大,相对原子质量越大,所以硅的相对原子质量在铝和磷之间,结合铝和磷的相对相对原子质量即可得出硅的相对原子质量的取值范围。
(3)根据化合物中各元素化合价之和为零判断钠和氧的个数比,金属写左边,非金属写右边。
(4)根据相对原子质量的定义求解,由于相对原子质量是质量之间的比值,所以单位不是kg,而是“1”。
【解答】(1)由图可知,第一周期,电子层数为一层,第二周期为两层,第三周期为三层,可知同一周期,各元素原子的电子层数相同,故A正确;
B、由图可知,同一周期,从左到右,最外层电子数逐渐增大,故B错误;
CD、由图可知,同一族最外侧电子数相同,而电子层数不同,故C错误,D正确。
故答案为:AD。
(2)由所给相对原子质量和原子的位置可知,硅的相对原子质量在铝和磷之间,即在27和31之间。
故答案为:C。
(3)第8号元素是氧元素,第11号元素是钠元素,钠元素的化合价为+1价,氧元素的化合价有-2价和-1价,化合物中各元素的化合价之和为零,可知化学式为Na2O或者Na2O2。
(4)相对原子质量以一个碳原子的质量的十二分之一为标准,即标准为,一个Z原子的质量为bkg,则相对原子质量为。
故答案为:B。
7.【答案】(1)48:7
(2)m(N)=312g×=28g
(3)20包
【知识点】有关化学式的计算和推断
【解析】【分析】(1)元素的质量比等于相对原子质量与原子个数的乘积之比;
(2)某元素的质量等于该物质的质量乘该元素的质量分数;
(3)根据题目所给的信息计算出该患儿一个疗程需服用的颗粒的包数。
【解答】(1)奥司他韦中C、H元素的质量比为:
;
(2)312g奥司他韦中N元素的质量=奥司他韦的质量×氮元素的质量分数;
(3)从表格中的数据可知,该儿童一次服用量为60mg,一天2次,则5天需要服用的质量为:
60mg×2×5=600mg,
则服用的包数为:。
8.【答案】(1)右上
(2)1.52
【知识点】元素周期表;有关化学式的计算和推断
【解析】【分析】(1)根据氧元素质子数及元素周期表排列顺序分析;
(2)根据自然界中氧气的密度和相对分子质量与所给氧气的相对分子质量分析。
【解答】(1)16O、标记物18O都属于氧元素,氧原子质子数为8,最外层电子数为6,氧元素位置大致在元素周期表的 右上方。
(2) 在相同的温度和压强下,相同体积的气体具有相同的分子数 , 若有一瓶氧气,只含18O和16O,且个数比为1:1, 则该氧气的相对分子质量为34,设 在标准状况下该瓶氧气的密度是 x,则 1.43千克/米3 :x=32:34,x=1.52 千克/米3。
故答案为:(1)右上;(2)1.52.
9.【答案】(1)Cl
(2)MgO
(3)A;D
【知识点】元素周期表;化学式的书写及意义
【解析】【解答】 (1)由迈耶尔和门捷列夫的研究可知,同一周期元素核外电子层 数相同,同一族元素化学性质相似。所以F元素的化合价与Cl相似。
(2)按照组兰兹的理论,元素的排列每逢八就出现周期性,故与G元素性质相似的元素为Mg,它与氧元素形成化合物的化学式为MgO。
(3)由题干科学史料可知,BC观点说的有点绝对,不正确,故观点正确的有AD。
【分析】同一周期元素核外电子层 数相同,同一族元素化学性质相似,表二中上下元素化学性质相似。
10.【答案】(1)AD
(2)Si2-
(3)D
【知识点】同位素;离子的书写与意义;相对原子质量
【解析】【分析】(1)具有相同的质子数和不同中子数的原子,称为同位素原子;
(2)根据表格可知,质子带正电,电子带负电,将二者的电荷数相减,哪个有剩余,那么该微粒就带几个单位的哪种电荷;
(3)相对原子质量等于质子数加中子数,相对原子质量越大,那么原子的实际质量越大。
【解答】(1)A和D的原子的质子数都是14,但是中子数不同,所以它们互为同位素;
(2)微粒C质子数14,电子数为16,二者之差为2,由于电子数多,所以带2个单位的负电荷;
(3)C的相对原子质量:14+14=28,D的相对原子质量:14+16=30,则质量较大的是D。
11.【答案】(1)金属元素在形成化合物时只能失去电子而不能得到电子
(2)不成立
(3)【得出结论】与氢元素组成的化合物,此时非金属元素都显负价。
(4)负
【知识点】元素化合价的规则与计算
【解析】【分析】(1)金属元素对电子的束缚能力弱,容易失去电子显正价;
(2)注意分析非金属元素的化合价是否只显示负价即可;
(3)三种化合物中都含有氢元素,据此分析另一种非金属元素的化合价规律;
(4)将上面得到的结论综合一起即可。
【解答】(1) 金属都显正价的可能原因是金属元素在形成化合物时只能失去电子而不能得到电子;
(2)在 H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4, 即在与氧元素形成的化合物中,非金属元素都显正价,则推测二不成立;
(3) HCl、H2S、CH4中氯、硫、碳元素的化合价分别为-1、-2、-4。 它们都是与氢元素组成的化合物,此时非金属元素都显负价。
(4)通过上述探究过程可知:金属元素在化合物中通常显正价,而非金属元素与氧化合时常显正价,与氢化合时常显负价。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
七下期末复习:第2章实验探究题
1.小科通过微信公众号“胜哥课程”观看了《电解水的微观解释》,对相关知识有了深刻的理
解。如图是电解水的简易装置和电解水生成的气体体积与时间的关系图。试回答下列问题。
(1)若甲试管中生成B气体,b应接电源的 极。
(2)把带火星的木条放入B气体中能看到的现象是 。
(3)图Ⅲ表示水电解的微观变化过程,其正确的顺序是 (填序号)。
(4)根据电解水微观示意图,下列叙述正确的是____。
A.理论上实验结束后甲、乙两支试管排出水的质量之比为2:1
B.从宏观上分析:该实验能证明水由氢气和氧气组成
C.水分解的过程中,氢原子和氧原子数都没发生变化
D.水电解的文字表达式:水 通直流电 2个氢原子+1个氧原子
2.为探究原子结构,1911年英国科学家卢瑟福进行了著名的α粒子(一个α粒子内含2个质子)轰击金箔实验,发现以下现象,如图甲。
现象1:大多数α粒子能穿透金箔而不改变原来运动方向; 现象2:少部分α粒子改变原来的运动方向: 现象3:极少数α粒子被弹了回来。
(1)请分析现象3的原因 。
(2)根据α粒子散射实验,统计不同偏转角度的α粒子数量,并绘制成图像(如图乙)。其中能说明原子内部绝大部分是空的数据是 点(用字母表示)。
(3)卢瑟福构建了核式原子结构模型,若以①、●和③分别代表电子、质子与中子,则下图中所描述的微粒与其它三项不属于同一类原子的是____。 (填选项)
A. B.
C. D.
3.下表是几种原子的构成情况,三位同学认真思考后,提出了各自的观点。
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
钠 11 12 11 23
镁 12 12 12 24
小光在原子里质子数等于核外电子数;
小红:相对原子质量=质子数+中子数;
小伟:原子都是由质子、中子和核外电子构成的;
老师听了三位同学提出的观点后说:“大家总结得非常好,都开动了脑筋体现了良好的求知态度。但有一位同学的结论不准确,需要加以修正,而且表中还隐藏着其他的一些结论。”
请你认真思考三位同学的观点,并对照上表回答下列问题:
(1)三位同学的结论中,不准确的是 ,理由是 。
(2)从上表中,你还能得出的结论有:(至少提出两条) 。
4.科学家对相对原子质量的认识经历了漫长的时间。
材料一:19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量,化学家测定出的元素相对原子质量是不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用C-12原子质量的1/12作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是该元素所有同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)下列元素的相对原子质量不支持材料一的是____。
A.O﹣16 B.Cl﹣35.5 C.Ag﹣108
(2)在克鲁克斯的假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是 。
(3)根据材料三,现发现氖的同位素在自然界中分布如图,根据上述资料,列出氖元素的相对原子质量的计算式子: 。
(4)结合以上材料及所学知识,判断下列说法正确的是____。
A.19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值
B.只要方法正确、仪器精确,实验结果就不会存在误差
C.若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准
D.元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素都有同位素原子
5.1932年LinusPauling提出电负性(其值用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小.他假定F的电负性为4,并通过热化学方法建立了其它元素的电负性.LinusPauling建立的部分元素的电负性如下:
H:2.1
Li:1.0 Be:1.5 N:3.0 O:3.5 F:4.0
Na:0.9 Mg:1.2 P:2.1 S:2.5 Cl:3.0
K:0.8 Ca:1.0 As:2.0 Se:2.4 Br:2.8
Rb:0.7 Sr:1.0 Sb:1.9 Te:? I:2.3
Cs:0.6 Ba:0.9 Bi:1.8 Po:2.0 At:2.2
回答下列问题:
(1)写出元素电负性在上表中同一横行的递变规律: .
(2)预测Te元素x的取值范围 .
(3)大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物.根据此经验规律,KBr物质 (填“是”或“不是”)离子化合物.
6.元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,回答问题:
注:相对原子质量:H-1,C-12,O-16,Na-23,Al-27,P-31,Cl-35.5,K-39,Fe-56
(1)元素周期表中一横行称为一个周期,一列称为一个族,下列说法正确的是____(多选);
A.同一周期,各元素原子的电子层数相同
B.同一周期,各元素原子的最外层电子数相同
C.同一族,各元素原子的电子层数相同
D.同一族,各元素原子的最外层电子数相同
(2)小科通过查阅本卷告知的相对原子质量,根据元素周期表推测出硅的相对原子质量可能是____;
A.18 B.26 C.28 D.33
(3)第8号元素与第11号元素组成的化合物的化学式是 ;
(4)已知1个C-12原子的质量为a千克,1个Z原子的质量为b千克,则Z原子的相对原子质量为____。
A.12b/a千克 B.12b/a C.12a/b千克 D.12a/b
7.前段时间,流感高发导致苍南人们医院人满为患,奥司他韦作为抗流感药物成为了家中的常备药品。如图是奥司他韦干颗粒的相关信息,请计算:
(1)奥司他韦中C、H元素的质量比。
(2)312g奥司他韦中N元素的质量。
(3)对1岁以上的儿童推荐按照下列“体重——剂量表”服用“奥司他韦”。
体重 小于等于15kg 15~23kg 23~40kg 大于40kg
每次用量 30mg 45mg 60mg 75mg
假如患病儿童的体重是30kg,在治疗过程中,需每天服用“奥司他韦”颗粒2次,一个疗程5天,那么该患儿一个疗程共服用多少包?
8.光合作用释放的氧气来自原料CO2还是H2O呢?科学家鲁宾和卡门曾对这个问题进行了研究,在实验中他们利用18O作为标记物,制备了三份相同浓度的碳酸氢盐溶液,三份溶液的碳酸氢盐和水都含有不同的18O百分比,将小球藻放入这三种溶液并光照,然后分析产生的氧,得出结论:光合作用产生的氧来自水。资料:
I.中子数为8的氧原子可用16O来表示,18O是表示中子数为10的氧原子;自然界的氧气在标准状况下的密度为1.43千克/米3,其中16O占99.76%(可视为100%)
Ⅱ.碳酸氢盐给小球藻的光合作用提供全部的CO2,而且不产生水。
Ⅲ.在相同的温度和压强下,相同体积的气体具有相同的分子数。
(1)16O、标记物18O都属于氧元素,其位置大致在元素周期表的 方。
(2)鲁宾和卡门通过测生成氧气的密度来确定氧气中18O含量。若有一瓶氧气,只含18O和16O,且个数比为1:1,结合材料,计算在标准状况下该瓶氧气的密度是 千克/米3。
9.元素周期表是学习和研究科学的重要工具, 经历了 100 多年的不断发展和完善,如图是元素周期表的一段发展史。
(1) 表一是元素周期表的一部分, 迈耶尔和门捷列夫都提到了这部分, 只是门捷列夫更为完善, F 元素的化合价与 相似。
(2) 表二是八音律表的一部分, 按照纽兰兹的理论, 请找出与 元素性质相似的元素, 它与氧元素形成化合物的化学式 。
(3) 分析上述科学史料, 下列观点正确的有____(可多选)
A.研究复杂的现象往往需要寻找规律
B.科学家在研究元素周期规律时, 不需要借助任何技术
C.如果当时门捷列夫没有发现元素周期表, 以后就不会再有人发现了
D.随着科学的进步, 新的元素陆续会被发现
E.纽兰兹的八音律理论中没有稀有气体元素, 说明他的理论完全错误
10.“胜哥”收集了一些微粒的资料,请你和他一起根据表格数据回答下列问题。
微粒名称 质子数 中子数 电子数 带电性
A 14 14 14 不带电
B 26 30 24 带2个单位正电荷
C 14 14 16
D 14 16 14 不带电
(1)表格中属于互为同位素的是 。
(2)根据表格信息写出微粒C的符号 。
(3)比较C与D两种微粒,其中质量较大的是 。
11.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于对元素的化合价不再“感冒”。下面是小科对元素化合价的部分探究过程。
【提出问题】元素正负化合价有何规律[
推测一:金属元素在化合物中都显正价;
推测二:非金属元素在化合物中只有负价。
【举例及分析】
(1)NaCl、CuO、Fe2O3中金属元素化合价分别为+1、+2,+3,其他金属在化合物中也都显正价,推测一正确。金属都显正价的可能原因是 。(从电子得失角度回答)
(2)H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4,说明推测二 (填“成立”或“不成立”)。
(3)HCl、H2S、CH4中氯、硫、碳元素的化合价分别为-1、-2、-4。
(4)通过上述探究过程可知:金属元素在化合物中通常显正价,而非金属元素与氧化合时常显正价,与氢化合时常显 价。
答案解析部分
1.【答案】(1)负
(2)木条复燃
(3)2、 1、 3
(4)C
【知识点】水的组成和主要性质
【解析】【分析】(1)生成氢气的体积大约是氧气体积的2倍,正极生成氧气,负极生成氢气;
(2)根据氧气的检验方法分析解答;
(3)根据化学变化的本质解答;
(4)A.根据对水的电解实验的现象的认识判断;
B.根据质量守恒定律分析;
C.根据化学变化的本质判断;
D.根据反应物、反应条件和生成物,确定反应的文字表达式。
【解答】 (1)在电解水实验中,“正氧负氢”,且生成氢气和氧气的体积比约为2:1。图Ⅰ中一中产生气体比甲多,故乙中产生氢气,甲中产生氧气,则b应接电源的负极。
(2)由图Ⅱ可知,A气体的体积约是B气体体积的2倍,所以A氢气,B是氧气。B气体是氧气,氧气具有助燃性,能使带火星的木条复燃,所以把带火星的木条放入B气体中能看到的现象是带火星的木条复燃。
(3)水电解的微观变化过程是水分子先分裂成氢原子和氧原子,然后氢原子重新组合成氢分子,氧原子重新组合成氧分子,所以正确的顺序是②①③。
(4)A.电解水时生成氢气和氧气的体积比约为 2:1,根据m=ρV同温同压下,氢气和氧气的密度不同),理论上实验结束后甲、乙两支试管排出水的质量之比不是 2:1,故A错误;
B.从宏观上分析,该实验能证明水由氢元素和氧元素组成,而不是由氢气和氧气组成,氢气和氧气是水分解的产物,故B错误;
C.根据质量守恒定律,化学反应前后原子的种类和数目不变,水分解的过程中,氢原子和氧原子数都没发生变化,故C正确;
D.水电解的文字表达式为:,故D错误。
故选C。
2.【答案】(1)原子核很小且质量很大
(2)A
(3)D
【知识点】原子的构成;原子结构的探索过程
【解析】【分析】 (1)根据原子结构分析解答;原子的质量主要集中在原子核上,核外有一个非常大的空间,原子不是个实心球体分析;
(2)根据原子结构分析解答;原子的质量主要集中在原子核上,核外有一个非常大的空间,原子不是个实心球体分析;
(3)根据决定原子所属类别的因素是原子核中的质子数进行分析。
【解答】 (1)在现象3中,有极少数α粒子被弹了回来,说明向着它质量大得多,且带有同种电荷的粒子运动,即原子核很小且质量很大;
(2)绝大多数α粒子穿过后方向不变即α粒子偏转角度为0,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的,故图乙中A点能说明原子内部绝大部分是空的;
(3)同一类原子中原子核中的质子数相同;A、B、C、D中的质子数分别为1、1、1、2,故选项中描述的微粒不属于同一类原子的是D。
3.【答案】小伟;氢原子只有质子、电子,没有中子;不同原子的质子数不同;同一原子质子数不一定等于中子数等(合理即可)
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)根据表中数据可知相对原子质量与质子数以及中子数的关系,质子数与电子数的关系,也可知道原子中可以没有中子。
(2)由表中数据可知,有的原子质子数等于中子数,有的原子不是,说明质子数与中子数可能相同,可能不相同。
【解答】(1)小伟:原子都是由质子、中子和核外电子构成的。结论不正确,因为根据图表中数据氢原子中只有质子,没有中子。
故答案为小伟;氢原子只有质子、电子,没有中子。
(2)从上表中,观察得出的结论有:①从氢、碳、氧、钠、镁原子的质子数分析得出结论:不同原子的质子数不同;
②从氢原子的质子数为1,中子数为0,钠原子的质子数为11,中子数为12,可得出结论:同一种原子,质子数不一定等于中子数;
③从钠原子的中子数为12,镁原子的中子数也为12,可得出结论:不同种的原子,中子数可能相同;
④从有的原子有中子,有的原子(氢原子)没有中子分析可得出结论:原子中可能不含有中子;
⑤从各原子的相对原子质量分析可得出结论:不同原子其相对原子质量不同。
故答案为不同原子的质子数不同;同一原子质子数不一定等于中子数等(合理即可)。
4.【答案】(1)B
(2)中子数
(3)21×a%+22×b%+20×c%
(4)C;D
【知识点】相对原子质量
【解析】【分析】(1)根据题意,氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,进行分析解答。
(2)根据同种元素的原子的核内质子数相同,进行分析解答。
(3)根据题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,进行分析解答。
(4)根据资料内容,结合所学知识,进行分析判断。
【解答】(1)19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,元素的相对原子质量不支持材料一的是Cl-35.5。
(2)同种元素的原子的核内质子数相同,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是中子数。
(3)由题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,氖元素的相对原子质量的计算式子为21×a%+22×b%+20×c%
(4)A.19世纪初,以氢为母体的相对原子质量标准是错误的,但它对科学的发展是有价值的,故选项说法错误。
B.即使方法正确、仪器精确,实验结果也会存在误差,故选项说法错误。
C.随着科学的发展,若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准,故选项说法正确。
D.某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子,故选项说法正确。
5.【答案】(1)同一横行中从左到右元素电负性逐渐增大
(2)2.0≤x≤2.4
(3)是
【知识点】元素周期表
【解析】【分析】(1)根据表格内的数据进行分析解答;
(2)根据表格内的数据及金属活动性顺序进行分析解答;
(3)根据Br与K的电负性差值判断。
【解答】(1)由表格内的数据可知,同一横行中从左到右元素电负性逐渐增大;
(2)由表中数据可知,一般情况下,同周期自左而右电负性增大,同主族自上而下电负性降低,Te元素x的取值范围介于Se和Po之间,Te元素x的取值范围是:2.0≤x≤2.4;
(3)Br的电负性为2.8,K的电负性为0.8,两种元素的x值相差为2,大于1.7,所以物质KBr是离子化合物。
6.【答案】(1)A;D
(2)C
(3)Na2O或者Na2O2
(4)B
【知识点】元素周期表;化学式的书写及意义;元素化合价的规则与计算;相对原子质量
【解析】【分析】(1)根据题中所给原子的额外电子排布图进行分析。
(2)由所给的相对原子质量可知,原子序数越大,相对原子质量越大,所以硅的相对原子质量在铝和磷之间,结合铝和磷的相对相对原子质量即可得出硅的相对原子质量的取值范围。
(3)根据化合物中各元素化合价之和为零判断钠和氧的个数比,金属写左边,非金属写右边。
(4)根据相对原子质量的定义求解,由于相对原子质量是质量之间的比值,所以单位不是kg,而是“1”。
【解答】(1)由图可知,第一周期,电子层数为一层,第二周期为两层,第三周期为三层,可知同一周期,各元素原子的电子层数相同,故A正确;
B、由图可知,同一周期,从左到右,最外层电子数逐渐增大,故B错误;
CD、由图可知,同一族最外侧电子数相同,而电子层数不同,故C错误,D正确。
故答案为:AD。
(2)由所给相对原子质量和原子的位置可知,硅的相对原子质量在铝和磷之间,即在27和31之间。
故答案为:C。
(3)第8号元素是氧元素,第11号元素是钠元素,钠元素的化合价为+1价,氧元素的化合价有-2价和-1价,化合物中各元素的化合价之和为零,可知化学式为Na2O或者Na2O2。
(4)相对原子质量以一个碳原子的质量的十二分之一为标准,即标准为,一个Z原子的质量为bkg,则相对原子质量为。
故答案为:B。
7.【答案】(1)48:7
(2)m(N)=312g×=28g
(3)20包
【知识点】有关化学式的计算和推断
【解析】【分析】(1)元素的质量比等于相对原子质量与原子个数的乘积之比;
(2)某元素的质量等于该物质的质量乘该元素的质量分数;
(3)根据题目所给的信息计算出该患儿一个疗程需服用的颗粒的包数。
【解答】(1)奥司他韦中C、H元素的质量比为:
;
(2)312g奥司他韦中N元素的质量=奥司他韦的质量×氮元素的质量分数;
(3)从表格中的数据可知,该儿童一次服用量为60mg,一天2次,则5天需要服用的质量为:
60mg×2×5=600mg,
则服用的包数为:。
8.【答案】(1)右上
(2)1.52
【知识点】元素周期表;有关化学式的计算和推断
【解析】【分析】(1)根据氧元素质子数及元素周期表排列顺序分析;
(2)根据自然界中氧气的密度和相对分子质量与所给氧气的相对分子质量分析。
【解答】(1)16O、标记物18O都属于氧元素,氧原子质子数为8,最外层电子数为6,氧元素位置大致在元素周期表的 右上方。
(2) 在相同的温度和压强下,相同体积的气体具有相同的分子数 , 若有一瓶氧气,只含18O和16O,且个数比为1:1, 则该氧气的相对分子质量为34,设 在标准状况下该瓶氧气的密度是 x,则 1.43千克/米3 :x=32:34,x=1.52 千克/米3。
故答案为:(1)右上;(2)1.52.
9.【答案】(1)Cl
(2)MgO
(3)A;D
【知识点】元素周期表;化学式的书写及意义
【解析】【解答】 (1)由迈耶尔和门捷列夫的研究可知,同一周期元素核外电子层 数相同,同一族元素化学性质相似。所以F元素的化合价与Cl相似。
(2)按照组兰兹的理论,元素的排列每逢八就出现周期性,故与G元素性质相似的元素为Mg,它与氧元素形成化合物的化学式为MgO。
(3)由题干科学史料可知,BC观点说的有点绝对,不正确,故观点正确的有AD。
【分析】同一周期元素核外电子层 数相同,同一族元素化学性质相似,表二中上下元素化学性质相似。
10.【答案】(1)AD
(2)Si2-
(3)D
【知识点】同位素;离子的书写与意义;相对原子质量
【解析】【分析】(1)具有相同的质子数和不同中子数的原子,称为同位素原子;
(2)根据表格可知,质子带正电,电子带负电,将二者的电荷数相减,哪个有剩余,那么该微粒就带几个单位的哪种电荷;
(3)相对原子质量等于质子数加中子数,相对原子质量越大,那么原子的实际质量越大。
【解答】(1)A和D的原子的质子数都是14,但是中子数不同,所以它们互为同位素;
(2)微粒C质子数14,电子数为16,二者之差为2,由于电子数多,所以带2个单位的负电荷;
(3)C的相对原子质量:14+14=28,D的相对原子质量:14+16=30,则质量较大的是D。
11.【答案】(1)金属元素在形成化合物时只能失去电子而不能得到电子
(2)不成立
(3)【得出结论】与氢元素组成的化合物,此时非金属元素都显负价。
(4)负
【知识点】元素化合价的规则与计算
【解析】【分析】(1)金属元素对电子的束缚能力弱,容易失去电子显正价;
(2)注意分析非金属元素的化合价是否只显示负价即可;
(3)三种化合物中都含有氢元素,据此分析另一种非金属元素的化合价规律;
(4)将上面得到的结论综合一起即可。
【解答】(1) 金属都显正价的可能原因是金属元素在形成化合物时只能失去电子而不能得到电子;
(2)在 H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4, 即在与氧元素形成的化合物中,非金属元素都显正价,则推测二不成立;
(3) HCl、H2S、CH4中氯、硫、碳元素的化合价分别为-1、-2、-4。 它们都是与氢元素组成的化合物,此时非金属元素都显负价。
(4)通过上述探究过程可知:金属元素在化合物中通常显正价,而非金属元素与氧化合时常显正价,与氢化合时常显负价。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
