浙教版(2024)科学七下期末复习:专题3 三微粒、元素与物质之间的关系(含解析)
文档属性
| 名称 | 浙教版(2024)科学七下期末复习:专题3 三微粒、元素与物质之间的关系(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-07 09:58:17 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
七下期末复习: 三微粒、元素与物质之间的关系
一、选择题
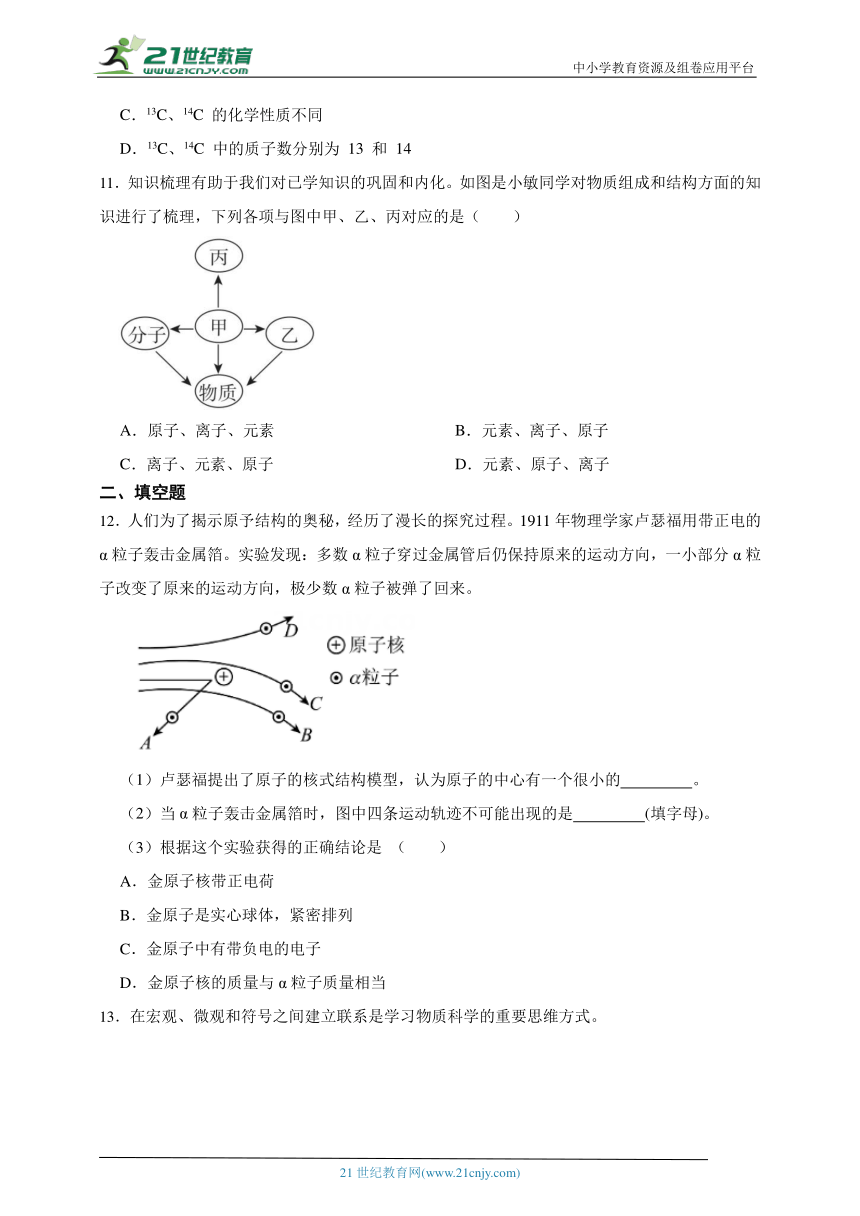
1.瓶中CO气体分子的微观示意图为(“”表示C原子,“”表示O原子)( )
A. B.
C. D.
2.如图所示是某原子的结构示意图,a、b、c分别表示构成原子的不同微粒,下列说法正确的是( )
A.原子种类由微粒a的数量决定
B.原子质量主要集中在微粒b和c 上
C.核电荷数由微粒b的数量决定
D.c 的数量=a 的数量+b的数量
3.关于物质的组成,下列说法中错误的是( )
A.原子是由原子核和核外电子构成
B.物质可以由大量分子构成的
C.原子核由质子和中子构成
D.质子带负电,电子带正电
4.如图表示四种原子的结构模型(“”“”和“”分别表示中子、质子和电子),下列说法正确的是( )
A.甲、乙的核电荷数不同 B.甲、乙为同一种原子
C.丙、丁属于同一种元素 D.甲、丁互为同位素原子
5.我国已启动“嫦娥工程”探月计划,该计划的一个重要目标是开发月球新能源“氦-3”。已知“氦-3”原子的原子核内有1个中子、2个质子。若以“O”代表电子、“”代表质子、“●”代表中子,则下列各微粒结构模型图中,能表示“氦-3”原子结构的是( )
A. B. C. D.
6.研究发现,苍蝇之所以能免受细菌感染,是由于其体内能产生过氧化氢(H2O2),下列关于过氧化氢的叙述正确的是( )
A.过氧化氢是由氢、氧两种元素组成的
B.过氧化氢是由氢气和氧气组成的
C.过氧化氢是一种混合物
D.过氧化氢不具有杀菌作用
7.等电子体具有原子数目相同、电子数目相同的特征。下列各组中的微粒属于等电子体的是( )
A.NO和O3 B.O2和 SO2 C.NO2和H2O D.CO32和NO3-
8.某元素原子A的质子数为a ,已知B3+和A2-具有相同的核外电子数,则B元素原子的质子数为( )
A.a-2+3 B.a-2-3 C.a+2+3 D.a+2-3
9.二氧化氯(ClO2)是一种黄色气体,能有效杀灭自来水中的细菌和病毒。下列说法正确的是( )
A.保持二氧化氯化学性质的最小微粒是二氧化氯分子
B.二氧化氯由一个氯元素和两个氧元素组成
C.二氧化氯分子中氯原子和氧原子的个数比为2:1
D.二氧化氯分子是由氯原子和氧分子构成的
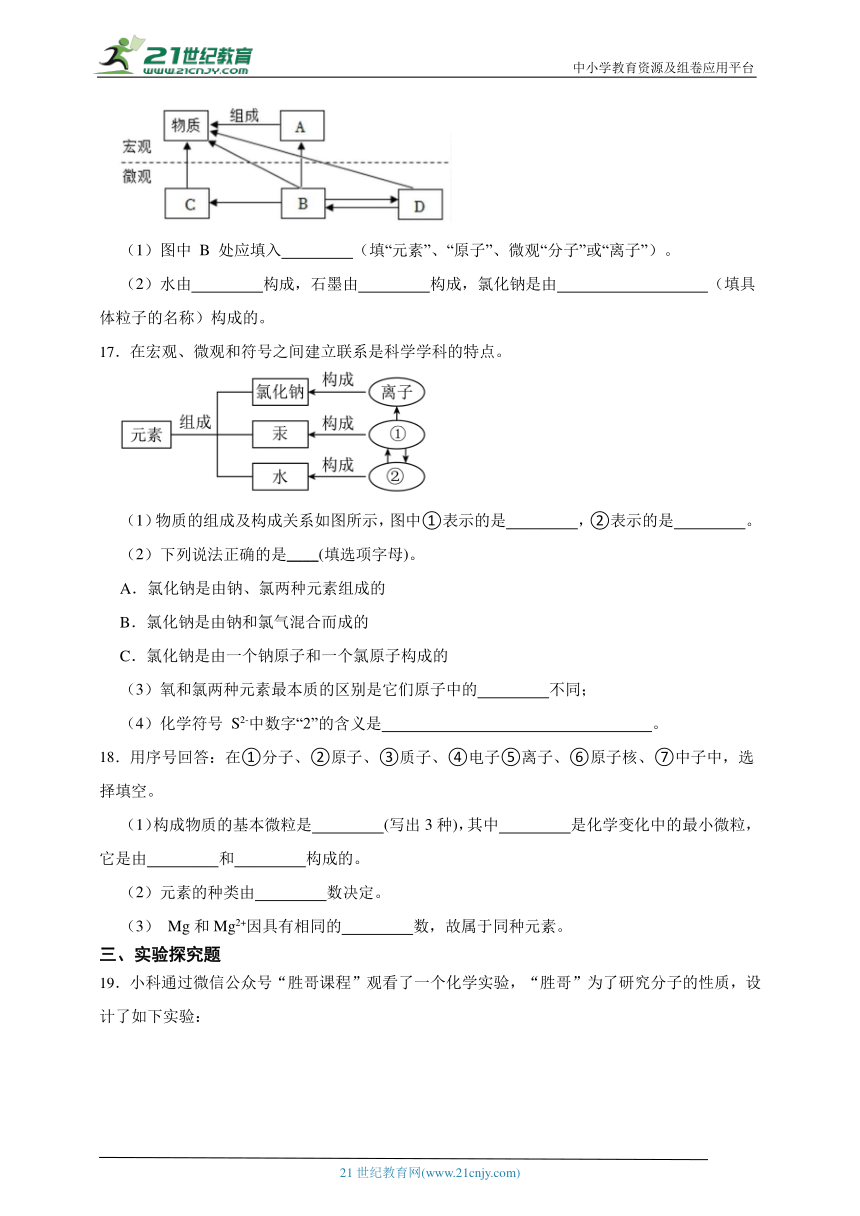
10.我国近七成的人有着肠胃不适的症状,在检查时大部分都会发现肠胃中存在着幽门螺旋杆菌,这是一种对肠胃伤害较大,且具有传染性的细菌。幽门螺旋杆菌检测方法中最简单的就是碳﹣13、碳﹣14 尿素呼气试验法。(碳﹣13、碳﹣14 为碳﹣12 原子的同位素原子,可表示为13C、14C)请回答:体检的人被要求口服一颗胶囊(内含 13C 或 14C 标记的尿素),15 分钟后吹气,便可检测是否感染,下列说法中正确的是( )
A.13C、14C 中的中子数相同
B.13C、14C 的核外电子数相同
C.13C、14C 的化学性质不同
D.13C、14C 中的质子数分别为 13 和 14
11.知识梳理有助于我们对已学知识的巩固和内化。如图是小敏同学对物质组成和结构方面的知识进行了梳理,下列各项与图中甲、乙、丙对应的是( )
A.原子、离子、元素 B.元素、离子、原子
C.离子、元素、原子 D.元素、原子、离子
二、填空题
12.人们为了揭示原予结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属管后仍保持原来的运动方向,一小部分α粒子改变了原来的运动方向,极少数α粒子被弹了回来。
(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 。
(2)当α粒子轰击金属箔时,图中四条运动轨迹不可能出现的是 (填字母)。
(3)根据这个实验获得的正确结论是 ( )
A.金原子核带正电荷
B.金原子是实心球体,紧密排列
C.金原子中有带负电的电子
D.金原子核的质量与α粒子质量相当
13.在宏观、微观和符号之间建立联系是学习物质科学的重要思维方式。
(1)图1为物质组成和构成的关系图,字母M代表的是 。(填“元素”、“分子”、“离子”或“原子”)
(2)图2是钠在氢气中燃烧形成氯化钠的电子的得失图。氯化钠是由 (填具体粒子的名称)构成的。
14.下表是“胜哥”收集的一些微粒的资料,请根据表格数据,回答下列问题。
粒子名称 质子数 中子数 电子数
A 14 14 14
B 26 30 24
C 14 14 18
D 14 18 14
(1)表中的元素共有 种。
(2)属于阳离子的是 (填字母)。
(3)与A互为同位素原子的是 。
(4)有人认为,D粒子的质量比C粒子大,你同意吗 为什么 。
15. 在宏观、微观和符号之间建立联系是学习物质科学的重要思维方式。
(1)图1为构成物质的粒子之间的关系,字母a代表的是 。
(2)图2是钠在氯气中燃烧形成氯化钠的电子的得失图。在钠、氯气、氯化钠三种物质中,由离子构成的物质是 。
16.小科通过微信公众号“胜哥课程”观看了《构成物质的三种微粒》科学视频,对相关知识有了深刻的理解。请完成下列问题:
(1)图中 B 处应填入 (填“元素”、“原子”、微观“分子”或“离子”)。
(2)水由 构成,石墨由 构成,氯化钠是由 (填具体粒子的名称)构成的。
17.在宏观、微观和符号之间建立联系是科学学科的特点。
(1)物质的组成及构成关系如图所示,图中①表示的是 ,②表示的是 。
(2)下列说法正确的是____(填选项字母)。
A.氯化钠是由钠、氯两种元素组成的
B.氯化钠是由钠和氯气混合而成的
C.氯化钠是由一个钠原子和一个氯原子构成的
(3)氧和氯两种元素最本质的区别是它们原子中的 不同;
(4)化学符号 S2-中数字“2”的含义是 。
18.用序号回答:在①分子、②原子、③质子、④电子⑤离子、⑥原子核、⑦中子中,选择填空。
(1)构成物质的基本微粒是 (写出3种),其中 是化学变化中的最小微粒,它是由 和 构成的。
(2)元素的种类由 数决定。
(3) Mg和Mg2+因具有相同的 数,故属于同种元素。
三、实验探究题
19.小科通过微信公众号“胜哥课程”观看了一个化学实验,“胜哥”为了研究分子的性质,设计了如下实验:
甲、乙两相同塑料管壁上各粘有一张相同的滤纸条,滤纸条上每隔2厘米滴有一滴酚试液.在橡皮塞上各固定一个小药瓶,里面都装有等量的浓氨水,甲中用瓶塞塞紧,乙中不塞瓶塞.知识链接:①浓氨水易挥发;②酚酸试液遇到挥发出来的氨气会变红.
(1)本实验中,甲的作用是 .
(2)预测实验结果(现象)是 ,
(3)该实验的优点有____(填字母,多选).
A.环保、节约
B.封闭实验,排除其他影响
C.现象快而明显,操作简单
(4)如果要研究分子运动与温度的关系,按照乙的条件,重新设置一个塑料管丙,将塑料管丙浸入中,观察 .
20.科学家对相对原子质量的认识经历了漫长的时间。
材料一:19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。化学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用碳-12 原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)下列元素的相对原子质量不支持材料一的是____。
A.0-16 B. C.Ag-108
(2)在克鲁克斯假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是 。
(3)根据材料三,现发现氖的同位素在自然界中分布如图,根据上述资料,列出氖元素的相对原子质量的计算式子: 。
(4)结合以上材料及所学知识,判断下列说法正确的是____。
A.19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值
B.只要方法正确、仪器精确,实验结果就不会存在误差
C.若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准
D.元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子
21. 探究原子结构的奥秘:
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在带正电荷的部分,它们是均匀分布还是集中分布的呢
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图甲所示:
①α粒子源————放射性物质放出α粒子(原子核带2个单位正电荷),质量是电子质量的7000倍;
②金箔———作为靶子,厚度1μm,重叠了3000层左右的原子;
③荧光屏———α粒子打在上面发出闪光;
④显微镜————通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被弹了回来如乙图所示。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。
(2)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明____。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒是 。
(4)从原子结构模型建立的过程中,我们发现____(填序号,可多选)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.人类借助模型的建立,对原子的认识逐渐接近本质
D.人的认识是随着科学的进步尤其是实验技术的提高而发展的
22.碘是一种由碘分子构成的非金属单质,某同学利用碘进行了如下的实验:
①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色(提示:碘分子能使馒头中的淀粉变蓝色);
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头 (填会或不会)变蓝色。
(2)由上述实验可知,分子是保持物质 的一种微粒。
(3)现在市场上买来的食盐都是加碘盐(含有KIO3,),用馒头沾取少量的食盐水 (填“会”或“不会”)变蓝色。
23.“胜哥”设计了如图所示的实验装置探究“分子的性质”。已知氨气溶于水生成氨水,氨水能使无色酚酞变红色。请回答下列问题:
(1)【进行实验】几分钟后,图Ⅰ实验中可以看到的现象是 。
【实验改进】老师对图Ⅰ所示的装置进行了改进(如图Ⅱ所示),并进行了以下操作:①取一长条形滤纸,等距离滴加无色酚酞试液;②将滴加了无色酚酞试液的长条形滤纸放入一洁净的试管中,并在试管口塞一团棉花;③向脱脂棉上滴加几滴浓氨水。
(2)【分析讨论】按照改进后的实验,几分钟后观察到的现象是 。
【拓展延伸】同学们经过讨论后认为,图Ⅰ、图Ⅱ所示装置虽能证明分子的性质,但不能证明影响分子性质的因素,于是又设计了如图Ⅲ所示的装置:在U形管的两个管口分别放入卷成筒状的棉纱布,并用橡皮塞塞紧。用注射器吸取酚酞试液从右侧管口的橡皮塞慢慢注入棉纱布上,使其润湿,从左侧管口插入吸取了浓氨水的注射器。按此方法再组装好另一套相同的装置,将其中一套装置的下端放入热水中,并同时向两支U形管中注入浓氨水。
(3)按照图Ⅲ所示的实验装置进行操作,几分钟后可以看到的现象是 ,该现象说明了 。
24.如图甲、乙所示,“胜哥”分别给写着“Na”和“Cl”的小球各贴上一块小磁体,将两者靠近,模拟钠和氯结合形成氯化钠的过程。
(1)氯化钠是由 构成(选填“分子”、“原子”和“离子”)。
(2)若“胜哥”的“Na”模型是贴了一个小磁体的小球,在此基础上另外选了一个“X”小球,贴了两个小磁体,它可能与两个“Cl”小球结合,如图丙所示,则“X”小球可能是 (选“氢离子”或“钙离子”),并说明理由 。
(3)“胜哥”针对模型的科学性设计了如图所示的评价量表。
氯化钠微粒模型评价量表
评价指标 优秀 合格 待改进
指标一 设计合理,有创意,结构完整 结构完整 结构不完整
指标二 可多次模拟,效果明显 能模拟,效果一般 无法模拟
“胜哥”认为,两球之间用小磁体吸合的方案比两球之间用双面胶粘贴的方案好,理由是 。
四、综合题
25.用和分别表示氮原子和氧原子,如图所示是氮气与氧气在放电条件下发生反应的微观模拟图。请回答下列问题:
(1)在B图中将相关粒子图形补充完整 (画图)。
(2)结合该图,从微观角度解释由A到C变化的实质是 。
(3)下列物质中,由原子直接构成的是____。(可多选)
A.甲烷 B.金刚石 C.水银 D.氮气
答案解析部分
1.【答案】C
【知识点】分子和原子的区别和联系
【解析】【分析】根据一氧化碳物质构成的知识分析判断。
【解答】根据化学式CO可知,一氧化碳分子由两个原子构成,即一个氧原子和一个氢原子,模型图为。由于它为纯净物,因此瓶内只有这一种分子,故C正确,而A、B、D错误。
故选C。
2.【答案】B
【知识点】原子的构成
【解析】【分析】原子中带正电的是质子,带负电的是电子,不带电的是中子,可知a为电子,b为中子,c为质子。
【解答】A、原子种类由质子数决定,由图可知,是由微粒c决定的,故A错误;
B、原子的质量主要集中在原子核上,原子核由质子c和中子b决定,故B正确;
C、核电荷数等于质子数,由图可知,是由微粒c决定的,故C错误;
D、原子呈电中性,电子数a等于质子数c,故D错误。
故答案为:B。
3.【答案】D
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】 物质是由分子组成,分子又由原子组成的,原子又由原子核和核外电子组成,且核外电子带负电绕原子核高速运动,原子核又是由带正电的质子和不带电的中子组成,比质子中子还小的微粒还有夸克。
【解答】 A.原子由位于中心的原子核和核外电子组成,故A正确不合题意;
B.物质是由分子组成的,故B正确不合题意;
C.原子核由带正电的质子和不带电的中子组成,故C正确不合题意;
D.在原子中,质子带正电,电子带负电,中子不带电,故D错误符合题意。
故选D。
4.【答案】C
【知识点】原子的构成
【解析】【分析】(1)核电荷数:核电荷数等于质子数,质子数决定元素种类 。
(2)原子种类:同种原子质子数和中子数都相同。
(3)元素:具有相同质子数(即核电荷数)的一类原子的总称 。
(4)同位素原子:质子数相同而中子数不同的同一元素的不同原子互称为同位素原子。
【解答】A、甲和乙质子数都为 1,核电荷数 = 质子数,所以甲、乙核电荷数相同,故错误。
B、甲的中子数为 2,乙的中子数为 0,同种原子要求质子数和中子数都相同,所以甲、乙不是同一种原子,故错误。
C、丙和丁质子数都为 2,根据元素定义,具有相同质子数的一类原子属于同一种元素,所以丙、丁属于同一种元素,故正确。
D、甲质子数为 1,丁质子数为 2,同位素原子要求质子数相同,所以甲、丁不是同位素原子,故错误。
故答案为:C。
5.【答案】D
【知识点】原子的构成
【解析】【分析】 根据氦的原子序数和在原子中质子数=核电荷数=核外电子数判断.
【解答】 “氦-3”原子的原子核内有1个中子、2个质子。由于在原子中质子数=核电荷数=核外电子数,所以氦原子的核外电子数是2。
故D正确,而A、B、C错误。
故选D。
6.【答案】A
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据物质由元素组成的分析;根据混合物定义分析;根据过氧化氢的性质分析。
【解答】A、 过氧化氢是由氢、氧两种元素组成的,叙述正确;
B、 过氧化氢是由氢、氧两种元素组成的,叙述错误;
C、过氧化氢是纯净物,叙述错误;
D、过氧化氢有杀菌作用,叙述错误;
故答案为:A。
7.【答案】D
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据等电子体的概念来分析,等电子体具有原子数目相同、电子数目相同的特征。
【解答】 A、NO和O3,所含原子数目不相等,故A错误;
B、CO2和SO2,原子数目相同,都为3个,电子数分别为:6+8×2=22,16+8×2=32,故B错误;
C、NO2和H2O,原子数目相同,都为3个,电子数分别为:7+8×2=23,2+8=10,故C错误;
D、碳酸根离子和硝酸根离子,原子数相同,电子数分别为:6+8×3+2=32,7+8×3+1=32,故D正确;
故答案为:D。
8.【答案】C
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】 在原子中,核电荷数=核内质子数=核外电子数,A元素原子的质子数为a,B失去2个电子后变为B2+,A得到2个电子后变为A2-,根据核外电子数相同,列出等式求解即可。
【解答】 设元素B的质子数是y,A元素原子的质子数为a,A原子的核外电子数为a,所以A2-的核外电子数等于a+2,同理阳离子B3+的离子中带有(y-3)个电子。因为B3+和A2-具有相同的核外电子数;所以a+2=y-3,即y=a+2+3。
故答案为:C。
9.【答案】A
【知识点】分子的定义与分子的特性;分子和原子的区别和联系;分子、原子、离子、元素与物质之间的关系
【解析】【分析】二氧化氯由二氧化氯分子构成,从宏观来说,二氧化氯由氯元素和氧元素组成。
【解答】A、由分子构成的物质,保持其化学性质的最小微粒为分子,可知保持二氧化氯化学性质的
最小微粒是二氧化氯分子,故A正确;
B、元素不能说个数,故B错误;
C、二氧化氯分子中氯原子和氧原子的个数比为1:2,故C错误;
D、分子中不能含有分子,分子由原子构成,二氧化氯分子由氯原子和氧原子构成,故D错误。
故答案为:A。
10.【答案】B
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据元素的定义、相对原子质量=质子数+中子数分析;
【解答】A、13C、14C都属于碳元素,质子数相同,中子数不同,A错误;
B、13C、14C都属于碳元素,质子数相同,核外电子数=质子数,核外电子数相同,B正确;
C、13C、14C都属于碳元素,化学性质相同,C错误;
D、13C、14C都属于碳元素,质子数都为6,相对原子质量分别为13、14,D错误;
故答案为:B。
11.【答案】A
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据分子、原子、离子以及元素之间的关系进行分析解答即可。
【解答】 原子能直接构成分子,通过得失电子能形成离子,分子、原子核离子是构成物质的基本微粒,元素是具有相同的核电荷数的一类原子的总称, 则甲、乙、丙对应的是原子、离子和元素,故A正确,而B、C、D错误。
故选A。
12.【答案】(1)原子核
(2)C
(3)A
【知识点】原子的构成
【解析】【分析】 (1)原子有原子核和核外电子组成;
(2)电荷间相互作用的规律:同种电荷相互排斥,异种电荷相互吸引。
(3)根据题目描述的现象对金原子的特点分析判断。
【解答】 (1) 卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的原子核;
(2)当α粒子轰击金属箔时,因为同种电荷相互排斥,故图中四条运动轨迹不可能出现的是C;
(3)根据这个实验获得的正确结论是金原子核带正电荷,故A正确,而B、C、D错误。
故选A。
13.【答案】(1)分子
(2)钠离子和氯离子
【知识点】构成物质的粒子模型;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)根据构成物质的基本粒子来分析;
(2) 氯化钠是由 离子构成的。
【解答】 (1)分子、原子和离子是构成物质的三种基本粒子,原子得失电子会形成离子,分子是由原子构成的,原子是由原子核和核外电子构成的, 母M代表的是分子;
(2) 图2是钠在氢气中燃烧形成氯化钠的电子的得失图。氯化钠是离子化合物,是由钠离子和氯离子构成的。
14.【答案】(1)2
(2)B
(3)D
(4)同意。D粒子质子数加中子数大于C粒子。
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)根据质子数决定元素种类判断表中元素的种类。
(2)原子通过得失电子转化为离子,失去电子形成阳离子,得到电子形成阴离子。
(3)同位素原子满足的条件:质子数相同而中子数不同的原子。
(4)原子的质量主要集中在原子核上,原子核由质子和中子构成,质子数和中子数总和多大的原子质量更大。
【解答】(1)质子数决定元素种类,由表中数据可知,ACD属于同种元素,B属于另一种元素,可知元素种类为2种。
(2)阳离子中质子数大于电子数,由表中数据可知,B表示的是阳离子。
(3)质子数相同而中子数不同的原子互称为同位素原子,可知AD属于同位素原子。
(4)D的质子数与C相同,但中子数更多,所以D原子的质量更大。
15.【答案】(1)原子
(2)氯化钠
【知识点】构成物质的粒子模型;原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)分子、原子、离子都可以构成物质,分子由原子组成,离子是由原子得失电子形成的。
(2)原子由核外电子和原子核组成,原子核包含质子和中子。
【解答】(1)分子、原子和离子是构成物质的三种基本粒子,原子得失电子会形成离子,分子是由原子构成的,原子是由原子核和核外电子构成的,即a表示原子;
(2)钠是一种金属单质,是由钠原子构成的;氯气是一种气态非金属单质,是由氯分子构成的;氯化钠是由金属元素与非金属元素组成的化合物,是由钠离子与氯离子构成的。
故答案为:(1)原子(2)氯化钠
16.【答案】(1)原子
(2)水分子;碳原子;钠离子和氯离子
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)物质由元素组成,原子可直接构成物质,也可构成分子,分子再构成物质,原子得失电子形成离子,离子也可构成物质 。
(2)不同物质的构成微粒不同,金属、大多数固态非金属单质、稀有气体等由原子构成;有些物质是由分子构成的,气态的非金属单质和一般由非金属元素组成的化合物;有些物质是由离子构成的,一般是含有金属元素和非金属元素的化合物。
【解答】(1)原子是化学变化中的最小粒子,可直接构成物质,也能构成分子,还能通过得失电子形成离子,所以图中 B 处应填 “原子” 。
(2)水是由非金属元素组成的化合物,由水分子构成;石墨属于固态非金属单质,由碳原子直接构成;氯化钠是含有金属元素和非金属元素的化合物,由钠离子和氯离子构成。
17.【答案】(1)原子;分子
(2)A
(3)质子数
(4)一个硫离子带有2个单位的负电荷
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据图中物质的组成及构成关系进行分析;根据氯化钠的组成和构成进行分析;根据元素的定义进行分析;根据化学符号中数字的含义进行分析。
【解答】(1)图中①表示的是原子,因为原子可以构成分子,而分子又可以构成物质;②表示的是分子,因为分子是由原子构成的,而分子也可以构成物质,故答案为:原子;分子;
(2)A.氯化钠是由钠、氯两种元素组成的,故A正确;
B.氯化钠不是由钠和氯气混合而成的,而是由钠离子和氯离子构成的,故B错误;
C.氯化钠是由钠离子和氯离子构成的,而不是由一个钠原子和一个氯原子构成的,故C错误。
故答案为:A;
(3)氧和氯两种元素最本质的区别是它们原子中的质子数不同,因为元素的定义是具有相同质子数的一类原子的总称,故答案为:质子数;
(4)化学符号S2-中数字“2”的含义是一个硫离子带有2个单位的负电荷,故答案为:一个硫离子带有2个单位的负电荷。
18.【答案】(1)①②⑤;②;⑥;④
(2)③
(3)③
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据对分子、原子、离子等构成的知识分析解答。
【解答】(1)构成物质的基本微粒是分子、原子和离子,故选①②⑤,其中②(原子)是化学变化中的最小微粒,它是由⑥(原子核)和④(电子)构成的。
(2)元素的种类由③(质子)数决定。
(3)Mg和Mg2+因具有相同的③(质子)数,故属于同种元素。
19.【答案】(1)对照
(2)甲中无明显现象,乙中滤纸条自下而上出现红点
(3)A;B;C
(4)观察滤纸条上红点出现的时间,与乙进行比较
【知识点】分子的定义与分子的特性
【解析】【分析】(1)在对照实验中,一个实验探究因素不改变,为对照组;其它的实验因素改变为实验组,通过二者比较确定探究因素对物理量的影响;
(2)甲中瓶塞塞紧,肯定没有氨气溢出,而乙中有氨气溢出,据此分析;
(3)分析实验器材和实验过程,从是否污染环境、现象是否明显等角度分析;
(4)探究温度对分子运动的影响时,需要控制其它因素相同,只改变温度,据此设置对照实验即可。
【解答】 (1)本实验中,甲瓶有瓶塞,氨气不能挥发出来,乙瓶敞口,有氨气逸出,甲的作用是与乙瓶形成对照;
(2)甲中无有明显变化,乙瓶敞口,挥发出氨气,酚酞溶液遇到挥发出来的氨气会变红;由于氨水在下方,向上挥发,所以滤纸条应该是自下而上变红,预测实验结果是:甲中无明显现象,乙中滤纸条自下而上出现红点;
(3)该实验装置密闭,需要药品的量少,优点有:环保、节约;封闭实验,排除其他影响,现象快而明显,操作简单;
故选ABC;
(4)如果要研究分子运动与温度关系,可在本实验基础上继续实验,增加一个步骤,按照乙的装置条件,重新设置一个管丙,将管丙浸入冰水(与乙瓶温度有较大的差别即可)中,观察红点出现的时间,与乙进行比较。
20.【答案】(1)C
(2)中子数
(3)21×a%+22×b%+20×c%
(4)C
【知识点】原子的构成
【解析】【分析】 (1)根据题意,氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,进行分析解答。
(2)根据同种元素的原子的核内质子数相同,进行分析解答。
(3)根据题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,进行分析解答。
(4)根据资料内容,结合所学知识,进行分析判断。
【解答】 (1)19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,元素的相对原子质量不支持材料一的是Cl-35.5。
故选B。
(2)同种元素的原子的核内质子数相同,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是中子数。
(3)由题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,氖元素的相对原子质量的计算式子为21×a%+22×b%+20×c%。
(4)A.19世纪初,以氢为母体的相对原子质量标准是错误的,但它对科学的发展是有价值的,故A错误;
B.即使方法正确、仪器精确,实验结果也会存在误差,故B错误;
C.随着科学的发展,若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准,故C正确;
D.某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子,故D正确。
故选CD。
21.【答案】(1)不会
(2)B
(3)质子
(4)A;B;C;D
【知识点】原子的构成;原子结构的探索过程
【解析】【分析】根据原子结构分析解答;原子的质量主要集中在原子核上,核外有一个非常大的空间,原子不是个实心球体。原子是由原子核及电子组成的,而原子核又是由质子和中子组成的。
【解答】(1)极少数α粒子散射的原因是受到了一个体积小但质量相对而言较大的粒子的斥力,这说明原子质量、正电荷在原子内并不是均匀分布的;
(2)绝大多数α粒子穿过后方向不变,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的,故选B;
(3)1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,说明原子核内的质子数变成了8个,所以打出的微粒是质子。
(4)A、科学模型的建立是一个不断完善、不断修正的过程,正确;
B、模型在科学研究中起着很重要的作用,正确;
C、人类借助模型的建立,对原子的认识逐渐接近本质,正确;
D、人的认识是随着科学的进步尤其是实验技术的提高而发展的,正确;
故答案为:ABCD。
22.【答案】(1)会
(2)化学性质
(3)不会
【知识点】分子的定义与分子的特性;分子和原子的区别和联系;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)馒头的主要成分是淀粉,淀粉有遇碘变蓝色的特性。
(2)碘是一种由碘分子构成的非金属单质,碘分子能使馒头中的淀粉变蓝色。
【解答】(1)同种分子性质相同,不同分子性质不同,所以把湿润的馒头放在碘蒸气中,馒头会变蓝色;因为淀粉遇碘变蓝色或者说碘能使淀粉变蓝色,而馒头中含淀粉。
(2)碘是一种由碘分子构成的非金属单质,三个实验结果一样,都能使馒头变蓝,表明分子是保持物质化学性质的最小微粒。
(3)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐不存在碘分子,碘盐中的“碘”是指碘元素。
23.【答案】(1)甲烧杯中溶液变为红色,乙烧杯中溶液不变红
(2)滤纸条上的酚酞试液由左向右依次变红
(3)D 处纱布比B处纱布先变红;分子的运动速率与温度有关,温度越高,分子的运动速率越快(合理即可)
【知识点】分子的定义与分子的特性
【解析】【分析】(1)根据氨水具有挥发性,氨分子运动到甲烧杯中,使甲烧杯中溶液显碱性,酚酞试液变为红色进行分析;
(2)根据右端酚酞试液最靠近浓氨水,最先变红进行分析;
(3)根据右边装置中的温度高于左边装置,分子的运动速率随温度的升高而加快,分子的运动速率与温度有关,温度越高,分子的运动速率越快进行分析;
【解答】(1)氨水具有挥发性,氨分子运动到甲烧杯中,使甲烧杯中溶液显碱性,酚酞试液变为红色,乙烧杯溶液不变红;
(2)右端酚酞试液最靠近浓氨水,最先变红,故会观察到酚酞试液由左向右依次变红;
(3)右边装置中的温度高于左边装置,分子的运动速率随温度的升高而加快,故D出比B处先变红;该实验能说明分子的运动速率与温度有关,温度越高,分子的运动速率越快。
(1)氨水具有挥发性,氨分子运动到甲烧杯中,使甲烧杯中溶液显碱性,酚酞试液变为红色,乙烧杯溶液不变红;
(2)右端酚酞试液最靠近浓氨水,最先变红,故会观察到酚酞试液由左向右依次变红;
(3)右边装置中的温度高于左边装置,分子的运动速率随温度的升高而加快,故D出比B处先变红;该实验能说明分子的运动速率与温度有关,温度越高,分子的运动速率越快。
24.【答案】(1)离子
(2)钙离子;一个Ca2+带两个单位正电荷,一个Cl-带一个单位负电荷,故需要两个Cl-才能保持电中性
(3)方便拆卸、可以多次模拟等
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)物质可能由分子、原子或离子构成,根据物质构成的知识解答;
(2)当正电荷数和负电荷数相同时,物质呈电中性;
(3)可从是否方便拆卸,以及是否可以多次使用的角度分析。
【解答】(1)氯化钠是由离子构成;
(2)如图丙所示,则“X”小球可能是钙离子,理由:一个Ca2+带两个单位正电荷,一个Cl-带一个单位负电荷,故需要两个Cl-才能保持电中性。
(3) 小组成员讨论后认为,两球之间用小磁体吸合的方案比两球之间用双面胶粘贴的方案好,理由是 方便拆卸、可以多次模拟等。
25.【答案】(1)
(2)在放电条件下,氧分子破裂成氧原子,氮分子破历程氮原子,每1个氮原子和1个氧原子结合成一个一氧化氮分子
(3)B
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】 (1)根据质量守恒定律和化学反应的实质在B图中将相关粒子图形补充完整。
(2)根据微粒的变化解释由A到C变化的实质。
(3)根据常见物质的构成分析。
【解答】 (1)由质量守恒定律和化学反应的实质可知,在B图中应补充一个氮原子和一个氧原子,相关粒子图形补充如图:。
(2)由微粒的变化可知,由A到C变化的实质是:在放电条件下,氧分子破裂成氧原子,氮分子破历程氮原子,每1个氮原子和1个氧原子结合成一个一氧化氮分子。
(3)由常见物质的构成可知,甲烷、氮气是由分子构成的,金刚石和水银是由原子直接构成,故选BC。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
七下期末复习: 三微粒、元素与物质之间的关系
一、选择题
1.瓶中CO气体分子的微观示意图为(“”表示C原子,“”表示O原子)( )
A. B.
C. D.
2.如图所示是某原子的结构示意图,a、b、c分别表示构成原子的不同微粒,下列说法正确的是( )
A.原子种类由微粒a的数量决定
B.原子质量主要集中在微粒b和c 上
C.核电荷数由微粒b的数量决定
D.c 的数量=a 的数量+b的数量
3.关于物质的组成,下列说法中错误的是( )
A.原子是由原子核和核外电子构成
B.物质可以由大量分子构成的
C.原子核由质子和中子构成
D.质子带负电,电子带正电
4.如图表示四种原子的结构模型(“”“”和“”分别表示中子、质子和电子),下列说法正确的是( )
A.甲、乙的核电荷数不同 B.甲、乙为同一种原子
C.丙、丁属于同一种元素 D.甲、丁互为同位素原子
5.我国已启动“嫦娥工程”探月计划,该计划的一个重要目标是开发月球新能源“氦-3”。已知“氦-3”原子的原子核内有1个中子、2个质子。若以“O”代表电子、“”代表质子、“●”代表中子,则下列各微粒结构模型图中,能表示“氦-3”原子结构的是( )
A. B. C. D.
6.研究发现,苍蝇之所以能免受细菌感染,是由于其体内能产生过氧化氢(H2O2),下列关于过氧化氢的叙述正确的是( )
A.过氧化氢是由氢、氧两种元素组成的
B.过氧化氢是由氢气和氧气组成的
C.过氧化氢是一种混合物
D.过氧化氢不具有杀菌作用
7.等电子体具有原子数目相同、电子数目相同的特征。下列各组中的微粒属于等电子体的是( )
A.NO和O3 B.O2和 SO2 C.NO2和H2O D.CO32和NO3-
8.某元素原子A的质子数为a ,已知B3+和A2-具有相同的核外电子数,则B元素原子的质子数为( )
A.a-2+3 B.a-2-3 C.a+2+3 D.a+2-3
9.二氧化氯(ClO2)是一种黄色气体,能有效杀灭自来水中的细菌和病毒。下列说法正确的是( )
A.保持二氧化氯化学性质的最小微粒是二氧化氯分子
B.二氧化氯由一个氯元素和两个氧元素组成
C.二氧化氯分子中氯原子和氧原子的个数比为2:1
D.二氧化氯分子是由氯原子和氧分子构成的
10.我国近七成的人有着肠胃不适的症状,在检查时大部分都会发现肠胃中存在着幽门螺旋杆菌,这是一种对肠胃伤害较大,且具有传染性的细菌。幽门螺旋杆菌检测方法中最简单的就是碳﹣13、碳﹣14 尿素呼气试验法。(碳﹣13、碳﹣14 为碳﹣12 原子的同位素原子,可表示为13C、14C)请回答:体检的人被要求口服一颗胶囊(内含 13C 或 14C 标记的尿素),15 分钟后吹气,便可检测是否感染,下列说法中正确的是( )
A.13C、14C 中的中子数相同
B.13C、14C 的核外电子数相同
C.13C、14C 的化学性质不同
D.13C、14C 中的质子数分别为 13 和 14
11.知识梳理有助于我们对已学知识的巩固和内化。如图是小敏同学对物质组成和结构方面的知识进行了梳理,下列各项与图中甲、乙、丙对应的是( )
A.原子、离子、元素 B.元素、离子、原子
C.离子、元素、原子 D.元素、原子、离子
二、填空题
12.人们为了揭示原予结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属管后仍保持原来的运动方向,一小部分α粒子改变了原来的运动方向,极少数α粒子被弹了回来。
(1)卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的 。
(2)当α粒子轰击金属箔时,图中四条运动轨迹不可能出现的是 (填字母)。
(3)根据这个实验获得的正确结论是 ( )
A.金原子核带正电荷
B.金原子是实心球体,紧密排列
C.金原子中有带负电的电子
D.金原子核的质量与α粒子质量相当
13.在宏观、微观和符号之间建立联系是学习物质科学的重要思维方式。
(1)图1为物质组成和构成的关系图,字母M代表的是 。(填“元素”、“分子”、“离子”或“原子”)
(2)图2是钠在氢气中燃烧形成氯化钠的电子的得失图。氯化钠是由 (填具体粒子的名称)构成的。
14.下表是“胜哥”收集的一些微粒的资料,请根据表格数据,回答下列问题。
粒子名称 质子数 中子数 电子数
A 14 14 14
B 26 30 24
C 14 14 18
D 14 18 14
(1)表中的元素共有 种。
(2)属于阳离子的是 (填字母)。
(3)与A互为同位素原子的是 。
(4)有人认为,D粒子的质量比C粒子大,你同意吗 为什么 。
15. 在宏观、微观和符号之间建立联系是学习物质科学的重要思维方式。
(1)图1为构成物质的粒子之间的关系,字母a代表的是 。
(2)图2是钠在氯气中燃烧形成氯化钠的电子的得失图。在钠、氯气、氯化钠三种物质中,由离子构成的物质是 。
16.小科通过微信公众号“胜哥课程”观看了《构成物质的三种微粒》科学视频,对相关知识有了深刻的理解。请完成下列问题:
(1)图中 B 处应填入 (填“元素”、“原子”、微观“分子”或“离子”)。
(2)水由 构成,石墨由 构成,氯化钠是由 (填具体粒子的名称)构成的。
17.在宏观、微观和符号之间建立联系是科学学科的特点。
(1)物质的组成及构成关系如图所示,图中①表示的是 ,②表示的是 。
(2)下列说法正确的是____(填选项字母)。
A.氯化钠是由钠、氯两种元素组成的
B.氯化钠是由钠和氯气混合而成的
C.氯化钠是由一个钠原子和一个氯原子构成的
(3)氧和氯两种元素最本质的区别是它们原子中的 不同;
(4)化学符号 S2-中数字“2”的含义是 。
18.用序号回答:在①分子、②原子、③质子、④电子⑤离子、⑥原子核、⑦中子中,选择填空。
(1)构成物质的基本微粒是 (写出3种),其中 是化学变化中的最小微粒,它是由 和 构成的。
(2)元素的种类由 数决定。
(3) Mg和Mg2+因具有相同的 数,故属于同种元素。
三、实验探究题
19.小科通过微信公众号“胜哥课程”观看了一个化学实验,“胜哥”为了研究分子的性质,设计了如下实验:
甲、乙两相同塑料管壁上各粘有一张相同的滤纸条,滤纸条上每隔2厘米滴有一滴酚试液.在橡皮塞上各固定一个小药瓶,里面都装有等量的浓氨水,甲中用瓶塞塞紧,乙中不塞瓶塞.知识链接:①浓氨水易挥发;②酚酸试液遇到挥发出来的氨气会变红.
(1)本实验中,甲的作用是 .
(2)预测实验结果(现象)是 ,
(3)该实验的优点有____(填字母,多选).
A.环保、节约
B.封闭实验,排除其他影响
C.现象快而明显,操作简单
(4)如果要研究分子运动与温度的关系,按照乙的条件,重新设置一个塑料管丙,将塑料管丙浸入中,观察 .
20.科学家对相对原子质量的认识经历了漫长的时间。
材料一:19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。化学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用碳-12 原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)下列元素的相对原子质量不支持材料一的是____。
A.0-16 B. C.Ag-108
(2)在克鲁克斯假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是 。
(3)根据材料三,现发现氖的同位素在自然界中分布如图,根据上述资料,列出氖元素的相对原子质量的计算式子: 。
(4)结合以上材料及所学知识,判断下列说法正确的是____。
A.19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值
B.只要方法正确、仪器精确,实验结果就不会存在误差
C.若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准
D.元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子
21. 探究原子结构的奥秘:
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在带正电荷的部分,它们是均匀分布还是集中分布的呢
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图甲所示:
①α粒子源————放射性物质放出α粒子(原子核带2个单位正电荷),质量是电子质量的7000倍;
②金箔———作为靶子,厚度1μm,重叠了3000层左右的原子;
③荧光屏———α粒子打在上面发出闪光;
④显微镜————通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被弹了回来如乙图所示。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。
(2)1μm金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明____。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,从现代观点看,被打出的微粒是 。
(4)从原子结构模型建立的过程中,我们发现____(填序号,可多选)。
A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研究中起着很重要的作用
C.人类借助模型的建立,对原子的认识逐渐接近本质
D.人的认识是随着科学的进步尤其是实验技术的提高而发展的
22.碘是一种由碘分子构成的非金属单质,某同学利用碘进行了如下的实验:
①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色(提示:碘分子能使馒头中的淀粉变蓝色);
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头 (填会或不会)变蓝色。
(2)由上述实验可知,分子是保持物质 的一种微粒。
(3)现在市场上买来的食盐都是加碘盐(含有KIO3,),用馒头沾取少量的食盐水 (填“会”或“不会”)变蓝色。
23.“胜哥”设计了如图所示的实验装置探究“分子的性质”。已知氨气溶于水生成氨水,氨水能使无色酚酞变红色。请回答下列问题:
(1)【进行实验】几分钟后,图Ⅰ实验中可以看到的现象是 。
【实验改进】老师对图Ⅰ所示的装置进行了改进(如图Ⅱ所示),并进行了以下操作:①取一长条形滤纸,等距离滴加无色酚酞试液;②将滴加了无色酚酞试液的长条形滤纸放入一洁净的试管中,并在试管口塞一团棉花;③向脱脂棉上滴加几滴浓氨水。
(2)【分析讨论】按照改进后的实验,几分钟后观察到的现象是 。
【拓展延伸】同学们经过讨论后认为,图Ⅰ、图Ⅱ所示装置虽能证明分子的性质,但不能证明影响分子性质的因素,于是又设计了如图Ⅲ所示的装置:在U形管的两个管口分别放入卷成筒状的棉纱布,并用橡皮塞塞紧。用注射器吸取酚酞试液从右侧管口的橡皮塞慢慢注入棉纱布上,使其润湿,从左侧管口插入吸取了浓氨水的注射器。按此方法再组装好另一套相同的装置,将其中一套装置的下端放入热水中,并同时向两支U形管中注入浓氨水。
(3)按照图Ⅲ所示的实验装置进行操作,几分钟后可以看到的现象是 ,该现象说明了 。
24.如图甲、乙所示,“胜哥”分别给写着“Na”和“Cl”的小球各贴上一块小磁体,将两者靠近,模拟钠和氯结合形成氯化钠的过程。
(1)氯化钠是由 构成(选填“分子”、“原子”和“离子”)。
(2)若“胜哥”的“Na”模型是贴了一个小磁体的小球,在此基础上另外选了一个“X”小球,贴了两个小磁体,它可能与两个“Cl”小球结合,如图丙所示,则“X”小球可能是 (选“氢离子”或“钙离子”),并说明理由 。
(3)“胜哥”针对模型的科学性设计了如图所示的评价量表。
氯化钠微粒模型评价量表
评价指标 优秀 合格 待改进
指标一 设计合理,有创意,结构完整 结构完整 结构不完整
指标二 可多次模拟,效果明显 能模拟,效果一般 无法模拟
“胜哥”认为,两球之间用小磁体吸合的方案比两球之间用双面胶粘贴的方案好,理由是 。
四、综合题
25.用和分别表示氮原子和氧原子,如图所示是氮气与氧气在放电条件下发生反应的微观模拟图。请回答下列问题:
(1)在B图中将相关粒子图形补充完整 (画图)。
(2)结合该图,从微观角度解释由A到C变化的实质是 。
(3)下列物质中,由原子直接构成的是____。(可多选)
A.甲烷 B.金刚石 C.水银 D.氮气
答案解析部分
1.【答案】C
【知识点】分子和原子的区别和联系
【解析】【分析】根据一氧化碳物质构成的知识分析判断。
【解答】根据化学式CO可知,一氧化碳分子由两个原子构成,即一个氧原子和一个氢原子,模型图为。由于它为纯净物,因此瓶内只有这一种分子,故C正确,而A、B、D错误。
故选C。
2.【答案】B
【知识点】原子的构成
【解析】【分析】原子中带正电的是质子,带负电的是电子,不带电的是中子,可知a为电子,b为中子,c为质子。
【解答】A、原子种类由质子数决定,由图可知,是由微粒c决定的,故A错误;
B、原子的质量主要集中在原子核上,原子核由质子c和中子b决定,故B正确;
C、核电荷数等于质子数,由图可知,是由微粒c决定的,故C错误;
D、原子呈电中性,电子数a等于质子数c,故D错误。
故答案为:B。
3.【答案】D
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】 物质是由分子组成,分子又由原子组成的,原子又由原子核和核外电子组成,且核外电子带负电绕原子核高速运动,原子核又是由带正电的质子和不带电的中子组成,比质子中子还小的微粒还有夸克。
【解答】 A.原子由位于中心的原子核和核外电子组成,故A正确不合题意;
B.物质是由分子组成的,故B正确不合题意;
C.原子核由带正电的质子和不带电的中子组成,故C正确不合题意;
D.在原子中,质子带正电,电子带负电,中子不带电,故D错误符合题意。
故选D。
4.【答案】C
【知识点】原子的构成
【解析】【分析】(1)核电荷数:核电荷数等于质子数,质子数决定元素种类 。
(2)原子种类:同种原子质子数和中子数都相同。
(3)元素:具有相同质子数(即核电荷数)的一类原子的总称 。
(4)同位素原子:质子数相同而中子数不同的同一元素的不同原子互称为同位素原子。
【解答】A、甲和乙质子数都为 1,核电荷数 = 质子数,所以甲、乙核电荷数相同,故错误。
B、甲的中子数为 2,乙的中子数为 0,同种原子要求质子数和中子数都相同,所以甲、乙不是同一种原子,故错误。
C、丙和丁质子数都为 2,根据元素定义,具有相同质子数的一类原子属于同一种元素,所以丙、丁属于同一种元素,故正确。
D、甲质子数为 1,丁质子数为 2,同位素原子要求质子数相同,所以甲、丁不是同位素原子,故错误。
故答案为:C。
5.【答案】D
【知识点】原子的构成
【解析】【分析】 根据氦的原子序数和在原子中质子数=核电荷数=核外电子数判断.
【解答】 “氦-3”原子的原子核内有1个中子、2个质子。由于在原子中质子数=核电荷数=核外电子数,所以氦原子的核外电子数是2。
故D正确,而A、B、C错误。
故选D。
6.【答案】A
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据物质由元素组成的分析;根据混合物定义分析;根据过氧化氢的性质分析。
【解答】A、 过氧化氢是由氢、氧两种元素组成的,叙述正确;
B、 过氧化氢是由氢、氧两种元素组成的,叙述错误;
C、过氧化氢是纯净物,叙述错误;
D、过氧化氢有杀菌作用,叙述错误;
故答案为:A。
7.【答案】D
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据等电子体的概念来分析,等电子体具有原子数目相同、电子数目相同的特征。
【解答】 A、NO和O3,所含原子数目不相等,故A错误;
B、CO2和SO2,原子数目相同,都为3个,电子数分别为:6+8×2=22,16+8×2=32,故B错误;
C、NO2和H2O,原子数目相同,都为3个,电子数分别为:7+8×2=23,2+8=10,故C错误;
D、碳酸根离子和硝酸根离子,原子数相同,电子数分别为:6+8×3+2=32,7+8×3+1=32,故D正确;
故答案为:D。
8.【答案】C
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】 在原子中,核电荷数=核内质子数=核外电子数,A元素原子的质子数为a,B失去2个电子后变为B2+,A得到2个电子后变为A2-,根据核外电子数相同,列出等式求解即可。
【解答】 设元素B的质子数是y,A元素原子的质子数为a,A原子的核外电子数为a,所以A2-的核外电子数等于a+2,同理阳离子B3+的离子中带有(y-3)个电子。因为B3+和A2-具有相同的核外电子数;所以a+2=y-3,即y=a+2+3。
故答案为:C。
9.【答案】A
【知识点】分子的定义与分子的特性;分子和原子的区别和联系;分子、原子、离子、元素与物质之间的关系
【解析】【分析】二氧化氯由二氧化氯分子构成,从宏观来说,二氧化氯由氯元素和氧元素组成。
【解答】A、由分子构成的物质,保持其化学性质的最小微粒为分子,可知保持二氧化氯化学性质的
最小微粒是二氧化氯分子,故A正确;
B、元素不能说个数,故B错误;
C、二氧化氯分子中氯原子和氧原子的个数比为1:2,故C错误;
D、分子中不能含有分子,分子由原子构成,二氧化氯分子由氯原子和氧原子构成,故D错误。
故答案为:A。
10.【答案】B
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据元素的定义、相对原子质量=质子数+中子数分析;
【解答】A、13C、14C都属于碳元素,质子数相同,中子数不同,A错误;
B、13C、14C都属于碳元素,质子数相同,核外电子数=质子数,核外电子数相同,B正确;
C、13C、14C都属于碳元素,化学性质相同,C错误;
D、13C、14C都属于碳元素,质子数都为6,相对原子质量分别为13、14,D错误;
故答案为:B。
11.【答案】A
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据分子、原子、离子以及元素之间的关系进行分析解答即可。
【解答】 原子能直接构成分子,通过得失电子能形成离子,分子、原子核离子是构成物质的基本微粒,元素是具有相同的核电荷数的一类原子的总称, 则甲、乙、丙对应的是原子、离子和元素,故A正确,而B、C、D错误。
故选A。
12.【答案】(1)原子核
(2)C
(3)A
【知识点】原子的构成
【解析】【分析】 (1)原子有原子核和核外电子组成;
(2)电荷间相互作用的规律:同种电荷相互排斥,异种电荷相互吸引。
(3)根据题目描述的现象对金原子的特点分析判断。
【解答】 (1) 卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的原子核;
(2)当α粒子轰击金属箔时,因为同种电荷相互排斥,故图中四条运动轨迹不可能出现的是C;
(3)根据这个实验获得的正确结论是金原子核带正电荷,故A正确,而B、C、D错误。
故选A。
13.【答案】(1)分子
(2)钠离子和氯离子
【知识点】构成物质的粒子模型;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)根据构成物质的基本粒子来分析;
(2) 氯化钠是由 离子构成的。
【解答】 (1)分子、原子和离子是构成物质的三种基本粒子,原子得失电子会形成离子,分子是由原子构成的,原子是由原子核和核外电子构成的, 母M代表的是分子;
(2) 图2是钠在氢气中燃烧形成氯化钠的电子的得失图。氯化钠是离子化合物,是由钠离子和氯离子构成的。
14.【答案】(1)2
(2)B
(3)D
(4)同意。D粒子质子数加中子数大于C粒子。
【知识点】原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)根据质子数决定元素种类判断表中元素的种类。
(2)原子通过得失电子转化为离子,失去电子形成阳离子,得到电子形成阴离子。
(3)同位素原子满足的条件:质子数相同而中子数不同的原子。
(4)原子的质量主要集中在原子核上,原子核由质子和中子构成,质子数和中子数总和多大的原子质量更大。
【解答】(1)质子数决定元素种类,由表中数据可知,ACD属于同种元素,B属于另一种元素,可知元素种类为2种。
(2)阳离子中质子数大于电子数,由表中数据可知,B表示的是阳离子。
(3)质子数相同而中子数不同的原子互称为同位素原子,可知AD属于同位素原子。
(4)D的质子数与C相同,但中子数更多,所以D原子的质量更大。
15.【答案】(1)原子
(2)氯化钠
【知识点】构成物质的粒子模型;原子的构成;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)分子、原子、离子都可以构成物质,分子由原子组成,离子是由原子得失电子形成的。
(2)原子由核外电子和原子核组成,原子核包含质子和中子。
【解答】(1)分子、原子和离子是构成物质的三种基本粒子,原子得失电子会形成离子,分子是由原子构成的,原子是由原子核和核外电子构成的,即a表示原子;
(2)钠是一种金属单质,是由钠原子构成的;氯气是一种气态非金属单质,是由氯分子构成的;氯化钠是由金属元素与非金属元素组成的化合物,是由钠离子与氯离子构成的。
故答案为:(1)原子(2)氯化钠
16.【答案】(1)原子
(2)水分子;碳原子;钠离子和氯离子
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)物质由元素组成,原子可直接构成物质,也可构成分子,分子再构成物质,原子得失电子形成离子,离子也可构成物质 。
(2)不同物质的构成微粒不同,金属、大多数固态非金属单质、稀有气体等由原子构成;有些物质是由分子构成的,气态的非金属单质和一般由非金属元素组成的化合物;有些物质是由离子构成的,一般是含有金属元素和非金属元素的化合物。
【解答】(1)原子是化学变化中的最小粒子,可直接构成物质,也能构成分子,还能通过得失电子形成离子,所以图中 B 处应填 “原子” 。
(2)水是由非金属元素组成的化合物,由水分子构成;石墨属于固态非金属单质,由碳原子直接构成;氯化钠是含有金属元素和非金属元素的化合物,由钠离子和氯离子构成。
17.【答案】(1)原子;分子
(2)A
(3)质子数
(4)一个硫离子带有2个单位的负电荷
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据图中物质的组成及构成关系进行分析;根据氯化钠的组成和构成进行分析;根据元素的定义进行分析;根据化学符号中数字的含义进行分析。
【解答】(1)图中①表示的是原子,因为原子可以构成分子,而分子又可以构成物质;②表示的是分子,因为分子是由原子构成的,而分子也可以构成物质,故答案为:原子;分子;
(2)A.氯化钠是由钠、氯两种元素组成的,故A正确;
B.氯化钠不是由钠和氯气混合而成的,而是由钠离子和氯离子构成的,故B错误;
C.氯化钠是由钠离子和氯离子构成的,而不是由一个钠原子和一个氯原子构成的,故C错误。
故答案为:A;
(3)氧和氯两种元素最本质的区别是它们原子中的质子数不同,因为元素的定义是具有相同质子数的一类原子的总称,故答案为:质子数;
(4)化学符号S2-中数字“2”的含义是一个硫离子带有2个单位的负电荷,故答案为:一个硫离子带有2个单位的负电荷。
18.【答案】(1)①②⑤;②;⑥;④
(2)③
(3)③
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】根据对分子、原子、离子等构成的知识分析解答。
【解答】(1)构成物质的基本微粒是分子、原子和离子,故选①②⑤,其中②(原子)是化学变化中的最小微粒,它是由⑥(原子核)和④(电子)构成的。
(2)元素的种类由③(质子)数决定。
(3)Mg和Mg2+因具有相同的③(质子)数,故属于同种元素。
19.【答案】(1)对照
(2)甲中无明显现象,乙中滤纸条自下而上出现红点
(3)A;B;C
(4)观察滤纸条上红点出现的时间,与乙进行比较
【知识点】分子的定义与分子的特性
【解析】【分析】(1)在对照实验中,一个实验探究因素不改变,为对照组;其它的实验因素改变为实验组,通过二者比较确定探究因素对物理量的影响;
(2)甲中瓶塞塞紧,肯定没有氨气溢出,而乙中有氨气溢出,据此分析;
(3)分析实验器材和实验过程,从是否污染环境、现象是否明显等角度分析;
(4)探究温度对分子运动的影响时,需要控制其它因素相同,只改变温度,据此设置对照实验即可。
【解答】 (1)本实验中,甲瓶有瓶塞,氨气不能挥发出来,乙瓶敞口,有氨气逸出,甲的作用是与乙瓶形成对照;
(2)甲中无有明显变化,乙瓶敞口,挥发出氨气,酚酞溶液遇到挥发出来的氨气会变红;由于氨水在下方,向上挥发,所以滤纸条应该是自下而上变红,预测实验结果是:甲中无明显现象,乙中滤纸条自下而上出现红点;
(3)该实验装置密闭,需要药品的量少,优点有:环保、节约;封闭实验,排除其他影响,现象快而明显,操作简单;
故选ABC;
(4)如果要研究分子运动与温度关系,可在本实验基础上继续实验,增加一个步骤,按照乙的装置条件,重新设置一个管丙,将管丙浸入冰水(与乙瓶温度有较大的差别即可)中,观察红点出现的时间,与乙进行比较。
20.【答案】(1)C
(2)中子数
(3)21×a%+22×b%+20×c%
(4)C
【知识点】原子的构成
【解析】【分析】 (1)根据题意,氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,进行分析解答。
(2)根据同种元素的原子的核内质子数相同,进行分析解答。
(3)根据题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,进行分析解答。
(4)根据资料内容,结合所学知识,进行分析判断。
【解答】 (1)19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍,元素的相对原子质量不支持材料一的是Cl-35.5。
故选B。
(2)同种元素的原子的核内质子数相同,相对原子质量却不同,是因为原子结构中的某种微粒数不同,该微粒的名称是中子数。
(3)由题意可知,1961年8月,国际上采用碳-12原子的作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,氖元素的相对原子质量的计算式子为21×a%+22×b%+20×c%。
(4)A.19世纪初,以氢为母体的相对原子质量标准是错误的,但它对科学的发展是有价值的,故A错误;
B.即使方法正确、仪器精确,实验结果也会存在误差,故B错误;
C.随着科学的发展,若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准,故C正确;
D.某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和,元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子,故D正确。
故选CD。
21.【答案】(1)不会
(2)B
(3)质子
(4)A;B;C;D
【知识点】原子的构成;原子结构的探索过程
【解析】【分析】根据原子结构分析解答;原子的质量主要集中在原子核上,核外有一个非常大的空间,原子不是个实心球体。原子是由原子核及电子组成的,而原子核又是由质子和中子组成的。
【解答】(1)极少数α粒子散射的原因是受到了一个体积小但质量相对而言较大的粒子的斥力,这说明原子质量、正电荷在原子内并不是均匀分布的;
(2)绝大多数α粒子穿过后方向不变,这是由于它们穿过了原子内部的空间,这也说明原子内部绝大部分空间是空的,故选B;
(3)1919年,卢瑟福用加速了的高能α粒子轰击氮原子,结果有种微粒从氮原子被打出,而α粒子留在了氮原子中,使氮原子变成了氧原子,说明原子核内的质子数变成了8个,所以打出的微粒是质子。
(4)A、科学模型的建立是一个不断完善、不断修正的过程,正确;
B、模型在科学研究中起着很重要的作用,正确;
C、人类借助模型的建立,对原子的认识逐渐接近本质,正确;
D、人的认识是随着科学的进步尤其是实验技术的提高而发展的,正确;
故答案为:ABCD。
22.【答案】(1)会
(2)化学性质
(3)不会
【知识点】分子的定义与分子的特性;分子和原子的区别和联系;分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)馒头的主要成分是淀粉,淀粉有遇碘变蓝色的特性。
(2)碘是一种由碘分子构成的非金属单质,碘分子能使馒头中的淀粉变蓝色。
【解答】(1)同种分子性质相同,不同分子性质不同,所以把湿润的馒头放在碘蒸气中,馒头会变蓝色;因为淀粉遇碘变蓝色或者说碘能使淀粉变蓝色,而馒头中含淀粉。
(2)碘是一种由碘分子构成的非金属单质,三个实验结果一样,都能使馒头变蓝,表明分子是保持物质化学性质的最小微粒。
(3)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐不存在碘分子,碘盐中的“碘”是指碘元素。
23.【答案】(1)甲烧杯中溶液变为红色,乙烧杯中溶液不变红
(2)滤纸条上的酚酞试液由左向右依次变红
(3)D 处纱布比B处纱布先变红;分子的运动速率与温度有关,温度越高,分子的运动速率越快(合理即可)
【知识点】分子的定义与分子的特性
【解析】【分析】(1)根据氨水具有挥发性,氨分子运动到甲烧杯中,使甲烧杯中溶液显碱性,酚酞试液变为红色进行分析;
(2)根据右端酚酞试液最靠近浓氨水,最先变红进行分析;
(3)根据右边装置中的温度高于左边装置,分子的运动速率随温度的升高而加快,分子的运动速率与温度有关,温度越高,分子的运动速率越快进行分析;
【解答】(1)氨水具有挥发性,氨分子运动到甲烧杯中,使甲烧杯中溶液显碱性,酚酞试液变为红色,乙烧杯溶液不变红;
(2)右端酚酞试液最靠近浓氨水,最先变红,故会观察到酚酞试液由左向右依次变红;
(3)右边装置中的温度高于左边装置,分子的运动速率随温度的升高而加快,故D出比B处先变红;该实验能说明分子的运动速率与温度有关,温度越高,分子的运动速率越快。
(1)氨水具有挥发性,氨分子运动到甲烧杯中,使甲烧杯中溶液显碱性,酚酞试液变为红色,乙烧杯溶液不变红;
(2)右端酚酞试液最靠近浓氨水,最先变红,故会观察到酚酞试液由左向右依次变红;
(3)右边装置中的温度高于左边装置,分子的运动速率随温度的升高而加快,故D出比B处先变红;该实验能说明分子的运动速率与温度有关,温度越高,分子的运动速率越快。
24.【答案】(1)离子
(2)钙离子;一个Ca2+带两个单位正电荷,一个Cl-带一个单位负电荷,故需要两个Cl-才能保持电中性
(3)方便拆卸、可以多次模拟等
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】(1)物质可能由分子、原子或离子构成,根据物质构成的知识解答;
(2)当正电荷数和负电荷数相同时,物质呈电中性;
(3)可从是否方便拆卸,以及是否可以多次使用的角度分析。
【解答】(1)氯化钠是由离子构成;
(2)如图丙所示,则“X”小球可能是钙离子,理由:一个Ca2+带两个单位正电荷,一个Cl-带一个单位负电荷,故需要两个Cl-才能保持电中性。
(3) 小组成员讨论后认为,两球之间用小磁体吸合的方案比两球之间用双面胶粘贴的方案好,理由是 方便拆卸、可以多次模拟等。
25.【答案】(1)
(2)在放电条件下,氧分子破裂成氧原子,氮分子破历程氮原子,每1个氮原子和1个氧原子结合成一个一氧化氮分子
(3)B
【知识点】分子、原子、离子、元素与物质之间的关系
【解析】【分析】 (1)根据质量守恒定律和化学反应的实质在B图中将相关粒子图形补充完整。
(2)根据微粒的变化解释由A到C变化的实质。
(3)根据常见物质的构成分析。
【解答】 (1)由质量守恒定律和化学反应的实质可知,在B图中应补充一个氮原子和一个氧原子,相关粒子图形补充如图:。
(2)由微粒的变化可知,由A到C变化的实质是:在放电条件下,氧分子破裂成氧原子,氮分子破历程氮原子,每1个氮原子和1个氧原子结合成一个一氧化氮分子。
(3)由常见物质的构成可知,甲烷、氮气是由分子构成的,金刚石和水银是由原子直接构成,故选BC。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
