浙教版(2024)科学七下期末复习:专题4 化学式的书写及意义(含解析)
文档属性
| 名称 | 浙教版(2024)科学七下期末复习:专题4 化学式的书写及意义(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 752.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-07 09:58:49 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
七下期末复习: 化学式的书写及意义
一、选择题
1.如图是四位同学对某化学式意义的描述,他们描述的化学式是( )
A.Zn B.CO C.H2O D.N2
2. 下列化学用语中,既表示一种元素,又表示一种原子,还表示一种物质的是()
A.H2 B.N C.Fe D.H2O
3.肼,又称联氨,常用作火箭的燃料,每个肼分子由2个氮原子和4个氢原子构成。则肼的化学式可以写作( )
A.2N4H B.NH C.2NH2 D.N2H4
4.物质的命名与化学式一致的是( )
A.氢气:H B.氦气: He2 C.氧气:O3 D.金刚石:C
5.小科通过微信公众号“胜哥课程”学习了化学式的写法与读法。化学式的正确读法是( )
A.硫化三氟 B.三氧化硫 C.硫化氧 D.氧化硫
6.高锰酸钾是一种常用的消毒剂,化学式为KMnO4。它是由离子构成的物质,其中阳离子是K+,那么其阴离子的化学式为( )
A. B. C.O2- D.MnO-
7.甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的质量分数分别是30.4%和25.9%,若已知甲的化学式是XY2,则乙的化学式可能是
A.XY B.X2Y C.X2Y5 D.X2Y3
8.眼镜洗液的主要成分是过氧化氢。下列说法中正确的是( )
A.是由2个氢元素和2个氧元素构成的
B.该物质是由多个原子构成的
C.是由氢分子和氧分子构成的
D.该物质的1个分子含质子数18
9.某同学制作的试剂标签如下,其中化学式书写正确的是( )
A. B.
C. D.
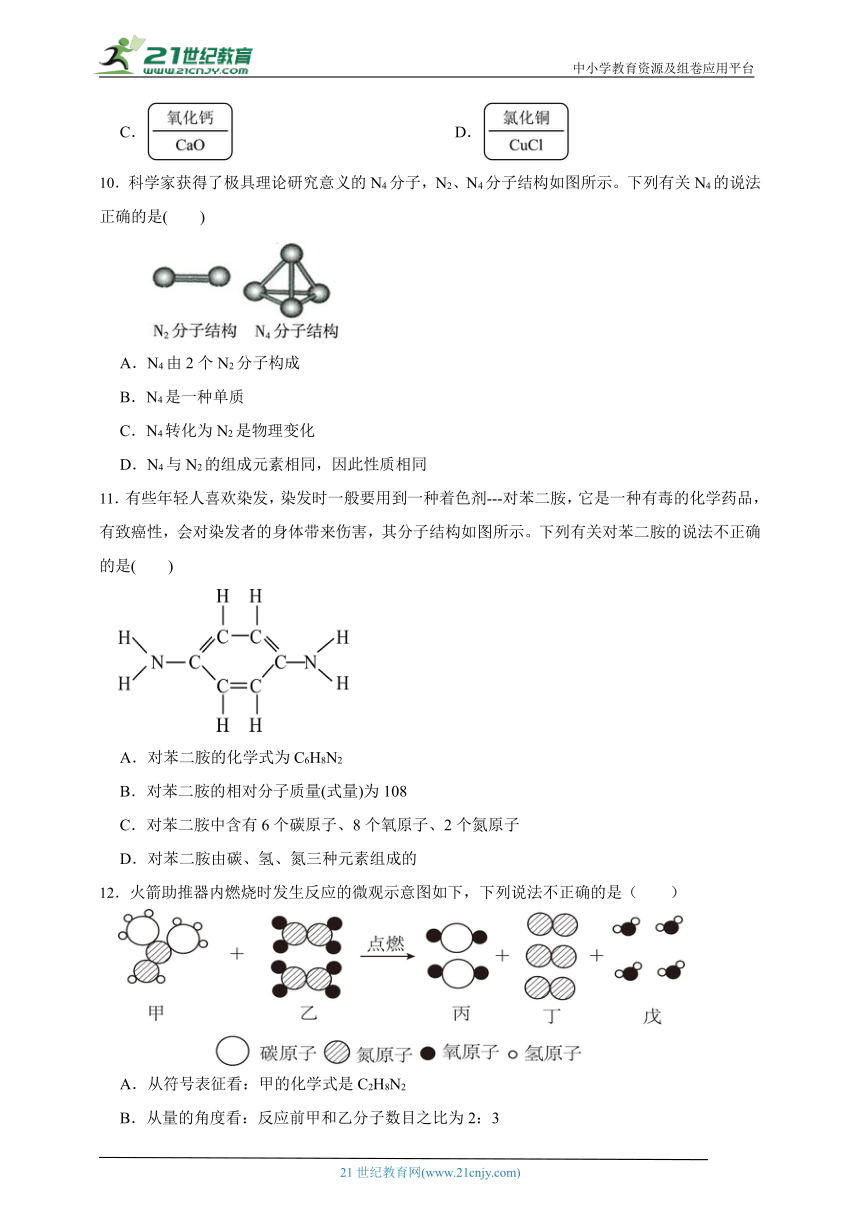
10.科学家获得了极具理论研究意义的N4分子,N2、N4分子结构如图所示。下列有关N4的说法正确的是( )
A.N4由2个N2分子构成
B.N4是一种单质
C.N4转化为N2是物理变化
D.N4与N2的组成元素相同,因此性质相同
11.有些年轻人喜欢染发,染发时一般要用到一种着色剂---对苯二胺,它是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的说法不正确的是( )
A.对苯二胺的化学式为C6H8N2
B.对苯二胺的相对分子质量(式量)为108
C.对苯二胺中含有6个碳原子、8个氧原子、2个氮原子
D.对苯二胺由碳、氢、氮三种元素组成的
12.火箭助推器内燃烧时发生反应的微观示意图如下,下列说法不正确的是( )
A.从符号表征看:甲的化学式是C2H8N2
B.从量的角度看:反应前甲和乙分子数目之比为2:3
C.从微观构成看:丙物质是由二氧化碳分子构成的
D.从宏观物质看:生成物中含有单质与化合物两类物质
13.如图是“胜哥”画的铜元素和硫元素常见的化合价坐标图,C表示的化合物的化学式是( )
A.CuS B.Cu2S C.CuS2 D.Cu2S2
二、填空题
14.化学用语可准确、简洁表达化学信息,请用化学用语填空。
(1)3个钾离子 。
(2)4个铵根离子 。
(3)地壳中含量最多的元素和含量最多的金属元素所形成的化合物是 。
15.请用化学符号表示:
(1) 2个氧分子 ,
(2) 3个硫酸根离子 ,
(3) 锌原子 ,
(4) 硝酸铵 ,
(5)碳酸钾 ,
(6) 氧化钠 。
16.小科通过微信公众号“胜哥课程”学会了一些化学用语。用化学用语完成下列填空:
(1)空气中含量最多的物质的化学式 。
(2)地壳中含量最多的金属元素的元素符号 。
(3) 3个氢氧根离子 。
(4) H2SO4中硫元素的化合价为 。
(5)硝酸亚铁的化学式 。
17.用化学用语表示:
(1) 2个铜原子 ;
(2) 氖气 ;
(3) 3个铁离子 ;
(4)一氧化碳中碳元素的化合价 ;
18.化学符号是学习和研究化学的重要工具,请按要求填空:
(1) 1个铁原子 ; 2个镁离子 ; 3个氯分子 ;
(2) 写出物质的化学式:氖气 ;硫酸铁 ;氢氧化钙 。
19.如图是元素周期表的一部分,请回答下列问题。
(1)周期表中位置①处的元素符号是 。
(2)N是一种 元素。 (选填“金属”或“非金属”)
(3)写出表中②和③组成的化合物的化学式 。
20.据报道:一颗陨石在俄罗斯中部乌拉尔山区的车里雅宾斯克市坠落,陨石进入大气层时速度达到了40倍音速,而落地前的飞行速度减小到了30公里/时。由此引发的“陨石雨”导致超过1200名当地居民受伤。右图为陨石样品中,各种元素含量的比例图。
(1)陨石中含量最高的金属元素是 。
(2)陨石碎块中含有铁单质,写出它与大气层剧烈摩擦,燃烧生成物四氧化三铁的化学式 。
(3)此样品中可能含有的化合物是 (可多选)。
A.二氧化硅B.氯化钾C.碳酸钙D.硫酸钠
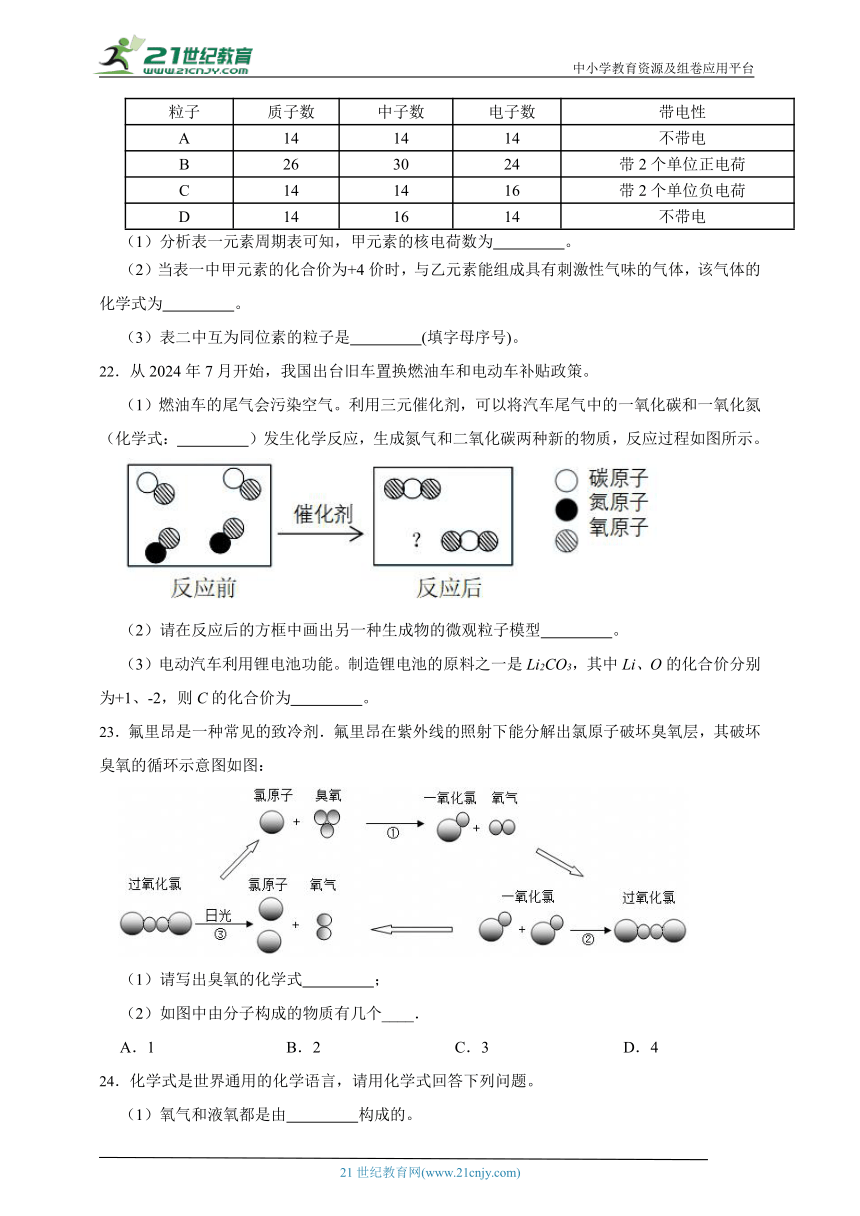
21.化学学习中非常重视从表格中获取信息。表一是元素周期表的一部分,表二是小时间学收集的一些微粒的资料,请根据表格信息回答下列问题。
表一
7 N 氮 乙 9 F 氟
15 P 磷 甲 17 Cl 氯
表二
粒子 质子数 中子数 电子数 带电性
A 14 14 14 不带电
B 26 30 24 带2个单位正电荷
C 14 14 16 带2个单位负电荷
D 14 16 14 不带电
(1)分析表一元素周期表可知,甲元素的核电荷数为 。
(2)当表一中甲元素的化合价为+4价时,与乙元素能组成具有刺激性气味的气体,该气体的化学式为 。
(3)表二中互为同位素的粒子是 (填字母序号)。
22.从2024年7月开始,我国出台旧车置换燃油车和电动车补贴政策。
(1)燃油车的尾气会污染空气。利用三元催化剂,可以将汽车尾气中的一氧化碳和一氧化氮(化学式: )发生化学反应,生成氮气和二氧化碳两种新的物质,反应过程如图所示。
(2)请在反应后的方框中画出另一种生成物的微观粒子模型 。
(3)电动汽车利用锂电池功能。制造锂电池的原料之一是Li2CO3,其中Li、O的化合价分别为+1、-2,则C的化合价为 。
23.氟里昂是一种常见的致冷剂.氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如图:
(1)请写出臭氧的化学式 ;
(2)如图中由分子构成的物质有几个____.
A.1 B.2 C.3 D.4
24.化学式是世界通用的化学语言,请用化学式回答下列问题。
(1)氧气和液氧都是由 构成的。
(2)由地壳中含量最多的非金属元素与金属元素组成的物质是:
25.根据下面提供的粒子结构示意图,回答下列问题
(1)D元素位于元素周期表第 周期,用化学符号写出微粒D 。
(2)A与B最本质的区别是 。
(3)C与E元素形成的化合物的化学式是 。
(4)写出氟原子的结构示意图 。
26.请仔细观察下面提供的1到18号元素的原子结构示意图,并根据这些信息回答以下问题。
(1)原子序数为13的元素位于元素周期表中的第 周期,它属于 (填“金属”或“非金属”)元素。
(2)同一族元素原子的 相同(除外),从上到下电子层数逐渐 。
(3)12号元素与17号元素组成的化合物的化学式为 。
三、综合题
27.请根据下表,回答下列问题:
原子序数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
元素名称 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
(1)各元素最本质的区别是 。
(2)如图是两种原子的结构示意图,它们在化学反应中因得失电子,形成离子,则这两种离子形成的化合物的化学式为 。
28.元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。
第1周期 1 H 1.008 2 He 4.003
第2周期 3 Li 6.941 4 Be 9.012 5 B 10.81 6 C 12.01 7 N 14.01 8 O 16.00 9 F 19.00 10 Ne 20.18
第3周期 11 Na 22.99 12 Mg 24.31 13 Al 26.98 14 Si 28.09 15 P 30.97 16 S 32.06 17 Cl 35.45 18 Ar 39.95
(1)第三周期中的稀有气体元素的质子数是 。
(2)元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、IIA族、IIIA族、IVA族、VA族、VIA族、VIIA族表示。同主族元素化学性质相似。X2+的核外电子数目为10,则X在第三周期第 族。
(3)下列各组中的两种元素具有相似化学性质的是____。
A.N C B.F Cl C.Mg Al D.Ne Na
(4)核电荷数1-18的非金属元素A和B,可形成原子个数比为2:1的常温下是液态的化合物,写出这种化合物的化学式 。
答案解析部分
1.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】一个化学式包含两层意义,①宏观意义:a.表示一种物质;b.表示该物质的元素组成;表示宏观时强调种类,而不讲个数 ②微观意义:a.表示该物质的一个分子;b.表示该物质的分子构成,进行分析判断。
【解答】根据题意,该物质由同种元素组成,1个分子由2个原子构成。
A、Zn是由一种元素组成的,且是由原子直接构成的,A错误;
B、CO是由两种元素组成的,故错误;
C、H2O是由两种元素组成的,且1个分子由2个氢原子和1个氧原子构成,C错误;
D、N2是由一种元素组成的,且1个分子由2个氮原子构成,D正确。
故答案为:D。
2.【答案】C
【知识点】化学式的书写及意义
【解析】【分析】元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了上述三层意义。金属、大多数固体非金属、稀有气体等都是由原子直接构成的,故它们的元素符号,既能表示一个原子,又能表示一种元素,还能表示一种物质。
【解答】A、该符号是氢气的化学式,不是元素符号,A不符合题意;
B、N属于气态非金属元素,可表示氮元素,表示一个氮原子,但不能表示一种物质,B不符合题意;
C、Fe属于金属元素,可表示铁元素,表示一个铁原子,因金属由原子直接构成,故还能表示铁这一纯净物,C符合题意;
D、该符号是水的化学式,不是元素符号,D不符合题意。
故答案为:C。
3.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】根据题意,每个肼分子由2个氮原子和4个氢原子构成,进行分析解答。
【解答】 每个肼分子由2个氮原子和4个氢原子构成,其化学式为N2H4。
故答案为:D。
4.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】根据单质(金属单质、固态非金属单质、稀有气体单质,直接用元素符号表示其化学式;气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字)和化合物(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)化学式的书写方法进行分析解答即可。
【解答】A、氢气的化学式为,故选项化学式书写错误。
B、氦气属于稀有气体单质,直接用元素符号表示其化学式,其化学式为He,故选项化学式书写错误。
C、氧气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为:O2,故选项化学式书写错误。
D、金刚石由碳元素组成,化学式书写正确。
故答案为:D。
5.【答案】B
【知识点】化学式的书写及意义
【解析】【分析】化学式由从向左读,S表示的是硫元素,O表示的是氧元素,表示氧化物是一般读作“某氧化某”。【解答】由氧化物的命名方法可知,SO3读作三氧化硫。
故答案为:B。
6.【答案】B
【知识点】化学式的书写及意义
【解析】【分析】(1)在化合物中,各元素化合价代数和为零 。
(2)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略 。
(3)对于由离子构成的化合物,阳离子所带正电荷总数等于阴离子所带负电荷总数 。
【解答】在KMnO4中,已知阳离子是K+,根据化合物中正负电荷代数和为零,K元素显+1价,那么阴离子整体显 1价,其阴离子为高锰酸根离子,化学式为MnO4 ,故该选项正确。
故答案为:B。
7.【答案】C
【知识点】化学式的书写及意义
【解析】【分析】由甲的化学式为XY2,可得其中X、Y原子个数比=1:2;根据甲、乙两种化合物中X元素的质量分数分别为30.4%和25.9%,可知甲物质中元素X的质量分数大于乙物质,可判断乙物质中X、Y原子个数比应小于1:2。
【解答】 A、由化学式XY,其中X、Y原子个数比=1:1,大于1:2;故A不正确;
B、由化学式X2Y,其中X、Y原子个数比=2:1,大于1:2;故B不正确;
C、由化学式X2Y5,其中X、Y原子个数比=2:5,小于1:2,故C正确;
D、由化学式X2Y3,其中X、Y原子个数比=2:3,大于1:2;故D不正确;
故答案为:C。
8.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】A.元素只分种类,不谈个数;
BC.物质由分子构成,分子由原子构成;
D.将某种原子的质子数与原子个数相乘,然后再求和即可。
【解答】A.根据化学式 可知,过氧化氢是由氢元素和氧元素组成的,故A错误;
B.过氧化氢是由过氧化氢分子构成的,故B错误;
C.根据化学式 可知,过氧化氢由分子构成,不含氢分子和氧分子,故C错误;
D.一个氢原子含1个质子,一个氧原子含8个质子,根据化学式 可知,一个过氧化氢分子中含2个氢原子和2个氧原子,则质子数为1×2+8×2=2+16=18,故D正确。
故选D。
9.【答案】C
【知识点】化学式的书写及意义
【解析】【分析】根据化合物中,正、负化合价的代数和为零,进行分析。
【解答】A、碳酸钠中钠元素显+1价,碳酸根显-2价,碳酸钠表示为:Na2CO3,故书写错误;
B、氯化铁中氯元素显-1价,铁元素显+3价,氯化铁表示为:FeCl3,故书写错误;
C、氧化钙中氧元素显-2价,钙元素呈+2价,氧化钙表示为CaO, 故书写正确;
D、氯化铜中氯元素显-1价,铜元素显+2价,氯化铜表示为:CuCl2,故书写错误。
故答案为:C。
10.【答案】B
【知识点】构成物质的粒子模型;化学式的书写及意义
【解析】【分析】A、根据N4是由N4分子构成的分析。
B、根据单质的概念分析。
C、根据变化的实质分析。
D、根据N4与N2组成元素相同,但分子构成不同分析。
【解答】A. N4是由N4分子构成的,不是2个N2分子构成,故错误。
B. 单质是含有一种元素的纯净物,N4属于单质,故正确。
C. N4转化为N2是生成了新物质,发生了化学变化,故错误。
D. 分子的结构决定性质,N4与N2结构不同性质一定不同,故错误。
故答案为:B。
11.【答案】C
【知识点】化学式的书写及意义;有关化学式的计算和推断
【解析】【分析】A、根据对苯二胺的分子结构图可知,1个对苯二胺分子是由6个碳原子、8个氢原子和2个氮原子构成的,据此进行分析判断.
B、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析判断.
C、根据物质的结构来分析;
D、根据对苯二胺化学式的含义进行分析判断.
【解答】 A、由对苯二胺的微观结构图可知,1个对苯二胺分子是由6个碳原子、8个氢原子和2个氮原子构成的,其化学式为C6H8N2,故选项说法正确。
B、对苯二胺的相对分子质量为12×6+1×8+14×2=108,故选项说法正确。
C、对苯二胺是由分子构成的而不是由原子直接构成的,故错误。
D、对苯二胺是由碳、氢、氮三种元素组成的,故选项说法正确。
故答案为:C。
12.【答案】B
【知识点】化学式的书写及意义;有关化学式的计算和推断
【解析】【分析】A、根据微观粒子的构成分析;
B、根据图示中原子种类和个数不变,确定分子个数比分析;
C、根据二氧化碳由二氧化碳分子构成分析;
D、根据由同种元素组成的纯净物为单质,由不同种元素组成的纯净物为化合物分析。
【解答】 由微观示意图可知,偏二甲肼与四氧化二氮在点燃的条件下反应生成水、二氧化碳和氮气,反应的化学方程式是:C2H8N2+2N2O43N2↑+2CO2↑+4H2O。
A、由分子结构模型可知,甲的化学式是C2N2H8,选项说法正确,不符合题意;
B、该反应方程式为C2H8N2+2N2O43N2↑+2CO2↑+4H2O,反应前后分子数目之比为2:8,选项说法不正确,符合题意;
C、丙物质为二氧化碳,是由二氧化碳分子构成的,选项说法正确,不符合题意;
D、生成物中含有单质与化合物两类物质,选项说法正确,不符合题意;
故选:B。
13.【答案】B
【知识点】化学式的书写及意义
【解析】【分析】根据铜元素和硫元素常见的化合价坐标,正确书写化学式进行分析。
【解答】C点硫元素-2价,铜元素+1价,根据化合物中,正、负化合价的代数和为零,化学式为Cu2S。
故答案为:B。
14.【答案】(1)3K+
(2)4NH4+
(3)Al2O3
【知识点】化学式的书写及意义
【解析】【分析】(1)(2)在元素符号右上角写数字和正负号表示离子所带电荷的量和电性,在左边写数字表示离子个数;
(3)根据地壳元素组成的知识分析解答。
【解答】 (1)钾离子带一个单位的正电荷,写作K+,在前面写数字3表中离子个数,即3个钾离子表示为3K+;
(2)铵根离子带一个单位的正电荷,写作NH4+,在前面写数字4表示离子个数,即4个铵根离子表示为4NH4+;
(3)地壳中含量最多的元素(氧元素)和含量最多的金属元素(铝元素)所形成的化合物是氧化铝,化学式为Al2O3。
15.【答案】(1)2O2
(2)3SO42-
(3)Zn
(4)NH4NO3
(5)K2CO3
(6)NaCl
【知识点】化学式的书写及意义
【解析】【分析】(1)在分子符号前面写数字表示分子个数;
(2)在离子符号前面写数字表示离子的个数;
(3)元素符号表示原子;
(4)(5)(6)根据物质名称确定组成分子的原子种类和个数,从而确定对应的化学式。
【解答】(1)氧分子由两个氧原子构成,写作O2,在前面写数字2表示个数,即2O2;
(2)硫酸根离子带两个单位的负电荷,写作SO42-,在前面写数字3表示离子个数,即3SO42-;
(3)锌原子写作Zn;
(4)硝酸铵由铵根离子和硝酸根离子构成,写作:NH4NO3;
(5)碳酸钾由钾离子和碳酸根离子构成,写作:K2CO3;
(6)氯化钠由氯离子和钠离子构成,写作:NaCl。
16.【答案】(1)N2
(2)Al
(3)3OH-
(4)
(5)Fe(NO3)2
【知识点】化学式的书写及意义
【解析】【分析】(1)根据空气组成的知识解答;
(2)根据地壳元素的分布特点解答;
(3)元素符号右上角的数字和正负号表示离子的电量和电性,在前面写数字表示离子个数;
(4)元素符号正上方的数字和正负号表示元素的化合价;
(5)根据物质名称确定组成分子的原子种类和个数,进而写出对应的化学式。
【解答】(1) 空气中含量最多的物质为氮气,它的分子由两个氮原子构成,写作N2;
(2) 地壳中含量最多的金属元素为铝,符号为Al;
(3)氢氧根离子带一个单位的负电荷,写作OH-,在前面写数字3表示个数,即3OH-;
(4) H2SO4中硫元素的化合价为+6价,写作:;
(5)硝酸亚铁分子由一个铁离子和2格硝酸根离子构成,写作:Fe(NO3)2。
17.【答案】(1)2Cu
(2)Ne
(3)3Fe3+
(4)
【知识点】化学式的书写及意义;化学符号及其周围数字的意义
【解析】【分析】(1)原子不带电,元素符号可代表一个原子。
(2)金属、稀有气体和常温下的非金属固体(除了碘)元素符号可以表示该物质。
(3)一个铁离子带来3个单位正电荷,一个亚铁离子带2个单位正电荷。
(4)化合价写在元素正上方,先写正负,再写数字,电荷数写在符号的右上角,先写数字,再写正负。
【解答】(1)表示原子个数的数字写在原子符号的前面,故答案为:2Cu。
(2)氖气是稀有气体,元素符号直接表示物质,故氖气的化学式为:Ne。
(3)表示离子个数的数字写在离子符号前面,故答案为:3Fe3+。
(4)表示元素化合价的数字写在元素符号的正上方,故答案为:。
18.【答案】(1)Fe;2Mg2+;3Cl2
(2)Ne;Fe2(SO4)3;Ca(OH)2
【知识点】化学式的书写及意义
【解析】【分析】 (1)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字。
离子的表示方法,在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个单位电荷时,1要省略。若表示多个该离子,就在其离子符号前加上相应的数字。
分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字。
(2)金属单质、固态非金属单质、稀有气体单质,直接用元素符号表示其化学式;气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字。
化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角。
【解答】 (1)个铁原子可表示为Fe;2个镁离子表示为2Mg2+;3个氯分子可表示为3Cl2。
(2)氖气属于气态非金属单质,其化学式为Ne。
硫酸铁写作Fe2(SO4)3;
氢氧化钙中钙元素显+2价,氢氧根显-1价,其化学式为Ca(OH)2。
19.【答案】(1)O
(2)非金属
(3)NaCl
【知识点】元素周期表;化学式的书写及意义;元素化合价的规则与计算
【解析】【分析】(1)在元素周期表中,同一横行指同一周期,从左到右,原子序数逐渐增大;同一竖行指同一族,从上到下,原子序数逐渐增大;
(2)在元素周期表中,元素名称中带有“金”字旁的金属元素,带有“气”字头的为气体;
(3)化学式中化合价代数和等于零。
【解答】(1) ① 处元素为第8号元素,在元素周期表中第8号元素为氧,符号为:O;
(2)N是氮元素的元素符号,氮为非金属;
(3) ② 处为第11号元素, ③ 处为第17号元素,分别为Na元素和Cl元素,Na元素和Cl元素组成氯化钠,Na元素的化合价为+1价,Cl元素化合价为-1价,化学式为:NaCl。
故答案为:(1)O (2)非金属 (3)NaCl
20.【答案】(1)铝
(2)Fe3O4
(3)A、D
【知识点】元素的种类与分布;化学式的书写及意义
【解析】【分析】(1)根据各种元素含量的比例图进行分析。
(2)根据四氧化三铁的化学式进行分析。
(3)根据陨石样品中不含氯、碳元素进行分析。
【解答】(1)根据各种元素含量的比例图,陨石中含量最高的金属元素是铝元素;
(2)四氧化三铁的化学式为Fe3O4;
(3)根据元素含量的比例图可知,陨石样品中不含氯、碳元素,故不含氯化钾、碳酸钙,此样品中可能含有的化合物是二氧化硅、硫酸钠。
故答案为:(1)铝;(2)Fe3O4;(3)AD。
21.【答案】(1)16
(2)
(3)AD
【知识点】同位素;元素周期表;化学式的书写及意义
【解析】【分析】(1)原子序数等于质子数等于核电荷数。
(2)根据化合物中各元素的化合价之和为零判断原子个数比。
(3)同位素:质子数相同而中子数不同的原子,同位素原子属于同种元素。
【解答】(1)从左到右,元素的核电荷数逐渐增大,由图可知,甲的核电荷数为:16。
(2)甲元素的核电荷数为16,可知是硫元素,乙核电荷数为8,是氧元素,硫元素的化合价为+4价,氧元素的化合价为-2价,可知该气体的化学式为:。
(3)由表中数据可知,A粒子和D粒子是质子数相同而中子数不同的原子,属于同位素原子。
22.【答案】(1)NO
(2)
(3)+4
【知识点】构成物质的粒子模型;化学式的书写及意义;元素化合价的规则与计算
【解析】【分析】(1)根据一氧化氮点的名称书写化学式,氧化物氧写在右侧。
(2)氮气由氮气分子构成,也可通过反应前后原子种类和个数不变进行判断。
(3)根据化合物中各元素的化合价之和为零进行计算。
【解答】(1)一个一氧化氮分子由一个氮原子和一个氧原子构成,分子式为:NO。
(2)另一个产物是氮气,由氮分子构成,一个氮分子含有两个氮原子。
故答案为:。
(3)碳元素的化合价为,解得x=+4。
23.【答案】(1)O3
(2)D
【知识点】化学式的书写及意义
【解析】【分析】(1)根据臭氧的分子结构模型写出其化学式,根据构成物质的基本粒子来分析;
(2)根据构成物质的基本粒子来分析;
【解答】1)由分子结构模型可知,每个臭氧分子是由3个氧原子构成的,则臭氧的化学式为O3;氧气是由氧分子构成的,臭氧是由臭氧分子构成的,不同种分子化学性质不同;
(2)由微观图示可知,过氧化氢、臭氧、一氧化氯、氧气四种物质都是由分子构成的。
24.【答案】(1)O2
(2)Al2O3
【知识点】元素的种类与分布;化学式的书写及意义
【解析】【分析】氧气和液氧都是由分子构成的;根据地壳中元素的含量以及化学式的写法来分析。
【解答】(1)氧气和液氧都是氧的单质,都是由O2分子构成的;
(2)地壳中含量最多的非金属元素是氧元素,地壳中含量最高的金属元素是铝元素,在化合物中铝元素显+3价,氧元素显-2价,则二者组成的化合物的化学式为Al2O3。
25.【答案】(1)三;Na+
(2)质子数不同
(3)AlCl3
(4)
【知识点】模型与符号;原子的构成;元素周期表;化学式的书写及意义
【解析】【分析】(1)原子序数等于质子数,可根据质子数判断元素种类。
(2)不同原子的本质区别是质子数不同。
(3)化合物各元素化合价之和为零,金属写在左侧。
(4)氟是9号元素,所以质子数为9,结合题中其它元素的结构示意图画出氟原子的结构示意图。
【解答】(1)D原子中质子数为11,为钠元素,在第三周期。
D质子数为11,核外电子数为10,质子数比电子数多1个,说明该微粒带有一个单位正电荷,符号为:。
(2)质子数决定元素种类,A和B质子数不同,所以元素种类不同,即AB的本质区别是质子数不同。
(3)C是17号元素,为氯元素,C带一个单位负电荷,E为13号元素,属于铝元素,E常见化合价为+3价,组成的化合物为:AlCl3。
(4)氟是9号元素,质子数为9,如图所示。
26.【答案】(1)三;金属
(2)最外层电子数;增加
(3)
【知识点】元素周期表;化学式的书写及意义
【解析】【分析】(1)元素周期表表每一横行表示一个周期,原子电子层数等于周数。“钅”字旁的元素和汞属于金属元素。
(2)同一列属于同一族,由图可知,同组元素最外层电子数相同,电子层数随周期数的增大而增多。
(3)镁是金属元素,写在左侧,氯是非金属元素,写在右侧,注意化合物中各元素化合价之和为零。
【解答】(1)原子序数为13的元素(铝元素)的原子核外电子排布为2、8、3,因此其电子层数为3,在元素周期表中位于第三周期。根据元素分类标准,铝属于典型的金属元素。
(2)通过分析元素结构示意图可总结出以下规律:
同族元素的原子最外层电子数相同;
同一族的元素,其原子从上至下电子层数依次递增。
(3)12号元素镁(Mg)的常见化合价为+2,17号元素氯(Cl)的常见化合价为-1。根据化合价规则,二者形成的化合物化学式为MgCl2(氯化镁)。
(1)原子序数为13的元素(铝元素)的原子核外电子层数是3,位于元素周期表中第三周期,它属于金属元素;
(2)由元素结构示意图信息可得:同族数元素的原子的最外层电子数相同;同一族的元素对应的原子从上往下电子层数在逐渐增加;
(3)12号元素为Mg,常用化合价为+2价,17号元素为Cl,常用化合价为-1价,则Mg与Cl构成的化合物为MgCl2。
27.【答案】(1)质子数不同
(2)NaCl
【知识点】元素的种类与分布;化学式的书写及意义
【解析】【分析】(1)质子数决定元素种类,可知不同元素之间的区别是质子数不同。
(2)根据元素化合价和化合价中各元素化合价之和为零判断化学式,注意金属元素写在左侧。
【解答】(1)元素种类由质子数决定,可知各元素最本质的区别是质子数不同。
(2)11号元素是钠元素,化合价为+1价,17号元素为氯元素,化合价为-1价,则形成的化合物为NaCl。
28.【答案】(1)18
(2)IIA
(3)B
(4)H2O和 H2O2
【知识点】元素的符号及其意义;元素周期表;化学式的书写及意义
【解析】【分析】 化学元素周期表是根据元素原子核电荷数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体、非金属元素、过渡元素等。这使周期表中形成元素分区且分有七主族、七副族、Ⅷ族、18族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
【解答】(1) 第三周期中的稀有气体元素的质子数是 18;稀有气体是最后一列的元素;
(2)元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、IIA族、IIIA族、IVA族、VA族、VIA族、VIIA族表示。同主族元素化学性质相似。X2+的核外电子数目为10,电子是带负电的,所以他有12个带正电的质子,则X在第三周期第IIA族。
(3) 下列各组中的两种元素具有相似化学性质的是 B;同一列上的元素化学性质相似,因为原子的最外层电子数相同;
(4) 核电荷数1-18的非金属元素A和B,可形成原子个数比为2:1的常温下是液态的化合物,写出这种化合物的化学式 H2O和H2O2
故答案为:(1)18(2)IIA(3)B(4)H2O H2O2
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
七下期末复习: 化学式的书写及意义
一、选择题
1.如图是四位同学对某化学式意义的描述,他们描述的化学式是( )
A.Zn B.CO C.H2O D.N2
2. 下列化学用语中,既表示一种元素,又表示一种原子,还表示一种物质的是()
A.H2 B.N C.Fe D.H2O
3.肼,又称联氨,常用作火箭的燃料,每个肼分子由2个氮原子和4个氢原子构成。则肼的化学式可以写作( )
A.2N4H B.NH C.2NH2 D.N2H4
4.物质的命名与化学式一致的是( )
A.氢气:H B.氦气: He2 C.氧气:O3 D.金刚石:C
5.小科通过微信公众号“胜哥课程”学习了化学式的写法与读法。化学式的正确读法是( )
A.硫化三氟 B.三氧化硫 C.硫化氧 D.氧化硫
6.高锰酸钾是一种常用的消毒剂,化学式为KMnO4。它是由离子构成的物质,其中阳离子是K+,那么其阴离子的化学式为( )
A. B. C.O2- D.MnO-
7.甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的质量分数分别是30.4%和25.9%,若已知甲的化学式是XY2,则乙的化学式可能是
A.XY B.X2Y C.X2Y5 D.X2Y3
8.眼镜洗液的主要成分是过氧化氢。下列说法中正确的是( )
A.是由2个氢元素和2个氧元素构成的
B.该物质是由多个原子构成的
C.是由氢分子和氧分子构成的
D.该物质的1个分子含质子数18
9.某同学制作的试剂标签如下,其中化学式书写正确的是( )
A. B.
C. D.
10.科学家获得了极具理论研究意义的N4分子,N2、N4分子结构如图所示。下列有关N4的说法正确的是( )
A.N4由2个N2分子构成
B.N4是一种单质
C.N4转化为N2是物理变化
D.N4与N2的组成元素相同,因此性质相同
11.有些年轻人喜欢染发,染发时一般要用到一种着色剂---对苯二胺,它是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害,其分子结构如图所示。下列有关对苯二胺的说法不正确的是( )
A.对苯二胺的化学式为C6H8N2
B.对苯二胺的相对分子质量(式量)为108
C.对苯二胺中含有6个碳原子、8个氧原子、2个氮原子
D.对苯二胺由碳、氢、氮三种元素组成的
12.火箭助推器内燃烧时发生反应的微观示意图如下,下列说法不正确的是( )
A.从符号表征看:甲的化学式是C2H8N2
B.从量的角度看:反应前甲和乙分子数目之比为2:3
C.从微观构成看:丙物质是由二氧化碳分子构成的
D.从宏观物质看:生成物中含有单质与化合物两类物质
13.如图是“胜哥”画的铜元素和硫元素常见的化合价坐标图,C表示的化合物的化学式是( )
A.CuS B.Cu2S C.CuS2 D.Cu2S2
二、填空题
14.化学用语可准确、简洁表达化学信息,请用化学用语填空。
(1)3个钾离子 。
(2)4个铵根离子 。
(3)地壳中含量最多的元素和含量最多的金属元素所形成的化合物是 。
15.请用化学符号表示:
(1) 2个氧分子 ,
(2) 3个硫酸根离子 ,
(3) 锌原子 ,
(4) 硝酸铵 ,
(5)碳酸钾 ,
(6) 氧化钠 。
16.小科通过微信公众号“胜哥课程”学会了一些化学用语。用化学用语完成下列填空:
(1)空气中含量最多的物质的化学式 。
(2)地壳中含量最多的金属元素的元素符号 。
(3) 3个氢氧根离子 。
(4) H2SO4中硫元素的化合价为 。
(5)硝酸亚铁的化学式 。
17.用化学用语表示:
(1) 2个铜原子 ;
(2) 氖气 ;
(3) 3个铁离子 ;
(4)一氧化碳中碳元素的化合价 ;
18.化学符号是学习和研究化学的重要工具,请按要求填空:
(1) 1个铁原子 ; 2个镁离子 ; 3个氯分子 ;
(2) 写出物质的化学式:氖气 ;硫酸铁 ;氢氧化钙 。
19.如图是元素周期表的一部分,请回答下列问题。
(1)周期表中位置①处的元素符号是 。
(2)N是一种 元素。 (选填“金属”或“非金属”)
(3)写出表中②和③组成的化合物的化学式 。
20.据报道:一颗陨石在俄罗斯中部乌拉尔山区的车里雅宾斯克市坠落,陨石进入大气层时速度达到了40倍音速,而落地前的飞行速度减小到了30公里/时。由此引发的“陨石雨”导致超过1200名当地居民受伤。右图为陨石样品中,各种元素含量的比例图。
(1)陨石中含量最高的金属元素是 。
(2)陨石碎块中含有铁单质,写出它与大气层剧烈摩擦,燃烧生成物四氧化三铁的化学式 。
(3)此样品中可能含有的化合物是 (可多选)。
A.二氧化硅B.氯化钾C.碳酸钙D.硫酸钠
21.化学学习中非常重视从表格中获取信息。表一是元素周期表的一部分,表二是小时间学收集的一些微粒的资料,请根据表格信息回答下列问题。
表一
7 N 氮 乙 9 F 氟
15 P 磷 甲 17 Cl 氯
表二
粒子 质子数 中子数 电子数 带电性
A 14 14 14 不带电
B 26 30 24 带2个单位正电荷
C 14 14 16 带2个单位负电荷
D 14 16 14 不带电
(1)分析表一元素周期表可知,甲元素的核电荷数为 。
(2)当表一中甲元素的化合价为+4价时,与乙元素能组成具有刺激性气味的气体,该气体的化学式为 。
(3)表二中互为同位素的粒子是 (填字母序号)。
22.从2024年7月开始,我国出台旧车置换燃油车和电动车补贴政策。
(1)燃油车的尾气会污染空气。利用三元催化剂,可以将汽车尾气中的一氧化碳和一氧化氮(化学式: )发生化学反应,生成氮气和二氧化碳两种新的物质,反应过程如图所示。
(2)请在反应后的方框中画出另一种生成物的微观粒子模型 。
(3)电动汽车利用锂电池功能。制造锂电池的原料之一是Li2CO3,其中Li、O的化合价分别为+1、-2,则C的化合价为 。
23.氟里昂是一种常见的致冷剂.氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如图:
(1)请写出臭氧的化学式 ;
(2)如图中由分子构成的物质有几个____.
A.1 B.2 C.3 D.4
24.化学式是世界通用的化学语言,请用化学式回答下列问题。
(1)氧气和液氧都是由 构成的。
(2)由地壳中含量最多的非金属元素与金属元素组成的物质是:
25.根据下面提供的粒子结构示意图,回答下列问题
(1)D元素位于元素周期表第 周期,用化学符号写出微粒D 。
(2)A与B最本质的区别是 。
(3)C与E元素形成的化合物的化学式是 。
(4)写出氟原子的结构示意图 。
26.请仔细观察下面提供的1到18号元素的原子结构示意图,并根据这些信息回答以下问题。
(1)原子序数为13的元素位于元素周期表中的第 周期,它属于 (填“金属”或“非金属”)元素。
(2)同一族元素原子的 相同(除外),从上到下电子层数逐渐 。
(3)12号元素与17号元素组成的化合物的化学式为 。
三、综合题
27.请根据下表,回答下列问题:
原子序数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
元素名称 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
(1)各元素最本质的区别是 。
(2)如图是两种原子的结构示意图,它们在化学反应中因得失电子,形成离子,则这两种离子形成的化合物的化学式为 。
28.元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。
第1周期 1 H 1.008 2 He 4.003
第2周期 3 Li 6.941 4 Be 9.012 5 B 10.81 6 C 12.01 7 N 14.01 8 O 16.00 9 F 19.00 10 Ne 20.18
第3周期 11 Na 22.99 12 Mg 24.31 13 Al 26.98 14 Si 28.09 15 P 30.97 16 S 32.06 17 Cl 35.45 18 Ar 39.95
(1)第三周期中的稀有气体元素的质子数是 。
(2)元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、IIA族、IIIA族、IVA族、VA族、VIA族、VIIA族表示。同主族元素化学性质相似。X2+的核外电子数目为10,则X在第三周期第 族。
(3)下列各组中的两种元素具有相似化学性质的是____。
A.N C B.F Cl C.Mg Al D.Ne Na
(4)核电荷数1-18的非金属元素A和B,可形成原子个数比为2:1的常温下是液态的化合物,写出这种化合物的化学式 。
答案解析部分
1.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】一个化学式包含两层意义,①宏观意义:a.表示一种物质;b.表示该物质的元素组成;表示宏观时强调种类,而不讲个数 ②微观意义:a.表示该物质的一个分子;b.表示该物质的分子构成,进行分析判断。
【解答】根据题意,该物质由同种元素组成,1个分子由2个原子构成。
A、Zn是由一种元素组成的,且是由原子直接构成的,A错误;
B、CO是由两种元素组成的,故错误;
C、H2O是由两种元素组成的,且1个分子由2个氢原子和1个氧原子构成,C错误;
D、N2是由一种元素组成的,且1个分子由2个氮原子构成,D正确。
故答案为:D。
2.【答案】C
【知识点】化学式的书写及意义
【解析】【分析】元素符号能表示一种元素,还能表示该元素的一个原子;化学式能表示一种物质,当元素符号又是化学式时,就同时具备了上述三层意义。金属、大多数固体非金属、稀有气体等都是由原子直接构成的,故它们的元素符号,既能表示一个原子,又能表示一种元素,还能表示一种物质。
【解答】A、该符号是氢气的化学式,不是元素符号,A不符合题意;
B、N属于气态非金属元素,可表示氮元素,表示一个氮原子,但不能表示一种物质,B不符合题意;
C、Fe属于金属元素,可表示铁元素,表示一个铁原子,因金属由原子直接构成,故还能表示铁这一纯净物,C符合题意;
D、该符号是水的化学式,不是元素符号,D不符合题意。
故答案为:C。
3.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】根据题意,每个肼分子由2个氮原子和4个氢原子构成,进行分析解答。
【解答】 每个肼分子由2个氮原子和4个氢原子构成,其化学式为N2H4。
故答案为:D。
4.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】根据单质(金属单质、固态非金属单质、稀有气体单质,直接用元素符号表示其化学式;气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字)和化合物(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)化学式的书写方法进行分析解答即可。
【解答】A、氢气的化学式为,故选项化学式书写错误。
B、氦气属于稀有气体单质,直接用元素符号表示其化学式,其化学式为He,故选项化学式书写错误。
C、氧气属于气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字,其化学式为:O2,故选项化学式书写错误。
D、金刚石由碳元素组成,化学式书写正确。
故答案为:D。
5.【答案】B
【知识点】化学式的书写及意义
【解析】【分析】化学式由从向左读,S表示的是硫元素,O表示的是氧元素,表示氧化物是一般读作“某氧化某”。【解答】由氧化物的命名方法可知,SO3读作三氧化硫。
故答案为:B。
6.【答案】B
【知识点】化学式的书写及意义
【解析】【分析】(1)在化合物中,各元素化合价代数和为零 。
(2)离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略 。
(3)对于由离子构成的化合物,阳离子所带正电荷总数等于阴离子所带负电荷总数 。
【解答】在KMnO4中,已知阳离子是K+,根据化合物中正负电荷代数和为零,K元素显+1价,那么阴离子整体显 1价,其阴离子为高锰酸根离子,化学式为MnO4 ,故该选项正确。
故答案为:B。
7.【答案】C
【知识点】化学式的书写及意义
【解析】【分析】由甲的化学式为XY2,可得其中X、Y原子个数比=1:2;根据甲、乙两种化合物中X元素的质量分数分别为30.4%和25.9%,可知甲物质中元素X的质量分数大于乙物质,可判断乙物质中X、Y原子个数比应小于1:2。
【解答】 A、由化学式XY,其中X、Y原子个数比=1:1,大于1:2;故A不正确;
B、由化学式X2Y,其中X、Y原子个数比=2:1,大于1:2;故B不正确;
C、由化学式X2Y5,其中X、Y原子个数比=2:5,小于1:2,故C正确;
D、由化学式X2Y3,其中X、Y原子个数比=2:3,大于1:2;故D不正确;
故答案为:C。
8.【答案】D
【知识点】化学式的书写及意义
【解析】【分析】A.元素只分种类,不谈个数;
BC.物质由分子构成,分子由原子构成;
D.将某种原子的质子数与原子个数相乘,然后再求和即可。
【解答】A.根据化学式 可知,过氧化氢是由氢元素和氧元素组成的,故A错误;
B.过氧化氢是由过氧化氢分子构成的,故B错误;
C.根据化学式 可知,过氧化氢由分子构成,不含氢分子和氧分子,故C错误;
D.一个氢原子含1个质子,一个氧原子含8个质子,根据化学式 可知,一个过氧化氢分子中含2个氢原子和2个氧原子,则质子数为1×2+8×2=2+16=18,故D正确。
故选D。
9.【答案】C
【知识点】化学式的书写及意义
【解析】【分析】根据化合物中,正、负化合价的代数和为零,进行分析。
【解答】A、碳酸钠中钠元素显+1价,碳酸根显-2价,碳酸钠表示为:Na2CO3,故书写错误;
B、氯化铁中氯元素显-1价,铁元素显+3价,氯化铁表示为:FeCl3,故书写错误;
C、氧化钙中氧元素显-2价,钙元素呈+2价,氧化钙表示为CaO, 故书写正确;
D、氯化铜中氯元素显-1价,铜元素显+2价,氯化铜表示为:CuCl2,故书写错误。
故答案为:C。
10.【答案】B
【知识点】构成物质的粒子模型;化学式的书写及意义
【解析】【分析】A、根据N4是由N4分子构成的分析。
B、根据单质的概念分析。
C、根据变化的实质分析。
D、根据N4与N2组成元素相同,但分子构成不同分析。
【解答】A. N4是由N4分子构成的,不是2个N2分子构成,故错误。
B. 单质是含有一种元素的纯净物,N4属于单质,故正确。
C. N4转化为N2是生成了新物质,发生了化学变化,故错误。
D. 分子的结构决定性质,N4与N2结构不同性质一定不同,故错误。
故答案为:B。
11.【答案】C
【知识点】化学式的书写及意义;有关化学式的计算和推断
【解析】【分析】A、根据对苯二胺的分子结构图可知,1个对苯二胺分子是由6个碳原子、8个氢原子和2个氮原子构成的,据此进行分析判断.
B、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析判断.
C、根据物质的结构来分析;
D、根据对苯二胺化学式的含义进行分析判断.
【解答】 A、由对苯二胺的微观结构图可知,1个对苯二胺分子是由6个碳原子、8个氢原子和2个氮原子构成的,其化学式为C6H8N2,故选项说法正确。
B、对苯二胺的相对分子质量为12×6+1×8+14×2=108,故选项说法正确。
C、对苯二胺是由分子构成的而不是由原子直接构成的,故错误。
D、对苯二胺是由碳、氢、氮三种元素组成的,故选项说法正确。
故答案为:C。
12.【答案】B
【知识点】化学式的书写及意义;有关化学式的计算和推断
【解析】【分析】A、根据微观粒子的构成分析;
B、根据图示中原子种类和个数不变,确定分子个数比分析;
C、根据二氧化碳由二氧化碳分子构成分析;
D、根据由同种元素组成的纯净物为单质,由不同种元素组成的纯净物为化合物分析。
【解答】 由微观示意图可知,偏二甲肼与四氧化二氮在点燃的条件下反应生成水、二氧化碳和氮气,反应的化学方程式是:C2H8N2+2N2O43N2↑+2CO2↑+4H2O。
A、由分子结构模型可知,甲的化学式是C2N2H8,选项说法正确,不符合题意;
B、该反应方程式为C2H8N2+2N2O43N2↑+2CO2↑+4H2O,反应前后分子数目之比为2:8,选项说法不正确,符合题意;
C、丙物质为二氧化碳,是由二氧化碳分子构成的,选项说法正确,不符合题意;
D、生成物中含有单质与化合物两类物质,选项说法正确,不符合题意;
故选:B。
13.【答案】B
【知识点】化学式的书写及意义
【解析】【分析】根据铜元素和硫元素常见的化合价坐标,正确书写化学式进行分析。
【解答】C点硫元素-2价,铜元素+1价,根据化合物中,正、负化合价的代数和为零,化学式为Cu2S。
故答案为:B。
14.【答案】(1)3K+
(2)4NH4+
(3)Al2O3
【知识点】化学式的书写及意义
【解析】【分析】(1)(2)在元素符号右上角写数字和正负号表示离子所带电荷的量和电性,在左边写数字表示离子个数;
(3)根据地壳元素组成的知识分析解答。
【解答】 (1)钾离子带一个单位的正电荷,写作K+,在前面写数字3表中离子个数,即3个钾离子表示为3K+;
(2)铵根离子带一个单位的正电荷,写作NH4+,在前面写数字4表示离子个数,即4个铵根离子表示为4NH4+;
(3)地壳中含量最多的元素(氧元素)和含量最多的金属元素(铝元素)所形成的化合物是氧化铝,化学式为Al2O3。
15.【答案】(1)2O2
(2)3SO42-
(3)Zn
(4)NH4NO3
(5)K2CO3
(6)NaCl
【知识点】化学式的书写及意义
【解析】【分析】(1)在分子符号前面写数字表示分子个数;
(2)在离子符号前面写数字表示离子的个数;
(3)元素符号表示原子;
(4)(5)(6)根据物质名称确定组成分子的原子种类和个数,从而确定对应的化学式。
【解答】(1)氧分子由两个氧原子构成,写作O2,在前面写数字2表示个数,即2O2;
(2)硫酸根离子带两个单位的负电荷,写作SO42-,在前面写数字3表示离子个数,即3SO42-;
(3)锌原子写作Zn;
(4)硝酸铵由铵根离子和硝酸根离子构成,写作:NH4NO3;
(5)碳酸钾由钾离子和碳酸根离子构成,写作:K2CO3;
(6)氯化钠由氯离子和钠离子构成,写作:NaCl。
16.【答案】(1)N2
(2)Al
(3)3OH-
(4)
(5)Fe(NO3)2
【知识点】化学式的书写及意义
【解析】【分析】(1)根据空气组成的知识解答;
(2)根据地壳元素的分布特点解答;
(3)元素符号右上角的数字和正负号表示离子的电量和电性,在前面写数字表示离子个数;
(4)元素符号正上方的数字和正负号表示元素的化合价;
(5)根据物质名称确定组成分子的原子种类和个数,进而写出对应的化学式。
【解答】(1) 空气中含量最多的物质为氮气,它的分子由两个氮原子构成,写作N2;
(2) 地壳中含量最多的金属元素为铝,符号为Al;
(3)氢氧根离子带一个单位的负电荷,写作OH-,在前面写数字3表示个数,即3OH-;
(4) H2SO4中硫元素的化合价为+6价,写作:;
(5)硝酸亚铁分子由一个铁离子和2格硝酸根离子构成,写作:Fe(NO3)2。
17.【答案】(1)2Cu
(2)Ne
(3)3Fe3+
(4)
【知识点】化学式的书写及意义;化学符号及其周围数字的意义
【解析】【分析】(1)原子不带电,元素符号可代表一个原子。
(2)金属、稀有气体和常温下的非金属固体(除了碘)元素符号可以表示该物质。
(3)一个铁离子带来3个单位正电荷,一个亚铁离子带2个单位正电荷。
(4)化合价写在元素正上方,先写正负,再写数字,电荷数写在符号的右上角,先写数字,再写正负。
【解答】(1)表示原子个数的数字写在原子符号的前面,故答案为:2Cu。
(2)氖气是稀有气体,元素符号直接表示物质,故氖气的化学式为:Ne。
(3)表示离子个数的数字写在离子符号前面,故答案为:3Fe3+。
(4)表示元素化合价的数字写在元素符号的正上方,故答案为:。
18.【答案】(1)Fe;2Mg2+;3Cl2
(2)Ne;Fe2(SO4)3;Ca(OH)2
【知识点】化学式的书写及意义
【解析】【分析】 (1)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字。
离子的表示方法,在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个单位电荷时,1要省略。若表示多个该离子,就在其离子符号前加上相应的数字。
分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字。
(2)金属单质、固态非金属单质、稀有气体单质,直接用元素符号表示其化学式;气态非金属单质,在元素符号的右下角写上表示分子中所含原子数的数字。
化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零,化合价数值约到最简交叉写在元素右下角。
【解答】 (1)个铁原子可表示为Fe;2个镁离子表示为2Mg2+;3个氯分子可表示为3Cl2。
(2)氖气属于气态非金属单质,其化学式为Ne。
硫酸铁写作Fe2(SO4)3;
氢氧化钙中钙元素显+2价,氢氧根显-1价,其化学式为Ca(OH)2。
19.【答案】(1)O
(2)非金属
(3)NaCl
【知识点】元素周期表;化学式的书写及意义;元素化合价的规则与计算
【解析】【分析】(1)在元素周期表中,同一横行指同一周期,从左到右,原子序数逐渐增大;同一竖行指同一族,从上到下,原子序数逐渐增大;
(2)在元素周期表中,元素名称中带有“金”字旁的金属元素,带有“气”字头的为气体;
(3)化学式中化合价代数和等于零。
【解答】(1) ① 处元素为第8号元素,在元素周期表中第8号元素为氧,符号为:O;
(2)N是氮元素的元素符号,氮为非金属;
(3) ② 处为第11号元素, ③ 处为第17号元素,分别为Na元素和Cl元素,Na元素和Cl元素组成氯化钠,Na元素的化合价为+1价,Cl元素化合价为-1价,化学式为:NaCl。
故答案为:(1)O (2)非金属 (3)NaCl
20.【答案】(1)铝
(2)Fe3O4
(3)A、D
【知识点】元素的种类与分布;化学式的书写及意义
【解析】【分析】(1)根据各种元素含量的比例图进行分析。
(2)根据四氧化三铁的化学式进行分析。
(3)根据陨石样品中不含氯、碳元素进行分析。
【解答】(1)根据各种元素含量的比例图,陨石中含量最高的金属元素是铝元素;
(2)四氧化三铁的化学式为Fe3O4;
(3)根据元素含量的比例图可知,陨石样品中不含氯、碳元素,故不含氯化钾、碳酸钙,此样品中可能含有的化合物是二氧化硅、硫酸钠。
故答案为:(1)铝;(2)Fe3O4;(3)AD。
21.【答案】(1)16
(2)
(3)AD
【知识点】同位素;元素周期表;化学式的书写及意义
【解析】【分析】(1)原子序数等于质子数等于核电荷数。
(2)根据化合物中各元素的化合价之和为零判断原子个数比。
(3)同位素:质子数相同而中子数不同的原子,同位素原子属于同种元素。
【解答】(1)从左到右,元素的核电荷数逐渐增大,由图可知,甲的核电荷数为:16。
(2)甲元素的核电荷数为16,可知是硫元素,乙核电荷数为8,是氧元素,硫元素的化合价为+4价,氧元素的化合价为-2价,可知该气体的化学式为:。
(3)由表中数据可知,A粒子和D粒子是质子数相同而中子数不同的原子,属于同位素原子。
22.【答案】(1)NO
(2)
(3)+4
【知识点】构成物质的粒子模型;化学式的书写及意义;元素化合价的规则与计算
【解析】【分析】(1)根据一氧化氮点的名称书写化学式,氧化物氧写在右侧。
(2)氮气由氮气分子构成,也可通过反应前后原子种类和个数不变进行判断。
(3)根据化合物中各元素的化合价之和为零进行计算。
【解答】(1)一个一氧化氮分子由一个氮原子和一个氧原子构成,分子式为:NO。
(2)另一个产物是氮气,由氮分子构成,一个氮分子含有两个氮原子。
故答案为:。
(3)碳元素的化合价为,解得x=+4。
23.【答案】(1)O3
(2)D
【知识点】化学式的书写及意义
【解析】【分析】(1)根据臭氧的分子结构模型写出其化学式,根据构成物质的基本粒子来分析;
(2)根据构成物质的基本粒子来分析;
【解答】1)由分子结构模型可知,每个臭氧分子是由3个氧原子构成的,则臭氧的化学式为O3;氧气是由氧分子构成的,臭氧是由臭氧分子构成的,不同种分子化学性质不同;
(2)由微观图示可知,过氧化氢、臭氧、一氧化氯、氧气四种物质都是由分子构成的。
24.【答案】(1)O2
(2)Al2O3
【知识点】元素的种类与分布;化学式的书写及意义
【解析】【分析】氧气和液氧都是由分子构成的;根据地壳中元素的含量以及化学式的写法来分析。
【解答】(1)氧气和液氧都是氧的单质,都是由O2分子构成的;
(2)地壳中含量最多的非金属元素是氧元素,地壳中含量最高的金属元素是铝元素,在化合物中铝元素显+3价,氧元素显-2价,则二者组成的化合物的化学式为Al2O3。
25.【答案】(1)三;Na+
(2)质子数不同
(3)AlCl3
(4)
【知识点】模型与符号;原子的构成;元素周期表;化学式的书写及意义
【解析】【分析】(1)原子序数等于质子数,可根据质子数判断元素种类。
(2)不同原子的本质区别是质子数不同。
(3)化合物各元素化合价之和为零,金属写在左侧。
(4)氟是9号元素,所以质子数为9,结合题中其它元素的结构示意图画出氟原子的结构示意图。
【解答】(1)D原子中质子数为11,为钠元素,在第三周期。
D质子数为11,核外电子数为10,质子数比电子数多1个,说明该微粒带有一个单位正电荷,符号为:。
(2)质子数决定元素种类,A和B质子数不同,所以元素种类不同,即AB的本质区别是质子数不同。
(3)C是17号元素,为氯元素,C带一个单位负电荷,E为13号元素,属于铝元素,E常见化合价为+3价,组成的化合物为:AlCl3。
(4)氟是9号元素,质子数为9,如图所示。
26.【答案】(1)三;金属
(2)最外层电子数;增加
(3)
【知识点】元素周期表;化学式的书写及意义
【解析】【分析】(1)元素周期表表每一横行表示一个周期,原子电子层数等于周数。“钅”字旁的元素和汞属于金属元素。
(2)同一列属于同一族,由图可知,同组元素最外层电子数相同,电子层数随周期数的增大而增多。
(3)镁是金属元素,写在左侧,氯是非金属元素,写在右侧,注意化合物中各元素化合价之和为零。
【解答】(1)原子序数为13的元素(铝元素)的原子核外电子排布为2、8、3,因此其电子层数为3,在元素周期表中位于第三周期。根据元素分类标准,铝属于典型的金属元素。
(2)通过分析元素结构示意图可总结出以下规律:
同族元素的原子最外层电子数相同;
同一族的元素,其原子从上至下电子层数依次递增。
(3)12号元素镁(Mg)的常见化合价为+2,17号元素氯(Cl)的常见化合价为-1。根据化合价规则,二者形成的化合物化学式为MgCl2(氯化镁)。
(1)原子序数为13的元素(铝元素)的原子核外电子层数是3,位于元素周期表中第三周期,它属于金属元素;
(2)由元素结构示意图信息可得:同族数元素的原子的最外层电子数相同;同一族的元素对应的原子从上往下电子层数在逐渐增加;
(3)12号元素为Mg,常用化合价为+2价,17号元素为Cl,常用化合价为-1价,则Mg与Cl构成的化合物为MgCl2。
27.【答案】(1)质子数不同
(2)NaCl
【知识点】元素的种类与分布;化学式的书写及意义
【解析】【分析】(1)质子数决定元素种类,可知不同元素之间的区别是质子数不同。
(2)根据元素化合价和化合价中各元素化合价之和为零判断化学式,注意金属元素写在左侧。
【解答】(1)元素种类由质子数决定,可知各元素最本质的区别是质子数不同。
(2)11号元素是钠元素,化合价为+1价,17号元素为氯元素,化合价为-1价,则形成的化合物为NaCl。
28.【答案】(1)18
(2)IIA
(3)B
(4)H2O和 H2O2
【知识点】元素的符号及其意义;元素周期表;化学式的书写及意义
【解析】【分析】 化学元素周期表是根据元素原子核电荷数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体、非金属元素、过渡元素等。这使周期表中形成元素分区且分有七主族、七副族、Ⅷ族、18族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
【解答】(1) 第三周期中的稀有气体元素的质子数是 18;稀有气体是最后一列的元素;
(2)元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、IIA族、IIIA族、IVA族、VA族、VIA族、VIIA族表示。同主族元素化学性质相似。X2+的核外电子数目为10,电子是带负电的,所以他有12个带正电的质子,则X在第三周期第IIA族。
(3) 下列各组中的两种元素具有相似化学性质的是 B;同一列上的元素化学性质相似,因为原子的最外层电子数相同;
(4) 核电荷数1-18的非金属元素A和B,可形成原子个数比为2:1的常温下是液态的化合物,写出这种化合物的化学式 H2O和H2O2
故答案为:(1)18(2)IIA(3)B(4)H2O H2O2
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
