浙教版(2024)科学七下期末复习:专题6 化合价的应用(含解析)
文档属性
| 名称 | 浙教版(2024)科学七下期末复习:专题6 化合价的应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 648.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-06-07 10:05:33 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
七下期末复习: 化合价的应用
一、选择题
1.在太空舱里常用NiFe2O4作催化剂将宇航员呼出的二氧化碳转化为氧气。已知NiFe2O4中 Fe元素为+3价,则 Ni元素的化合价为()
A.+1价 B.+2价 C.+3价 D.+4价
2.研究发现,组成物质的元素化合价越高,物质的氧化性越强,则下列含氯物质氧化性最强的是( )
A.KClO B.K C.KClO3 D.KCl
3.硫化锑(Sb2S3)主要用于制造火柴。硫化锑中S的化合价为-2,则Sb的化合价为( )
A.-3 B.-2 C.+2 D.+3
4. 依据氯元素的化合价不同,有关物质按照一定规律可排列为:①NaCl ②Cl2 ③HClO ④X ⑤HClO4,则物质X可能是下列物质中的()
A.FeCl2 B.KClO3 C.KCl D.Cl2O7
5.“84消毒液”的有效成分是次氯酸钠(NaClO)。NaClO中 Na的化合价为+1,0的化合价为-2,则Cl的化合价为( )
A.+1 B.0 C.- 1 D.-3
6.一种新型高效净水剂PAFC(化学式为: 广泛应用于工业污水的处理。该净水剂中铁元素的化合价为( )
A.0 B.+2 C.+3 D.+6
7.缺碘易使人患甲状腺机能亢进,因此在食盐中一般都加入碘这种物质。在碘酸钾中碘的化合价为+5,则碘酸钾的化学式为( )
A.ΚΙΟ B. C. D.
8.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于对元素的化合价不再“感冒”。关于下列物质中氮元素化合价由高到低的排序中正确的是( )
①NO2;②NO;③NH3;④HNO3;⑤NaNO2;⑥N2。
A.④⑤①②⑥③ B.④①⑤②⑥③
C.④①③⑤⑥② D.①④⑤③②⑥
9.某元素R的氧化物相对分子质量为M,其硫酸盐的相对分子质量为N,则该元素的化合价可能是下列关系式中的( )
A. B. C. D.
二、填空题
10. 化合价的规律
⑴在化合物里,氢元素通常显 价,氧元素通常显 价。
⑵金属元素在化合物里通常显 价。
⑶非金属元素与金属元素或氢元素化合时显负价,与氧元素化合时显正价。
⑷单质中元素的化合价为 。
⑸同种元素在不同化合物中可能显不同的化合价,如、。
⑹同种元素在同一化合物中可能显不同的化合价,如
⑺在化合物中,正负化合价的代数和为 。
⑻原子团的化合价一般不等于零,其数值由组成元素的正负化合价的代数和决定。
11.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于对元素的化合价不再“感冒”。请完成常见元素化合价口诀:
钾钠银氢 ,钙镁钡锌 ;
氟氯溴碘 ,通常氧显 ;
铜, 铁, 铝, 硅, 磷;勿忘 是零价。
12.含氮元素的物质与人类生产、生活关系密切。、、、等都是常见的含氮物质,请分别写出其中氮元素的化合价。
(1) ;
(2) ;
(3) ;
(4) 。
13.交警常用装有重铬酸钾(化学式为K2Cr2Ox)的仪器检测司机是否酒后驾车,已知重铬酸钾中钾元素的化合价为+1价,铬元素的化合价为+6价,则化学式中x的值为 。
14.钢铁在生活中应用非常广泛,认识铁的有关知识很有意义。铁有多种氧化物,根据下列信息推断它们的化学式:
(1)某铁的氧化物中铁元素的化合价为+3价,氧元素的化合价为-2价,则该铁的氧化物的化学式为 。
(2)某铁的氧化物的化学式为FexOy,其式量为72,则该铁的氧化物的化学式为 。
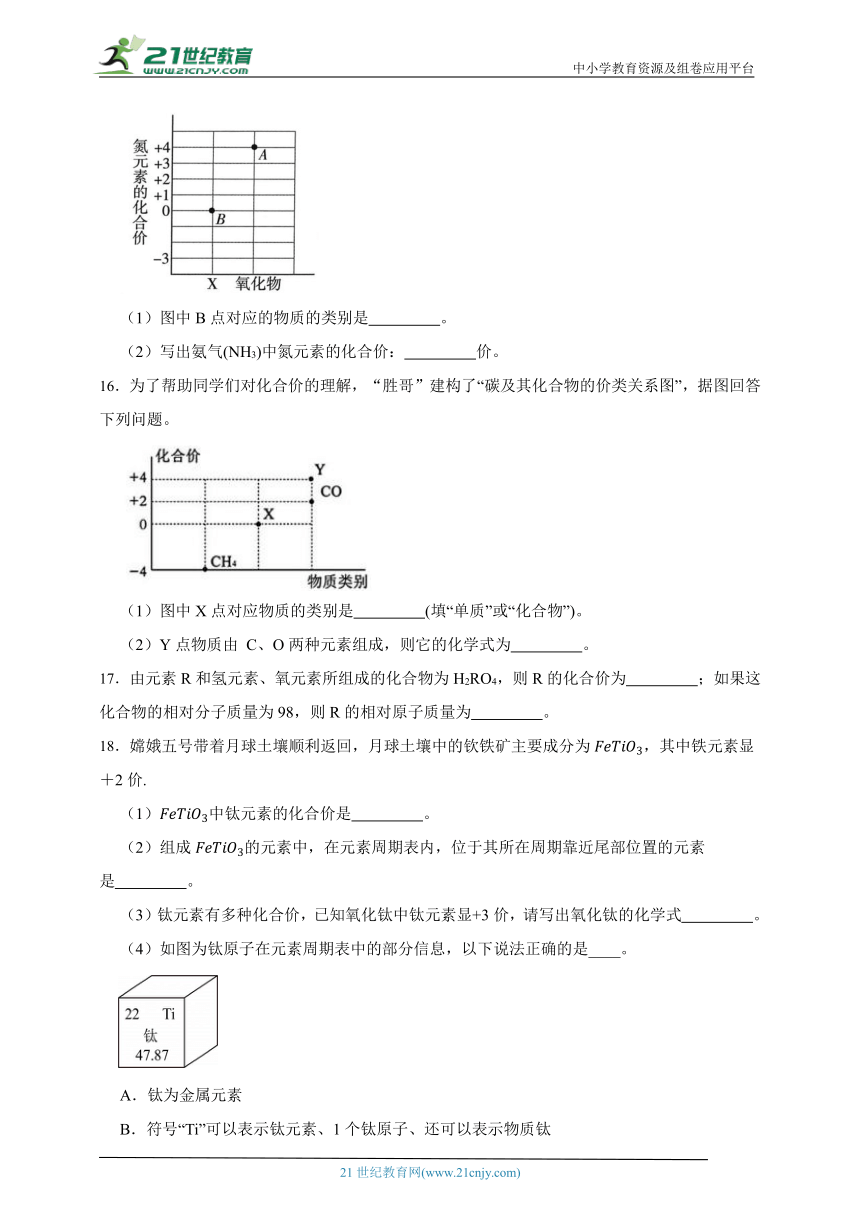
15.为了帮助同学们对化合价的理解,“胜哥”建构了氮及其化合价的价、类关系图。
(1)图中B点对应的物质的类别是 。
(2)写出氨气(NH3)中氮元素的化合价: 价。
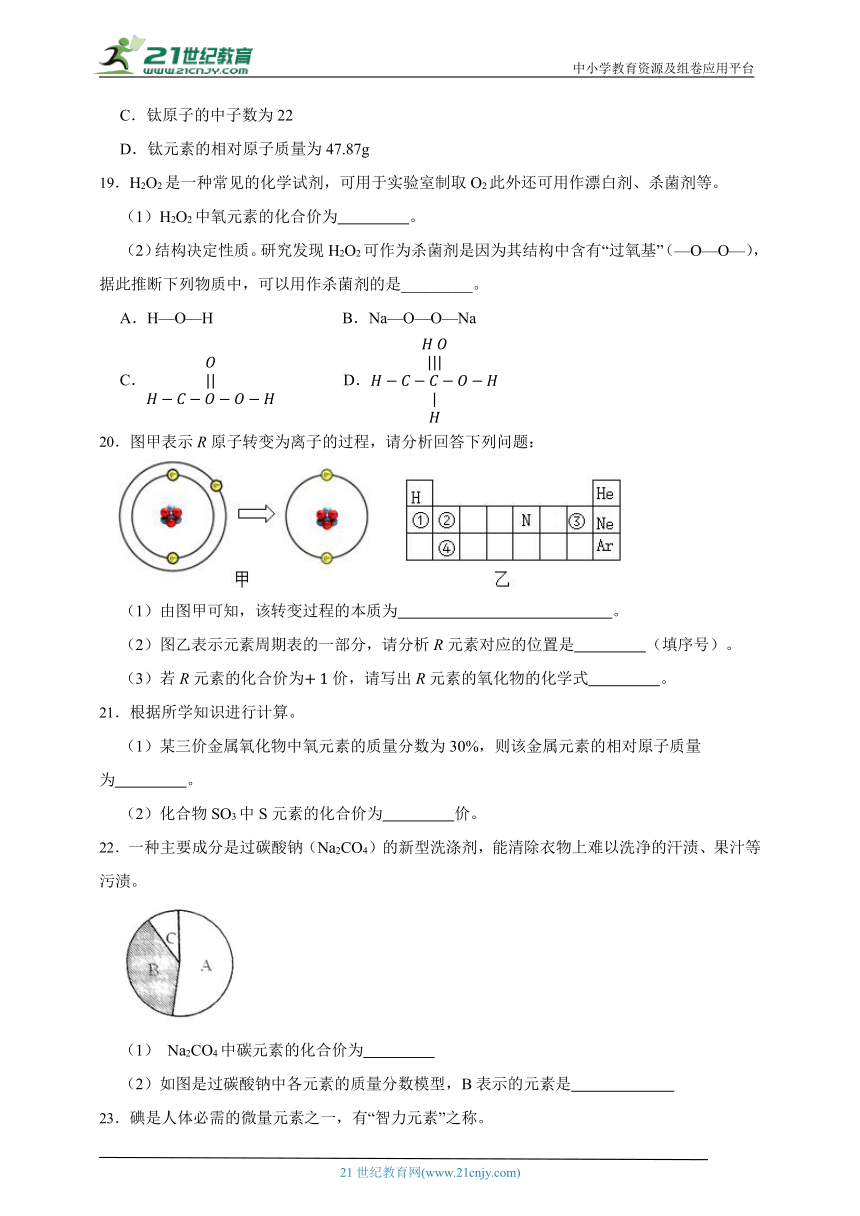
16.为了帮助同学们对化合价的理解,“胜哥”建构了“碳及其化合物的价类关系图”,据图回答下列问题。
(1)图中X点对应物质的类别是 (填“单质”或“化合物”)。
(2)Y点物质由 C、O两种元素组成,则它的化学式为 。
17.由元素R和氢元素、氧元素所组成的化合物为H2RO4,则R的化合价为 ;如果这化合物的相对分子质量为98,则R的相对原子质量为 。
18.嫦娥五号带着月球土壤顺利返回,月球土壤中的钦铁矿主要成分为,其中铁元素显+2价.
(1)中钛元素的化合价是 。
(2)组成的元素中,在元素周期表内,位于其所在周期靠近尾部位置的元素是 。
(3)钛元素有多种化合价,已知氧化钛中钛元素显+3价,请写出氧化钛的化学式 。
(4)如图为钛原子在元素周期表中的部分信息,以下说法正确的是____。
A.钛为金属元素
B.符号“Ti”可以表示钛元素、1个钛原子、还可以表示物质钛
C.钛原子的中子数为22
D.钛元素的相对原子质量为47.87g
19.H2O2是一种常见的化学试剂,可用于实验室制取O2此外还可用作漂白剂、杀菌剂等。
(1)H2O2中氧元素的化合价为 。
(2)结构决定性质。研究发现H2O2可作为杀菌剂是因为其结构中含有“过氧基”(—O—O—),据此推断下列物质中,可以用作杀菌剂的是_________。
A.H—O—H B.Na—O—O—Na
C. D.
20.图甲表示R原子转变为离子的过程,请分析回答下列问题:
(1)由图甲可知,该转变过程的本质为 。
(2)图乙表示元素周期表的一部分,请分析R元素对应的位置是 (填序号)。
(3)若R元素的化合价为价,请写出R元素的氧化物的化学式 。
21.根据所学知识进行计算。
(1)某三价金属氧化物中氧元素的质量分数为30%,则该金属元素的相对原子质量为 。
(2)化合物SO3中S元素的化合价为 价。
22.一种主要成分是过碳酸钠(Na2CO4)的新型洗涤剂,能清除衣物上难以洗净的汗渍、果汁等污渍。
(1) Na2CO4中碳元素的化合价为
(2)如图是过碳酸钠中各元素的质量分数模型,B表示的元素是
23.碘是人体必需的微量元素之一,有“智力元素”之称。
(1)生活中常见的含碘元素的物质为:碘酒—含碘单质I2;碘片和藻类食物—含碘化钾KI;加碘盐—含碘酸钾KIO3。下列关于I2、KI、KIO3中碘元素化合价正确的是 。
A.+1、﹣1、+5 B.0、+1、+5 C.0、﹣1、+5
(2)适当食用加碘盐(含KIO3)可预防碘缺乏,但服用碘酒(含I2)却会引起碘中毒。KIO3和I2性质不同的原因是 。
24.已知有机化合物中,氢元素通常为+1价,氧元素通常为-2价。草酸(H2C2O4)是一种有机化合物,其中碳元素的化合价为 价;尿素[C0(NH2)2也是一种有机化合物,若碳元素的化合价为+4价,则氮元素的化合价为 价。
25. 标出下列物质中各元素的化合价。
CO2 CuO SO2 NO2 K2O NaCl H2
26.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于熟记了元素的化合价。
(1)已知铁的氧化物中通常只有+2、+3两种化合价,氧元素在化合物中通常显-2价,测得铁的某种氧化物晶体的化学式为Fe23O25,则其中Fe2+、Fe3+的粒子个数比为 。
(2)如图所示是四位同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
①选择上述4种元素中的两种,写出所选两种元素组成物质的化学式 。
②上述4种元素的根本区别是 不同。
(3)在一石灰石样品中混有一些不含钙元素的杂质,测定样品中钙元素的质量分数为 36%,则样品中碳酸钙(CaCO3)的质量分数为 。
(4) 已知有Na2S、Na2SO3、Na2SO4三种物质的混合物100g,测得硫的质量分数为32%,则混合物中含氧元素的质量为 。
27.汽车尾气已成为污染空气的主要来源。如图表示治理汽车尾气所涉及反应的微观过程,请根据示意图回答下列问题。
(1)该反应前后化合价没有变化的元素有 。(用符号表示)
(2)尾气处理后生成物有 种;其中产物里单质和化合物的个数比为 。
(3)分析以上微观过程模拟图,从微观角度总结一条规律: 。
28.已知氮的氧化物有①NO②NO2③N2O3④N2O⑤N2O5(下面两小题均填序号)。
(1)请将以上5种氮的氧化物按照氮元素的化合价从高到低的顺序排列为 ;
(2)请将以上5种氮的氧化物按照含氮量从高到低的顺序排列为 。
三、综合题
29.化合价是一个重要的概念。下面是小科对元素化合价的部分探究过程。
【提出问题】元素正负化合价有何规律?
推测一:金属元素在化合物中都显正价。
推测二:非金属元素在化合物中只有负价。
【举例及分析】
(1)NaCl、CuO、Fe2O3中金属元素化合价分别为+1、+2,+3,其他金属在化合物中也都显正价,推测一正确。金属都显正价的可能原因是 (从电子得失角度回答)。
(2)H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4,说明推测二 (填“成立”或“不成立”)。HCl、H2S、CH4中氯、硫、碳元素的化合价分别为﹣1、﹣2、﹣4。
(3)【得出结论】
通过上述探究过程可知:金属元素在化合物中通常显正价,而非金属元素与氧化合时常显正价,与氢化合时常显 价。由此可知NH3中的氮元素显 价。
答案解析部分
1.【答案】B
【知识点】元素化合价的规则与计算
【解析】【分析】化合物的化学式中正负化合价代数和为零。
【解答】已知NiFe2O4中Fe为+3价,氧元素一般显-2价,设镍元素的化合价是,根据在化合物中正负化合价代数和为零,可得:+(+3)×2+(-2)×4=0,则=+2价。
故答案为:B。
2.【答案】C
【知识点】元素化合价的规则与计算
【解析】【分析】根据在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.
【解答】A、钾元素显+1价,氧元素显-2价,设KClO中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价;
B、钾元素显+1价,氧元素显-2价,设KClO3中氯元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y+(-2)×3=0,则y=+5价。
C、钾元素显+1价,氧元素显-2价,设KClO3中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+z+(-2)×4=0,则z=+7价。
D、钾元素显+1价,设KCl中氯元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)+w=0,则w=-1价;
组成物质的元素化合价越高,物质的氧化性越强,则含氯物质氧化性最强的是C。
故答案为:C。
3.【答案】D
【知识点】元素化合价的规则与计算
【解析】【分析】根据化合物中各元素的化合价之和为零进行判断。
【解答】Sb的化合价,解得x=+3。
故答案为:D。
4.【答案】B
【知识点】元素化合价的规则与计算
【解析】【分析】利用化合物中元素的化合价代数和为零的原则和单质中元素的化合价为零,计算出①②③⑤四种物质中Cl元素的化合价,并找出物质排列与Cl元素化合价的关系;经计算后发现①到⑤应该是按Cl元素化合价由低到高进行排列的,则④X中Cl元素化合价应在+1和+7之间。依据这一关系,确定所给选项的四种物质中Cl元素化合价符合这一规律的物质。
【解答】A、设FeCl2中Cl元素化合价a,利用化合物中元素的化合价代数为零,可得(+2)+a×2=0,解得a=-1,Cl元素化合价不在+1和+7之间,A不符合题意;
B、设KClO3中Cl元素化合价b,利用化合物中元素的化合价代数为零,可得(+1)+b+(-2)×3=0,解得b=+5,Cl元素化合价在+1和+7之间,B符合题意;
C、设KCl中Cl元素化合价c,利用化合物中元素的化合价代数为零,可得(+1)+c=0,解得c=-1,Cl元素化合价不在+1和+7之间,C不符合题意;
D、设Cl2O7中Cl元素化合价d,利用化合物中元素的化合价代数为零,可得d×2+(-2)×7=0,解得d=+7,Cl元素化合价不在+1和+7之间,D不符合题意;
故答案为:B。
5.【答案】A
【知识点】元素化合价的规则与计算
【解析】【分析】 根据化合物中正负化合价代数和为零分析。
【解答】 次氯酸钠中钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价。
故选A。
6.【答案】C
【知识点】元素化合价的规则与计算
【解析】【分析】根据在化合物中正负化合价代数和为零,进行解答本题。
【解答】据在化合物中正负化合价代数和为零,可得高效净水剂PAFC中铁元素的化合价为:
(+3)+x+(-1)×n+(-1)×(6-n)=0,
解得 x=+3;
故答案为:C。
7.【答案】C
【知识点】元素化合价的规则与计算;常见元素与原子团的化合价
【解析】【分析】根据在化合物中正负化合价代数和为零,结合各选项的化学式进行解答本题.
【解答】A、钾元素显+1价,设中碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(﹣2)=0,则x=+1价,故错误;
B、钾元素显+1价,氧元素显﹣2价,设KIO2中碘元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y+(﹣2)×2=0,则y=+3价,故错误;
C、钾元素显+1价,氧元素显﹣2价,设KIO3中碘元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+z+(﹣2)×3=0,则z=+5价,故正确;
D、钾元素显+1价,氧元素显﹣2价,设KIO4中碘元素的化合价是m,根据在化合物中正负化合价代数和为零,可得:(+1)+m+(﹣2)×4=0,则m=+7价,故错误。
故答案为:C。
8.【答案】B
【知识点】常见元素与原子团的化合价
【解析】【分析】根据化合价原则和常见元素的化合价,可以计算出物质中氮元素的化合价,再通过比较,就能得出本题的答案。
【解答】①NO2中,氧元素化合价为-2,设二氧化氮中氮元素的化合价为x,根据化合物中元素化合价代数为零,则有:x+(﹣2)×2=0,x=+4;
②NO中,氧元素化合价为-2,设一氧化氮中氮元素的化合价为y,根据化合物中元素化合价代数为零,则有:y+(﹣2)=0,y=+2;
③NH3中,氢元素化合价为+1,设氨气中氮元素的化合价为z,根据化合物中元素化合价代数为零,则有:z+(+1)×3=0,z=-3;
④HNO3中,氧元素化合价为-2,氢元素化合价为+1,设硝酸中氮元素的化合价为w,根据化合物中元素化合价代数为零,则有:(+1)+w+(﹣2)×3=0,w=+5;
⑤NaNO2中,氧元素化合价为-2,钠元素化合价为+1,设亚硝酸钠中氮元素的化合价为m,根据化合物中元素化合价代数为零,则有:(+1)+m+(﹣2)×2=0,m=+3;
⑥单质中元素的化合价为零,氮气为单质;
因此六种物质中氮元素的化合价由高到低的顺序为④①⑤②⑥③。
故答案为:B。
9.【答案】B
【知识点】元素化合价的规则与计算
【解析】【分析】 根据相对分子的质量为组成分子的各原子的相对原子质量之和,
(1)如x为奇数时,氧化物化学式为 R2Ox,硫酸盐的化学式为 R2(SO4)x
(2)x为偶数时,氧化物化学式为 硫酸盐的化学式为,
依据分子量与化学式的关系解答出x 的值即可.
【解答】 设元素R化合价为+x价,相对原子质量为a,(1)如x为奇数时,氧化物化学式为R2Ox,硫酸盐的化学式为R2(SO4)x,据题意有
2a+16x=M
2a+96x=N
解得
(2)x为偶数时,氧化物化学式为 硫酸盐的化学式为,据题意有
a+16×=Ma+96×
=N
解答
故答案为:B。
10.【答案】+1;-2;正;零;零
【知识点】元素化合价的规则与计算
【解析】【分析】根据常见元素的化合价以及化合价的规律分析。
【解答】(1)在化合物里,氢元素通常显+1价,氧元素通常显-2价。
(2)金属元素在化合物里通常显正价。
(3)非金属元素与金属元素或氢元素化合时显负价,与氧元素化合时显正价。
(4)单质中元素的化合价为零。
(7)在化合物中,各元素正负化合价的代数和为零。
11.【答案】正一价;正二价;负一价;负二价;一二;二三;三;四;五价;单质
【知识点】元素化合价的规则与计算
【解析】【分析】根据常见元素化合价口诀分析。
【解答】钾钠银氢正一价,钙镁钡锌正二价;
氟氯溴碘负一价,通常氧显负二价;
一二铜,二三铁,三铝,四硅,五价磷;勿忘单质是零价。
12.【答案】(1)
(2)
(3)
(4)
【知识点】元素化合价的规则与计算
【解析】【分析】(1)单质的化合价均为0,无论是金属单质还是非金属单质。
(2)(3)(4)根据化合物中各元素的化合价之和为零计算所求元素的化合价。
【解答】(1)单质中元素的化合价为0价;N2是氮气单质,N2中氮元素的化合价为0价,表示为:。
(2)在化合物中,氢元素通常显+1价;设NH3中氮元素的化合价为x;根据化合物中各元素正负化合价代数和为0,可得x+(+1)×3=0;解得x= 3。NH3中氮元素的化合价为 3价,表示为:。
(3)在化合物中,氢元素显+1价,氧元素通常显 2价;设HNO3中氮元素的化合价为y。 根据化合物中各元素正负化合价代数和为0,可得(+1)+y+( 2)×3=0,y 5=0,解得y=+5;HNO3中氮元素的化合价为+5价,表示为:。
(4)在化合物中,氧元素显 2价。设NO2中氮元素的化合价为z。 根据化合物中各元素正负化合价代数和为0,可得z+( 2)×2=0,解得z=+4;NO2中氮元素的化合价为+4价,表示为。
(1)单质中元素的化合价为0价;N2是氮气单质,N2中氮元素的化合价为0价,表示为:;
(2)在化合物中,氢元素通常显+1价;设NH3中氮元素的化合价为x;根据化合物中各元素正负化合价代数和为0,可得x+(+1)×3=0;解得x= 3。NH3中氮元素的化合价为 3价,表示为:;
(3)在化合物中,氢元素显+1价,氧元素通常显 2价;设HNO3中氮元素的化合价为y。 根据化合物中各元素正负化合价代数和为0,可得(+1)+y+( 2)×3=0,y 5=0,解得y=+5;HNO3中氮元素的化合价为+5价,表示为:;
(4)在化合物中,氧元素显 2价。设NO2中氮元素的化合价为z。 根据化合物中各元素正负化合价代数和为0,可得z+( 2)×2=0,解得z=+4;NO2中氮元素的化合价为+4价,表示为。
13.【答案】7
【知识点】元素化合价的规则与计算
【解析】【分析】本题可根据化合物中各元素正负化合价代数和为零的原则来计算x的值。
【解答】在K2Cr2Ox中,钾元素的化合价为+1价,铬元素的化合价为+6价,
氧元素的化合价通常为-2价;
则(+1)×2+(+6)×2+(-2)×x =0,:2x = 14;
解得x=7。
14.【答案】(1)Fe2O3
(2)FeO
【知识点】元素化合价的规则与计算;相对原子质量
【解析】【分析】(1)根据化学式中正负化合价代数和为零计算出原子的个数即可;
(2)化学式的式量等于相对原子质量与个数的乘积之和。
【解答】(1)设该氧化物的化学式为 FexOy ,根据正负化合价代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3,那么化学式为:Fe2O3。
(2)根据相对分子质量的定义得到:56x+16y=72,解得:x:y=1:1,那么氧化物的化学式为FeO。
15.【答案】(1)单质
(2)-3
【知识点】单质和化合物的区别;元素化合价的规则与计算
【解析】【分析】(1)根据B 点氮元素的化合价为0价分析。
(2)根据化合物中各元素的化合价的代数和为0分析。
【解答】(1)B 点氮元素的化合价为0价,单质中元素的化合价为0,所以B 点对应的物质为氮气,化学式N2,氮气是由一种元素组成的纯净物,属于单质。
(2)根据在化合物中各元素的正负化合价的代数和为0,氢元素的化合价为+1价,设氮元素的化合价为x,
x+(+1)×3=0
x=-3
所以NH3中氮元素的化合价为-3价。
16.【答案】(1)单质
(2)CO2
【知识点】单质和化合物的区别;化学式的书写及意义;有关化学式的计算和推断;常见元素与原子团的化合价
【解析】【分析】(1)单质的化合价均为零,化合物中各元素的化合价均不为零,总和为零。
(2)只含两种元素,其中一种元素为氧元素的化合物称为氧化物,书写氧化物的化学式时,要将氧元素写在右侧。
【解答】(1)由图可知,X的化合价为0,属于单质。
(2)Y中碳元素的化合价为+4价,氧元素的化合价为-2价,化合物中各元素的化合价之和为零,可知Y的化学式为。
17.【答案】+6;32
【知识点】元素化合价的规则与计算;相对原子质量
【解析】【分析】(1)根据正负化合价代数和为零计算;
(2)相对分子质量等于相对原子质量与个数的乘积之和,据此分析计算。
【解答】(1)在化学式 H2RO4 中,H的化合价为+1,O的化合价为-2,根据正负化合价代数和为零得到:(+1)×2+x+(-2)×4=0,解得:x=+6;
(2)根据相对分子质量的定义得到:1×2+y+16×4=98,解得:y=32。
18.【答案】(1)+4
(2)氧
(3)Ti2O3
(4)A
【知识点】元素周期表;化学式的书写及意义;常见元素与原子团的化合价
【解析】【分析】 (1)根据化合物中各元素的化合价代数和为0规律分析;
(2)根据元素周期表中元素排列的规律进行分析;
(3)根据化合物中各元素的化合价代数和为0规律分析;
(4)根据元素周期表中一格内容中提供的信息进行分析。
【解答】 (1)FeTiO3中,铁元素为+2价,氧元素为-2价,根据化合物中各元素的化合价代数和为0得到:(+2)+x+(-2)×3=0,解得:x=+4,则钛元素的化合价是+4价。
(2)在元素周期表中,每一周期(第一周期除外)都以金属开头,然后逐渐过渡到非金属元素,最后以稀有气体元素结束,组成FeTiO3的元素中,位于其所在周期靠近尾部位置的元素是氧元素;
(3)氧化钛中钛元素显+3价,氧元素为-2价,根据化合价法则可知,氧化钛的化学式Ti2O3;
(4)A.钛字带有“钅“字旁,为金属元素,故A正确;
B.符号“Ti”可以表示钛元素、1个钛原子,还可以表示物质钛,故B正确;
C.元素名称的左上角的数字为原子序数,原子序数=质子数,钛原子的质子数为22,故C错误;
D.钛元素的相对原子质量为47.87,单位为“1”,不是“g”,故D错误。
故选AB。
19.【答案】(1)-1
(2)B;C
【知识点】化学式的书写及意义;元素化合价的规则与计算
【解析】【分析】(1)根据化合物中各元素的代数和为0进行解答;(2)根据题目所给信息进行解答。
【解答】(1)化合物中,各元素的化合价代数和为0,H2O2中,氢元素为+1价,则氧元素的化合价为-1价;
(2)H2O2可作为杀菌剂是因为其结构中含有“过氧基”(),因此可以用作杀菌剂的是BC。
故答案为:(1)-1;(2)BC。
(1)化合物中,各元素的化合价代数和为0,H2O2中,氢元素为+1价,则氧元素的化合价为-1价;
(2)H2O2可作为杀菌剂是因为其结构中含有“过氧基”(),因此可以用作杀菌剂的是BC。
20.【答案】(1)失去原子核外最外层电子
(2)①
(3)R2O
【知识点】分子、原子、离子、元素与物质之间的关系;元素化合价的规则与计算
【解析】【分析】(1)根据甲图分析原子转化为离子的本质;
(2)原子序数=质子数,据此确定R的原子序数,进而确定它在元素周期表中的位置;
(3)根据正负化合价的代数和为零推算氧化物的化学式。
【解答】(1)根据甲图可知,R原子和R离子的区别就在于最外层的那个电子没有了,即转变过程的本质为: 失去原子核外最外层电子 。
(2)根据甲图可知,R原子中有2个质子,则原子序数为2,那么应该在H下面,故选①;
(3)设R的氧化物的化学式为RxOy, 若R元素的化合价为价, 根据正负化合价代数和为零得到:(+1)x+(-2)×y=0,解得:x:y=2:1,则化学式为R2O。
21.【答案】(1)56
(2)+6
【知识点】元素化合价的规则与计算;有关化学式的计算和推断
【解析】【分析】(1)根据所给元素化合价确定原子个数比,由元素质量比为相对原子质量×原子个数之比分析;
(2)根据化合物中元素化合价代数和为0分析。
【解答】(1) 某三价金属氧化物中氧元素的质量分数为30%,氧化物中金属元素原子和氧原子个数比为2:3,设该金属元素的相对原子质量为x,则2x:48=70%:30%,x=56.
(2) 化合物SO3中氧元素化合价为-2价,由化合物中元素化合价代数和为0可知,S元素的化合价为+6价。
故答案为:(1)56;(2)+6。
22.【答案】(1)+6
(2)钠(Na)
【知识点】元素化合价的规则与计算;有关化学式的计算和推断
【解析】【分析】(1)根据化合物中各元素正负化合价的代数和为零原则分析。
(2)在化学式中,元素的质量比等于元素的相对原子质量与原子个数的乘积之比。
【解答】(1)在化合物中,各元素正负化合价的代数和为零,过碳酸钠中钠元素显+1价,氧元素显-2价,设其中碳元素的化合价为x,则:
(+1)×2+x+(-2)×4=0
x=+6。
(2)过碳酸钠中钠、碳、氧元素的质量比=(23×2):12:(16×4)=23:6:32;
可见B表示的元素是钠元素。
23.【答案】C;构成物质的微粒不同
【知识点】分子、原子、离子、元素与物质之间的关系;常见元素与原子团的化合价
【解析】【分析】(1)单质中元素的化合价为0,化合物中各元素的化合价的代数和为0,据此计算元素的化合价即可;
(2)物质的结构决定性质,据此分析解答。
【解答】(1)I2中碘元素为0价;
KI中钾元素为+1价,根据正负化合价代数和为零得到:(+1)+x=0,解得:x=-1,则碘元素为-1价;
KIO3中钾元素为+1价,氧元素为-2价,根据正负化合价代数和为零得到:(+1)+y+(-2)×3=0,解得:y=+5,即碘元素化合价+5价,
所以选C;
(2)KIO3和I2性质不同的原因是因为构成物质的微粒不同而导致的。
24.【答案】+3;-3
【知识点】元素化合价的规则与计算
【解析】【分析】根据在化合物中元素的正负化合价的代数和为0计算。
【解答】草酸中H元素为+1价,O元素为-2价,设其中碳元素的化合价为x,由草酸的化学式为H2C2O4,根据在化合物中元素的正负化合价的代数和为0,则(+1)×2+x×2+(-2)×4=0,x=+3。
尿素(CO(NH2)2)中H元素为+1价,O元素为-2价,C元素为+4价,设氮元素的化合价是y,根据在化合物中元素的正负化合价的代数和为0,则(+4)+(-2)+2y+(+1)×4=0,y=-3。
25.【答案】+4,-2;+2,-2;+4,-2;+4,-2;+1,-2;+1,-1;0
【知识点】元素化合价的规则与计算
【解析】【分析】根据常见元素的化合价以及化合价的表示方法分析。
元素的化合价标注在对应元素符号的正上方,符号在前,数值在后。
【解答】CO2中,碳元素显+4价,氧元素显-2价,所以二氧化碳中碳、氧元素的化合价表示为.
CuO中,铜元素显+2价,氧元素显-2价,所以氧化铜中铜、氧元素的化合价表示为。
SO2中,硫元素显+4价,氧元素显-2价,所以二氧化硫中硫、氧元素的化合价表示为。
NO2中,氮元素显+4价,氧元素显-2价,所以二氧化氮中硫、氧元素的化合价表示为。
K2O中,钾元素显+1价,氧元素显-2价,所以氧化钾中钾、氧元素的化合价表示为。
NaCl中,钠元素显+1价,氯元素显-1价,所以氯化钠中钠、氯元素的化合价表示为。
H2是是一种单质,单质中元素的化合价为零,所以氢气中氢元素的化合价为零表示为。
26.【答案】(1)19:4
(2)Al2O3;质子
(3)90%
(4)22g
【知识点】元素化合价的规则与计算;有关化学式的计算和推断
【解析】【分析】 (1)分析化学式 Fe23O25 ,可知该物质中既含有FeO又含有Fe2O3,可分别设出两者的物质的量利用原子个数比等于角码之比进行分析即可。
(2)根据元素符号的书写方法进行解答;
根据元素是指具有相同质子数的一类原子的总称进行解答。
(3)根据化合物的质量=该化合物中某元素的质量÷该元素的质量分数,进行分析解答.
(4) 通过观察分析Na2S、Na2SO3、Na2SO4三种物质组成会发现:其中的钠原子和硫原子的个数比始终是2:1,也就是说不论Na2S、Na2SO3、Na2SO4三种物质以任意质量比混合,混合物中钠元素与硫元素的质量比都是定值,可求出其质量比;混合物的组成元素有钠、硫、氧三种元素,其中硫的质量分数为32%,由钠元素与硫元素的质量比可以计算出钠元素的质量分数,进而可以求出氧元素的质量分数及氧元素的质量.
【解答】(1) Fe23O25由FeO和Fe2O3组成,设有FeOxmol 有Fe2O3ymol
则两中化合物中Fe与O比为23:25
即(x+2y):(x+3y)=23:25
解得x:y=19:2
则其中Fe2+、Fe3+的粒子个数比为19:(2×2)=19:4
(2)①若选氧元素O和铝元素Al ,铝元素显+3价,氧元素显 2价,根据化合物中各元素化合价代数和为零,组成物质的化学式为Al2O3。
元素的根据区别是质子数不同;
(3)某石灰石样品中含有不含钙元素的杂质,测得该石灰石样品中含钙的质量分数为36%,该样品中碳酸钙的质量分数为
(4) Na2S、Na2SO3、Na2SO4三种物质中,钠原子和硫原子的个数比始终是2:1,也就是说不论Na2S、Na2SO3、Na2SO4三种物质以任意质量比混合,混合物中钠元素与硫元素的质量比都是定值,则混合物中钠元素与硫元素的质量比为(23×2):(32×1)=46:32。
测得硫的质量分数为32%,则混合物中钠元素的质量分数为46%,则混合物中氧元素的质量分数为1-46%-32%=22%。
则混合物中含氧元素的质量为100g×22%=22g.
27.【答案】(1)O
(2)两;1:2
(3)从微观角度看,化学反应前后分子的种类发生了变化,而原子的种类和数目都没有发生变化。
【知识点】单质和化合物的区别;元素化合价的规则与计算;化学反应的实质
【解析】【分析】(1)化合价的计算:根据化合物中各元素化合价代数和为零,单质中元素化合价为零,计算反应前后各元素化合价并对比 。
(2)物质的分类:单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物 。通过微观示意图确定生成物种类及单质、化合物个数 。
(3)化学反应的微观实质:化学反应中分子分裂成原子,原子重新组合成新分子,在这个过程中原子的种类、数目不变 。
【解答】(1)由微观示意图可知 。反应前CO中C元素化合价为+2价,NO中N元素化合价为+2价;反应后N2 中N元素化合价为0价,CO2中C元素化合价为+4价,O元素反应前后化合价均为 2
价,所以该反应前后化合价没有变化的元素是O 。
(2)由化学方程式可知,尾气处理后生成物有N2和CO2两种;其中N2是单质,CO2是化合物,单质和化合物的个数比为1:2。
(3)从微观角度看,化学反应前后分子的种类发生了变化,而原子的种类和数目都没有发生变化。
28.【答案】(1)⑤②③①④
(2)④①③②⑤
【知识点】元素化合价的规则与计算
【解析】【分析】(1)根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各化学式进行解答本题。
(2)首先采用归一法对各物质的化学式进行变形,进而比较各物质中的氧原子个数即可解答。
【解答】 (1)NO中氧元素显-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)=0,则x=+2.
N2O5中氧元素显-2价,设氮元素的化合价是y,据在化合物中正负化合价代数和为零,
可得:2y+(-2)×5=0,则y=+5.
N2O中氧元素显-2价,设氮元素的化合价是z,据在化合物中正负化合价代数和为零,
可得:2z+(-2)=0,则z=+1.
同理,N2O3,NO2,氧元素显-2价,根据在化合物中正负化合价代数和为零,N2O3,NO2中氮元素的化合价分别为+3、+4.
氮元素化合价由低到高的顺序排列为:N2O5 NO2 N2O3 NO N2O;
故答案为:⑤②③①④。
(2)首先将氮的五种氧化物N2O、NO、N2O3、NO2、N2O5进行变形,得到N2O、N2O2、N2O3、N2O4、N2O5,变形后氮原子个数相等,氧原子个数依次增加,含氮量低高到低的顺序排列为:N2O NO N2O3 NO2 N2O5。
故答案为:④①③②⑤。
29.【答案】(1)金属元素在形成化合物时只能失去电子而不能得到电子
(2)不成立
(3)负;—3
【知识点】元素化合价的规则与计算
【解析】【分析】金属元素在形成化合物时只能失去电子而不能得到电子,因此金属元素在化合物中都显正价,而非金属元素在化合物中即有负价也有正价,且一种元素可能有多种化合价,据此进行分析。
【解答】(1)金属元素在形成化合物时只能失去电子而不能得到电子,因此金属元素在化合物中都显正价,推测一正确;
(2)推测二:非金属元素在化合物中只有负价;而H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4,说明非金属元素在化合物中即有负价也有正价,即推测二不成立;
(3)金属元素在形成化合物时只能失去电子而不能得到电子,而非金属元素与氧化合时常显正价,与氢化合时常显负价。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
七下期末复习: 化合价的应用
一、选择题
1.在太空舱里常用NiFe2O4作催化剂将宇航员呼出的二氧化碳转化为氧气。已知NiFe2O4中 Fe元素为+3价,则 Ni元素的化合价为()
A.+1价 B.+2价 C.+3价 D.+4价
2.研究发现,组成物质的元素化合价越高,物质的氧化性越强,则下列含氯物质氧化性最强的是( )
A.KClO B.K C.KClO3 D.KCl
3.硫化锑(Sb2S3)主要用于制造火柴。硫化锑中S的化合价为-2,则Sb的化合价为( )
A.-3 B.-2 C.+2 D.+3
4. 依据氯元素的化合价不同,有关物质按照一定规律可排列为:①NaCl ②Cl2 ③HClO ④X ⑤HClO4,则物质X可能是下列物质中的()
A.FeCl2 B.KClO3 C.KCl D.Cl2O7
5.“84消毒液”的有效成分是次氯酸钠(NaClO)。NaClO中 Na的化合价为+1,0的化合价为-2,则Cl的化合价为( )
A.+1 B.0 C.- 1 D.-3
6.一种新型高效净水剂PAFC(化学式为: 广泛应用于工业污水的处理。该净水剂中铁元素的化合价为( )
A.0 B.+2 C.+3 D.+6
7.缺碘易使人患甲状腺机能亢进,因此在食盐中一般都加入碘这种物质。在碘酸钾中碘的化合价为+5,则碘酸钾的化学式为( )
A.ΚΙΟ B. C. D.
8.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于对元素的化合价不再“感冒”。关于下列物质中氮元素化合价由高到低的排序中正确的是( )
①NO2;②NO;③NH3;④HNO3;⑤NaNO2;⑥N2。
A.④⑤①②⑥③ B.④①⑤②⑥③
C.④①③⑤⑥② D.①④⑤③②⑥
9.某元素R的氧化物相对分子质量为M,其硫酸盐的相对分子质量为N,则该元素的化合价可能是下列关系式中的( )
A. B. C. D.
二、填空题
10. 化合价的规律
⑴在化合物里,氢元素通常显 价,氧元素通常显 价。
⑵金属元素在化合物里通常显 价。
⑶非金属元素与金属元素或氢元素化合时显负价,与氧元素化合时显正价。
⑷单质中元素的化合价为 。
⑸同种元素在不同化合物中可能显不同的化合价,如、。
⑹同种元素在同一化合物中可能显不同的化合价,如
⑺在化合物中,正负化合价的代数和为 。
⑻原子团的化合价一般不等于零,其数值由组成元素的正负化合价的代数和决定。
11.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于对元素的化合价不再“感冒”。请完成常见元素化合价口诀:
钾钠银氢 ,钙镁钡锌 ;
氟氯溴碘 ,通常氧显 ;
铜, 铁, 铝, 硅, 磷;勿忘 是零价。
12.含氮元素的物质与人类生产、生活关系密切。、、、等都是常见的含氮物质,请分别写出其中氮元素的化合价。
(1) ;
(2) ;
(3) ;
(4) 。
13.交警常用装有重铬酸钾(化学式为K2Cr2Ox)的仪器检测司机是否酒后驾车,已知重铬酸钾中钾元素的化合价为+1价,铬元素的化合价为+6价,则化学式中x的值为 。
14.钢铁在生活中应用非常广泛,认识铁的有关知识很有意义。铁有多种氧化物,根据下列信息推断它们的化学式:
(1)某铁的氧化物中铁元素的化合价为+3价,氧元素的化合价为-2价,则该铁的氧化物的化学式为 。
(2)某铁的氧化物的化学式为FexOy,其式量为72,则该铁的氧化物的化学式为 。
15.为了帮助同学们对化合价的理解,“胜哥”建构了氮及其化合价的价、类关系图。
(1)图中B点对应的物质的类别是 。
(2)写出氨气(NH3)中氮元素的化合价: 价。
16.为了帮助同学们对化合价的理解,“胜哥”建构了“碳及其化合物的价类关系图”,据图回答下列问题。
(1)图中X点对应物质的类别是 (填“单质”或“化合物”)。
(2)Y点物质由 C、O两种元素组成,则它的化学式为 。
17.由元素R和氢元素、氧元素所组成的化合物为H2RO4,则R的化合价为 ;如果这化合物的相对分子质量为98,则R的相对原子质量为 。
18.嫦娥五号带着月球土壤顺利返回,月球土壤中的钦铁矿主要成分为,其中铁元素显+2价.
(1)中钛元素的化合价是 。
(2)组成的元素中,在元素周期表内,位于其所在周期靠近尾部位置的元素是 。
(3)钛元素有多种化合价,已知氧化钛中钛元素显+3价,请写出氧化钛的化学式 。
(4)如图为钛原子在元素周期表中的部分信息,以下说法正确的是____。
A.钛为金属元素
B.符号“Ti”可以表示钛元素、1个钛原子、还可以表示物质钛
C.钛原子的中子数为22
D.钛元素的相对原子质量为47.87g
19.H2O2是一种常见的化学试剂,可用于实验室制取O2此外还可用作漂白剂、杀菌剂等。
(1)H2O2中氧元素的化合价为 。
(2)结构决定性质。研究发现H2O2可作为杀菌剂是因为其结构中含有“过氧基”(—O—O—),据此推断下列物质中,可以用作杀菌剂的是_________。
A.H—O—H B.Na—O—O—Na
C. D.
20.图甲表示R原子转变为离子的过程,请分析回答下列问题:
(1)由图甲可知,该转变过程的本质为 。
(2)图乙表示元素周期表的一部分,请分析R元素对应的位置是 (填序号)。
(3)若R元素的化合价为价,请写出R元素的氧化物的化学式 。
21.根据所学知识进行计算。
(1)某三价金属氧化物中氧元素的质量分数为30%,则该金属元素的相对原子质量为 。
(2)化合物SO3中S元素的化合价为 价。
22.一种主要成分是过碳酸钠(Na2CO4)的新型洗涤剂,能清除衣物上难以洗净的汗渍、果汁等污渍。
(1) Na2CO4中碳元素的化合价为
(2)如图是过碳酸钠中各元素的质量分数模型,B表示的元素是
23.碘是人体必需的微量元素之一,有“智力元素”之称。
(1)生活中常见的含碘元素的物质为:碘酒—含碘单质I2;碘片和藻类食物—含碘化钾KI;加碘盐—含碘酸钾KIO3。下列关于I2、KI、KIO3中碘元素化合价正确的是 。
A.+1、﹣1、+5 B.0、+1、+5 C.0、﹣1、+5
(2)适当食用加碘盐(含KIO3)可预防碘缺乏,但服用碘酒(含I2)却会引起碘中毒。KIO3和I2性质不同的原因是 。
24.已知有机化合物中,氢元素通常为+1价,氧元素通常为-2价。草酸(H2C2O4)是一种有机化合物,其中碳元素的化合价为 价;尿素[C0(NH2)2也是一种有机化合物,若碳元素的化合价为+4价,则氮元素的化合价为 价。
25. 标出下列物质中各元素的化合价。
CO2 CuO SO2 NO2 K2O NaCl H2
26.小科通过微信公众号“胜哥课程”观看了《化合价之歌》科学视频,终于熟记了元素的化合价。
(1)已知铁的氧化物中通常只有+2、+3两种化合价,氧元素在化合物中通常显-2价,测得铁的某种氧化物晶体的化学式为Fe23O25,则其中Fe2+、Fe3+的粒子个数比为 。
(2)如图所示是四位同学替4种元素进行的自我介绍,请你根据所学知识回答下列问题。
①选择上述4种元素中的两种,写出所选两种元素组成物质的化学式 。
②上述4种元素的根本区别是 不同。
(3)在一石灰石样品中混有一些不含钙元素的杂质,测定样品中钙元素的质量分数为 36%,则样品中碳酸钙(CaCO3)的质量分数为 。
(4) 已知有Na2S、Na2SO3、Na2SO4三种物质的混合物100g,测得硫的质量分数为32%,则混合物中含氧元素的质量为 。
27.汽车尾气已成为污染空气的主要来源。如图表示治理汽车尾气所涉及反应的微观过程,请根据示意图回答下列问题。
(1)该反应前后化合价没有变化的元素有 。(用符号表示)
(2)尾气处理后生成物有 种;其中产物里单质和化合物的个数比为 。
(3)分析以上微观过程模拟图,从微观角度总结一条规律: 。
28.已知氮的氧化物有①NO②NO2③N2O3④N2O⑤N2O5(下面两小题均填序号)。
(1)请将以上5种氮的氧化物按照氮元素的化合价从高到低的顺序排列为 ;
(2)请将以上5种氮的氧化物按照含氮量从高到低的顺序排列为 。
三、综合题
29.化合价是一个重要的概念。下面是小科对元素化合价的部分探究过程。
【提出问题】元素正负化合价有何规律?
推测一:金属元素在化合物中都显正价。
推测二:非金属元素在化合物中只有负价。
【举例及分析】
(1)NaCl、CuO、Fe2O3中金属元素化合价分别为+1、+2,+3,其他金属在化合物中也都显正价,推测一正确。金属都显正价的可能原因是 (从电子得失角度回答)。
(2)H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4,说明推测二 (填“成立”或“不成立”)。HCl、H2S、CH4中氯、硫、碳元素的化合价分别为﹣1、﹣2、﹣4。
(3)【得出结论】
通过上述探究过程可知:金属元素在化合物中通常显正价,而非金属元素与氧化合时常显正价,与氢化合时常显 价。由此可知NH3中的氮元素显 价。
答案解析部分
1.【答案】B
【知识点】元素化合价的规则与计算
【解析】【分析】化合物的化学式中正负化合价代数和为零。
【解答】已知NiFe2O4中Fe为+3价,氧元素一般显-2价,设镍元素的化合价是,根据在化合物中正负化合价代数和为零,可得:+(+3)×2+(-2)×4=0,则=+2价。
故答案为:B。
2.【答案】C
【知识点】元素化合价的规则与计算
【解析】【分析】根据在化合物中正负化合价代数和为零,结合各选项中的化学式进行解答本题.
【解答】A、钾元素显+1价,氧元素显-2价,设KClO中氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价;
B、钾元素显+1价,氧元素显-2价,设KClO3中氯元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y+(-2)×3=0,则y=+5价。
C、钾元素显+1价,氧元素显-2价,设KClO3中氯元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+z+(-2)×4=0,则z=+7价。
D、钾元素显+1价,设KCl中氯元素的化合价是w,根据在化合物中正负化合价代数和为零,可得:(+1)+w=0,则w=-1价;
组成物质的元素化合价越高,物质的氧化性越强,则含氯物质氧化性最强的是C。
故答案为:C。
3.【答案】D
【知识点】元素化合价的规则与计算
【解析】【分析】根据化合物中各元素的化合价之和为零进行判断。
【解答】Sb的化合价,解得x=+3。
故答案为:D。
4.【答案】B
【知识点】元素化合价的规则与计算
【解析】【分析】利用化合物中元素的化合价代数和为零的原则和单质中元素的化合价为零,计算出①②③⑤四种物质中Cl元素的化合价,并找出物质排列与Cl元素化合价的关系;经计算后发现①到⑤应该是按Cl元素化合价由低到高进行排列的,则④X中Cl元素化合价应在+1和+7之间。依据这一关系,确定所给选项的四种物质中Cl元素化合价符合这一规律的物质。
【解答】A、设FeCl2中Cl元素化合价a,利用化合物中元素的化合价代数为零,可得(+2)+a×2=0,解得a=-1,Cl元素化合价不在+1和+7之间,A不符合题意;
B、设KClO3中Cl元素化合价b,利用化合物中元素的化合价代数为零,可得(+1)+b+(-2)×3=0,解得b=+5,Cl元素化合价在+1和+7之间,B符合题意;
C、设KCl中Cl元素化合价c,利用化合物中元素的化合价代数为零,可得(+1)+c=0,解得c=-1,Cl元素化合价不在+1和+7之间,C不符合题意;
D、设Cl2O7中Cl元素化合价d,利用化合物中元素的化合价代数为零,可得d×2+(-2)×7=0,解得d=+7,Cl元素化合价不在+1和+7之间,D不符合题意;
故答案为:B。
5.【答案】A
【知识点】元素化合价的规则与计算
【解析】【分析】 根据化合物中正负化合价代数和为零分析。
【解答】 次氯酸钠中钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)=0,则x=+1价。
故选A。
6.【答案】C
【知识点】元素化合价的规则与计算
【解析】【分析】根据在化合物中正负化合价代数和为零,进行解答本题。
【解答】据在化合物中正负化合价代数和为零,可得高效净水剂PAFC中铁元素的化合价为:
(+3)+x+(-1)×n+(-1)×(6-n)=0,
解得 x=+3;
故答案为:C。
7.【答案】C
【知识点】元素化合价的规则与计算;常见元素与原子团的化合价
【解析】【分析】根据在化合物中正负化合价代数和为零,结合各选项的化学式进行解答本题.
【解答】A、钾元素显+1价,设中碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(﹣2)=0,则x=+1价,故错误;
B、钾元素显+1价,氧元素显﹣2价,设KIO2中碘元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)+y+(﹣2)×2=0,则y=+3价,故错误;
C、钾元素显+1价,氧元素显﹣2价,设KIO3中碘元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+1)+z+(﹣2)×3=0,则z=+5价,故正确;
D、钾元素显+1价,氧元素显﹣2价,设KIO4中碘元素的化合价是m,根据在化合物中正负化合价代数和为零,可得:(+1)+m+(﹣2)×4=0,则m=+7价,故错误。
故答案为:C。
8.【答案】B
【知识点】常见元素与原子团的化合价
【解析】【分析】根据化合价原则和常见元素的化合价,可以计算出物质中氮元素的化合价,再通过比较,就能得出本题的答案。
【解答】①NO2中,氧元素化合价为-2,设二氧化氮中氮元素的化合价为x,根据化合物中元素化合价代数为零,则有:x+(﹣2)×2=0,x=+4;
②NO中,氧元素化合价为-2,设一氧化氮中氮元素的化合价为y,根据化合物中元素化合价代数为零,则有:y+(﹣2)=0,y=+2;
③NH3中,氢元素化合价为+1,设氨气中氮元素的化合价为z,根据化合物中元素化合价代数为零,则有:z+(+1)×3=0,z=-3;
④HNO3中,氧元素化合价为-2,氢元素化合价为+1,设硝酸中氮元素的化合价为w,根据化合物中元素化合价代数为零,则有:(+1)+w+(﹣2)×3=0,w=+5;
⑤NaNO2中,氧元素化合价为-2,钠元素化合价为+1,设亚硝酸钠中氮元素的化合价为m,根据化合物中元素化合价代数为零,则有:(+1)+m+(﹣2)×2=0,m=+3;
⑥单质中元素的化合价为零,氮气为单质;
因此六种物质中氮元素的化合价由高到低的顺序为④①⑤②⑥③。
故答案为:B。
9.【答案】B
【知识点】元素化合价的规则与计算
【解析】【分析】 根据相对分子的质量为组成分子的各原子的相对原子质量之和,
(1)如x为奇数时,氧化物化学式为 R2Ox,硫酸盐的化学式为 R2(SO4)x
(2)x为偶数时,氧化物化学式为 硫酸盐的化学式为,
依据分子量与化学式的关系解答出x 的值即可.
【解答】 设元素R化合价为+x价,相对原子质量为a,(1)如x为奇数时,氧化物化学式为R2Ox,硫酸盐的化学式为R2(SO4)x,据题意有
2a+16x=M
2a+96x=N
解得
(2)x为偶数时,氧化物化学式为 硫酸盐的化学式为,据题意有
a+16×=Ma+96×
=N
解答
故答案为:B。
10.【答案】+1;-2;正;零;零
【知识点】元素化合价的规则与计算
【解析】【分析】根据常见元素的化合价以及化合价的规律分析。
【解答】(1)在化合物里,氢元素通常显+1价,氧元素通常显-2价。
(2)金属元素在化合物里通常显正价。
(3)非金属元素与金属元素或氢元素化合时显负价,与氧元素化合时显正价。
(4)单质中元素的化合价为零。
(7)在化合物中,各元素正负化合价的代数和为零。
11.【答案】正一价;正二价;负一价;负二价;一二;二三;三;四;五价;单质
【知识点】元素化合价的规则与计算
【解析】【分析】根据常见元素化合价口诀分析。
【解答】钾钠银氢正一价,钙镁钡锌正二价;
氟氯溴碘负一价,通常氧显负二价;
一二铜,二三铁,三铝,四硅,五价磷;勿忘单质是零价。
12.【答案】(1)
(2)
(3)
(4)
【知识点】元素化合价的规则与计算
【解析】【分析】(1)单质的化合价均为0,无论是金属单质还是非金属单质。
(2)(3)(4)根据化合物中各元素的化合价之和为零计算所求元素的化合价。
【解答】(1)单质中元素的化合价为0价;N2是氮气单质,N2中氮元素的化合价为0价,表示为:。
(2)在化合物中,氢元素通常显+1价;设NH3中氮元素的化合价为x;根据化合物中各元素正负化合价代数和为0,可得x+(+1)×3=0;解得x= 3。NH3中氮元素的化合价为 3价,表示为:。
(3)在化合物中,氢元素显+1价,氧元素通常显 2价;设HNO3中氮元素的化合价为y。 根据化合物中各元素正负化合价代数和为0,可得(+1)+y+( 2)×3=0,y 5=0,解得y=+5;HNO3中氮元素的化合价为+5价,表示为:。
(4)在化合物中,氧元素显 2价。设NO2中氮元素的化合价为z。 根据化合物中各元素正负化合价代数和为0,可得z+( 2)×2=0,解得z=+4;NO2中氮元素的化合价为+4价,表示为。
(1)单质中元素的化合价为0价;N2是氮气单质,N2中氮元素的化合价为0价,表示为:;
(2)在化合物中,氢元素通常显+1价;设NH3中氮元素的化合价为x;根据化合物中各元素正负化合价代数和为0,可得x+(+1)×3=0;解得x= 3。NH3中氮元素的化合价为 3价,表示为:;
(3)在化合物中,氢元素显+1价,氧元素通常显 2价;设HNO3中氮元素的化合价为y。 根据化合物中各元素正负化合价代数和为0,可得(+1)+y+( 2)×3=0,y 5=0,解得y=+5;HNO3中氮元素的化合价为+5价,表示为:;
(4)在化合物中,氧元素显 2价。设NO2中氮元素的化合价为z。 根据化合物中各元素正负化合价代数和为0,可得z+( 2)×2=0,解得z=+4;NO2中氮元素的化合价为+4价,表示为。
13.【答案】7
【知识点】元素化合价的规则与计算
【解析】【分析】本题可根据化合物中各元素正负化合价代数和为零的原则来计算x的值。
【解答】在K2Cr2Ox中,钾元素的化合价为+1价,铬元素的化合价为+6价,
氧元素的化合价通常为-2价;
则(+1)×2+(+6)×2+(-2)×x =0,:2x = 14;
解得x=7。
14.【答案】(1)Fe2O3
(2)FeO
【知识点】元素化合价的规则与计算;相对原子质量
【解析】【分析】(1)根据化学式中正负化合价代数和为零计算出原子的个数即可;
(2)化学式的式量等于相对原子质量与个数的乘积之和。
【解答】(1)设该氧化物的化学式为 FexOy ,根据正负化合价代数和为零得到:(+3)x+(-2)y=0,解得:x:y=2:3,那么化学式为:Fe2O3。
(2)根据相对分子质量的定义得到:56x+16y=72,解得:x:y=1:1,那么氧化物的化学式为FeO。
15.【答案】(1)单质
(2)-3
【知识点】单质和化合物的区别;元素化合价的规则与计算
【解析】【分析】(1)根据B 点氮元素的化合价为0价分析。
(2)根据化合物中各元素的化合价的代数和为0分析。
【解答】(1)B 点氮元素的化合价为0价,单质中元素的化合价为0,所以B 点对应的物质为氮气,化学式N2,氮气是由一种元素组成的纯净物,属于单质。
(2)根据在化合物中各元素的正负化合价的代数和为0,氢元素的化合价为+1价,设氮元素的化合价为x,
x+(+1)×3=0
x=-3
所以NH3中氮元素的化合价为-3价。
16.【答案】(1)单质
(2)CO2
【知识点】单质和化合物的区别;化学式的书写及意义;有关化学式的计算和推断;常见元素与原子团的化合价
【解析】【分析】(1)单质的化合价均为零,化合物中各元素的化合价均不为零,总和为零。
(2)只含两种元素,其中一种元素为氧元素的化合物称为氧化物,书写氧化物的化学式时,要将氧元素写在右侧。
【解答】(1)由图可知,X的化合价为0,属于单质。
(2)Y中碳元素的化合价为+4价,氧元素的化合价为-2价,化合物中各元素的化合价之和为零,可知Y的化学式为。
17.【答案】+6;32
【知识点】元素化合价的规则与计算;相对原子质量
【解析】【分析】(1)根据正负化合价代数和为零计算;
(2)相对分子质量等于相对原子质量与个数的乘积之和,据此分析计算。
【解答】(1)在化学式 H2RO4 中,H的化合价为+1,O的化合价为-2,根据正负化合价代数和为零得到:(+1)×2+x+(-2)×4=0,解得:x=+6;
(2)根据相对分子质量的定义得到:1×2+y+16×4=98,解得:y=32。
18.【答案】(1)+4
(2)氧
(3)Ti2O3
(4)A
【知识点】元素周期表;化学式的书写及意义;常见元素与原子团的化合价
【解析】【分析】 (1)根据化合物中各元素的化合价代数和为0规律分析;
(2)根据元素周期表中元素排列的规律进行分析;
(3)根据化合物中各元素的化合价代数和为0规律分析;
(4)根据元素周期表中一格内容中提供的信息进行分析。
【解答】 (1)FeTiO3中,铁元素为+2价,氧元素为-2价,根据化合物中各元素的化合价代数和为0得到:(+2)+x+(-2)×3=0,解得:x=+4,则钛元素的化合价是+4价。
(2)在元素周期表中,每一周期(第一周期除外)都以金属开头,然后逐渐过渡到非金属元素,最后以稀有气体元素结束,组成FeTiO3的元素中,位于其所在周期靠近尾部位置的元素是氧元素;
(3)氧化钛中钛元素显+3价,氧元素为-2价,根据化合价法则可知,氧化钛的化学式Ti2O3;
(4)A.钛字带有“钅“字旁,为金属元素,故A正确;
B.符号“Ti”可以表示钛元素、1个钛原子,还可以表示物质钛,故B正确;
C.元素名称的左上角的数字为原子序数,原子序数=质子数,钛原子的质子数为22,故C错误;
D.钛元素的相对原子质量为47.87,单位为“1”,不是“g”,故D错误。
故选AB。
19.【答案】(1)-1
(2)B;C
【知识点】化学式的书写及意义;元素化合价的规则与计算
【解析】【分析】(1)根据化合物中各元素的代数和为0进行解答;(2)根据题目所给信息进行解答。
【解答】(1)化合物中,各元素的化合价代数和为0,H2O2中,氢元素为+1价,则氧元素的化合价为-1价;
(2)H2O2可作为杀菌剂是因为其结构中含有“过氧基”(),因此可以用作杀菌剂的是BC。
故答案为:(1)-1;(2)BC。
(1)化合物中,各元素的化合价代数和为0,H2O2中,氢元素为+1价,则氧元素的化合价为-1价;
(2)H2O2可作为杀菌剂是因为其结构中含有“过氧基”(),因此可以用作杀菌剂的是BC。
20.【答案】(1)失去原子核外最外层电子
(2)①
(3)R2O
【知识点】分子、原子、离子、元素与物质之间的关系;元素化合价的规则与计算
【解析】【分析】(1)根据甲图分析原子转化为离子的本质;
(2)原子序数=质子数,据此确定R的原子序数,进而确定它在元素周期表中的位置;
(3)根据正负化合价的代数和为零推算氧化物的化学式。
【解答】(1)根据甲图可知,R原子和R离子的区别就在于最外层的那个电子没有了,即转变过程的本质为: 失去原子核外最外层电子 。
(2)根据甲图可知,R原子中有2个质子,则原子序数为2,那么应该在H下面,故选①;
(3)设R的氧化物的化学式为RxOy, 若R元素的化合价为价, 根据正负化合价代数和为零得到:(+1)x+(-2)×y=0,解得:x:y=2:1,则化学式为R2O。
21.【答案】(1)56
(2)+6
【知识点】元素化合价的规则与计算;有关化学式的计算和推断
【解析】【分析】(1)根据所给元素化合价确定原子个数比,由元素质量比为相对原子质量×原子个数之比分析;
(2)根据化合物中元素化合价代数和为0分析。
【解答】(1) 某三价金属氧化物中氧元素的质量分数为30%,氧化物中金属元素原子和氧原子个数比为2:3,设该金属元素的相对原子质量为x,则2x:48=70%:30%,x=56.
(2) 化合物SO3中氧元素化合价为-2价,由化合物中元素化合价代数和为0可知,S元素的化合价为+6价。
故答案为:(1)56;(2)+6。
22.【答案】(1)+6
(2)钠(Na)
【知识点】元素化合价的规则与计算;有关化学式的计算和推断
【解析】【分析】(1)根据化合物中各元素正负化合价的代数和为零原则分析。
(2)在化学式中,元素的质量比等于元素的相对原子质量与原子个数的乘积之比。
【解答】(1)在化合物中,各元素正负化合价的代数和为零,过碳酸钠中钠元素显+1价,氧元素显-2价,设其中碳元素的化合价为x,则:
(+1)×2+x+(-2)×4=0
x=+6。
(2)过碳酸钠中钠、碳、氧元素的质量比=(23×2):12:(16×4)=23:6:32;
可见B表示的元素是钠元素。
23.【答案】C;构成物质的微粒不同
【知识点】分子、原子、离子、元素与物质之间的关系;常见元素与原子团的化合价
【解析】【分析】(1)单质中元素的化合价为0,化合物中各元素的化合价的代数和为0,据此计算元素的化合价即可;
(2)物质的结构决定性质,据此分析解答。
【解答】(1)I2中碘元素为0价;
KI中钾元素为+1价,根据正负化合价代数和为零得到:(+1)+x=0,解得:x=-1,则碘元素为-1价;
KIO3中钾元素为+1价,氧元素为-2价,根据正负化合价代数和为零得到:(+1)+y+(-2)×3=0,解得:y=+5,即碘元素化合价+5价,
所以选C;
(2)KIO3和I2性质不同的原因是因为构成物质的微粒不同而导致的。
24.【答案】+3;-3
【知识点】元素化合价的规则与计算
【解析】【分析】根据在化合物中元素的正负化合价的代数和为0计算。
【解答】草酸中H元素为+1价,O元素为-2价,设其中碳元素的化合价为x,由草酸的化学式为H2C2O4,根据在化合物中元素的正负化合价的代数和为0,则(+1)×2+x×2+(-2)×4=0,x=+3。
尿素(CO(NH2)2)中H元素为+1价,O元素为-2价,C元素为+4价,设氮元素的化合价是y,根据在化合物中元素的正负化合价的代数和为0,则(+4)+(-2)+2y+(+1)×4=0,y=-3。
25.【答案】+4,-2;+2,-2;+4,-2;+4,-2;+1,-2;+1,-1;0
【知识点】元素化合价的规则与计算
【解析】【分析】根据常见元素的化合价以及化合价的表示方法分析。
元素的化合价标注在对应元素符号的正上方,符号在前,数值在后。
【解答】CO2中,碳元素显+4价,氧元素显-2价,所以二氧化碳中碳、氧元素的化合价表示为.
CuO中,铜元素显+2价,氧元素显-2价,所以氧化铜中铜、氧元素的化合价表示为。
SO2中,硫元素显+4价,氧元素显-2价,所以二氧化硫中硫、氧元素的化合价表示为。
NO2中,氮元素显+4价,氧元素显-2价,所以二氧化氮中硫、氧元素的化合价表示为。
K2O中,钾元素显+1价,氧元素显-2价,所以氧化钾中钾、氧元素的化合价表示为。
NaCl中,钠元素显+1价,氯元素显-1价,所以氯化钠中钠、氯元素的化合价表示为。
H2是是一种单质,单质中元素的化合价为零,所以氢气中氢元素的化合价为零表示为。
26.【答案】(1)19:4
(2)Al2O3;质子
(3)90%
(4)22g
【知识点】元素化合价的规则与计算;有关化学式的计算和推断
【解析】【分析】 (1)分析化学式 Fe23O25 ,可知该物质中既含有FeO又含有Fe2O3,可分别设出两者的物质的量利用原子个数比等于角码之比进行分析即可。
(2)根据元素符号的书写方法进行解答;
根据元素是指具有相同质子数的一类原子的总称进行解答。
(3)根据化合物的质量=该化合物中某元素的质量÷该元素的质量分数,进行分析解答.
(4) 通过观察分析Na2S、Na2SO3、Na2SO4三种物质组成会发现:其中的钠原子和硫原子的个数比始终是2:1,也就是说不论Na2S、Na2SO3、Na2SO4三种物质以任意质量比混合,混合物中钠元素与硫元素的质量比都是定值,可求出其质量比;混合物的组成元素有钠、硫、氧三种元素,其中硫的质量分数为32%,由钠元素与硫元素的质量比可以计算出钠元素的质量分数,进而可以求出氧元素的质量分数及氧元素的质量.
【解答】(1) Fe23O25由FeO和Fe2O3组成,设有FeOxmol 有Fe2O3ymol
则两中化合物中Fe与O比为23:25
即(x+2y):(x+3y)=23:25
解得x:y=19:2
则其中Fe2+、Fe3+的粒子个数比为19:(2×2)=19:4
(2)①若选氧元素O和铝元素Al ,铝元素显+3价,氧元素显 2价,根据化合物中各元素化合价代数和为零,组成物质的化学式为Al2O3。
元素的根据区别是质子数不同;
(3)某石灰石样品中含有不含钙元素的杂质,测得该石灰石样品中含钙的质量分数为36%,该样品中碳酸钙的质量分数为
(4) Na2S、Na2SO3、Na2SO4三种物质中,钠原子和硫原子的个数比始终是2:1,也就是说不论Na2S、Na2SO3、Na2SO4三种物质以任意质量比混合,混合物中钠元素与硫元素的质量比都是定值,则混合物中钠元素与硫元素的质量比为(23×2):(32×1)=46:32。
测得硫的质量分数为32%,则混合物中钠元素的质量分数为46%,则混合物中氧元素的质量分数为1-46%-32%=22%。
则混合物中含氧元素的质量为100g×22%=22g.
27.【答案】(1)O
(2)两;1:2
(3)从微观角度看,化学反应前后分子的种类发生了变化,而原子的种类和数目都没有发生变化。
【知识点】单质和化合物的区别;元素化合价的规则与计算;化学反应的实质
【解析】【分析】(1)化合价的计算:根据化合物中各元素化合价代数和为零,单质中元素化合价为零,计算反应前后各元素化合价并对比 。
(2)物质的分类:单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物 。通过微观示意图确定生成物种类及单质、化合物个数 。
(3)化学反应的微观实质:化学反应中分子分裂成原子,原子重新组合成新分子,在这个过程中原子的种类、数目不变 。
【解答】(1)由微观示意图可知 。反应前CO中C元素化合价为+2价,NO中N元素化合价为+2价;反应后N2 中N元素化合价为0价,CO2中C元素化合价为+4价,O元素反应前后化合价均为 2
价,所以该反应前后化合价没有变化的元素是O 。
(2)由化学方程式可知,尾气处理后生成物有N2和CO2两种;其中N2是单质,CO2是化合物,单质和化合物的个数比为1:2。
(3)从微观角度看,化学反应前后分子的种类发生了变化,而原子的种类和数目都没有发生变化。
28.【答案】(1)⑤②③①④
(2)④①③②⑤
【知识点】元素化合价的规则与计算
【解析】【分析】(1)根据单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合各化学式进行解答本题。
(2)首先采用归一法对各物质的化学式进行变形,进而比较各物质中的氧原子个数即可解答。
【解答】 (1)NO中氧元素显-2价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)=0,则x=+2.
N2O5中氧元素显-2价,设氮元素的化合价是y,据在化合物中正负化合价代数和为零,
可得:2y+(-2)×5=0,则y=+5.
N2O中氧元素显-2价,设氮元素的化合价是z,据在化合物中正负化合价代数和为零,
可得:2z+(-2)=0,则z=+1.
同理,N2O3,NO2,氧元素显-2价,根据在化合物中正负化合价代数和为零,N2O3,NO2中氮元素的化合价分别为+3、+4.
氮元素化合价由低到高的顺序排列为:N2O5 NO2 N2O3 NO N2O;
故答案为:⑤②③①④。
(2)首先将氮的五种氧化物N2O、NO、N2O3、NO2、N2O5进行变形,得到N2O、N2O2、N2O3、N2O4、N2O5,变形后氮原子个数相等,氧原子个数依次增加,含氮量低高到低的顺序排列为:N2O NO N2O3 NO2 N2O5。
故答案为:④①③②⑤。
29.【答案】(1)金属元素在形成化合物时只能失去电子而不能得到电子
(2)不成立
(3)负;—3
【知识点】元素化合价的规则与计算
【解析】【分析】金属元素在形成化合物时只能失去电子而不能得到电子,因此金属元素在化合物中都显正价,而非金属元素在化合物中即有负价也有正价,且一种元素可能有多种化合价,据此进行分析。
【解答】(1)金属元素在形成化合物时只能失去电子而不能得到电子,因此金属元素在化合物中都显正价,推测一正确;
(2)推测二:非金属元素在化合物中只有负价;而H2O、SO2、CO2中氢、硫、碳元素的化合价分别为+1、+4、+4,说明非金属元素在化合物中即有负价也有正价,即推测二不成立;
(3)金属元素在形成化合物时只能失去电子而不能得到电子,而非金属元素与氧化合时常显正价,与氢化合时常显负价。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
