分层作业22 沉淀溶解平衡图像--2025鲁科版化学选择性必修1同步练习题
文档属性
| 名称 | 分层作业22 沉淀溶解平衡图像--2025鲁科版化学选择性必修1同步练习题 |

|
|
| 格式 | docx | ||
| 文件大小 | 619.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-09 08:50:15 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学选择性必修1
分层作业22 沉淀溶解平衡图像
A级必备知识基础练
题组1.常规沉淀溶解平衡曲线
1.某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。关于AgCl悬浊液的下列说法正确的是( )
A.加入AgNO3溶液,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
2.硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
3.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示(T1A.图中a和b分别为T1、T2温度下CdS在水中的溶解度(mol·L-1)
B.图中各点对应的Ksp的关系为Ksp(m)=Ksp(n)C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
题组2.对数型直线图像
4.已知锌及其化合物的性质与铝及其化合物相似。如图所示横轴为溶液的pH,纵轴为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。25 ℃时,下列说法不正确的是( )
A.往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-[Zn(OH)4]2-
B.若要将某废液中Zn2+完全沉淀,通常调控该溶液的pH在8.0~12.0之间
C.pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D.该温度时,Zn(OH)2的溶度积常数(Ksp)为1×10-10 mol3·L-3
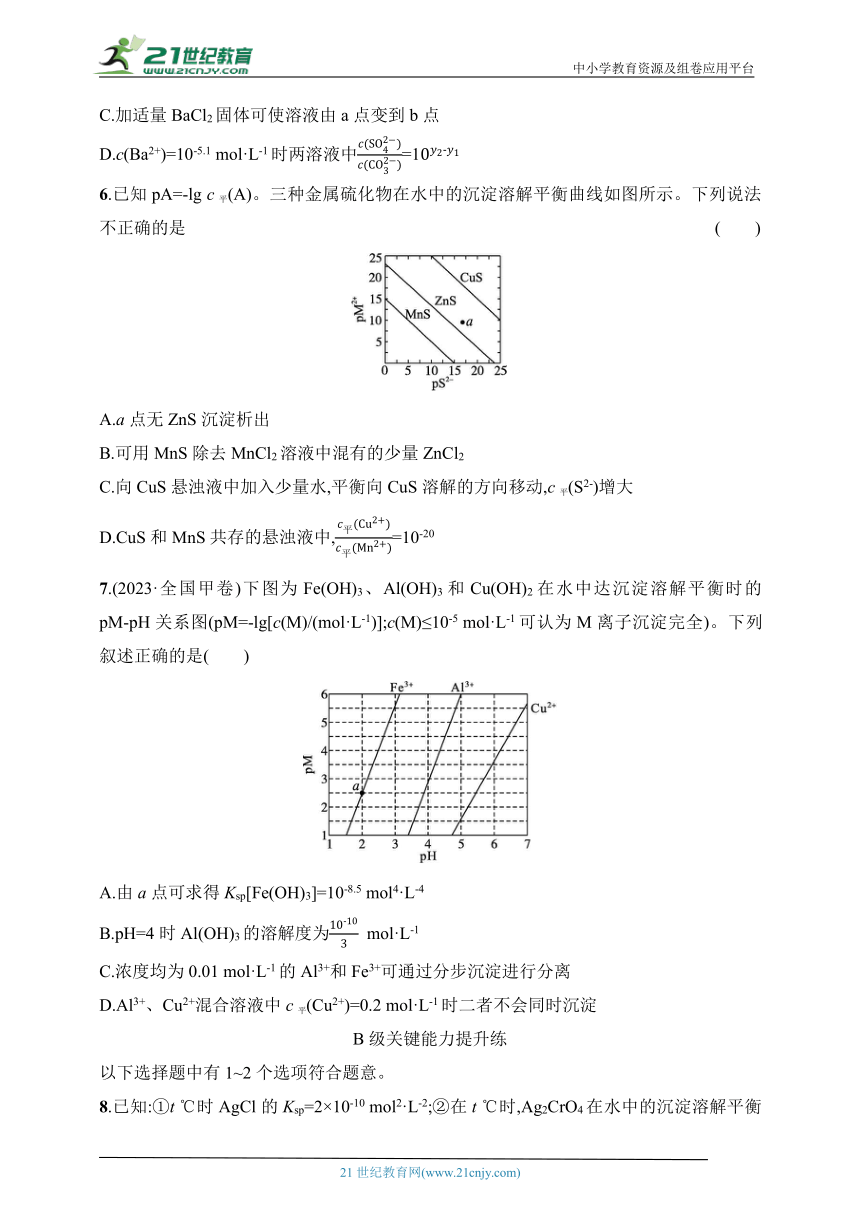
5.(2021·全国甲卷)已知相同温度下,Ksp(BaSO4)下列说法正确的是( )
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10 mol2·L-2
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1 mol·L-1时两溶液中=1
6.已知pA=-lg c平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 ( )
A.a点无ZnS沉淀析出
B.可用MnS除去MnCl2溶液中混有的少量ZnCl2
C.向CuS悬浊液中加入少量水,平衡向CuS溶解的方向移动,c平(S2-)增大
D.CuS和MnS共存的悬浊液中,=10-20
7.(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全)。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5 mol4·L-4
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c平(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
B级关键能力提升练
以下选择题中有1~2个选项符合题意。
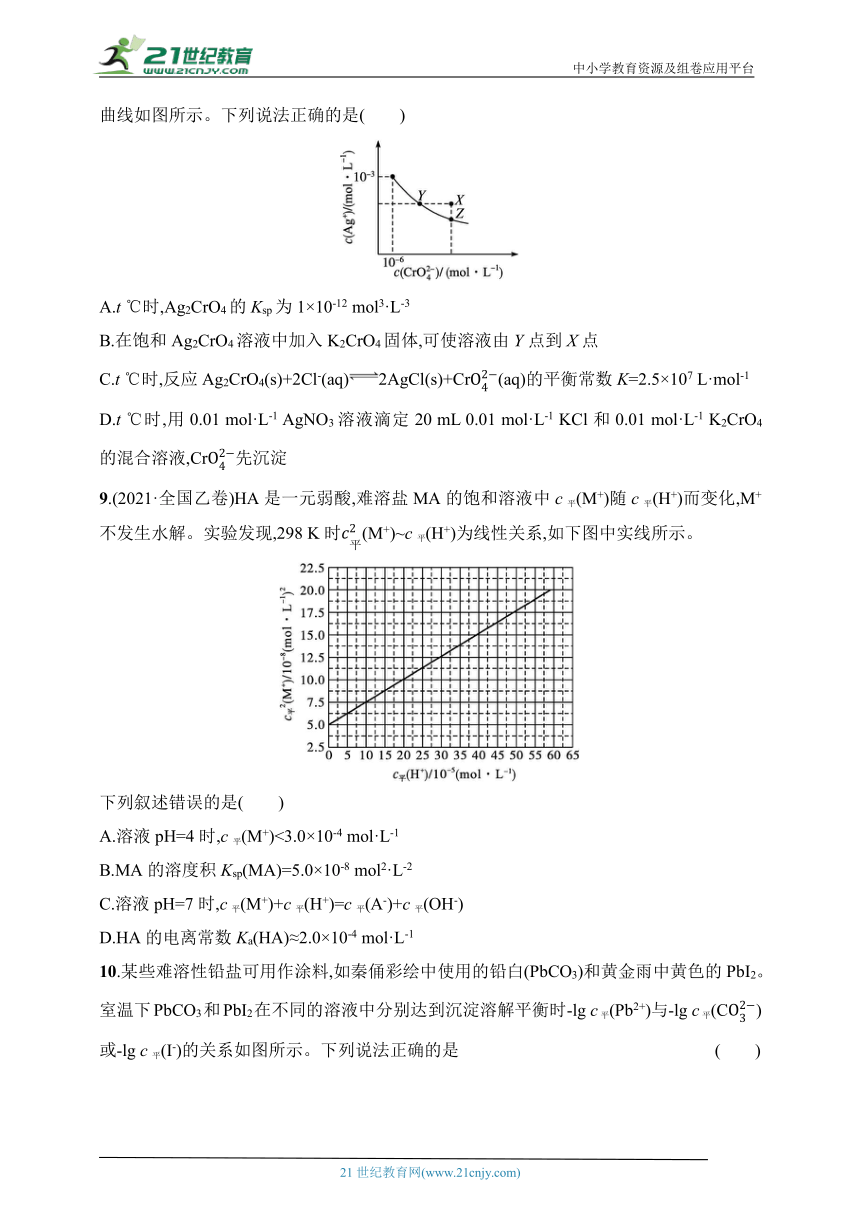
8.已知:①t ℃时AgCl的Ksp=2×10-10 mol2·L-2;②在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.t ℃时,Ag2CrO4的Ksp为1×10-12 mol3·L-3
B.在饱和Ag2CrO4溶液中加入K2CrO4固体,可使溶液由Y点到X点
C.t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+Cr(aq)的平衡常数K=2.5×107 L·mol-1
D.t ℃时,用0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液,Cr先沉淀
9.(2021·全国乙卷)HA是一元弱酸,难溶盐MA的饱和溶液中c平(M+)随c平(H+)而变化,M+不发生水解。实验发现,298 K时(M+)~c平(H+)为线性关系,如下图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c平(M+)<3.0×10-4 mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8 mol2·L-2
C.溶液pH=7时,c平(M+)+c平(H+)=c平(A-)+c平(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4 mol·L-1
10.某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下PbCO3和PbI2在不同的溶液中分别达到沉淀溶解平衡时-lg c平(Pb2+)与-lg c平(C)或-lg c平(I-)的关系如图所示。下列说法正确的是 ( )
A.Ksp(PbCO3)的数量级为10-14
B.p点对应的是PbCO3不饱和溶液
C.L1对应的是-lg c平(Pb2+)与-lg c平(I-)的关系变化
D.向浓度均为1 mol·L-1的Na2CO3、NaI混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀
11.某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为
M(OH)2(s)M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq)[M(OH)4]2-(aq)
25 ℃,-lg c与pH的关系如图所示,c为M2+或[M(OH)4]2-浓度的值。下列说法错误的是 ( )
A.曲线①代表-lgc平(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-7 mol3·L-3
C.向c平(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)形式存在
D.向c平([M(OH)4]2-)=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl后,体系中元素M主要以M2+存在
C级学科素养拔高练
12.金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为 (填字母)。
A.<1 B.在4左右
C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质, (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式: 。
(5)已知一些难溶物的溶度积常数如下表:
物质 FeS MnS CuS PbS HgS ZnS
6.3×10-18 2.5×10-13 1.3×10-35 3.4×10-28 6.4×10-33 1.6×10-24
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 (填字母)除去它们。
A.NaOH B.FeS C.Na2S
分层作业22 沉淀溶解平衡图像
1.D 解析 加入AgNO3溶液,c(Ag+)增大,c(Cl-)减小,而c、d点c(Cl-)相同,A项错误;加入少量水,平衡右移,AgCl固体部分溶解,则c(Cl-)不变,B项错误;d点处Q=c(Ag+)·c(Cl-)>Ksp(AgCl),有氯化银沉淀生成,C项错误;温度不变,Ksp不变,a、c点是相同温度下的沉淀溶解平衡,Ksp相同,D项正确。
2.C 解析 温度不变,硫化汞的Ksp不变,A项错误;a点在沉淀溶解平衡曲线的下方,未达到饱和,B项错误;c点对应溶液为饱和溶液,加入Hg(NO3)2,Hg2+浓度增大,S2-的浓度减小,C项正确;升高温度,Hg2+与S2-浓度均升高,D项错误。
3.B 解析 CdS的沉淀溶解平衡:CdS(s)Cd2+(aq)+S2-(aq),其溶度积Ksp=c平(Cd2+)·c平(S2-),在饱和溶液中,c平(Cd2+)=c平(S2-),结合图像可以看出,图中a和b分别表示T1和T2温度下CdS的溶解度(mol·L-1),A项正确;CdS的沉淀溶解平衡中的溶度积受温度影响,m、n和p点均在温度为T1条件下的沉淀溶解平衡曲线上,则其溶度积相同,B项错误;m点达到沉淀溶解平衡,向其中加入硫化钠后,平衡逆向移动,c平(Cd2+)减小,c平(S2-)增大,溶液组成由m沿mpn向p方向移动,C项正确;从图像中可以看出,随着温度的升高,Ksp增大,说明CdS(s)Cd2+(aq)+S2-(aq)为吸热过程,则温度降低时,q点对应饱和溶液的溶解度下降,溶液中的c平(Cd2+)与c平(S2-)同时减小,会沿qp线向p点方向移动,D项正确。
4.D 解析 根据图像,往ZnCl2溶液中加入过量NaOH溶液,Zn2+最终以[Zn(OH)4]2-的形式存在,故离子方程式为Zn2++4OH-[Zn(OH)4]2-,A项正确;控制溶液的pH在8.0~12.0之间时,可以将该废液中的Zn2+完全沉淀,B项正确;由a点可知pH=7.0即c平(OH-)=10-7 mol·L-1时,lg c平(Zn2+)=-3.0,即c平(Zn2+)=10-3 mol·L-1,则
Ksp[Zn(OH)2]=c平(Zn2+)·(OH-)=10-3 mol·L-1×(10-7 mol·L-1)2=10-17 mol3·L-3。pH=8.0即c平(OH-)=10-6 mol·L-1时,c平(Zn2+)= mol·L-1=10-5 mol·L-1,pH=12.0即c平(OH-)=10-2 mol·L-1时,c平(Zn2+)= mol·L-1=10-13 mol·L-1,故两种废液中Zn2+浓度之比为=108,C项正确,D项错误。
5.B 解析 BaCO3、BaSO4均为难溶物,Ksp(BaSO4)6.C 解析 pA=-lg c(A),则c平(A)=10-pA mol·L-1,故pA越大,c平(A)越小,所以平衡曲线右上方为不饱和溶液,平衡曲线左下方为过饱和溶液。a点为ZnS的不饱和溶液,没有ZnS沉淀析出,A项正确。MnS的溶解度大于ZnS,向MnCl2溶液中加入MnS固体,可以促使平衡MnS(s)+Zn2+(aq)ZnS(s)+Mn2+(aq)向右移动,即MnS转化为更难溶的ZnS,达到除去Zn2+的目的,B项正确。向CuS悬浊液中加入少量水,平衡向CuS溶解的方向移动,由于悬浊液中存在CuS固体,溶液依然是饱和的,所以c平(S2-)不变,C项错误。当pS2-=0,pMn2+=15,即c平(S2-)=1 mol·L-1时,c平(Mn2+)=10-15 mol·L-1,Ksp(MnS)=c平(Mn2+)·c平(S2-)=10-15 mol2·L-2;当pS2-=25,pCu2+=10,即c平(S2-)=10-25 mol·L-1时,c平(Cu2+)=10-10 mol·L-1,Ksp(CuS)=c平(Cu2+)·c平(S2-)=10-35 mol2·L-2;CuS和MnS共存的悬浊液中,=10-20,D项正确。
7.C 解析 由点a(2,2.5)可知,此时pH=2,pOH=12,则Ksp[Fe(OH)3]=c平(Fe3+)·(OH-)=10-2.5×10-12×3 mol4·L-4=10-38.5 mol4·L-4,故A错误;由点(5,6)可知,此时pH=5,pOH=9,则Ksp[Al(OH)3]=c平(Al3+)·(OH-)=10-6×10-9×3 mol4·L-4=10-33 mol4·L-4,pH=4时Al(OH)3的溶解度为 mol·L-1=10-3 mol·L-1,故B错误;由图可知,当Fe3+完全沉淀时,Al3+尚未开始沉淀,可通过调节溶液pH的方法分步沉淀Al3+和Fe3+,故C正确;由图可知,Al3+沉淀完全时,c平(Al3+)≤10-5 mol·L-1,pM≥5,此时pH约为4.7,在此pH下Cu2+刚开始沉淀的浓度为0.1 mol·L-1,而题中c平(Cu2+)=0.2 mol·L-1>0.1 mol·L-1,则Al3+、Cu2+会同时沉淀,故D错误。
8.AC 解析 Ag2CrO4的沉淀溶解平衡为Ag2CrO4(s)2Ag+(aq)+Cr(aq),根据图像曲线上的数据结合溶度积常数概念计算得到Ksp(Ag2CrO4)=(Ag+)·c平(Cr)=(10-3 mol·L-1)2×10-6 mol·L-1=1×10-12 mol3·L-3,A正确;在Ag2CrO4饱和溶液中加入K2CrO4固体,可使沉淀溶解平衡逆向移动,则溶液中c(Cr)增大,c(Ag+)减小,不可能由Y点到X点,B错误;在t ℃时,Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+Cr(aq)的平衡常数K==
=2.5×107 L·mol-1,C正确;混合溶液中c平(Cl-)=0.01 mol·L-1,c平(Cr)=0.01 mol·L-1,向其中滴加0.01 mol·L-1AgNO3溶液,开始生成AgCl沉淀时所需c(Ag+)= mol·L-1=2×10-8 mol·L-1,开始生成Ag2CrO4沉淀时所需c(Ag+)= mol·L-1=10-5 mol·L-1>2×10-8 mol·L-1,故先析出氯化银沉淀,D错误。
9.C 解析 由图可知pH=4,即c平(H+)=10×10-5 mol·L-1时,(M+)=7.5×10-8 mol2·L-2,c平(M+)= mol·L-1=×10-4 mol·L-1<3.0×10-4 mol·L-1,A项正确;MA的饱和溶液中,M+不发生水解,A-发生水解,其饱和溶液呈碱性,当溶液pH=7时,需要加酸调节,即还有其他酸根离子存在,C项错误;溶液中c平(M+)=c平(HA)+c平(A-),Ka(HA)=。将c平(H+)=10×10-5 mol·L-1时,(M+)=7.5×10-8 mol2·L-2和c平(H+)=20×10-5 mol·L-1时,(M+)=10.0×10-8 mol2·L-2,代入上述计算式,解得Ksp(MA)=5.0×10-8 mol2·L-2,Ka(HA)=2.0×10-4 mol·L-1,B、D项正确。
10.AC 解析 Ksp(PbCO3)=c平(Pb2+)·c平(C),则lg c平(Pb2+)=lg[Ksp(PbCO3)]-lg c(C),同理lg c(Pb2+)=lg[Ksp(PbI2)]-2lgc(I-),则图像L1对应的是-lg c(Pb2+)与-lg c(I-)的关系变化,图像L2对应的是-lg c(Pb2+)与-lg c(C)的关系变化,则Ksp(PbCO3)=c(Pb2+)·c(C)=1.0×10-13.1 mol2·L-2,数量级为10-14,故A正确,C正确;离子浓度的负对数值越小,则离子浓度越大,p点位于L2的左下方,则对应PbCO3溶液为过饱和溶液,故B错误;Ksp(PbCO3)=1.0×10-13.1 mol2·L-2,Ksp(PbI2)=c平(Pb2+)·(I-)=1.0×10-8 mol3·L-3,c平(C)和c平(I-)均为1 mol·L-1,形成PbCO3饱和溶液时,c(Pb2+)= mol·L-1=10-13.1 mol·L-1,形成PbI2饱和溶液时,c(Pb2+)=10-8 mol·L-1,则生成PbCO3沉淀需要的Pb2+的浓度更小,故先生成白色沉淀,故D错误。
11.BD 解析 由元素M的氢氧化物M(OH)2(s)在水中的溶解反应为M(OH)2(s)M2+(aq)+2OH-(aq)①,M(OH)2(s)+2OH-(aq)[M(OH)4]2-(aq)②,可知在酸性较强的情况下反应①正向移动,反应②逆向移动,则在酸性较强时M2+浓度大,碱性较强时[M(OH)4]2-浓度大,由分析可知曲线①代表-lg c平(M2+)与pH的关系,故A正确;M(OH)2(s)M2+(aq)+2OH-(aq),Ksp=c平(M2+)·(OH-),由题图可知,在pH=7.0时,-lg c(M2+)=3.0,c(M2+)=10-3 mol·L-1,则c平(OH-)==10-7 mol·L-1,Ksp=c平(M2+)·(OH-)=10-3×(10-7)2 mol3·L-3=10-17 mol3·L-3,故B错误;由图像可知在pH=9时[M(OH)4]2-和M2+含量极低,主要以M(OH)2(s)形式存在,故C正确;由曲线②可知,c平([M(OH)4]2-)=0.1 mol·L-1,即-lg c=1.0,则pH≈14.5,则c平(OH-)=100.5 mol·L-1>3 mol·L-1>0.4 mol·L-1,因此加入等体积0.4 mol·L-1的盐酸后,c平(OH-)减小,盐酸的量不能使M(OH)2溶解,所以体系中M不可能主要以M2+存在,D错误。
12.答案 (1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小 (4)Cu(OH)2+4NH3·H2O[Cu(NH3)4]2++2OH-+4H2O (5)B
解析 (1)据图知pH=4~5时,Cu2+开始沉淀为Cu(OH)2,因此pH=3时,铜元素主要以Cu2+形式存在。
(2)若要除去CuCl2溶液中的Fe3+,即要保证Fe3+完全沉淀,而Cu2+还未沉淀,据图知pH应为4左右。
(3)据图知,Co2+和Ni2+沉淀的pH范围相差太小,无法通过调节溶液pH的方法除去Ni(OH)2溶液中的Co2+。
(5)若在废水中加入过量的NaOH、Na2S,仍会污染环境。对于FeS,其溶度积远大于CuS、PbS、HgS,因此应用沉淀转化法可除去废水中的Cu2+、Pb2+、Hg2+,且因FeS也难溶,不会引入新的杂质。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学选择性必修1
分层作业22 沉淀溶解平衡图像
A级必备知识基础练
题组1.常规沉淀溶解平衡曲线
1.某温度时,AgCl(s)Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。关于AgCl悬浊液的下列说法正确的是( )
A.加入AgNO3溶液,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
2.硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
3.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示(T1
B.图中各点对应的Ksp的关系为Ksp(m)=Ksp(n)
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
题组2.对数型直线图像
4.已知锌及其化合物的性质与铝及其化合物相似。如图所示横轴为溶液的pH,纵轴为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。25 ℃时,下列说法不正确的是( )
A.往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-[Zn(OH)4]2-
B.若要将某废液中Zn2+完全沉淀,通常调控该溶液的pH在8.0~12.0之间
C.pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D.该温度时,Zn(OH)2的溶度积常数(Ksp)为1×10-10 mol3·L-3
5.(2021·全国甲卷)已知相同温度下,Ksp(BaSO4)
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10 mol2·L-2
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1 mol·L-1时两溶液中=1
6.已知pA=-lg c平(A)。三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是 ( )
A.a点无ZnS沉淀析出
B.可用MnS除去MnCl2溶液中混有的少量ZnCl2
C.向CuS悬浊液中加入少量水,平衡向CuS溶解的方向移动,c平(S2-)增大
D.CuS和MnS共存的悬浊液中,=10-20
7.(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全)。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5 mol4·L-4
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c平(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
B级关键能力提升练
以下选择题中有1~2个选项符合题意。
8.已知:①t ℃时AgCl的Ksp=2×10-10 mol2·L-2;②在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.t ℃时,Ag2CrO4的Ksp为1×10-12 mol3·L-3
B.在饱和Ag2CrO4溶液中加入K2CrO4固体,可使溶液由Y点到X点
C.t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+Cr(aq)的平衡常数K=2.5×107 L·mol-1
D.t ℃时,用0.01 mol·L-1 AgNO3溶液滴定20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液,Cr先沉淀
9.(2021·全国乙卷)HA是一元弱酸,难溶盐MA的饱和溶液中c平(M+)随c平(H+)而变化,M+不发生水解。实验发现,298 K时(M+)~c平(H+)为线性关系,如下图中实线所示。
下列叙述错误的是( )
A.溶液pH=4时,c平(M+)<3.0×10-4 mol·L-1
B.MA的溶度积Ksp(MA)=5.0×10-8 mol2·L-2
C.溶液pH=7时,c平(M+)+c平(H+)=c平(A-)+c平(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4 mol·L-1
10.某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下PbCO3和PbI2在不同的溶液中分别达到沉淀溶解平衡时-lg c平(Pb2+)与-lg c平(C)或-lg c平(I-)的关系如图所示。下列说法正确的是 ( )
A.Ksp(PbCO3)的数量级为10-14
B.p点对应的是PbCO3不饱和溶液
C.L1对应的是-lg c平(Pb2+)与-lg c平(I-)的关系变化
D.向浓度均为1 mol·L-1的Na2CO3、NaI混合溶液中滴入Pb(NO3)2溶液先产生黄色沉淀
11.某元素M的氢氧化物M(OH)2(s)在水中的溶解反应为
M(OH)2(s)M2+(aq)+2OH-(aq)
M(OH)2(s)+2OH-(aq)[M(OH)4]2-(aq)
25 ℃,-lg c与pH的关系如图所示,c为M2+或[M(OH)4]2-浓度的值。下列说法错误的是 ( )
A.曲线①代表-lgc平(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-7 mol3·L-3
C.向c平(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)形式存在
D.向c平([M(OH)4]2-)=0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl后,体系中元素M主要以M2+存在
C级学科素养拔高练
12.金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为 (填字母)。
A.<1 B.在4左右
C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质, (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式: 。
(5)已知一些难溶物的溶度积常数如下表:
物质 FeS MnS CuS PbS HgS ZnS
6.3×10-18 2.5×10-13 1.3×10-35 3.4×10-28 6.4×10-33 1.6×10-24
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的 (填字母)除去它们。
A.NaOH B.FeS C.Na2S
分层作业22 沉淀溶解平衡图像
1.D 解析 加入AgNO3溶液,c(Ag+)增大,c(Cl-)减小,而c、d点c(Cl-)相同,A项错误;加入少量水,平衡右移,AgCl固体部分溶解,则c(Cl-)不变,B项错误;d点处Q=c(Ag+)·c(Cl-)>Ksp(AgCl),有氯化银沉淀生成,C项错误;温度不变,Ksp不变,a、c点是相同温度下的沉淀溶解平衡,Ksp相同,D项正确。
2.C 解析 温度不变,硫化汞的Ksp不变,A项错误;a点在沉淀溶解平衡曲线的下方,未达到饱和,B项错误;c点对应溶液为饱和溶液,加入Hg(NO3)2,Hg2+浓度增大,S2-的浓度减小,C项正确;升高温度,Hg2+与S2-浓度均升高,D项错误。
3.B 解析 CdS的沉淀溶解平衡:CdS(s)Cd2+(aq)+S2-(aq),其溶度积Ksp=c平(Cd2+)·c平(S2-),在饱和溶液中,c平(Cd2+)=c平(S2-),结合图像可以看出,图中a和b分别表示T1和T2温度下CdS的溶解度(mol·L-1),A项正确;CdS的沉淀溶解平衡中的溶度积受温度影响,m、n和p点均在温度为T1条件下的沉淀溶解平衡曲线上,则其溶度积相同,B项错误;m点达到沉淀溶解平衡,向其中加入硫化钠后,平衡逆向移动,c平(Cd2+)减小,c平(S2-)增大,溶液组成由m沿mpn向p方向移动,C项正确;从图像中可以看出,随着温度的升高,Ksp增大,说明CdS(s)Cd2+(aq)+S2-(aq)为吸热过程,则温度降低时,q点对应饱和溶液的溶解度下降,溶液中的c平(Cd2+)与c平(S2-)同时减小,会沿qp线向p点方向移动,D项正确。
4.D 解析 根据图像,往ZnCl2溶液中加入过量NaOH溶液,Zn2+最终以[Zn(OH)4]2-的形式存在,故离子方程式为Zn2++4OH-[Zn(OH)4]2-,A项正确;控制溶液的pH在8.0~12.0之间时,可以将该废液中的Zn2+完全沉淀,B项正确;由a点可知pH=7.0即c平(OH-)=10-7 mol·L-1时,lg c平(Zn2+)=-3.0,即c平(Zn2+)=10-3 mol·L-1,则
Ksp[Zn(OH)2]=c平(Zn2+)·(OH-)=10-3 mol·L-1×(10-7 mol·L-1)2=10-17 mol3·L-3。pH=8.0即c平(OH-)=10-6 mol·L-1时,c平(Zn2+)= mol·L-1=10-5 mol·L-1,pH=12.0即c平(OH-)=10-2 mol·L-1时,c平(Zn2+)= mol·L-1=10-13 mol·L-1,故两种废液中Zn2+浓度之比为=108,C项正确,D项错误。
5.B 解析 BaCO3、BaSO4均为难溶物,Ksp(BaSO4)
7.C 解析 由点a(2,2.5)可知,此时pH=2,pOH=12,则Ksp[Fe(OH)3]=c平(Fe3+)·(OH-)=10-2.5×10-12×3 mol4·L-4=10-38.5 mol4·L-4,故A错误;由点(5,6)可知,此时pH=5,pOH=9,则Ksp[Al(OH)3]=c平(Al3+)·(OH-)=10-6×10-9×3 mol4·L-4=10-33 mol4·L-4,pH=4时Al(OH)3的溶解度为 mol·L-1=10-3 mol·L-1,故B错误;由图可知,当Fe3+完全沉淀时,Al3+尚未开始沉淀,可通过调节溶液pH的方法分步沉淀Al3+和Fe3+,故C正确;由图可知,Al3+沉淀完全时,c平(Al3+)≤10-5 mol·L-1,pM≥5,此时pH约为4.7,在此pH下Cu2+刚开始沉淀的浓度为0.1 mol·L-1,而题中c平(Cu2+)=0.2 mol·L-1>0.1 mol·L-1,则Al3+、Cu2+会同时沉淀,故D错误。
8.AC 解析 Ag2CrO4的沉淀溶解平衡为Ag2CrO4(s)2Ag+(aq)+Cr(aq),根据图像曲线上的数据结合溶度积常数概念计算得到Ksp(Ag2CrO4)=(Ag+)·c平(Cr)=(10-3 mol·L-1)2×10-6 mol·L-1=1×10-12 mol3·L-3,A正确;在Ag2CrO4饱和溶液中加入K2CrO4固体,可使沉淀溶解平衡逆向移动,则溶液中c(Cr)增大,c(Ag+)减小,不可能由Y点到X点,B错误;在t ℃时,Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+Cr(aq)的平衡常数K==
=2.5×107 L·mol-1,C正确;混合溶液中c平(Cl-)=0.01 mol·L-1,c平(Cr)=0.01 mol·L-1,向其中滴加0.01 mol·L-1AgNO3溶液,开始生成AgCl沉淀时所需c(Ag+)= mol·L-1=2×10-8 mol·L-1,开始生成Ag2CrO4沉淀时所需c(Ag+)= mol·L-1=10-5 mol·L-1>2×10-8 mol·L-1,故先析出氯化银沉淀,D错误。
9.C 解析 由图可知pH=4,即c平(H+)=10×10-5 mol·L-1时,(M+)=7.5×10-8 mol2·L-2,c平(M+)= mol·L-1=×10-4 mol·L-1<3.0×10-4 mol·L-1,A项正确;MA的饱和溶液中,M+不发生水解,A-发生水解,其饱和溶液呈碱性,当溶液pH=7时,需要加酸调节,即还有其他酸根离子存在,C项错误;溶液中c平(M+)=c平(HA)+c平(A-),Ka(HA)=。将c平(H+)=10×10-5 mol·L-1时,(M+)=7.5×10-8 mol2·L-2和c平(H+)=20×10-5 mol·L-1时,(M+)=10.0×10-8 mol2·L-2,代入上述计算式,解得Ksp(MA)=5.0×10-8 mol2·L-2,Ka(HA)=2.0×10-4 mol·L-1,B、D项正确。
10.AC 解析 Ksp(PbCO3)=c平(Pb2+)·c平(C),则lg c平(Pb2+)=lg[Ksp(PbCO3)]-lg c(C),同理lg c(Pb2+)=lg[Ksp(PbI2)]-2lgc(I-),则图像L1对应的是-lg c(Pb2+)与-lg c(I-)的关系变化,图像L2对应的是-lg c(Pb2+)与-lg c(C)的关系变化,则Ksp(PbCO3)=c(Pb2+)·c(C)=1.0×10-13.1 mol2·L-2,数量级为10-14,故A正确,C正确;离子浓度的负对数值越小,则离子浓度越大,p点位于L2的左下方,则对应PbCO3溶液为过饱和溶液,故B错误;Ksp(PbCO3)=1.0×10-13.1 mol2·L-2,Ksp(PbI2)=c平(Pb2+)·(I-)=1.0×10-8 mol3·L-3,c平(C)和c平(I-)均为1 mol·L-1,形成PbCO3饱和溶液时,c(Pb2+)= mol·L-1=10-13.1 mol·L-1,形成PbI2饱和溶液时,c(Pb2+)=10-8 mol·L-1,则生成PbCO3沉淀需要的Pb2+的浓度更小,故先生成白色沉淀,故D错误。
11.BD 解析 由元素M的氢氧化物M(OH)2(s)在水中的溶解反应为M(OH)2(s)M2+(aq)+2OH-(aq)①,M(OH)2(s)+2OH-(aq)[M(OH)4]2-(aq)②,可知在酸性较强的情况下反应①正向移动,反应②逆向移动,则在酸性较强时M2+浓度大,碱性较强时[M(OH)4]2-浓度大,由分析可知曲线①代表-lg c平(M2+)与pH的关系,故A正确;M(OH)2(s)M2+(aq)+2OH-(aq),Ksp=c平(M2+)·(OH-),由题图可知,在pH=7.0时,-lg c(M2+)=3.0,c(M2+)=10-3 mol·L-1,则c平(OH-)==10-7 mol·L-1,Ksp=c平(M2+)·(OH-)=10-3×(10-7)2 mol3·L-3=10-17 mol3·L-3,故B错误;由图像可知在pH=9时[M(OH)4]2-和M2+含量极低,主要以M(OH)2(s)形式存在,故C正确;由曲线②可知,c平([M(OH)4]2-)=0.1 mol·L-1,即-lg c=1.0,则pH≈14.5,则c平(OH-)=100.5 mol·L-1>3 mol·L-1>0.4 mol·L-1,因此加入等体积0.4 mol·L-1的盐酸后,c平(OH-)减小,盐酸的量不能使M(OH)2溶解,所以体系中M不可能主要以M2+存在,D错误。
12.答案 (1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小 (4)Cu(OH)2+4NH3·H2O[Cu(NH3)4]2++2OH-+4H2O (5)B
解析 (1)据图知pH=4~5时,Cu2+开始沉淀为Cu(OH)2,因此pH=3时,铜元素主要以Cu2+形式存在。
(2)若要除去CuCl2溶液中的Fe3+,即要保证Fe3+完全沉淀,而Cu2+还未沉淀,据图知pH应为4左右。
(3)据图知,Co2+和Ni2+沉淀的pH范围相差太小,无法通过调节溶液pH的方法除去Ni(OH)2溶液中的Co2+。
(5)若在废水中加入过量的NaOH、Na2S,仍会污染环境。对于FeS,其溶度积远大于CuS、PbS、HgS,因此应用沉淀转化法可除去废水中的Cu2+、Pb2+、Hg2+,且因FeS也难溶,不会引入新的杂质。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
