第1章测评--2025鲁科版化学选择性必修1同步练习题
文档属性
| 名称 | 第1章测评--2025鲁科版化学选择性必修1同步练习题 |  | |
| 格式 | docx | ||
| 文件大小 | 822.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-09 08:50:15 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2025鲁科版化学选择性必修1
第1章测评
一、选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(s,石墨)C(s,金刚石) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
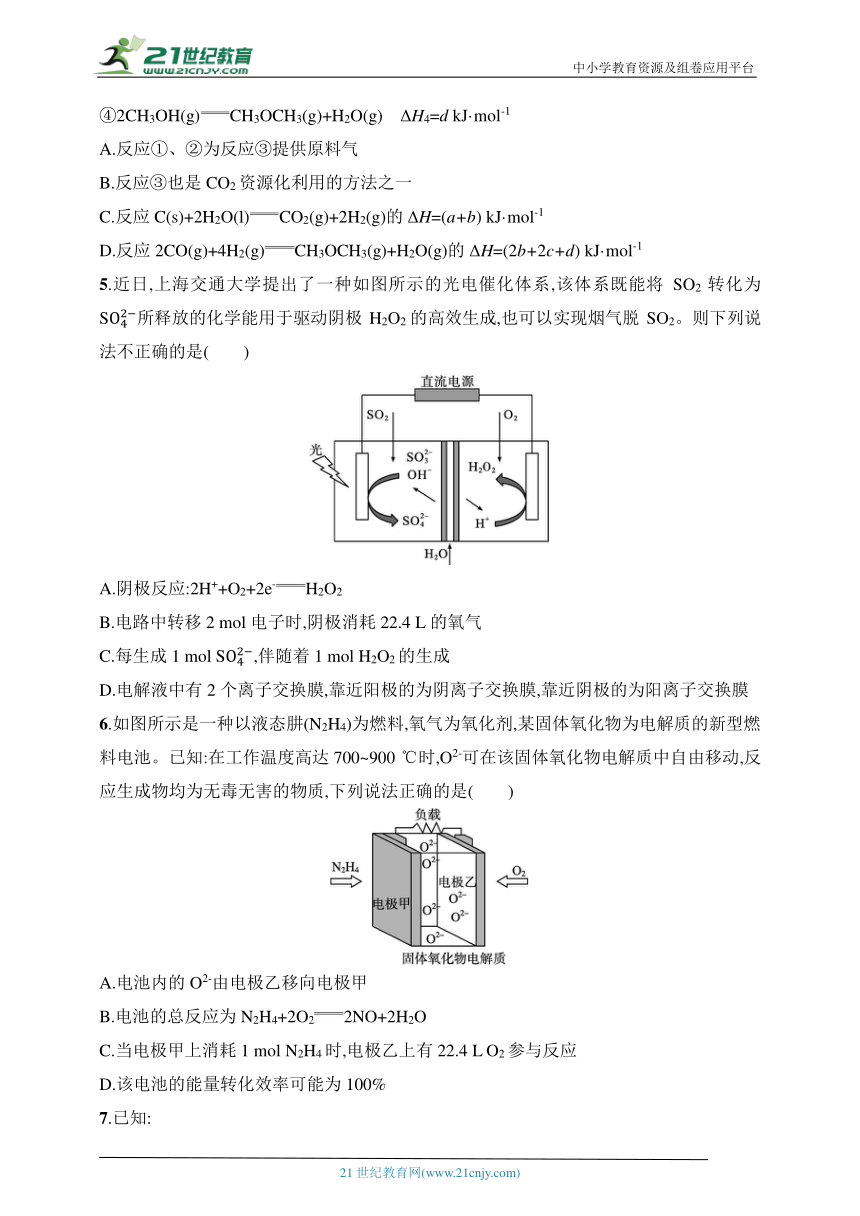
2.下列有关电化学腐蚀和电化学保护的说法,不正确的是( )
A.图甲是钢铁的吸氧腐蚀示意图
B.图乙中的电解质溶液呈酸性
C.图丙中的电子被强制流向钢闸门
D.图丁是牺牲阳极示意图,利用了电解原理
3.下列有关中和反应的反应热测定实验的说法正确的是( )
A.温度计能代替玻璃搅拌器,用于搅拌反应物
B.为了使反应均匀进行,可以向酸(碱)溶液中分几次加入碱(酸)溶液
C.测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度
D.某同学通过实验测得硫酸和NaOH溶液反应生成1 mol H2O(l)放出的热量为52.3 kJ(理论值是57.3 kJ),造成此结果的原因不可能是所用酸、碱溶液浓度过大
4.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应C(s)+2H2O(l)CO2(g)+2H2(g)的ΔH=(a+b) kJ·mol-1
D.反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
5.近日,上海交通大学提出了一种如图所示的光电催化体系,该体系既能将SO2转化为S所释放的化学能用于驱动阴极H2O2的高效生成,也可以实现烟气脱SO2。则下列说法不正确的是( )
A.阴极反应:2H++O2+2e-H2O2
B.电路中转移2 mol电子时,阴极消耗22.4 L的氧气
C.每生成1 mol S,伴随着1 mol H2O2的生成
D.电解液中有2个离子交换膜,靠近阳极的为阴离子交换膜,靠近阴极的为阳离子交换膜
6.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。已知:在工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质,下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池的总反应为N2H4+2O22NO+2H2O
C.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
D.该电池的能量转化效率可能为100%
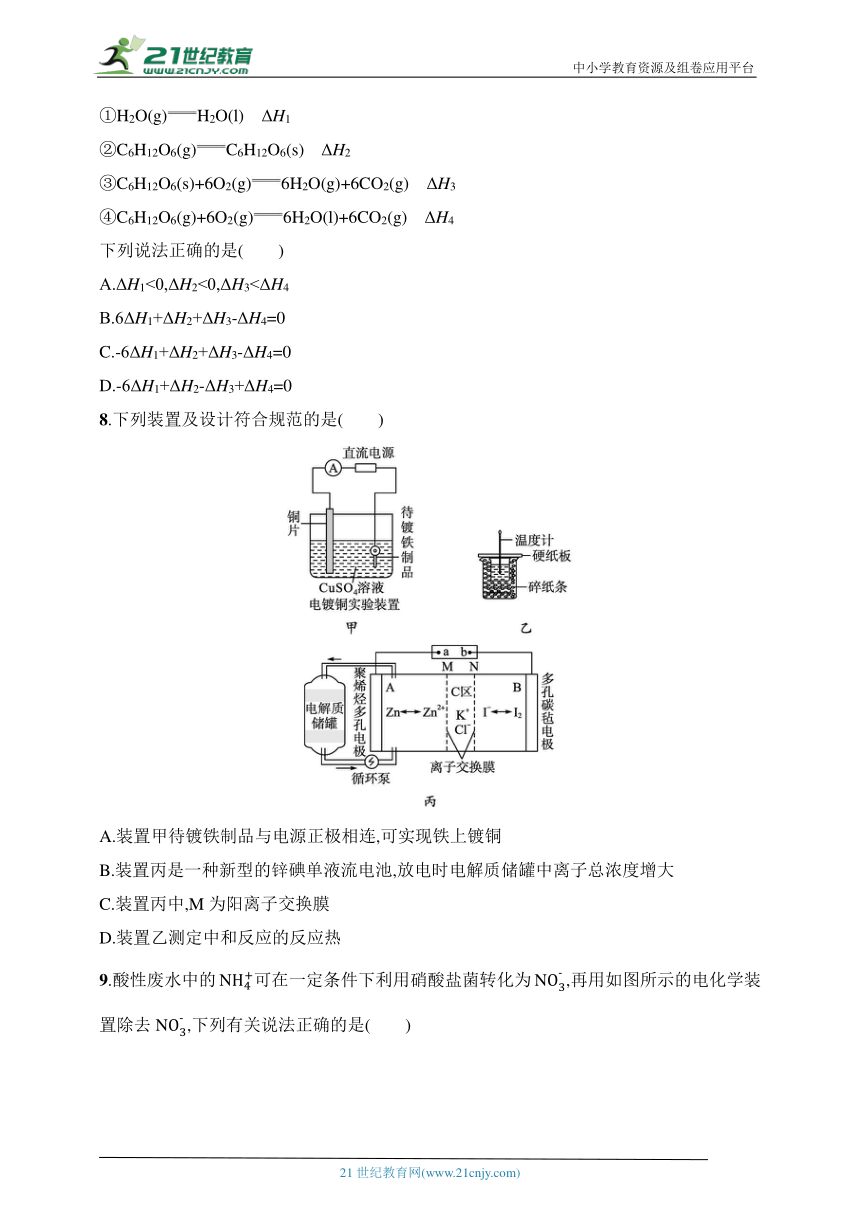
7.已知:
①H2O(g)H2O(l) ΔH1
②C6H12O6(g)C6H12O6(s) ΔH2
③C6H12O6(s)+6O2(g)6H2O(g)+6CO2(g) ΔH3
④C6H12O6(g)+6O2(g)6H2O(l)+6CO2(g) ΔH4
下列说法正确的是( )
A.ΔH1<0,ΔH2<0,ΔH3<ΔH4
B.6ΔH1+ΔH2+ΔH3-ΔH4=0
C.-6ΔH1+ΔH2+ΔH3-ΔH4=0
D.-6ΔH1+ΔH2-ΔH3+ΔH4=0
8.下列装置及设计符合规范的是( )
A.装置甲待镀铁制品与电源正极相连,可实现铁上镀铜
B.装置丙是一种新型的锌碘单液流电池,放电时电解质储罐中离子总浓度增大
C.装置丙中,M为阳离子交换膜
D.装置乙测定中和反应的反应热
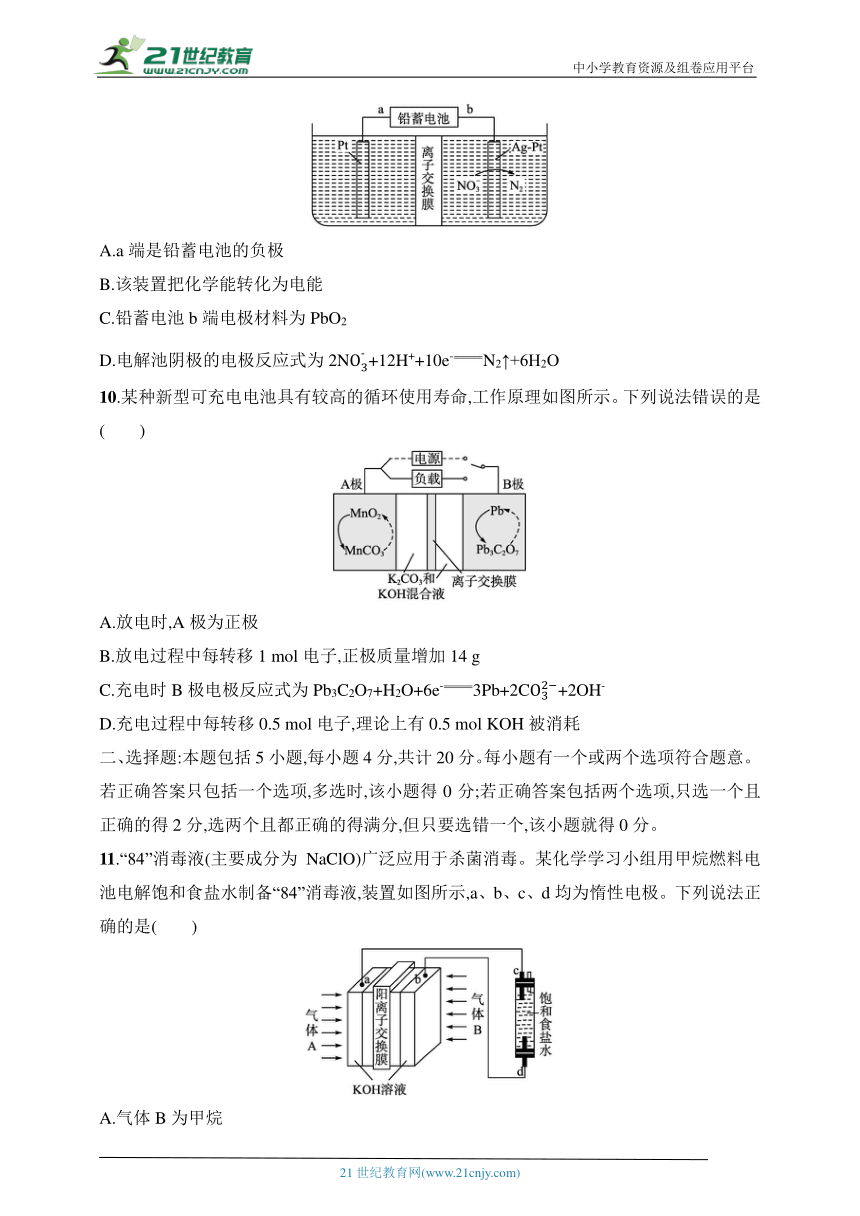
9.酸性废水中的N可在一定条件下利用硝酸盐菌转化为N,再用如图所示的电化学装置除去N,下列有关说法正确的是( )
A.a端是铅蓄电池的负极
B.该装置把化学能转化为电能
C.铅蓄电池b端电极材料为PbO2
D.电解池阴极的电极反应式为2N+12H++10e-N2↑+6H2O
10.某种新型可充电电池具有较高的循环使用寿命,工作原理如图所示。下列说法错误的是( )
A.放电时,A极为正极
B.放电过程中每转移1 mol电子,正极质量增加14 g
C.充电时B极电极反应式为Pb3C2O7+H2O+6e-3Pb+2C+2OH-
D.充电过程中每转移0.5 mol电子,理论上有0.5 mol KOH被消耗
二、选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.“84”消毒液(主要成分为NaClO)广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,a、b、c、d均为惰性电极。下列说法正确的是( )
A.气体B为甲烷
B.电解装置中的总反应为NaCl+H2ONaClO+H2↑
C.消耗2.24 L(标准状况)甲烷,K+通过交换膜向左室移动0.8 mol
D.甲烷发生的电极反应为CH4-8e-+8OH-CO2+6H2O
12.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是( )
A.由ΔH3可知,该步反应的反应物键能总和大于生成物的键能总和
B.ΔH1-ΔH2+ΔH3=0
C.ΔH1<ΔH2
D.若用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大
13.我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯。装置示意图如下。已知:电解效率η(B)=×100%。
下列说法错误的是( )
A.电极a连接电源的负极
B.电极a上有O2产生
C.纳米Cu催化剂上发生反应:2CO+6H2O+8e-C2H4+8OH-
D.若乙烯的电解效率为60%,电路中通过1 mol电子时,产生0.075 mol乙烯
14.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯(CHClCCl2),进行水体修复的过程如图。H+、O2、N等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
A.反应①②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时ne=a mol
C.④的电极反应式为N+10H++8e-N+3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大
15.最近有科学家发现正丁烷(C4H10)脱氢或不完全氧化也可制得1,3-丁二烯(C4H6),已知热化学方程式如下:
①C4H10(g)C4H6(g)+2H2(g) ΔH1=+123 kJ·mol-1
②C4H10(g)+O2(g)C4H6(g)+2H2O(g) ΔH2=-119 kJ·mol-1
③H+(aq)+OH-(aq)H2O(l) ΔH3=-57.3 kJ·mol-1
下列说法正确的是( )
A.由①可知,正丁烷(C4H10)比1,3-丁二烯(C4H6)稳定
B.由①和②可推知:2H2(g)+O2(g)2H2O(g) ΔH4=-242 kJ·mol-1
C.HCl(aq)+NH3·H2O(aq)NH4Cl(aq)+H2O(l) ΔH>-57.3 kJ·mol-1
D.由①和②可知,同质量的正丁烷(C4H10)转变为1,3-丁二烯(C4H6)所需要的能量相同
三、非选择题:共4小题,共60分。
16.(14分)乙醇(C2H5OH)是重要的基础化工原料,可用于制造乙醛、乙烯等。某同学用弹式热量计(结构如图所示)按以下实验步骤测量C2H5OH(l)的摩尔燃烧焓。
弹式热量计示意图
a.用电子天平称量1 400.00 g纯水,倒入内筒中;
b.用电子天平称量1.00 g苯甲酸,置于氧弹内的坩埚上,与点火丝保持微小距离;
c.将试样装入氧弹内,用氧气排空气再注满高纯氧气;
d.打开搅拌器开关,读取纯水温度,当温度不再改变时,记为初始温度;
e.当纯水温度保持不变时,打开引燃电极,读取并记录内筒最高水温;
f.重复实验4次,所得数据如表:
实验序号 初始温度/℃ 最高水温/℃
① 25.00 28.01
② 24.50 27.49
③ 25.55 28.55
④ 24.00 28.42
g.用电子天平称量1.00 g CH3CH2OH(l)替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为3.30 ℃。
已知:①1.00 g苯甲酸完全燃烧放出26.4 kJ热量;
②查阅资料知常温常压时,C2H5OH(l)的摩尔燃烧焓ΔH=-1 366.8 kJ·mol-1。
(1)搅拌器适宜的材质为 (填字母);氧弹的材质为不锈钢,原因是 (答一点即可);氧弹内注满过量高纯氧气的目的是 。
A.铜 B.银 C.陶瓷 D.玻璃纤维
(2)苯甲酸完全燃烧,弹式热量计内筒升高的温度平均为 ℃,该绝热套内水温升高1 ℃需要的热量为 kJ。
(3)通过以上实验可换算出1 mol C2H5OH(l)完全燃烧放出的热量为 (精确至0.1) kJ。
17.(14分)氮和氮的化合物与人类有密切关系。
(1)氮的固定有利于生物吸收氮。下列属于氮的固定的是 (填序号)。
①工业上N2和H2合成NH3 ②N2和O2放电条件下生成NO ③NH3催化氧化生成NO
写出反应③的化学方程式: 。
(2)治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮。下列物质可以氧化NO的是 (填字母)。
A.NaCl溶液 B.NaOH溶液
C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥标出反应中电子的得失和数目: 。
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气污染空气的关键反应。用Rh做催化剂时该反应的过程示意图如下:
①过程Ⅰ为 (填“吸热”或“放热”)过程。过程Ⅱ生成的化学键有 (填“极性键”“非极性键”或“极性键和非极性键”)。
②已知过程Ⅰ的焓变为a kJ·mol-1,过程Ⅱ的焓变为b kJ·mol-1,则该反应的热化学方程式为 。
18.(14分)通过化学反应与能量的学习,某化学兴趣小组的同学对原电池产生了浓厚的兴趣。
Ⅰ.甲同学是一位考古爱好者,我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。经过研究发现青铜器的腐蚀都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
(1)腐蚀过程中,负极是 (填“a”“b”或“c”)。
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上消耗氧气的体积为 L(标准状况)。
Ⅱ.乙同学是一位生物爱好者,南美亚马孙河流域生活着一种带状生物——电鳗,根据仿生学原理,我国研究团队制得一种柔性水系锌电池,该电池以锌盐溶液作为电解液,其原理如图所示。
(4)电池放电时,N极发生 (填“氧化”或“还原”)反应,Zn2+向 (填“M”或“N”)极移动。
(5)电池放电时,每生成1 mol PTO-Zn2+,M极溶解Zn的质量为 g。
19.(18分)Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4 mol液态肼和0.8 mol H2O2混合反应,生成氮气和水蒸气,放出256.0 kJ的热量(相当于25 ℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)已知H2O(l)H2O(g) ΔH=+44 kJ·mol-1。则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(4)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2(g)和H2(g)反应的热化学方程式: 。
(5)已知下列数据:
化学键 H—H N≡N
435 943
根据表中及图中数据计算N—H键的键能是 kJ·mol-1。
(6)用NH3催化还原NO,还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3(g)还原NO(g)至N2(g)和H2O(g),则该反应过程中放出的热量为 kJ(用含a、b的式子表示)。
Ⅲ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
(7)阳极产生ClO2的电极反应式: 。
(8)当阴极产生标准状况下112 mL气体时,通过阳离子交换膜的离子的物质的量为 。
第1章测评
1.D 解析 等质量的水和冰相比较,冰的能量低,A错误;发生化学反应时能量的变化有多种形式,可以表现为热能,还可以表现为光能、电能等,B错误;ΔH>0,说明该反应吸热,石墨的能量较低,故石墨更稳定,C错误;化学反应遵循质量守恒的同时,也遵循能量守恒,D正确。
2.D 解析 图甲中O2得到电子转化为OH-,属于钢铁的吸氧腐蚀示意图,A正确;图乙中H+得到电子转化为H2,属于钢铁的析氢腐蚀,说明电解质溶液呈酸性,B正确;图丙中钢铁和电源的负极相连,作阴极被保护,这说明电子被强制流向钢闸门,C正确;图丁中负极是锌,属于牺牲阳极的阴极保护法,利用了原电池原理,D错误。
3.D 解析 温度计不能代替玻璃搅拌器,只能用于测量溶液的温度,A错误;为了防止热量损失,向酸(碱)溶液中一次加入碱(酸)溶液,B错误;测定中和反应反应热时,应读取混合溶液的最高温度,C错误;浓酸或浓碱溶于水时会放热,则生成1 mol H2O(l)时放出的热量大于57.3 kJ,D正确。
4.C 解析 反应③中的反应物为CO2、H2,由已知反应可知,反应①、②为反应③提供原料气,A项正确;反应③中的反应物为CO2,CO2转化为甲醇,则反应③也是CO2资源化利用的方法之一,B项正确;反应①+②得C(s)+2H2O(g)CO2(g)+2H2(g) ΔH=(a+b) kJ·mol-1,则C(s)+2H2O(l)CO2(g)+2H2(g)的ΔH≠(a+b) kJ·mol-1,C项错误;由盖斯定律知,②×2+③×2+④得2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH=(2b+2c+d) kJ·mol-1,D项正确。
5.B 解析 从图中可知,左侧电极上S转化为S,硫元素化合价升高,则电解池中左侧电极为阳极,右侧电极为阴极,O2在阴极得电子结合H+生成H2O2,阴极反应为2H++O2+2e-H2O2,A正确;从阴极反应式可以看出,电路中转移2 mol电子时,阴极消耗1 mol O2,由于未指明温度和压强,所以消耗的O2的体积不一定是22.4 L,B错误;依据得失电子守恒,当阳极生成1 mol S时,电路中转移2 mol电子,伴随着1 mol H2O2的生成,C正确;从图中可以看出,OH-从左侧离子交换膜向阳极迁移,H+从右侧离子交换膜向阴极迁移,电解液中有2个离子交换膜,靠近阳极的为阴离子交换膜,靠近阴极的为阳离子交换膜,D正确。
6.A 解析 由图可知,通入肼的电极甲为燃料电池的负极,根据反应生成物均为无毒无害的物质,则肼在负极失去电子发生氧化反应生成氮气和水,电极乙为正极,氧气在正极得到电子发生还原反应生成O2-,O2-由电极乙移向电极甲,A正确;电池的总反应为N2H4+O2N2+2H2O,B错误;缺标准状况下,无法计算消耗1 mol N2H4时消耗氧气的体积,C错误;燃料电池工作时,化学能不可能完全转化为电能,D错误。
7.B 解析 物质由气态转化为液态(液化)需要放热,物质由固态转化为气态需要吸热,反应③和反应④中C6H12O6(s)→C6H12O6(g)为吸热过程,6H2O(g)→6H2O(l)为放热过程,所以反应④放出更多能量,ΔH更小,故ΔH3>ΔH4,A错误;由盖斯定律知,6ΔH1+ΔH2+ΔH3=ΔH4,则6ΔH1+ΔH2+ΔH3-ΔH4=0,B正确,C、D均错误。
8.B 解析 电镀铜实验中,Cu作阳极,Cu与电源正极相连,A错误;装置丙放电时,左侧电极是负极,电极反应式为Zn-2e-Zn2+,所以储罐中的离子总浓度增大,B正确;装置丙放电时,负极区生成Zn2+、正电荷增加,正极区生成I-、负电荷增加,所以Cl-通过M膜进入负极区,K+通过N膜进入正极区,所以M为阴离子交换膜,N为阳离子交换膜,C错误;图乙中缺少搅拌装置,且保温效果不够好,不能测定中和热,D错误。
9.D 解析 图示的电化学装置把电能转化为化学能,B错误;N转化为N2的反应在阴极上发生,所以b是电源的负极,A错误;阴极反应:2N+12H++10e-N2↑+6H2O,D正确;铅蓄电池中,Pb为负极、PbO2为正极,根据分析可知b是电源的负极,则铅蓄电池b端电极材料为Pb,C错误。
10.D 解析 充电时,发生电解反应,A极中MnCO3转化为MnO2,锰元素化合价升高,发生氧化反应,A极为阳极,B极中Pb3C2O7转化为Pb,铅元素化合价降低,发生还原反应,B极为阴极;放电时,发生原电池反应,A极中MnO2转化为MnCO3,A极为正极,B极中Pb转化为Pb3C2O7,B极为负极。根据分析,放电时,A极为正极,A正确;放电时正极MnO2转化为MnCO3,1 mol MnO2反应转移2 mol电子,相当于增重1 mol CO,所以转移1 mol电子时,正极质量增加14 g,B正确;充电时B极为阴极,得到电子,电极反应式为Pb3C2O7+H2O+6e-3Pb+2C+2OH-,C正确;充电时的总方程式为Pb3C2O7+3MnCO3+10KOH3Pb+3MnO2+5K2CO3+5H2O,整个反应转移6 mol电子,消耗10 mol KOH,所以充电过程中每转移0.5 mol电子,理论上有mol KOH被消耗,D错误。
11.B 解析 电解装置为电解饱和食盐水制备“84”消毒液,应在d极产生Cl2,c极产生NaOH,因此d极为阳极,c极为阴极,总反应为NaCl+H2ONaClO+H2↑,B正确;与c极相连的a极为负极,与d极相连的b极为正极,通入的气体B为氧气,A错误;原电池中阳离子移向正极,所以K+通过交换膜向右室移动,C错误;a电极为负极,甲烷在负极失去电子发生氧化反应生成C,电极反应为CH4-8e-+10OH-C+7H2O,D错误。
12.AB 解析 燃烧为放热反应,ΔH3<0,则该步反应的反应物键能总和小于生成物的键能总和,A错误;由盖斯定律可知,ΔH1=ΔH2+ΔH3,ΔH1-ΔH2-ΔH3=0,B错误;ΔH2>0,而ΔH1<0,则ΔH1<ΔH2,C正确;C(s)与水蒸气的反应为吸热反应,且气态水的能量比液态水的能量高,若用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大,D正确。
13.BD 解析 电极a实现将CO2转化为乙烯,C由+4价变为-2价,化合价降低,发生还原反应,电极a为阴极,与电源负极相连,A正确;电极a上CO2得电子生成CO或CO得电子产生乙烯,没有O2的产生,B错误;由图可知,纳米Cu催化剂上CO转化为乙烯的电极反应为2CO+6H2O+8e-C2H4+8OH-,C正确;若乙烯的电解效率为60%,电路中通过1 mol电子时,根据公式得n(生成乙烯所用的电子)=0.6 mol,CO2转化为乙烯的电极反应为2CO2+8H2O+12e-C2H4+12OH-,所以当n(生成乙烯所用的电子)=0.6 mol,产生的乙烯为0.05 mol,D错误。
14.B 解析 由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,A正确;三氯乙烯C2HCl3中C元素化合价为+1价,乙烯中C元素化合价为-2价,1 mol C2HCl3转化为1 mol C2H4时,得到6 mol电子,脱去3 mol Cl,所以脱去a mol Cl时ne=2a mol,B错误;由示意图及N元素的化合价变化可写出④的电极反应式为N+10H++8e-N+3H2O,C正确;增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,加快ZVI释放电子的速率,可使nt增大,D正确。
15.BC 解析 由反应①可知,C4H10的总能量低于C4H6与H2的总能量,无法对比C4H10与C4H6的能量高低,不能比较二者的稳定性,A项错误;根据盖斯定律,由②-①得,2H2(g)+O2(g)2H2O(g) ΔH4=-242 kJ·mol-1,B项正确;NH3·H2O是弱碱,电离过程吸热,ΔH大于-57.3 kJ·mol-1,C项正确;由①和②可知,同质量的正丁烷(C4H10)转变为1,3-丁二烯(C4H6)所需要的能量可能不相同,D项错误。
16.答案 (1)CD 热传导的速率快 确保可燃物完全燃烧
(2)3.00 8.8
(3)1 335.8
解析 (1)搅拌器适宜的材质为导热性能差的陶瓷和玻璃纤维,故选CD。氧弹的材质为不锈钢,原因是热传导的速率快。氧弹内注满过量高纯氧气的目的是确保可燃物完全燃烧。
(2)实验①温差为28.01 ℃-25.00 ℃=3.01 ℃,实验②温差为27.49 ℃-24.50 ℃=2.99 ℃,实验③温差为28.55 ℃-25.55 ℃=3.00 ℃,实验④温差为28.42 ℃-24.00 ℃=4.42 ℃,实验④数据较①②③明显大,应该舍去,苯甲酸完全燃烧,弹式热量计内筒升高的温度平均为 ℃=3.00 ℃;1 g苯甲酸完全燃烧放出26.4 kJ热量,则该绝热套内水温升高1 ℃需要的热量为 kJ=8.8 kJ。
(3)用电子天平称量1.00 g CH3CH2OH(l)替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为3.30 ℃,放出的热量为3.30×8.8 kJ=29.04 kJ,可换算出1 mol C2H5OH(l)完全燃烧放出的热量为×29.04 kJ=1 335.8 kJ。
17.答案 (1)①② 4NH3+5O24NO+6H2O
(2)D
(3)①吸热 极性键和非极性键
②2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=(a+b) kJ·mol-1
解析 (1)氮的固定是游离态的氮转变为化合态的氮,因此属于氮的固定的是①②;反应③是氨气催化氧化生成一氧化氮和水,其化学方程式为4NH3+5O24NO+6H2O。
(2)只有高锰酸钾具有氧化性,其余物质不具有氧化性,因此选D;用NaClO溶液氧化NO的化学方程式和电子转移情况为。
(3)①过程Ⅰ是化学键断裂,因此为吸热过程。过程Ⅱ生成的化学键有碳氧极性键和氮氮非极性键。
②已知过程Ⅰ的焓变为a kJ·mol-1,过程Ⅱ的焓变为b kJ·mol-1,根据盖斯定律,该反应的热化学方程式为2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=(a+b) kJ·mol-1。
18.答案 Ⅰ.(1)c
(2)2Cu2++3OH-+Cl-Cu2(OH)3Cl↓
(3)0.448
Ⅱ.(4)还原 N (5)260
解析 Ⅰ.(1)根据图知,氧气得电子生成OH-,Cu失电子生成Cu2+,发生吸氧腐蚀,则Cu作负极,即c是负极。
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子,正极上生成OH-,所以离子方程式为2Cu2++3OH-+Cl-Cu2(OH)3Cl↓。
(3)n[Cu2(OH)3Cl]==0.02 mol,根据得失电子守恒得n(O2)==0.02 mol,V(O2)=0.02 mol×22.4 L·mol-1=0.448 L。
Ⅱ.(4)放电时,金属Zn发生氧化反应生成Zn2+,即M电极为负极,则N电极为正极,得电子发生还原反应;原电池中阳离子向正极移动,所以Zn2+向N极移动。
(5)根据PTO-Zn2+的结构可知,每生成1 mol PTO-Zn2+,需要4 mol Zn2+,所以M极溶解Zn的质量为65 g·mol-1×4 mol=260 g。
19.答案 (1)N2H4(l)+2H2O2(l)N2(g)+4H2O(g) ΔH=-640.0 kJ·mol-1
(2)408.0
(3)释放大量热、产物不会造成环境污染
(4)N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1
(5)390
(6)
(7)Cl--5e-+2H2OClO2↑+4H+
(8)0.01 mol
解析 (1)由题意可知,肼与双氧水反应生成氮气和水,反应的化学方程式为N2H4+2H2O2N2+4H2O,0.4 mol液态肼与0.8 mol H2O2恰好完全反应放出256.0 kJ的热量,则1 mol液态肼反应放出的热量为=640.0 kJ,反应的热化学方程式为N2H4(l)+2H2O2(l)N2(g)+4H2O(g) ΔH=-640.0 kJ·mol-1。
(2)将肼与双氧水反应生成氮气和水设为①,液态水转化为气态水设为②,由盖斯定律可知,反应①-②×4得到N2H4(l)+2H2O2(l)N2(g)+4H2O(l) ΔH=-816.0 kJ·mol-1,16 g液态肼与液态双氧水反应生成液态水时放出的热量是×816.0 kJ·mol-1=408.0 kJ。
(3)由反应方程式可知,用于火箭推进的反应为肼与双氧水反应生成氮气和水,反应时释放大量热、产物为氮气和水,不会造成环境污染。
(4)由图可知,合成氨反应的反应物总能量大于生成物总能量,生成1 mol氨气放出46 kJ热量,则反应的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1。
(5)设N—H键的键能为a kJ·mol-1,由反应热等于反应物的总键能和生成物的总键能之差可得:ΔH=943 kJ·mol-1+3×435 kJ·mol-1-6a kJ·mol-1=-92 kJ·mol-1,解得a=390。
(6)由盖斯定律可知,反应①-3×②可得反应4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH=(3b-a) kJ·mol-1,1 mol NH3还原NO至N2放出热量为 kJ。
(7)由题意可知,Cl-放电生成ClO2,电极反应式为Cl--5e-+2H2OClO2↑+4H+。
(8)阴极产生标准状况下112 mL气体是H2,物质的量为0.005 mol,阴极电极反应式为2H2O+2e-H2↑+2OH-,所以阴极区产生0.01 mol OH-,则通过阳离子交换膜的Na+的物质的量为0.01 mol。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2025鲁科版化学选择性必修1
第1章测评
一、选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(s,石墨)C(s,金刚石) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
2.下列有关电化学腐蚀和电化学保护的说法,不正确的是( )
A.图甲是钢铁的吸氧腐蚀示意图
B.图乙中的电解质溶液呈酸性
C.图丙中的电子被强制流向钢闸门
D.图丁是牺牲阳极示意图,利用了电解原理
3.下列有关中和反应的反应热测定实验的说法正确的是( )
A.温度计能代替玻璃搅拌器,用于搅拌反应物
B.为了使反应均匀进行,可以向酸(碱)溶液中分几次加入碱(酸)溶液
C.测定中和反应反应热实验中,读取混合溶液不再变化的温度为终止温度
D.某同学通过实验测得硫酸和NaOH溶液反应生成1 mol H2O(l)放出的热量为52.3 kJ(理论值是57.3 kJ),造成此结果的原因不可能是所用酸、碱溶液浓度过大
4.通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )
①C(s)+H2O(g)CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3=c kJ·mol-1
④2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH4=d kJ·mol-1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应C(s)+2H2O(l)CO2(g)+2H2(g)的ΔH=(a+b) kJ·mol-1
D.反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
5.近日,上海交通大学提出了一种如图所示的光电催化体系,该体系既能将SO2转化为S所释放的化学能用于驱动阴极H2O2的高效生成,也可以实现烟气脱SO2。则下列说法不正确的是( )
A.阴极反应:2H++O2+2e-H2O2
B.电路中转移2 mol电子时,阴极消耗22.4 L的氧气
C.每生成1 mol S,伴随着1 mol H2O2的生成
D.电解液中有2个离子交换膜,靠近阳极的为阴离子交换膜,靠近阴极的为阳离子交换膜
6.如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。已知:在工作温度高达700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质,下列说法正确的是( )
A.电池内的O2-由电极乙移向电极甲
B.电池的总反应为N2H4+2O22NO+2H2O
C.当电极甲上消耗1 mol N2H4时,电极乙上有22.4 L O2参与反应
D.该电池的能量转化效率可能为100%
7.已知:
①H2O(g)H2O(l) ΔH1
②C6H12O6(g)C6H12O6(s) ΔH2
③C6H12O6(s)+6O2(g)6H2O(g)+6CO2(g) ΔH3
④C6H12O6(g)+6O2(g)6H2O(l)+6CO2(g) ΔH4
下列说法正确的是( )
A.ΔH1<0,ΔH2<0,ΔH3<ΔH4
B.6ΔH1+ΔH2+ΔH3-ΔH4=0
C.-6ΔH1+ΔH2+ΔH3-ΔH4=0
D.-6ΔH1+ΔH2-ΔH3+ΔH4=0
8.下列装置及设计符合规范的是( )
A.装置甲待镀铁制品与电源正极相连,可实现铁上镀铜
B.装置丙是一种新型的锌碘单液流电池,放电时电解质储罐中离子总浓度增大
C.装置丙中,M为阳离子交换膜
D.装置乙测定中和反应的反应热
9.酸性废水中的N可在一定条件下利用硝酸盐菌转化为N,再用如图所示的电化学装置除去N,下列有关说法正确的是( )
A.a端是铅蓄电池的负极
B.该装置把化学能转化为电能
C.铅蓄电池b端电极材料为PbO2
D.电解池阴极的电极反应式为2N+12H++10e-N2↑+6H2O
10.某种新型可充电电池具有较高的循环使用寿命,工作原理如图所示。下列说法错误的是( )
A.放电时,A极为正极
B.放电过程中每转移1 mol电子,正极质量增加14 g
C.充电时B极电极反应式为Pb3C2O7+H2O+6e-3Pb+2C+2OH-
D.充电过程中每转移0.5 mol电子,理论上有0.5 mol KOH被消耗
二、选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.“84”消毒液(主要成分为NaClO)广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,a、b、c、d均为惰性电极。下列说法正确的是( )
A.气体B为甲烷
B.电解装置中的总反应为NaCl+H2ONaClO+H2↑
C.消耗2.24 L(标准状况)甲烷,K+通过交换膜向左室移动0.8 mol
D.甲烷发生的电极反应为CH4-8e-+8OH-CO2+6H2O
12.已知煤转化成水煤气及其燃烧过程的能量变化如图,下列说法不正确的是( )
A.由ΔH3可知,该步反应的反应物键能总和大于生成物的键能总和
B.ΔH1-ΔH2+ΔH3=0
C.ΔH1<ΔH2
D.若用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大
13.我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯。装置示意图如下。已知:电解效率η(B)=×100%。
下列说法错误的是( )
A.电极a连接电源的负极
B.电极a上有O2产生
C.纳米Cu催化剂上发生反应:2CO+6H2O+8e-C2H4+8OH-
D.若乙烯的电解效率为60%,电路中通过1 mol电子时,产生0.075 mol乙烯
14.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯(CHClCCl2),进行水体修复的过程如图。H+、O2、N等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )
A.反应①②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时ne=a mol
C.④的电极反应式为N+10H++8e-N+3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大
15.最近有科学家发现正丁烷(C4H10)脱氢或不完全氧化也可制得1,3-丁二烯(C4H6),已知热化学方程式如下:
①C4H10(g)C4H6(g)+2H2(g) ΔH1=+123 kJ·mol-1
②C4H10(g)+O2(g)C4H6(g)+2H2O(g) ΔH2=-119 kJ·mol-1
③H+(aq)+OH-(aq)H2O(l) ΔH3=-57.3 kJ·mol-1
下列说法正确的是( )
A.由①可知,正丁烷(C4H10)比1,3-丁二烯(C4H6)稳定
B.由①和②可推知:2H2(g)+O2(g)2H2O(g) ΔH4=-242 kJ·mol-1
C.HCl(aq)+NH3·H2O(aq)NH4Cl(aq)+H2O(l) ΔH>-57.3 kJ·mol-1
D.由①和②可知,同质量的正丁烷(C4H10)转变为1,3-丁二烯(C4H6)所需要的能量相同
三、非选择题:共4小题,共60分。
16.(14分)乙醇(C2H5OH)是重要的基础化工原料,可用于制造乙醛、乙烯等。某同学用弹式热量计(结构如图所示)按以下实验步骤测量C2H5OH(l)的摩尔燃烧焓。
弹式热量计示意图
a.用电子天平称量1 400.00 g纯水,倒入内筒中;
b.用电子天平称量1.00 g苯甲酸,置于氧弹内的坩埚上,与点火丝保持微小距离;
c.将试样装入氧弹内,用氧气排空气再注满高纯氧气;
d.打开搅拌器开关,读取纯水温度,当温度不再改变时,记为初始温度;
e.当纯水温度保持不变时,打开引燃电极,读取并记录内筒最高水温;
f.重复实验4次,所得数据如表:
实验序号 初始温度/℃ 最高水温/℃
① 25.00 28.01
② 24.50 27.49
③ 25.55 28.55
④ 24.00 28.42
g.用电子天平称量1.00 g CH3CH2OH(l)替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为3.30 ℃。
已知:①1.00 g苯甲酸完全燃烧放出26.4 kJ热量;
②查阅资料知常温常压时,C2H5OH(l)的摩尔燃烧焓ΔH=-1 366.8 kJ·mol-1。
(1)搅拌器适宜的材质为 (填字母);氧弹的材质为不锈钢,原因是 (答一点即可);氧弹内注满过量高纯氧气的目的是 。
A.铜 B.银 C.陶瓷 D.玻璃纤维
(2)苯甲酸完全燃烧,弹式热量计内筒升高的温度平均为 ℃,该绝热套内水温升高1 ℃需要的热量为 kJ。
(3)通过以上实验可换算出1 mol C2H5OH(l)完全燃烧放出的热量为 (精确至0.1) kJ。
17.(14分)氮和氮的化合物与人类有密切关系。
(1)氮的固定有利于生物吸收氮。下列属于氮的固定的是 (填序号)。
①工业上N2和H2合成NH3 ②N2和O2放电条件下生成NO ③NH3催化氧化生成NO
写出反应③的化学方程式: 。
(2)治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮。下列物质可以氧化NO的是 (填字母)。
A.NaCl溶液 B.NaOH溶液
C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥标出反应中电子的得失和数目: 。
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气污染空气的关键反应。用Rh做催化剂时该反应的过程示意图如下:
①过程Ⅰ为 (填“吸热”或“放热”)过程。过程Ⅱ生成的化学键有 (填“极性键”“非极性键”或“极性键和非极性键”)。
②已知过程Ⅰ的焓变为a kJ·mol-1,过程Ⅱ的焓变为b kJ·mol-1,则该反应的热化学方程式为 。
18.(14分)通过化学反应与能量的学习,某化学兴趣小组的同学对原电池产生了浓厚的兴趣。
Ⅰ.甲同学是一位考古爱好者,我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。经过研究发现青铜器的腐蚀都跟原电池有关。如图为青铜器在潮湿环境中发生电化学腐蚀的示意图。
(1)腐蚀过程中,负极是 (填“a”“b”或“c”)。
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 。
(3)若生成4.29 g Cu2(OH)3Cl,则理论上消耗氧气的体积为 L(标准状况)。
Ⅱ.乙同学是一位生物爱好者,南美亚马孙河流域生活着一种带状生物——电鳗,根据仿生学原理,我国研究团队制得一种柔性水系锌电池,该电池以锌盐溶液作为电解液,其原理如图所示。
(4)电池放电时,N极发生 (填“氧化”或“还原”)反应,Zn2+向 (填“M”或“N”)极移动。
(5)电池放电时,每生成1 mol PTO-Zn2+,M极溶解Zn的质量为 g。
19.(18分)Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4 mol液态肼和0.8 mol H2O2混合反应,生成氮气和水蒸气,放出256.0 kJ的热量(相当于25 ℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)已知H2O(l)H2O(g) ΔH=+44 kJ·mol-1。则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(4)如图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2(g)和H2(g)反应的热化学方程式: 。
(5)已知下列数据:
化学键 H—H N≡N
435 943
根据表中及图中数据计算N—H键的键能是 kJ·mol-1。
(6)用NH3催化还原NO,还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3(g)还原NO(g)至N2(g)和H2O(g),则该反应过程中放出的热量为 kJ(用含a、b的式子表示)。
Ⅲ.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取ClO2的新工艺。
(7)阳极产生ClO2的电极反应式: 。
(8)当阴极产生标准状况下112 mL气体时,通过阳离子交换膜的离子的物质的量为 。
第1章测评
1.D 解析 等质量的水和冰相比较,冰的能量低,A错误;发生化学反应时能量的变化有多种形式,可以表现为热能,还可以表现为光能、电能等,B错误;ΔH>0,说明该反应吸热,石墨的能量较低,故石墨更稳定,C错误;化学反应遵循质量守恒的同时,也遵循能量守恒,D正确。
2.D 解析 图甲中O2得到电子转化为OH-,属于钢铁的吸氧腐蚀示意图,A正确;图乙中H+得到电子转化为H2,属于钢铁的析氢腐蚀,说明电解质溶液呈酸性,B正确;图丙中钢铁和电源的负极相连,作阴极被保护,这说明电子被强制流向钢闸门,C正确;图丁中负极是锌,属于牺牲阳极的阴极保护法,利用了原电池原理,D错误。
3.D 解析 温度计不能代替玻璃搅拌器,只能用于测量溶液的温度,A错误;为了防止热量损失,向酸(碱)溶液中一次加入碱(酸)溶液,B错误;测定中和反应反应热时,应读取混合溶液的最高温度,C错误;浓酸或浓碱溶于水时会放热,则生成1 mol H2O(l)时放出的热量大于57.3 kJ,D正确。
4.C 解析 反应③中的反应物为CO2、H2,由已知反应可知,反应①、②为反应③提供原料气,A项正确;反应③中的反应物为CO2,CO2转化为甲醇,则反应③也是CO2资源化利用的方法之一,B项正确;反应①+②得C(s)+2H2O(g)CO2(g)+2H2(g) ΔH=(a+b) kJ·mol-1,则C(s)+2H2O(l)CO2(g)+2H2(g)的ΔH≠(a+b) kJ·mol-1,C项错误;由盖斯定律知,②×2+③×2+④得2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH=(2b+2c+d) kJ·mol-1,D项正确。
5.B 解析 从图中可知,左侧电极上S转化为S,硫元素化合价升高,则电解池中左侧电极为阳极,右侧电极为阴极,O2在阴极得电子结合H+生成H2O2,阴极反应为2H++O2+2e-H2O2,A正确;从阴极反应式可以看出,电路中转移2 mol电子时,阴极消耗1 mol O2,由于未指明温度和压强,所以消耗的O2的体积不一定是22.4 L,B错误;依据得失电子守恒,当阳极生成1 mol S时,电路中转移2 mol电子,伴随着1 mol H2O2的生成,C正确;从图中可以看出,OH-从左侧离子交换膜向阳极迁移,H+从右侧离子交换膜向阴极迁移,电解液中有2个离子交换膜,靠近阳极的为阴离子交换膜,靠近阴极的为阳离子交换膜,D正确。
6.A 解析 由图可知,通入肼的电极甲为燃料电池的负极,根据反应生成物均为无毒无害的物质,则肼在负极失去电子发生氧化反应生成氮气和水,电极乙为正极,氧气在正极得到电子发生还原反应生成O2-,O2-由电极乙移向电极甲,A正确;电池的总反应为N2H4+O2N2+2H2O,B错误;缺标准状况下,无法计算消耗1 mol N2H4时消耗氧气的体积,C错误;燃料电池工作时,化学能不可能完全转化为电能,D错误。
7.B 解析 物质由气态转化为液态(液化)需要放热,物质由固态转化为气态需要吸热,反应③和反应④中C6H12O6(s)→C6H12O6(g)为吸热过程,6H2O(g)→6H2O(l)为放热过程,所以反应④放出更多能量,ΔH更小,故ΔH3>ΔH4,A错误;由盖斯定律知,6ΔH1+ΔH2+ΔH3=ΔH4,则6ΔH1+ΔH2+ΔH3-ΔH4=0,B正确,C、D均错误。
8.B 解析 电镀铜实验中,Cu作阳极,Cu与电源正极相连,A错误;装置丙放电时,左侧电极是负极,电极反应式为Zn-2e-Zn2+,所以储罐中的离子总浓度增大,B正确;装置丙放电时,负极区生成Zn2+、正电荷增加,正极区生成I-、负电荷增加,所以Cl-通过M膜进入负极区,K+通过N膜进入正极区,所以M为阴离子交换膜,N为阳离子交换膜,C错误;图乙中缺少搅拌装置,且保温效果不够好,不能测定中和热,D错误。
9.D 解析 图示的电化学装置把电能转化为化学能,B错误;N转化为N2的反应在阴极上发生,所以b是电源的负极,A错误;阴极反应:2N+12H++10e-N2↑+6H2O,D正确;铅蓄电池中,Pb为负极、PbO2为正极,根据分析可知b是电源的负极,则铅蓄电池b端电极材料为Pb,C错误。
10.D 解析 充电时,发生电解反应,A极中MnCO3转化为MnO2,锰元素化合价升高,发生氧化反应,A极为阳极,B极中Pb3C2O7转化为Pb,铅元素化合价降低,发生还原反应,B极为阴极;放电时,发生原电池反应,A极中MnO2转化为MnCO3,A极为正极,B极中Pb转化为Pb3C2O7,B极为负极。根据分析,放电时,A极为正极,A正确;放电时正极MnO2转化为MnCO3,1 mol MnO2反应转移2 mol电子,相当于增重1 mol CO,所以转移1 mol电子时,正极质量增加14 g,B正确;充电时B极为阴极,得到电子,电极反应式为Pb3C2O7+H2O+6e-3Pb+2C+2OH-,C正确;充电时的总方程式为Pb3C2O7+3MnCO3+10KOH3Pb+3MnO2+5K2CO3+5H2O,整个反应转移6 mol电子,消耗10 mol KOH,所以充电过程中每转移0.5 mol电子,理论上有mol KOH被消耗,D错误。
11.B 解析 电解装置为电解饱和食盐水制备“84”消毒液,应在d极产生Cl2,c极产生NaOH,因此d极为阳极,c极为阴极,总反应为NaCl+H2ONaClO+H2↑,B正确;与c极相连的a极为负极,与d极相连的b极为正极,通入的气体B为氧气,A错误;原电池中阳离子移向正极,所以K+通过交换膜向右室移动,C错误;a电极为负极,甲烷在负极失去电子发生氧化反应生成C,电极反应为CH4-8e-+10OH-C+7H2O,D错误。
12.AB 解析 燃烧为放热反应,ΔH3<0,则该步反应的反应物键能总和小于生成物的键能总和,A错误;由盖斯定律可知,ΔH1=ΔH2+ΔH3,ΔH1-ΔH2-ΔH3=0,B错误;ΔH2>0,而ΔH1<0,则ΔH1<ΔH2,C正确;C(s)与水蒸气的反应为吸热反应,且气态水的能量比液态水的能量高,若用C(s)和H2O(l)转化为H2(g)和CO(g),则ΔH2变大,D正确。
13.BD 解析 电极a实现将CO2转化为乙烯,C由+4价变为-2价,化合价降低,发生还原反应,电极a为阴极,与电源负极相连,A正确;电极a上CO2得电子生成CO或CO得电子产生乙烯,没有O2的产生,B错误;由图可知,纳米Cu催化剂上CO转化为乙烯的电极反应为2CO+6H2O+8e-C2H4+8OH-,C正确;若乙烯的电解效率为60%,电路中通过1 mol电子时,根据公式得n(生成乙烯所用的电子)=0.6 mol,CO2转化为乙烯的电极反应为2CO2+8H2O+12e-C2H4+12OH-,所以当n(生成乙烯所用的电子)=0.6 mol,产生的乙烯为0.05 mol,D错误。
14.B 解析 由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以应在正极发生,A正确;三氯乙烯C2HCl3中C元素化合价为+1价,乙烯中C元素化合价为-2价,1 mol C2HCl3转化为1 mol C2H4时,得到6 mol电子,脱去3 mol Cl,所以脱去a mol Cl时ne=2a mol,B错误;由示意图及N元素的化合价变化可写出④的电极反应式为N+10H++8e-N+3H2O,C正确;增大单位体积水体中小微粒ZVI的投入量,可以增大小微粒ZVI和正极的接触面积,加快ZVI释放电子的速率,可使nt增大,D正确。
15.BC 解析 由反应①可知,C4H10的总能量低于C4H6与H2的总能量,无法对比C4H10与C4H6的能量高低,不能比较二者的稳定性,A项错误;根据盖斯定律,由②-①得,2H2(g)+O2(g)2H2O(g) ΔH4=-242 kJ·mol-1,B项正确;NH3·H2O是弱碱,电离过程吸热,ΔH大于-57.3 kJ·mol-1,C项正确;由①和②可知,同质量的正丁烷(C4H10)转变为1,3-丁二烯(C4H6)所需要的能量可能不相同,D项错误。
16.答案 (1)CD 热传导的速率快 确保可燃物完全燃烧
(2)3.00 8.8
(3)1 335.8
解析 (1)搅拌器适宜的材质为导热性能差的陶瓷和玻璃纤维,故选CD。氧弹的材质为不锈钢,原因是热传导的速率快。氧弹内注满过量高纯氧气的目的是确保可燃物完全燃烧。
(2)实验①温差为28.01 ℃-25.00 ℃=3.01 ℃,实验②温差为27.49 ℃-24.50 ℃=2.99 ℃,实验③温差为28.55 ℃-25.55 ℃=3.00 ℃,实验④温差为28.42 ℃-24.00 ℃=4.42 ℃,实验④数据较①②③明显大,应该舍去,苯甲酸完全燃烧,弹式热量计内筒升高的温度平均为 ℃=3.00 ℃;1 g苯甲酸完全燃烧放出26.4 kJ热量,则该绝热套内水温升高1 ℃需要的热量为 kJ=8.8 kJ。
(3)用电子天平称量1.00 g CH3CH2OH(l)替换苯甲酸,重复上述实验,测得内筒温度改变的平均值为3.30 ℃,放出的热量为3.30×8.8 kJ=29.04 kJ,可换算出1 mol C2H5OH(l)完全燃烧放出的热量为×29.04 kJ=1 335.8 kJ。
17.答案 (1)①② 4NH3+5O24NO+6H2O
(2)D
(3)①吸热 极性键和非极性键
②2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=(a+b) kJ·mol-1
解析 (1)氮的固定是游离态的氮转变为化合态的氮,因此属于氮的固定的是①②;反应③是氨气催化氧化生成一氧化氮和水,其化学方程式为4NH3+5O24NO+6H2O。
(2)只有高锰酸钾具有氧化性,其余物质不具有氧化性,因此选D;用NaClO溶液氧化NO的化学方程式和电子转移情况为。
(3)①过程Ⅰ是化学键断裂,因此为吸热过程。过程Ⅱ生成的化学键有碳氧极性键和氮氮非极性键。
②已知过程Ⅰ的焓变为a kJ·mol-1,过程Ⅱ的焓变为b kJ·mol-1,根据盖斯定律,该反应的热化学方程式为2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH=(a+b) kJ·mol-1。
18.答案 Ⅰ.(1)c
(2)2Cu2++3OH-+Cl-Cu2(OH)3Cl↓
(3)0.448
Ⅱ.(4)还原 N (5)260
解析 Ⅰ.(1)根据图知,氧气得电子生成OH-,Cu失电子生成Cu2+,发生吸氧腐蚀,则Cu作负极,即c是负极。
(2)Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子,正极上生成OH-,所以离子方程式为2Cu2++3OH-+Cl-Cu2(OH)3Cl↓。
(3)n[Cu2(OH)3Cl]==0.02 mol,根据得失电子守恒得n(O2)==0.02 mol,V(O2)=0.02 mol×22.4 L·mol-1=0.448 L。
Ⅱ.(4)放电时,金属Zn发生氧化反应生成Zn2+,即M电极为负极,则N电极为正极,得电子发生还原反应;原电池中阳离子向正极移动,所以Zn2+向N极移动。
(5)根据PTO-Zn2+的结构可知,每生成1 mol PTO-Zn2+,需要4 mol Zn2+,所以M极溶解Zn的质量为65 g·mol-1×4 mol=260 g。
19.答案 (1)N2H4(l)+2H2O2(l)N2(g)+4H2O(g) ΔH=-640.0 kJ·mol-1
(2)408.0
(3)释放大量热、产物不会造成环境污染
(4)N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1
(5)390
(6)
(7)Cl--5e-+2H2OClO2↑+4H+
(8)0.01 mol
解析 (1)由题意可知,肼与双氧水反应生成氮气和水,反应的化学方程式为N2H4+2H2O2N2+4H2O,0.4 mol液态肼与0.8 mol H2O2恰好完全反应放出256.0 kJ的热量,则1 mol液态肼反应放出的热量为=640.0 kJ,反应的热化学方程式为N2H4(l)+2H2O2(l)N2(g)+4H2O(g) ΔH=-640.0 kJ·mol-1。
(2)将肼与双氧水反应生成氮气和水设为①,液态水转化为气态水设为②,由盖斯定律可知,反应①-②×4得到N2H4(l)+2H2O2(l)N2(g)+4H2O(l) ΔH=-816.0 kJ·mol-1,16 g液态肼与液态双氧水反应生成液态水时放出的热量是×816.0 kJ·mol-1=408.0 kJ。
(3)由反应方程式可知,用于火箭推进的反应为肼与双氧水反应生成氮气和水,反应时释放大量热、产物为氮气和水,不会造成环境污染。
(4)由图可知,合成氨反应的反应物总能量大于生成物总能量,生成1 mol氨气放出46 kJ热量,则反应的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·mol-1。
(5)设N—H键的键能为a kJ·mol-1,由反应热等于反应物的总键能和生成物的总键能之差可得:ΔH=943 kJ·mol-1+3×435 kJ·mol-1-6a kJ·mol-1=-92 kJ·mol-1,解得a=390。
(6)由盖斯定律可知,反应①-3×②可得反应4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH=(3b-a) kJ·mol-1,1 mol NH3还原NO至N2放出热量为 kJ。
(7)由题意可知,Cl-放电生成ClO2,电极反应式为Cl--5e-+2H2OClO2↑+4H+。
(8)阴极产生标准状况下112 mL气体是H2,物质的量为0.005 mol,阴极电极反应式为2H2O+2e-H2↑+2OH-,所以阴极区产生0.01 mol OH-,则通过阳离子交换膜的Na+的物质的量为0.01 mol。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
