湖北省黄冈中学2025届高三下学期第四次模拟考试 化学试卷(含答案)
文档属性
| 名称 | 湖北省黄冈中学2025届高三下学期第四次模拟考试 化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-07 10:03:23 | ||
图片预览


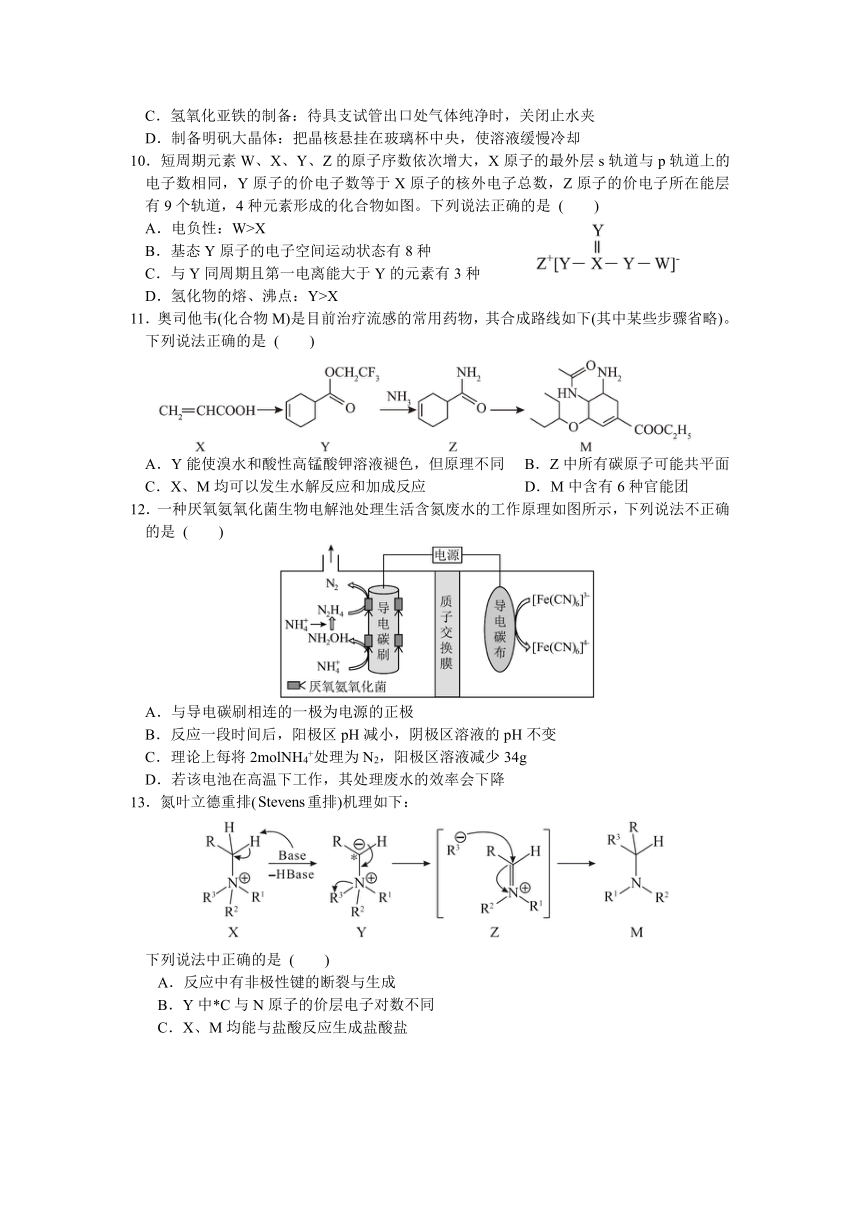
文档简介
湖北省黄冈中学2025届高三第四次模拟考试
化学试卷
试卷满分:100分
可能用到的相对原子质量:H:1 C:12 N:14 O:16
一、选择题:本题共15小题,每题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2025央视春晚舞台上,创意融合舞蹈《秧BOT》,不仅仅是一场视觉盛宴,更是科技与传统文化的完美结合。下列说法正确的是 ( )
A.其控制芯片主要材料为二氧化硅,属于共价晶体
B.为机器人提供续航的锂电池,轻便稳定,比能量较低
C.机身使用碳纤维属于新型无机非金属材料
D.机身用到的铝合金,比纯铝的熔点高、硬度大
2.下列化学用语表达正确的是 ( )
A.H-Cl的s-p σ键的形成:
B.SeO3的VSEPR模型:
C.CaO2的电子式:
D.丁酸的键线式:
3.下列陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是 ( )
选项 陈述Ⅰ 陈述Ⅱ
A 先铺设聚丙烯酸钠树脂材料后再种植 聚丙烯酸钠树脂具有吸水性和保水性
B 用氧炔焰切割金属 乙炔具有还原性
C 石墨可用作润滑剂 石墨中形成大π键的电子可以在整个碳原子平面上运动
D 卤素单质沸点:Cl2Br-Br>I-I
4.下列离子方程式书写正确的是 ( )
A.H2O2使酸性KMnO4溶液褪色:2MnO4- +H2O2 + 6H+ = 2Mn2+ + 3O2↑ + 4H2O
B.向冷的石灰乳中通入Cl2制漂白粉:Cl2 + 2OH- = Cl- + ClO- + H2O
C.用铁氰化钾检验FeSO4溶液中的Fe2+:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
D.水杨酸溶液中加入少量碳酸钠:
5.设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )
A.标准状况下,1molFe与22.4LCl2完全反应时则转移电子数目为3 NA
B.在常温常压下,44g N2O与CO2混合物气体中所含的原子数目一定为3 NA
C.1L pH=13的NaOH溶液中含有OH 的数目一定为0.1 NA
D.环戊二烯()分子中含有的键数目为5 NA
6.类比和推理是学习化学常用的思维方法,下列结论合理的是( )
选项 已知 方法 结论
A O2是非极性分子 类比 O3是非极性分子
B 苯不能使酸性KMnO4溶液褪色 类比 甲苯不能使酸性KMnO4溶液褪色
C “杯酚”分离C60和C70 推理 “杯酚”与C60、C70形成化学键强度不同
D 离子液体中离子的半径大 推理 离子液体的熔沸点低
7.关于CO2和SO2的下列说法中,正确的是 ( )
A.由推知,可发生反应:
B.澄清石灰水和酸性KMnO4溶液均可以区分CO2和SO2
C.可用饱和Na2CO3溶液除去CO2中少量的SO2
D.分子的球棍模型:
8.回收某光盘金属层中少量Ag的方案如下(其他金属含量过低,可忽略)。
下列说法不正确的是 ( )
A.操作a和操作b均为过滤
B.①中NaClO作氧化剂
C.②中加入氨水的作用溶解AgCl
D.③中若X是甲醛溶液,生成Ag的反应为HCHO + 2[Ag(NH3)2]OH HCOONH4
+ 2Ag↓+ 3NH3 + H2O
9.下列实验中,实验装置及操作均正确的是 ( )
A.制备氢氧化铁胶体:向沸水中逐滴加入5~6滴Fe2(SO4)3饱和溶液
B.检验溴乙烷与NaOH溶液反应后的Br—:向反应后的溶液中加入AgNO3溶液
C.氢氧化亚铁的制备:待具支试管出口处气体纯净时,关闭止水夹
D.制备明矾大晶体:把晶核悬挂在玻璃杯中央,使溶液缓慢冷却
10.短周期元素W、X、Y、Z的原子序数依次增大,X原子的最外层s轨道与p轨道上的电子数相同,Y原子的价电子数等于X原子的核外电子总数,Z原子的价电子所在能层有9个轨道,4种元素形成的化合物如图。下列说法正确的是 ( )
A.电负性:W>X
B.基态Y原子的电子空间运动状态有8种
C.与Y同周期且第一电离能大于Y的元素有3种
D.氢化物的熔、沸点:Y>X
11.奥司他韦(化合物M)是目前治疗流感的常用药物,其合成路线如下(其中某些步骤省略)。下列说法正确的是 ( )
A.Y能使溴水和酸性高锰酸钾溶液褪色,但原理不同 B.Z中所有碳原子可能共平面
C.X、M均可以发生水解反应和加成反应 D.M中含有6种官能团
12.一种厌氧氨氧化菌生物电解池处理生活含氮废水的工作原理如图所示,下列说法不正确的是 ( )
A.与导电碳刷相连的一极为电源的正极
B.反应一段时间后,阳极区pH减小,阴极区溶液的pH不变
C.理论上每将2molNH4+处理为N2,阳极区溶液减少34g
D.若该电池在高温下工作,其处理废水的效率会下降
13.氮叶立德重排(重排)机理如下:
下列说法中正确的是 ( )
A.反应中有非极性键的断裂与生成
B.Y中*C与N原子的价层电子对数不同
C.X、M均能与盐酸反应生成盐酸盐
D.根据机理推测,可实现如下转化
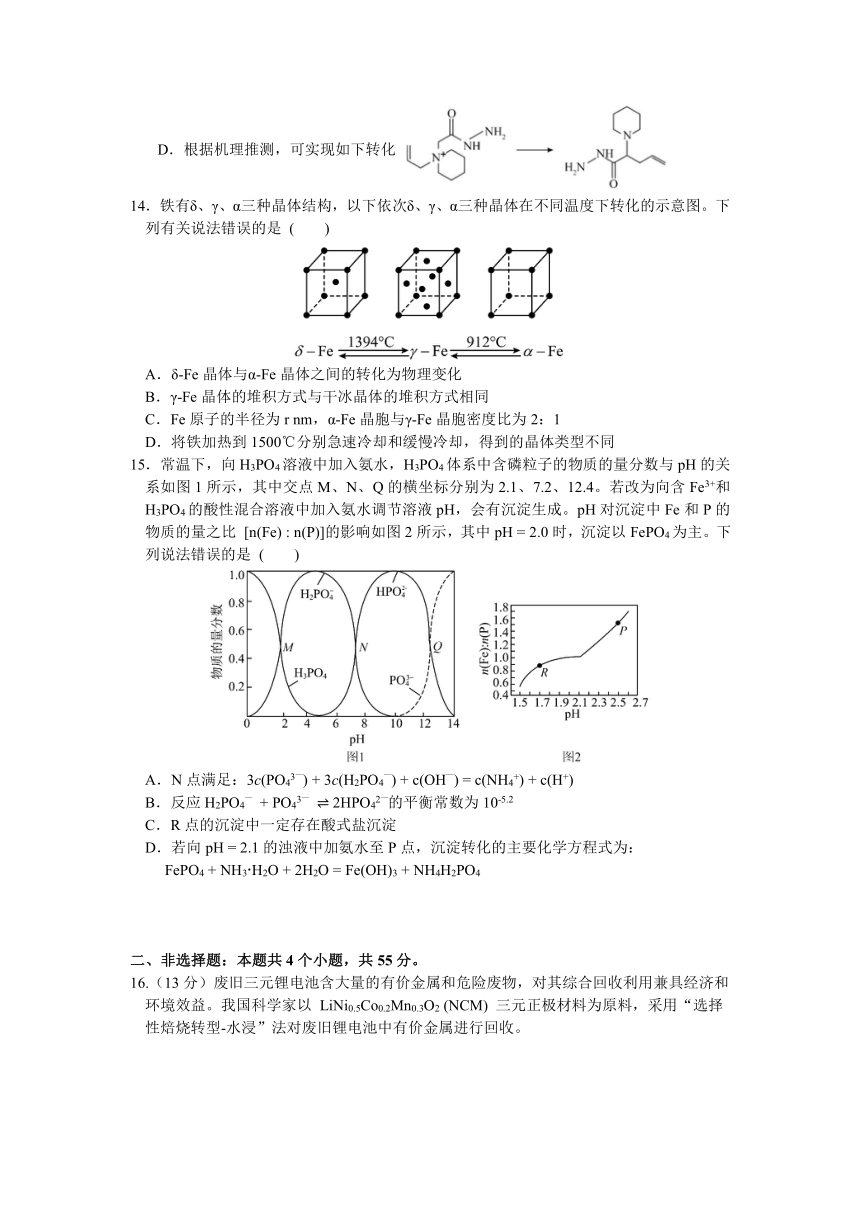
14.铁有δ、γ、α三种晶体结构,以下依次δ、γ、α三种晶体在不同温度下转化的示意图。下列有关说法错误的是 ( )
A.δ-Fe晶体与α-Fe晶体之间的转化为物理变化
B.γ-Fe晶体的堆积方式与干冰晶体的堆积方式相同
C.Fe原子的半径为r nm,α-Fe晶胞与γ-Fe晶胞密度比为2:1
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型不同
15.常温下,向H3PO4溶液中加入氨水,H3PO4体系中含磷粒子的物质的量分数与pH的关系如图1所示,其中交点M、N、Q的横坐标分别为2.1、7.2、12.4。若改为向含Fe3+和H3PO4的酸性混合溶液中加入氨水调节溶液pH,会有沉淀生成。pH对沉淀中Fe和P的物质的量之比 [n(Fe) : n(P)]的影响如图2所示,其中pH = 2.0时,沉淀以FePO4为主。下列说法错误的是 ( )
A.N点满足:3c(PO43—) + 3c(H2PO4—) + c(OH—) = c(NH4+) + c(H+)
B.反应H2PO4— + PO43— 2HPO42—的平衡常数为10-5.2
C.R点的沉淀中一定存在酸式盐沉淀
D.若向pH = 2.1的浊液中加氨水至P点,沉淀转化的主要化学方程式为:
FePO4 + NH3H2O + 2H2O = Fe(OH)3 + NH4H2PO4
二、非选择题:本题共4个小题,共55分。
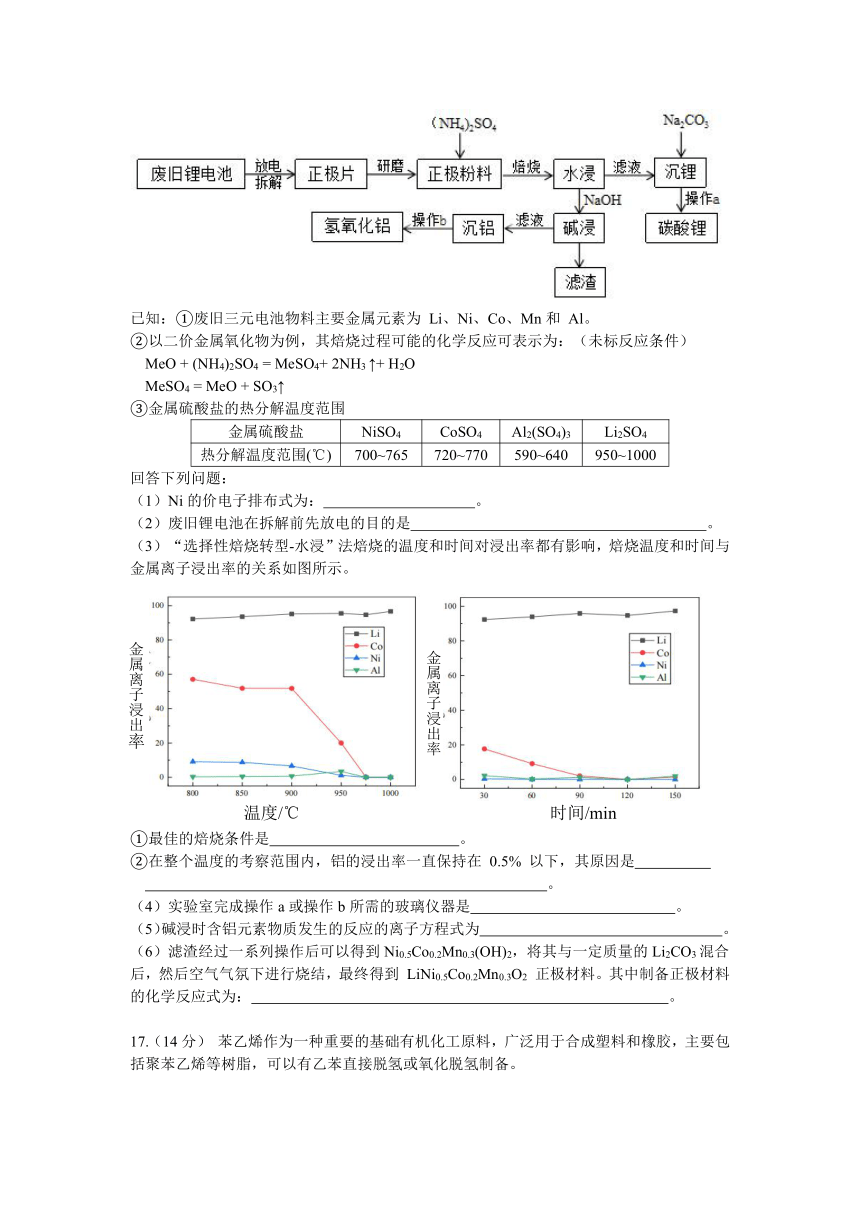
16.(13分)废旧三元锂电池含大量的有价金属和危险废物,对其综合回收利用兼具经济和环境效益。我国科学家以 LiNi0.5Co0.2Mn0.3O2 (NCM) 三元正极材料为原料,采用“选择性焙烧转型-水浸”法对废旧锂电池中有价金属进行回收。
已知:①废旧三元电池物料主要金属元素为 Li、Ni、Co、Mn和 Al。
②以二价金属氧化物为例,其焙烧过程可能的化学反应可表示为:(未标反应条件)
MeO + (NH4)2SO4 = MeSO4+ 2NH3 ↑+ H2O
MeSO4 = MeO + SO3↑
③金属硫酸盐的热分解温度范围
金属硫酸盐 NiSO4 CoSO4 Al2(SO4)3 Li2SO4
热分解温度范围(℃) 700~765 720~770 590~640 950~1000
回答下列问题:
Ni的价电子排布式为: 。
废旧锂电池在拆解前先放电的目的是 。
“选择性焙烧转型-水浸”法焙烧的温度和时间对浸出率都有影响,焙烧温度和时间与 金属离子浸出率的关系如图所示。
①最佳的焙烧条件是 。
②在整个温度的考察范围内,铝的浸出率一直保持在 0.5% 以下,其原因是
。
(4)实验室完成操作a或操作b所需的玻璃仪器是 。
(5)碱浸时含铝元素物质发生的反应的离子方程式为 。
(6)滤渣经过一系列操作后可以得到Ni0.5Co0.2Mn0.3(OH)2,将其与一定质量的Li2CO3混合后,然后空气气氛下进行烧结,最终得到 LiNi0.5Co0.2Mn0.3O2 正极材料。其中制备正极材料的化学反应式为: 。
17.(14分) 苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶,主要包括聚苯乙烯等树脂,可以有乙苯直接脱氢或氧化脱氢制备。
反应I(直接脱氢):(g)(g)+H2(g) ΔH1=+117.6kJ/mol
反应II(氧化脱氢):(g)+CO2(g)(g)+CO(g)+H2O(g) ΔH2=+158.7kJ/mol。
(1)CO2氧化乙苯脱氢过程中伴随反应III:H2(g)+CO2(g)CO(g)+H2O(g)ΔH3= kJ/mol。
(2)工业上不以O2、N2O或SO2作为乙苯氧化脱氢的氧化剂的原因可能是 (填标号)
以强化剂O2为氧源进行乙苯氧化脱氢是放热反应
氧气氧化性强,乙苯容易被深度氧化为CO和CO2,显著降低了苯乙烯的收率
N2O或SO2的氧化性太弱,不能氧化乙苯脱氢
N2O或SO2有毒性,对环境会造成污染
(3)在起始压强100KPa和催化剂作用下,向恒容容器中充入等物质的量的乙苯和CO2。发生上述三个反应,达到平衡时,各物质的体积分数随温度的变化如图所示(A点为虚线的交点)。
①随反应温度升高,苯乙烯体积分数增大的原因是 。
②300℃之后,苯乙烯和H2的体积分数差异变大的原因可能是 。
③590℃下,平衡时乙苯的转化率为 。
(4)CO2氧化乙苯脱氢的催化剂是目前研究的热点,其催化机理如下图所示,催化剂表面的酸碱性对催化效果影响较大。CO2分子中C原子的杂化方式为:________。根据机理分析,在催化剂中加入CaO等碱性氧化物作为助剂的原因是 。
18.(14分)某化学小组探究酸性条件下双氧水与重铬酸钾的反应,室温下进行了相关实验。
已知:①CrO5【也写成CrO(O2)2】为深蓝色,易溶于乙醚、戊醇等有机溶剂,在水溶液中很不稳定,容易分解为Cr3+和O2 ②乙醚易挥发
一般不能用盐酸酸化K2Cr2O7溶液,其原因是 。
实验Ⅰ 实验Ⅱ
迅速变为蓝紫色,无气泡生成,稍后至无色气泡生成,溶液变成绿色 下层呈橙色,上层呈深蓝色,没有观察到有明显气泡生成
实验I中无色气泡是 。
实验I和实验II表明酸性条件下双氧水与重铬酸钾的反应分两步进行,则第一步反应的离子方程式为 。
查阅文献可知,实验II中上层深蓝色物质中含有CrO5与乙醚形成的一种配合物,该配合物中,铬原子周围的四个配位体呈四面体排布,过氧基配体中的O-O键轴正对中心铬原子,乙醚分子中的O原子的孤电子对与中心铬原子以σ键相结合,则该配合物的结构示意图为 。
为探究第二步反应,小组同学将实验II中上层深蓝色物质溶于稀硫酸中,迅速产生气泡,溶液变成绿色。查阅文献可知第二步反应可能的方程式有以下四种情况。
甲:2CrO5+3H2O2+6H+==2Cr3++6H2O+5O2↑
乙:2CrO5+7H2O2+6H+==2Cr3++10H2O+7O2↑
丙:4CrO5+12H+==4Cr3++6H2O+7O2↑
丁:2CrO5+6H+==2Cr3++2H2O+H2O2+3O2↑
为探究哪个方程更符合实际情况,小组同学利用下图装置做了补充实验。
电磁搅拌器 2-H2SO4溶液层 3-含CrO5的乙醚层 4-经过水封的CCl4
①仪器5的名称是 。
②装置4的作用是 。
③反应后的溶液除去乙醚,用KMnO4将Cr3+氧化成Cr2O72-,过量的KMnO4用尿素和亚硝酸钠溶液处理(不考虑尿素、亚硝酸钠与Cr2O72-的反应),然后加入指示剂,用0.0400mol/L标准(NH4)2Fe(SO4)2溶液滴定,共用去标准液30.00mL。另测得生成的O2为15.68mL(已折算至标准状况)。通过计算,则方程 (填“甲”“乙”“丙”或“丁”)更符合实际情况。
19.(14分)有机物M是合成药物多替拉韦钠的中间体,其合成路线如下:
已知:Bn=C6H5CH2-(苄基);Ph=C6H5-(苯基)
M是H与足量H2反应后的产物,M中含氧官能团的名称是 。
A→B反应为取代反应,其中K2CO3的作用是 。
B→C的反应类型为: 。
D→E反应中另一生成物的名称是 。
E→F反应的化学方程式为 。
与含有相同官能团(-OH和-NH2),且含有手性碳原子的同分异构体还有 种。
G→H的第一步反应一般认为是两个羟基脱水,两个羟基连在同一个碳原子上会脱水的原因可能是 。
湖北省黄冈中学2025届高三第四次模拟考试
参考答案
1 2 3 4 5 6 7 8
C D A C B D A D
9 10 11 12 13 14 15
D C A B D C B
16、(13分,除标注外,每空2分)
(1)3d84s2(1分)
防止拆解过程中因短路发生火灾、爆炸等事故
①温度975℃、时间90min(缺少一个条件扣1分)
②在此温度范围内,Al2(SO4)3分解为Al2O3,而Al2O3难溶于水
漏斗、烧杯、玻璃棒
Al2O3+2OH-+3H2O==2[Al(OH)4]-或Al2O3+2OH-==2AlO2-+H2O
4Ni0.5Co0.2Mn0.3(OH)2+O2+2Li2CO3==4LiNi0.5Co0.2Mn0.3O2 +2CO2+4H2O
(14分,每空2分)
+41.1(没有写+也给分)
BD
①反应I、反应II均为吸热反应,升高温度,平衡正向移动
②300℃之后,反应II正向进行的程度大于反应I正向进行的程度 或者 CO2与H2反应,消耗了H2 (合理即给分)
③50%
sp ;增强催化剂表面的碱性,有利于CO2的吸附,增强催化剂的催化效果
(14分,每空2分)
K2Cr2O7可以氧化HCl生成Cl2,对环境会造成污染
O2
4H2O2+Cr2O72-+2H+==2CrO5+5H2O
(没有虚线也可以)
①量气管 (或滴定管、碱式滴定管)
②吸收挥发的乙醚蒸汽,防止其对O2体积的测定产生干扰 ③丙
(14分,每空2分)
羟基、醚键、酰胺基(缺少一个扣1分,扣完为止,有错误不得分)
消耗反应生成的HBr,增大反应物的转化率
加成反应
苯甲酸
6
通过脱水反应生成更稳定的羰基化合物。(或羟基是强吸电子基团,两个羟基同时连在同一个碳上会导致该碳原子正电荷密度过高,引发强烈的电荷排斥;或两个羟基的接近会导致分子内空间排斥,增强结构的张力;或一个羟基的氧原子会通过分子内氢键强烈吸引另一个羟基上的H,导致结构张力极大。合理就给分)
化学试卷
试卷满分:100分
可能用到的相对原子质量:H:1 C:12 N:14 O:16
一、选择题:本题共15小题,每题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.2025央视春晚舞台上,创意融合舞蹈《秧BOT》,不仅仅是一场视觉盛宴,更是科技与传统文化的完美结合。下列说法正确的是 ( )
A.其控制芯片主要材料为二氧化硅,属于共价晶体
B.为机器人提供续航的锂电池,轻便稳定,比能量较低
C.机身使用碳纤维属于新型无机非金属材料
D.机身用到的铝合金,比纯铝的熔点高、硬度大
2.下列化学用语表达正确的是 ( )
A.H-Cl的s-p σ键的形成:
B.SeO3的VSEPR模型:
C.CaO2的电子式:
D.丁酸的键线式:
3.下列陈述Ⅰ和陈述Ⅱ均正确且具有因果关系的是 ( )
选项 陈述Ⅰ 陈述Ⅱ
A 先铺设聚丙烯酸钠树脂材料后再种植 聚丙烯酸钠树脂具有吸水性和保水性
B 用氧炔焰切割金属 乙炔具有还原性
C 石墨可用作润滑剂 石墨中形成大π键的电子可以在整个碳原子平面上运动
D 卤素单质沸点:Cl2
4.下列离子方程式书写正确的是 ( )
A.H2O2使酸性KMnO4溶液褪色:2MnO4- +H2O2 + 6H+ = 2Mn2+ + 3O2↑ + 4H2O
B.向冷的石灰乳中通入Cl2制漂白粉:Cl2 + 2OH- = Cl- + ClO- + H2O
C.用铁氰化钾检验FeSO4溶液中的Fe2+:K++Fe2++[Fe(CN)6]3-=KFe[Fe(CN)6]↓
D.水杨酸溶液中加入少量碳酸钠:
5.设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )
A.标准状况下,1molFe与22.4LCl2完全反应时则转移电子数目为3 NA
B.在常温常压下,44g N2O与CO2混合物气体中所含的原子数目一定为3 NA
C.1L pH=13的NaOH溶液中含有OH 的数目一定为0.1 NA
D.环戊二烯()分子中含有的键数目为5 NA
6.类比和推理是学习化学常用的思维方法,下列结论合理的是( )
选项 已知 方法 结论
A O2是非极性分子 类比 O3是非极性分子
B 苯不能使酸性KMnO4溶液褪色 类比 甲苯不能使酸性KMnO4溶液褪色
C “杯酚”分离C60和C70 推理 “杯酚”与C60、C70形成化学键强度不同
D 离子液体中离子的半径大 推理 离子液体的熔沸点低
7.关于CO2和SO2的下列说法中,正确的是 ( )
A.由推知,可发生反应:
B.澄清石灰水和酸性KMnO4溶液均可以区分CO2和SO2
C.可用饱和Na2CO3溶液除去CO2中少量的SO2
D.分子的球棍模型:
8.回收某光盘金属层中少量Ag的方案如下(其他金属含量过低,可忽略)。
下列说法不正确的是 ( )
A.操作a和操作b均为过滤
B.①中NaClO作氧化剂
C.②中加入氨水的作用溶解AgCl
D.③中若X是甲醛溶液,生成Ag的反应为HCHO + 2[Ag(NH3)2]OH HCOONH4
+ 2Ag↓+ 3NH3 + H2O
9.下列实验中,实验装置及操作均正确的是 ( )
A.制备氢氧化铁胶体:向沸水中逐滴加入5~6滴Fe2(SO4)3饱和溶液
B.检验溴乙烷与NaOH溶液反应后的Br—:向反应后的溶液中加入AgNO3溶液
C.氢氧化亚铁的制备:待具支试管出口处气体纯净时,关闭止水夹
D.制备明矾大晶体:把晶核悬挂在玻璃杯中央,使溶液缓慢冷却
10.短周期元素W、X、Y、Z的原子序数依次增大,X原子的最外层s轨道与p轨道上的电子数相同,Y原子的价电子数等于X原子的核外电子总数,Z原子的价电子所在能层有9个轨道,4种元素形成的化合物如图。下列说法正确的是 ( )
A.电负性:W>X
B.基态Y原子的电子空间运动状态有8种
C.与Y同周期且第一电离能大于Y的元素有3种
D.氢化物的熔、沸点:Y>X
11.奥司他韦(化合物M)是目前治疗流感的常用药物,其合成路线如下(其中某些步骤省略)。下列说法正确的是 ( )
A.Y能使溴水和酸性高锰酸钾溶液褪色,但原理不同 B.Z中所有碳原子可能共平面
C.X、M均可以发生水解反应和加成反应 D.M中含有6种官能团
12.一种厌氧氨氧化菌生物电解池处理生活含氮废水的工作原理如图所示,下列说法不正确的是 ( )
A.与导电碳刷相连的一极为电源的正极
B.反应一段时间后,阳极区pH减小,阴极区溶液的pH不变
C.理论上每将2molNH4+处理为N2,阳极区溶液减少34g
D.若该电池在高温下工作,其处理废水的效率会下降
13.氮叶立德重排(重排)机理如下:
下列说法中正确的是 ( )
A.反应中有非极性键的断裂与生成
B.Y中*C与N原子的价层电子对数不同
C.X、M均能与盐酸反应生成盐酸盐
D.根据机理推测,可实现如下转化
14.铁有δ、γ、α三种晶体结构,以下依次δ、γ、α三种晶体在不同温度下转化的示意图。下列有关说法错误的是 ( )
A.δ-Fe晶体与α-Fe晶体之间的转化为物理变化
B.γ-Fe晶体的堆积方式与干冰晶体的堆积方式相同
C.Fe原子的半径为r nm,α-Fe晶胞与γ-Fe晶胞密度比为2:1
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型不同
15.常温下,向H3PO4溶液中加入氨水,H3PO4体系中含磷粒子的物质的量分数与pH的关系如图1所示,其中交点M、N、Q的横坐标分别为2.1、7.2、12.4。若改为向含Fe3+和H3PO4的酸性混合溶液中加入氨水调节溶液pH,会有沉淀生成。pH对沉淀中Fe和P的物质的量之比 [n(Fe) : n(P)]的影响如图2所示,其中pH = 2.0时,沉淀以FePO4为主。下列说法错误的是 ( )
A.N点满足:3c(PO43—) + 3c(H2PO4—) + c(OH—) = c(NH4+) + c(H+)
B.反应H2PO4— + PO43— 2HPO42—的平衡常数为10-5.2
C.R点的沉淀中一定存在酸式盐沉淀
D.若向pH = 2.1的浊液中加氨水至P点,沉淀转化的主要化学方程式为:
FePO4 + NH3H2O + 2H2O = Fe(OH)3 + NH4H2PO4
二、非选择题:本题共4个小题,共55分。
16.(13分)废旧三元锂电池含大量的有价金属和危险废物,对其综合回收利用兼具经济和环境效益。我国科学家以 LiNi0.5Co0.2Mn0.3O2 (NCM) 三元正极材料为原料,采用“选择性焙烧转型-水浸”法对废旧锂电池中有价金属进行回收。
已知:①废旧三元电池物料主要金属元素为 Li、Ni、Co、Mn和 Al。
②以二价金属氧化物为例,其焙烧过程可能的化学反应可表示为:(未标反应条件)
MeO + (NH4)2SO4 = MeSO4+ 2NH3 ↑+ H2O
MeSO4 = MeO + SO3↑
③金属硫酸盐的热分解温度范围
金属硫酸盐 NiSO4 CoSO4 Al2(SO4)3 Li2SO4
热分解温度范围(℃) 700~765 720~770 590~640 950~1000
回答下列问题:
Ni的价电子排布式为: 。
废旧锂电池在拆解前先放电的目的是 。
“选择性焙烧转型-水浸”法焙烧的温度和时间对浸出率都有影响,焙烧温度和时间与 金属离子浸出率的关系如图所示。
①最佳的焙烧条件是 。
②在整个温度的考察范围内,铝的浸出率一直保持在 0.5% 以下,其原因是
。
(4)实验室完成操作a或操作b所需的玻璃仪器是 。
(5)碱浸时含铝元素物质发生的反应的离子方程式为 。
(6)滤渣经过一系列操作后可以得到Ni0.5Co0.2Mn0.3(OH)2,将其与一定质量的Li2CO3混合后,然后空气气氛下进行烧结,最终得到 LiNi0.5Co0.2Mn0.3O2 正极材料。其中制备正极材料的化学反应式为: 。
17.(14分) 苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶,主要包括聚苯乙烯等树脂,可以有乙苯直接脱氢或氧化脱氢制备。
反应I(直接脱氢):(g)(g)+H2(g) ΔH1=+117.6kJ/mol
反应II(氧化脱氢):(g)+CO2(g)(g)+CO(g)+H2O(g) ΔH2=+158.7kJ/mol。
(1)CO2氧化乙苯脱氢过程中伴随反应III:H2(g)+CO2(g)CO(g)+H2O(g)ΔH3= kJ/mol。
(2)工业上不以O2、N2O或SO2作为乙苯氧化脱氢的氧化剂的原因可能是 (填标号)
以强化剂O2为氧源进行乙苯氧化脱氢是放热反应
氧气氧化性强,乙苯容易被深度氧化为CO和CO2,显著降低了苯乙烯的收率
N2O或SO2的氧化性太弱,不能氧化乙苯脱氢
N2O或SO2有毒性,对环境会造成污染
(3)在起始压强100KPa和催化剂作用下,向恒容容器中充入等物质的量的乙苯和CO2。发生上述三个反应,达到平衡时,各物质的体积分数随温度的变化如图所示(A点为虚线的交点)。
①随反应温度升高,苯乙烯体积分数增大的原因是 。
②300℃之后,苯乙烯和H2的体积分数差异变大的原因可能是 。
③590℃下,平衡时乙苯的转化率为 。
(4)CO2氧化乙苯脱氢的催化剂是目前研究的热点,其催化机理如下图所示,催化剂表面的酸碱性对催化效果影响较大。CO2分子中C原子的杂化方式为:________。根据机理分析,在催化剂中加入CaO等碱性氧化物作为助剂的原因是 。
18.(14分)某化学小组探究酸性条件下双氧水与重铬酸钾的反应,室温下进行了相关实验。
已知:①CrO5【也写成CrO(O2)2】为深蓝色,易溶于乙醚、戊醇等有机溶剂,在水溶液中很不稳定,容易分解为Cr3+和O2 ②乙醚易挥发
一般不能用盐酸酸化K2Cr2O7溶液,其原因是 。
实验Ⅰ 实验Ⅱ
迅速变为蓝紫色,无气泡生成,稍后至无色气泡生成,溶液变成绿色 下层呈橙色,上层呈深蓝色,没有观察到有明显气泡生成
实验I中无色气泡是 。
实验I和实验II表明酸性条件下双氧水与重铬酸钾的反应分两步进行,则第一步反应的离子方程式为 。
查阅文献可知,实验II中上层深蓝色物质中含有CrO5与乙醚形成的一种配合物,该配合物中,铬原子周围的四个配位体呈四面体排布,过氧基配体中的O-O键轴正对中心铬原子,乙醚分子中的O原子的孤电子对与中心铬原子以σ键相结合,则该配合物的结构示意图为 。
为探究第二步反应,小组同学将实验II中上层深蓝色物质溶于稀硫酸中,迅速产生气泡,溶液变成绿色。查阅文献可知第二步反应可能的方程式有以下四种情况。
甲:2CrO5+3H2O2+6H+==2Cr3++6H2O+5O2↑
乙:2CrO5+7H2O2+6H+==2Cr3++10H2O+7O2↑
丙:4CrO5+12H+==4Cr3++6H2O+7O2↑
丁:2CrO5+6H+==2Cr3++2H2O+H2O2+3O2↑
为探究哪个方程更符合实际情况,小组同学利用下图装置做了补充实验。
电磁搅拌器 2-H2SO4溶液层 3-含CrO5的乙醚层 4-经过水封的CCl4
①仪器5的名称是 。
②装置4的作用是 。
③反应后的溶液除去乙醚,用KMnO4将Cr3+氧化成Cr2O72-,过量的KMnO4用尿素和亚硝酸钠溶液处理(不考虑尿素、亚硝酸钠与Cr2O72-的反应),然后加入指示剂,用0.0400mol/L标准(NH4)2Fe(SO4)2溶液滴定,共用去标准液30.00mL。另测得生成的O2为15.68mL(已折算至标准状况)。通过计算,则方程 (填“甲”“乙”“丙”或“丁”)更符合实际情况。
19.(14分)有机物M是合成药物多替拉韦钠的中间体,其合成路线如下:
已知:Bn=C6H5CH2-(苄基);Ph=C6H5-(苯基)
M是H与足量H2反应后的产物,M中含氧官能团的名称是 。
A→B反应为取代反应,其中K2CO3的作用是 。
B→C的反应类型为: 。
D→E反应中另一生成物的名称是 。
E→F反应的化学方程式为 。
与含有相同官能团(-OH和-NH2),且含有手性碳原子的同分异构体还有 种。
G→H的第一步反应一般认为是两个羟基脱水,两个羟基连在同一个碳原子上会脱水的原因可能是 。
湖北省黄冈中学2025届高三第四次模拟考试
参考答案
1 2 3 4 5 6 7 8
C D A C B D A D
9 10 11 12 13 14 15
D C A B D C B
16、(13分,除标注外,每空2分)
(1)3d84s2(1分)
防止拆解过程中因短路发生火灾、爆炸等事故
①温度975℃、时间90min(缺少一个条件扣1分)
②在此温度范围内,Al2(SO4)3分解为Al2O3,而Al2O3难溶于水
漏斗、烧杯、玻璃棒
Al2O3+2OH-+3H2O==2[Al(OH)4]-或Al2O3+2OH-==2AlO2-+H2O
4Ni0.5Co0.2Mn0.3(OH)2+O2+2Li2CO3==4LiNi0.5Co0.2Mn0.3O2 +2CO2+4H2O
(14分,每空2分)
+41.1(没有写+也给分)
BD
①反应I、反应II均为吸热反应,升高温度,平衡正向移动
②300℃之后,反应II正向进行的程度大于反应I正向进行的程度 或者 CO2与H2反应,消耗了H2 (合理即给分)
③50%
sp ;增强催化剂表面的碱性,有利于CO2的吸附,增强催化剂的催化效果
(14分,每空2分)
K2Cr2O7可以氧化HCl生成Cl2,对环境会造成污染
O2
4H2O2+Cr2O72-+2H+==2CrO5+5H2O
(没有虚线也可以)
①量气管 (或滴定管、碱式滴定管)
②吸收挥发的乙醚蒸汽,防止其对O2体积的测定产生干扰 ③丙
(14分,每空2分)
羟基、醚键、酰胺基(缺少一个扣1分,扣完为止,有错误不得分)
消耗反应生成的HBr,增大反应物的转化率
加成反应
苯甲酸
6
通过脱水反应生成更稳定的羰基化合物。(或羟基是强吸电子基团,两个羟基同时连在同一个碳上会导致该碳原子正电荷密度过高,引发强烈的电荷排斥;或两个羟基的接近会导致分子内空间排斥,增强结构的张力;或一个羟基的氧原子会通过分子内氢键强烈吸引另一个羟基上的H,导致结构张力极大。合理就给分)
同课章节目录
