专题—溶解度曲线与溶液的稀释 课件(共17张PPT)
文档属性
| 名称 | 专题—溶解度曲线与溶液的稀释 课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-08 11:54:23 | ||
图片预览




文档简介
(共17张PPT)
2
0
2
5
2025中考化学专题复习 Special topic review
专题—溶解度曲线与溶液的稀释
目录
明
确
考
点
Define the test site
1.
一定温度时溶解度大小的比较
2.
饱和溶液与不饱和溶液的判断与转化
3.
溶质质量分数的相关计算
4.
饱和溶液改变温度时析出晶体的量的比较
改变温度后,溶液中各量的变化
5.
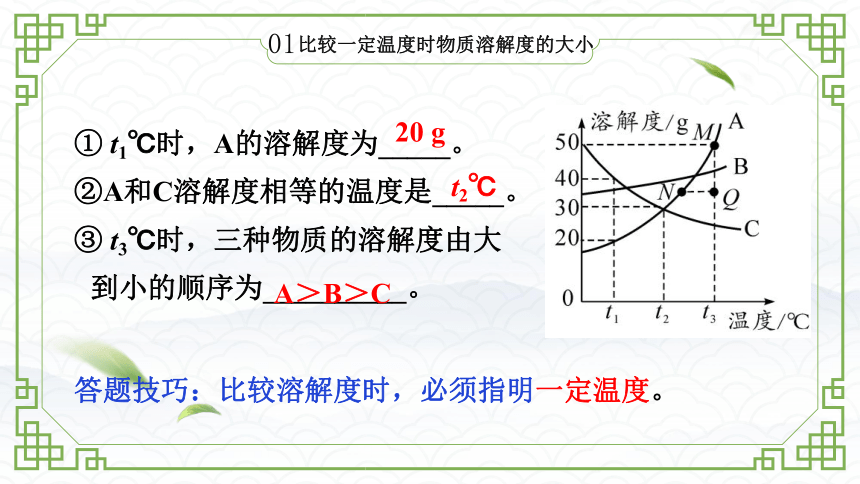
比较一定温度时物质溶解度的大小
01
① t1℃时,A的溶解度为_____。
②A和C溶解度相等的温度是_____。
③ t3℃时,三种物质的溶解度由大
到小的顺序为__________。
20 g
t2℃
A>B>C
答题技巧:比较溶解度时,必须指明一定温度。
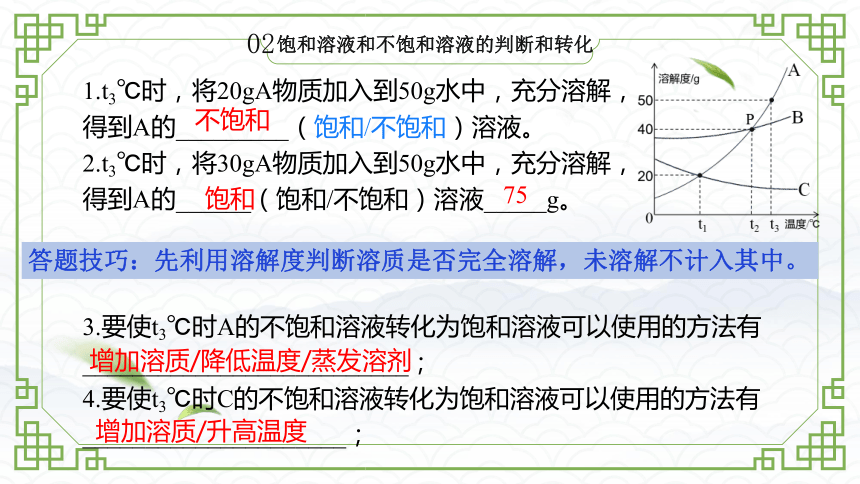
饱和溶液和不饱和溶液的判断和转化
02
1.t3℃时,将20gA物质加入到50g水中,充分溶解,得到A的_________(饱和/不饱和)溶液。
2.t3℃时,将30gA物质加入到50g水中,充分溶解,得到A的______(饱和/不饱和)溶液_____g。
不饱和
饱和
75
3.要使t3℃时A的不饱和溶液转化为饱和溶液可以使用的方法有__________________________;
4.要使t3℃时C的不饱和溶液转化为饱和溶液可以使用的方法有_____________________;
增加溶质/降低温度/蒸发溶剂
增加溶质/升高温度
答题技巧:先利用溶解度判断溶质是否完全溶解,未溶解不计入其中。
溶质质量分数的相关计算
03
①t1℃时,C的饱和溶液的溶质质量
分数为_______(无需保留小数,下同)。
②t2℃时,将20 g水加入盛有50g A的烧杯
中,充分搅拌,所得溶液的溶质质量
分数为_______;
29%
23%
答题技巧:先利用溶解度判断溶质是否完全溶解,未溶解不计入其中。
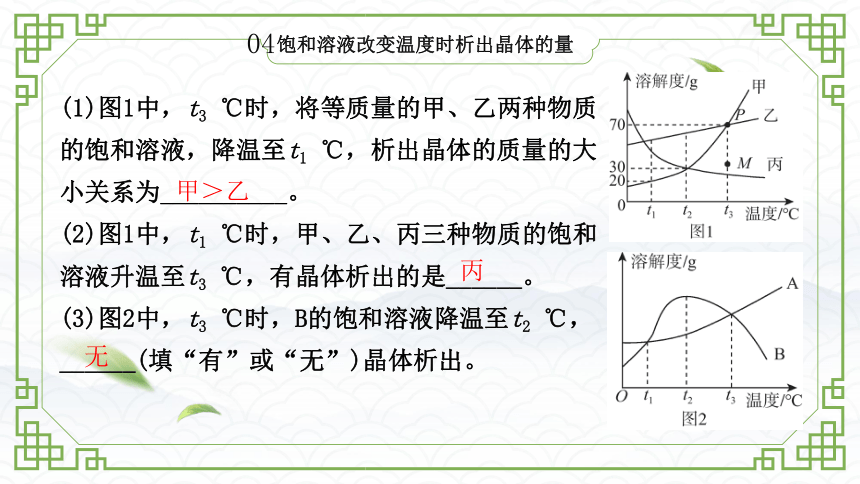
饱和溶液改变温度时析出晶体的量
04
(1)图1中,t3 ℃时,将等质量的甲、乙两种物质的饱和溶液,降温至t1 ℃,析出晶体的质量的大小关系为__________。
(2)图1中,t1 ℃时,甲、乙、丙三种物质的饱和溶液升温至t3 ℃,有晶体析出的是______。
(3)图2中,t3 ℃时,B的饱和溶液降温至t2 ℃,______(填“有”或“无”)晶体析出。
甲>乙
丙
无
改变温度后,溶液中各量的变化
05
方法指导:温度改变,饱和溶液中的溶液、溶质和溶剂的质量以及溶质质量分数可以根据是否有晶体析出判断:
①有晶体析出时,溶质质量 ,溶剂质量 ,溶质质量分数 ;
②无晶体析出时,溶质、溶剂、溶液质量、溶质质量分数 。
减小
不变
减小
都不变
例:分别将甲、乙、丙三种物质的饱和溶液从t1 ℃升温至t3 ℃,所得溶液的溶质质量分数由大到小的顺序为 .
乙>丙>甲
溶质和溶剂质量的比较
06
1.t3℃时,分别用等质量的A、B、C配制成
饱和溶液,需溶剂质量大小为__________;
2.t3℃时,等质量的A、B、C的饱和溶液,
所含溶剂的质量大小为:__________。
C>B>A
C>B>A
答题技巧:①同一温度,等质量的溶质恰好完全溶解,溶解度小的用水多,
形成的溶液的质量大。
②同一温度,等质量的饱和溶液,溶解度小的含水多。
中考链接
1.(2024·广东)硫酸铝的溶解度曲线如图所示.下列说法正确的是( )
A.将硫酸铝饱和溶液从10 ℃升温至40 ℃,仍是饱和溶液
B.20 ℃时,将16.0 g硫酸铝加入50.0 g水中,形成不饱和溶液
C.30 ℃时,硫酸铝的溶解度为36.4 g
D.40 ℃时,硫酸铝饱和溶液的溶质质量分数为45.8%
B
中考链接
2.(2024·深圳)以下为Ca(OH)2、K2CO3溶解度曲线示意图,下列说法正确的是 ( )
A.40 ℃时,琴琴同学将0.14 g Ca(OH)2放入100 g水中得到100.14 g溶液
B.40 ℃时,Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.40 ℃时,K2CO3饱和溶液的溶质质量分数为11.7%
D.40 ℃时,Ca(OH)2溶解度比K2CO3溶解度大
A
中考链接
3.(2023·广东)采集的盐水主要含NaCl和MgSO4.根据图判断,下列说法正确的是 ( )
A.溶解度:MgSO4>NaCl
B.MgSO4的溶解度随温度升高而增大
C.a ℃时,MgSO4溶液的溶质质量分数为50%
D.将盐水蒸发结晶,可得到较纯的NaCl
D
溶液稀释的计算
07
1.t4℃时,将75gA物质的饱和溶液稀释成为溶质质量分数为20%的溶液,需要加水的质量为____g。
50
【方法指导】计算依据:稀释前后溶质的质量不变。
稀释公式:m浓×C%浓 = m稀×C%稀=(m浓+m水)×C%稀
代入数据:75g× ×100%=(75g+m水)×20%
解得:m水=50g
50g 1
50g+100g
1.m溶质=75g× =25g
2.m稀= 25g÷20%=125g
3.m水= 125g-75g=50g
溶液稀释的计算
07
2.t4℃时,向75gA物质的饱和溶液中加入50g水,稀释后溶质质量分数为______。
20%
【方法指导】计算依据:稀释前后溶质的质量不变。
稀释公式:m浓×C%浓 = m稀×C%稀=(m浓+m水)×C%稀
代入数据:75g× ×100%=(75g+50g)×C%稀
解得:C%稀=20%
50g 1
50g+100g
1.m溶质=75g× =25g
2.C%稀= ×100%=20%
中考链接
4. (2020·苏州)K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是 ( )
A. K2CO3的溶解度大于KNO3
B. 乙代表K2CO3的溶解度曲线
C. t ℃应在50~60 ℃之间
D. 40 ℃时,100 g KNO3饱和溶液中含63.9 g KNO3
温度/℃ 20 40 50 60 80
溶解度/g K2CO3 110 117 121 126 139
KNO3 31.6 63.9 85.5 110 169
B
中考链接
5. (2020·淮安)如图是硝酸钾(KNO3)和氯化钾(KCl)的溶解度曲线,请回答下列问题。
(1) 10 ℃时,KNO3和KCl的溶解度大小关系:KNO3________(填“>”“<”或“=”)KCl。
(2) 60 ℃时,将120 g KNO3固体放入100 g水中,充分溶解后,所得溶液的质量为________g。
(3) KNO3中混有少量的KCl,可用____________的方法提纯KNO3。
<
210
降温结晶
中考链接
6. (2020·金昌)如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1) 0 ℃时,三种物质中溶解度最小的是________。
(2) 将甲溶液由A点转变为B点,可采用的方法是________________(填一种)。
(3) t2℃时,在盛有50 g水的烧杯中加入35 g丙物质,充分搅拌后所得溶液的质量是________g。
(4) 若将t3℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,没有晶体析出的是________物质。
甲
增加甲物质
80
丙
谢谢观看
Your content to play here, or through paste in this box, and select only the text. Your content to play here
工作总结 / 工作汇报 / 工作计划 / 中国风
2
0
2
5
2
0
2
5
2025中考化学专题复习 Special topic review
专题—溶解度曲线与溶液的稀释
目录
明
确
考
点
Define the test site
1.
一定温度时溶解度大小的比较
2.
饱和溶液与不饱和溶液的判断与转化
3.
溶质质量分数的相关计算
4.
饱和溶液改变温度时析出晶体的量的比较
改变温度后,溶液中各量的变化
5.
比较一定温度时物质溶解度的大小
01
① t1℃时,A的溶解度为_____。
②A和C溶解度相等的温度是_____。
③ t3℃时,三种物质的溶解度由大
到小的顺序为__________。
20 g
t2℃
A>B>C
答题技巧:比较溶解度时,必须指明一定温度。
饱和溶液和不饱和溶液的判断和转化
02
1.t3℃时,将20gA物质加入到50g水中,充分溶解,得到A的_________(饱和/不饱和)溶液。
2.t3℃时,将30gA物质加入到50g水中,充分溶解,得到A的______(饱和/不饱和)溶液_____g。
不饱和
饱和
75
3.要使t3℃时A的不饱和溶液转化为饱和溶液可以使用的方法有__________________________;
4.要使t3℃时C的不饱和溶液转化为饱和溶液可以使用的方法有_____________________;
增加溶质/降低温度/蒸发溶剂
增加溶质/升高温度
答题技巧:先利用溶解度判断溶质是否完全溶解,未溶解不计入其中。
溶质质量分数的相关计算
03
①t1℃时,C的饱和溶液的溶质质量
分数为_______(无需保留小数,下同)。
②t2℃时,将20 g水加入盛有50g A的烧杯
中,充分搅拌,所得溶液的溶质质量
分数为_______;
29%
23%
答题技巧:先利用溶解度判断溶质是否完全溶解,未溶解不计入其中。
饱和溶液改变温度时析出晶体的量
04
(1)图1中,t3 ℃时,将等质量的甲、乙两种物质的饱和溶液,降温至t1 ℃,析出晶体的质量的大小关系为__________。
(2)图1中,t1 ℃时,甲、乙、丙三种物质的饱和溶液升温至t3 ℃,有晶体析出的是______。
(3)图2中,t3 ℃时,B的饱和溶液降温至t2 ℃,______(填“有”或“无”)晶体析出。
甲>乙
丙
无
改变温度后,溶液中各量的变化
05
方法指导:温度改变,饱和溶液中的溶液、溶质和溶剂的质量以及溶质质量分数可以根据是否有晶体析出判断:
①有晶体析出时,溶质质量 ,溶剂质量 ,溶质质量分数 ;
②无晶体析出时,溶质、溶剂、溶液质量、溶质质量分数 。
减小
不变
减小
都不变
例:分别将甲、乙、丙三种物质的饱和溶液从t1 ℃升温至t3 ℃,所得溶液的溶质质量分数由大到小的顺序为 .
乙>丙>甲
溶质和溶剂质量的比较
06
1.t3℃时,分别用等质量的A、B、C配制成
饱和溶液,需溶剂质量大小为__________;
2.t3℃时,等质量的A、B、C的饱和溶液,
所含溶剂的质量大小为:__________。
C>B>A
C>B>A
答题技巧:①同一温度,等质量的溶质恰好完全溶解,溶解度小的用水多,
形成的溶液的质量大。
②同一温度,等质量的饱和溶液,溶解度小的含水多。
中考链接
1.(2024·广东)硫酸铝的溶解度曲线如图所示.下列说法正确的是( )
A.将硫酸铝饱和溶液从10 ℃升温至40 ℃,仍是饱和溶液
B.20 ℃时,将16.0 g硫酸铝加入50.0 g水中,形成不饱和溶液
C.30 ℃时,硫酸铝的溶解度为36.4 g
D.40 ℃时,硫酸铝饱和溶液的溶质质量分数为45.8%
B
中考链接
2.(2024·深圳)以下为Ca(OH)2、K2CO3溶解度曲线示意图,下列说法正确的是 ( )
A.40 ℃时,琴琴同学将0.14 g Ca(OH)2放入100 g水中得到100.14 g溶液
B.40 ℃时,Ca(OH)2的饱和溶液降温后仍是饱和溶液
C.40 ℃时,K2CO3饱和溶液的溶质质量分数为11.7%
D.40 ℃时,Ca(OH)2溶解度比K2CO3溶解度大
A
中考链接
3.(2023·广东)采集的盐水主要含NaCl和MgSO4.根据图判断,下列说法正确的是 ( )
A.溶解度:MgSO4>NaCl
B.MgSO4的溶解度随温度升高而增大
C.a ℃时,MgSO4溶液的溶质质量分数为50%
D.将盐水蒸发结晶,可得到较纯的NaCl
D
溶液稀释的计算
07
1.t4℃时,将75gA物质的饱和溶液稀释成为溶质质量分数为20%的溶液,需要加水的质量为____g。
50
【方法指导】计算依据:稀释前后溶质的质量不变。
稀释公式:m浓×C%浓 = m稀×C%稀=(m浓+m水)×C%稀
代入数据:75g× ×100%=(75g+m水)×20%
解得:m水=50g
50g 1
50g+100g
1.m溶质=75g× =25g
2.m稀= 25g÷20%=125g
3.m水= 125g-75g=50g
溶液稀释的计算
07
2.t4℃时,向75gA物质的饱和溶液中加入50g水,稀释后溶质质量分数为______。
20%
【方法指导】计算依据:稀释前后溶质的质量不变。
稀释公式:m浓×C%浓 = m稀×C%稀=(m浓+m水)×C%稀
代入数据:75g× ×100%=(75g+50g)×C%稀
解得:C%稀=20%
50g 1
50g+100g
1.m溶质=75g× =25g
2.C%稀= ×100%=20%
中考链接
4. (2020·苏州)K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如下。下列说法正确的是 ( )
A. K2CO3的溶解度大于KNO3
B. 乙代表K2CO3的溶解度曲线
C. t ℃应在50~60 ℃之间
D. 40 ℃时,100 g KNO3饱和溶液中含63.9 g KNO3
温度/℃ 20 40 50 60 80
溶解度/g K2CO3 110 117 121 126 139
KNO3 31.6 63.9 85.5 110 169
B
中考链接
5. (2020·淮安)如图是硝酸钾(KNO3)和氯化钾(KCl)的溶解度曲线,请回答下列问题。
(1) 10 ℃时,KNO3和KCl的溶解度大小关系:KNO3________(填“>”“<”或“=”)KCl。
(2) 60 ℃时,将120 g KNO3固体放入100 g水中,充分溶解后,所得溶液的质量为________g。
(3) KNO3中混有少量的KCl,可用____________的方法提纯KNO3。
<
210
降温结晶
中考链接
6. (2020·金昌)如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:
(1) 0 ℃时,三种物质中溶解度最小的是________。
(2) 将甲溶液由A点转变为B点,可采用的方法是________________(填一种)。
(3) t2℃时,在盛有50 g水的烧杯中加入35 g丙物质,充分搅拌后所得溶液的质量是________g。
(4) 若将t3℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,没有晶体析出的是________物质。
甲
增加甲物质
80
丙
谢谢观看
Your content to play here, or through paste in this box, and select only the text. Your content to play here
工作总结 / 工作汇报 / 工作计划 / 中国风
2
0
2
5
同课章节目录
