人教版高中化学课件 必修一 3.2几种重要的金属化合物 (共51张PPT)
文档属性
| 名称 | 人教版高中化学课件 必修一 3.2几种重要的金属化合物 (共51张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 00:00:00 | ||
图片预览








文档简介
课件51张PPT。第二节
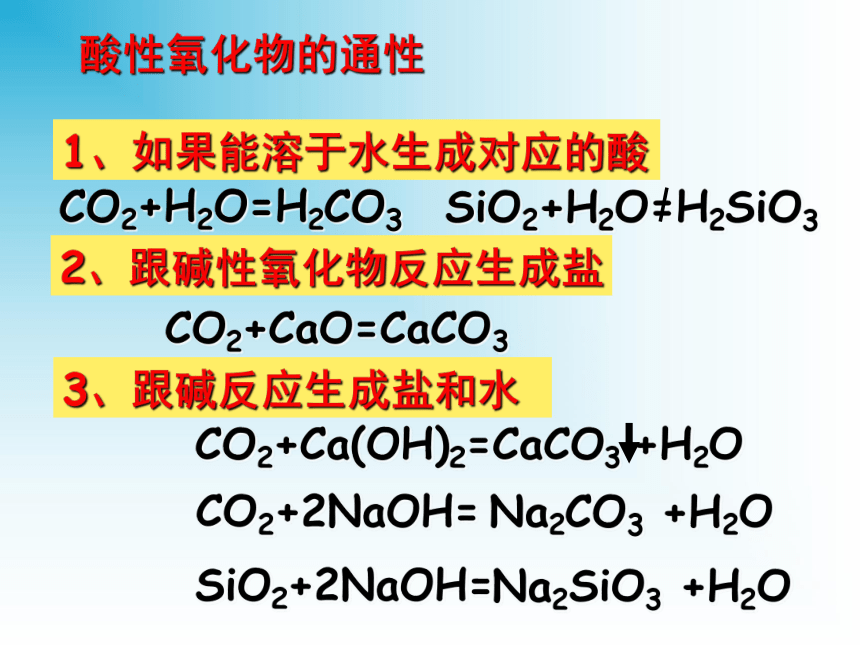
几种重要的金属化合物第一课时:钠的重要化合物金属化合物金属氧化物金属氢氧化物盐绝大多数金属的化学性质活泼,在自然界中以化合态的形式存在氧化物:由两种元素组成,其中一种元素是氧的化合物。酸性氧化物:能跟碱反应生成盐和水的氧化物
如: CO2、SO2、SO3、Mn2O7等不成盐氧化物 如:CO、NO碱性氧化物:能跟酸反应生成盐和水的氧化物
如:CaO 、Na2O、 MgO 等另外还有过氧化物等 如Na2O2两性氧化物:既能跟酸反应生成盐和水,又能跟碱 反应生成盐和水的氧化物 中学阶段只要求知道Al2O3酸性氧化物的通性1、如果能溶于水生成对应的酸3、跟碱反应生成盐和水2、跟碱性氧化物反应生成盐CO2+H2O=H2CO3CO2+CaO=CaCO3CO2+2NaOH=Na2CO3 +H2OSiO2+2NaOH=Na2SiO3 +H2O碱性氧化物的通性1、如果能溶于水生成对应的碱3、跟酸反应生成盐和水2、跟酸性氧化物反应生成盐氧化钠和过氧化钠的性质比较2Na2O2+4HCl ==2Na2O2+2CO2 ==2Na2O2+2H2O ==
一、钠的氧化物有 和 。Na2ONa2O2Na2O2 的重要用途:用于呼吸面具和潜水艇Na2O+H2O=2NaOHNa2O+CO2=Na2CO3Na2O+2HCl=
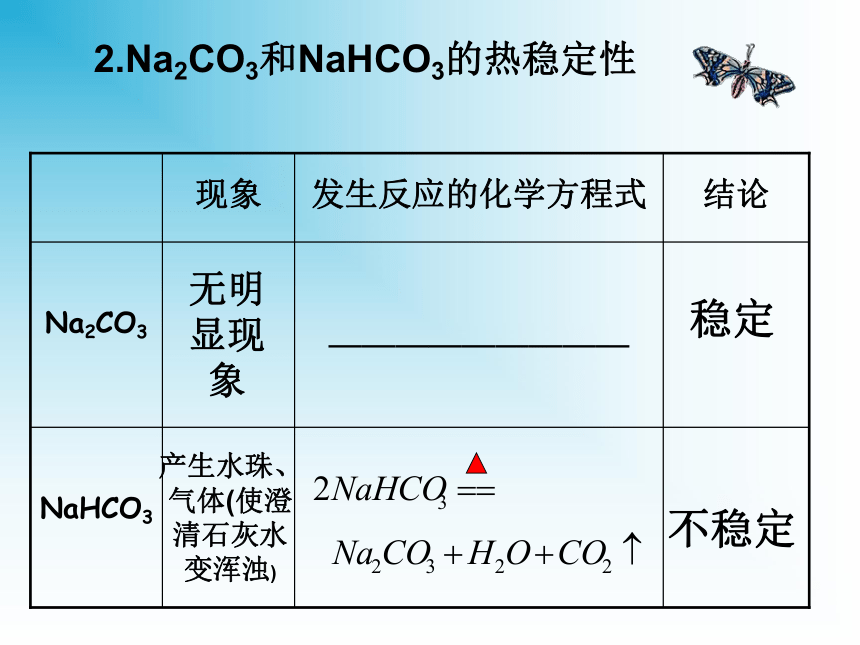
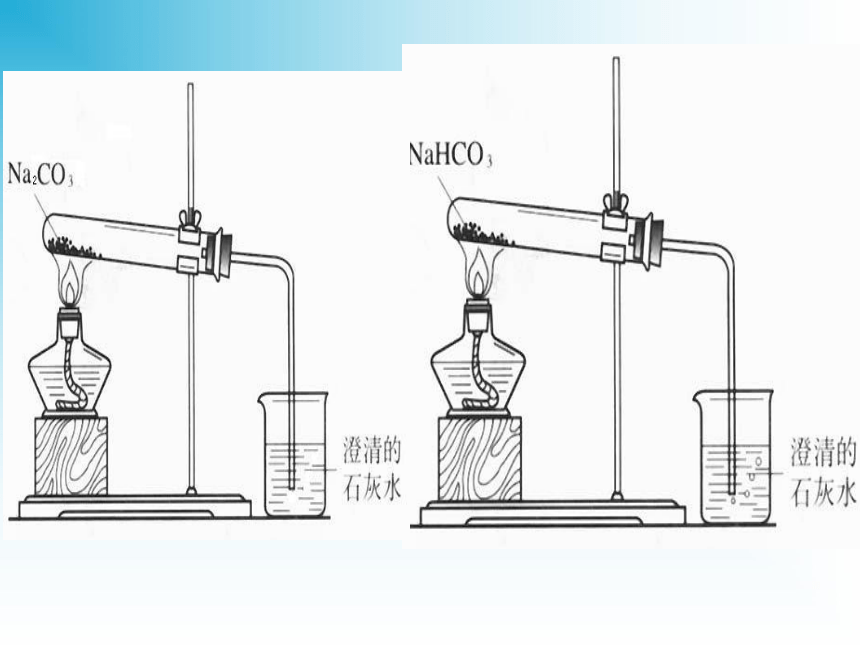
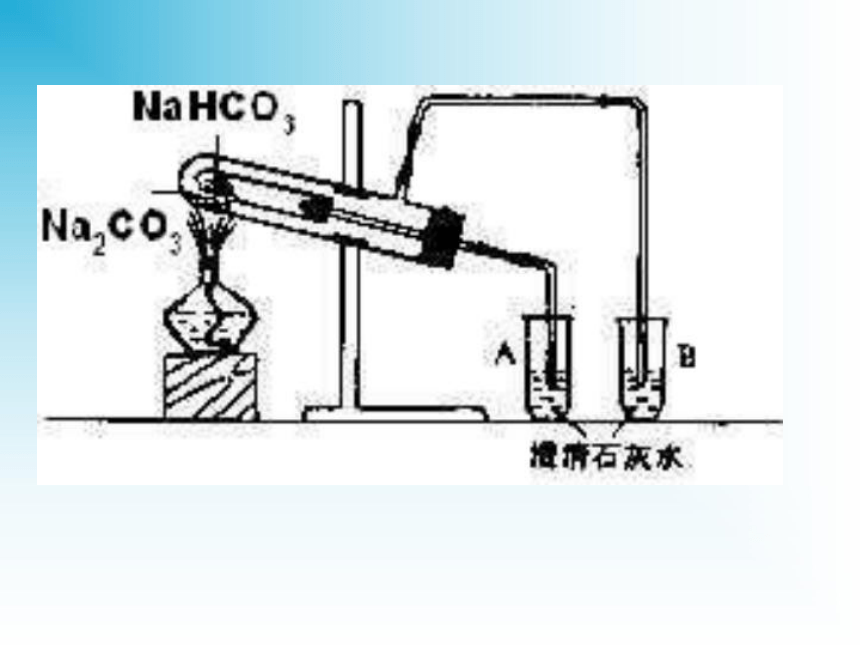
2NaCl+H2O4NaOH+O2↑2Na2CO3+O24NaCl+2H2O+O2↑二、碳酸钠和碳酸氢钠的性质碳酸钠俗名纯碱,也叫苏打。碳酸氢钠俗名小苏打。在水中的电离方程式:1.Na2CO3和NaHCO3的溶解性和碱性实验探究白色粉末,加水结变成晶体;放热细小白色粉末,加水部分溶解;感受不到热量变化振荡时间长时可以溶解固体量减小溶液变红(较深)溶液变微红色溶解度大,溶液的碱性比NaHCO3强溶解度小,溶液的碱性比Na2CO3弱2.Na2CO3和NaHCO3的热稳定性稳定不稳定无明显现象产生水珠、气体(使澄清石灰水变浑浊)思考:怎样除去Na2CO3固体中混有的NaHCO3?充分加热到质量不再减少为止(充分加热到不再有气体产生为止)3.Na2CO3和NaHCO3的其它性质(1)与酸反应反应剧烈程度:CO32-+2H+==H2O+CO2↑HCO3-+H+==H2O+CO2↑(2)与碱反应,Na2CO3与碱不反应(生成难溶性盐的除外,例如Ca(OH)2、Ba(OH)2)注意:在水溶液中HCO3—不能与H+大量共存;也不能与OH—大量共存4、碳酸钠和碳酸氢钠的相互转化Na2CO3 + CO2 + H2O == 2NaHCO3焰色反应焰色反应 —— 金属或它们的化合物在灼烧时 使火焰呈现特殊的颜色,叫焰色反应(是物理现象,不是化学变化,没有生成新的物质)。常见金属元素或金属离子的焰色
钠——黄色
钾——紫色(透过蓝色的钴玻璃)
铜——绿色
钙——砖红色应用—— 可用于鉴别物质中含有哪种金属元素、溶液中含有哪种金属阳离子1、现有两瓶失去标签的Na2CO3和NaHCO3
固体,你能用几种方法将它们区分开来? 2、在饱和Na2CO3溶液中,吹入CO2气体,
可能会有什么现象?
(Na2CO3+H2O+CO2==2NaHCO3)答:看状态,溶解性,热稳定性,与酸反
应快慢,强碱溶液等。答:析出白色晶体(溶解度差别)。3、怎样除去碳酸钠中的碳酸氢钠?又
怎样除去碳酸氢钠中的碳酸钠?实验3-5
现象:滴入水后有大量气泡产生;气体使带有火星的木条复燃;试管外壁发热;向溶液里滴入酚酞溶液后,溶液颜色变红,后褪色。 铝是地壳中含量最多的金属元素,它占地壳总质量的7.73%,比铁几乎多1倍,是铜的近千倍。
……
逐渐成为继铁之后又一对人类发展产生重大影响的金属。 :铝 及 其 重 要 化 合 物铝制餐具:
也不宜蒸煮或长时间存放碱性食物。铝制餐具:
不宜蒸煮或长时间存放酸性食物。你知道吗?铝制餐具的兴与衰密度小
导热性好
延展性好铝的
物理性质1、氧化铝的主要性质:(1)物理性质:白色、不溶于水的固体,熔点很高。( 、 的主要成分)红宝石蓝宝石二、铝的化合物: A.和酸反应:
Al2O3 +6HCl = 2AlCl3 + 3H2O
Al2O3 + 6H+ =2Al3+ + 3H2O B.和碱反应:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 2OH- = 2AlO2- + H2O氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,所以氧化铝是两性氧化物。 (2)化学性质:滴加氨水 Al2(SO4)3溶
液中滴加氨水
最终生成白色胶状沉淀 Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+
3(NH4)2SO4Al(OH)3的制取Al2(SO4)3溶液一滴管2Al3++6NH3·H2O=2Al(OH)3↓+ 6NH4+
(1)物理性质:白色胶状物质,不溶于水,有强的吸附性,能凝聚水中的悬浮物,并能吸附色素。2、氢氧化铝的主要性质: 氢氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,氢氧化铝属于两性氢氧化物。
氢氧化铝不溶于弱酸、弱碱,而溶解在强酸、强碱中。A、与酸反应:Al(OH)3+3HCl=AlCl3+3H2O B、与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3 + 3H+ = Al3+ + 3H2OAl(OH)3 + OH- = AlO2- + 2H2O偏铝酸钠(2)化学性质: 实验3-8 Al2(SO4)3溶
液中滴加氨水Al2(SO4)3溶液中滴加NaOH溶液最终生成白色胶状沉淀 先出现白色沉淀,后沉淀逐渐溶解Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+
3(NH4)2SO4Al(OH)3+NaOH = NaAlO2+ 2H2OAl2(SO4)3+6NaOH =2 Al(OH)3↓+ 3Na2SO4【学与问】硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子。明矾是常用的净水剂硫酸铝钾 KAl(SO4)2 KAl(SO4)2·12H2O(明矾)某些药物、食物中含有Al的化合物
请设计实验证明其成分和性质:
1、晶体中含有K+的实验为
2、晶体中含有水的实验为
3、晶体中含有Al3+的实验为
4、晶体中含有SO42-的实验为
5、溶液是否有胶体存在的实验为硫酸铝钾 KAl(SO4)2 KAl(SO4)2·12H2O(明矾)无水硫酸铜变蓝 加入过量的氢氧化钠
溶液,先有白色沉淀后消失
先加盐酸,再加氯化钡溶液,有白色沉淀生成 用激光照射,有光亮的通路(丁达尔效应) 灼烧,透过蓝色钴玻璃火焰为紫色(焰色反应)AlAl2O3Al(OH)3Al3+. OH- NH3·H2O 、AlO2- H+ CO2 、Al3+ (4)、铝及其化合物的转化关系小结:[问题]
1.本转化关系的核心知识是什么?答:氧化铝和氢氧化铝的两性实践·应用 :1、铝和铍的性质十分相似,下列关于铍的性质推断不正确的是( )
A.铍能与盐酸或氢氧化钠反应??????????????
B.氢氧化铍可溶于水
C.氧化铍能与盐酸或氢氧化钠反应??
D.氧化铍的化学式为Be2O3B、D2、氧化铝熔点很高,常用于制造耐火材料,例如制作坩埚,下列操作不能在氧化铝坩埚中进行的是( )
A、加热使CuSO4?5H2O失水 B、加热使KMnO4分解 C、加热熔化烧碱 D、加热分解碱式碳酸铜C3、从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是: ( )
A.铝土矿溶于NaOH溶液中
B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体
D.电解熔融的氧化铝
D4、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1 B.2:1
C.3:1 D1:3C
5、下列变化不可能一步实验直接完成的是( )
A、Al(OH)3---Al2O3 B、Al2O3---Al(OH)3
C、Al2O3 ---- AlO2- D、Al(OH)3----Al3+
6、有A、B、C、D四种化合物,其中A、B、C、D是铝的化合物。有下列反应:
???①? A+NaOH—D+H2O;②B—A+H2O;
③C+NaOH(适量)—B+NaCl;
④B+NaOH(足量)—D+H2O
A、B、C、D的化学式分别为:
A 、B 、C 、D 。BAl2O3Al(OH)3AlCl3NaAlO2(3)有关Al(OH)3沉淀图像:图像4H++AlO-2= Al3++2H2O
Al3++3AlO-2+6H2O=4Al(OH)3↓AlO2 -+H++H2O=Al(OH)3↓
Al(OH)3+3H+=Al3++2H2O4OH-+Al3+=AlO2- +2H2O
3AlO2- +6H2O+Al3+=4Al(OH)3↓Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O反应先无沉淀,后有沉淀且不消失,先有白色絮状沉淀,过量沉淀消失。先无沉淀,后有沉淀且不消失, 先产生白色絮状沉淀,然后沉淀消失现象将NaAlO2逐滴滴入盐酸中至过量将盐酸逐滴滴入NaAlO2至过量将AlCl3逐滴滴入到NaOH中至过量将NaOH逐滴滴入AlCl3中至过量实验第2节 几种重要的金属化合物(3)FeO是一种黑色粉末,不稳定,在空气里会迅速被氧化为Fe3O4。
Fe3O4是一种复杂的化合物,是具有磁性的黑色晶体,俗称磁性氧化铁,是磁铁矿的主要成分。 Fe2O3是一种红棕色粉末,
俗称铁红.三、铁的重要化合物 1、铁的氧化物 黑色粉末 +2难溶于水 FeO+2H+=
Fe2++H2O 红棕色粉末 铁 红+3难溶于水 不稳定稳 定Fe2O3+6H+=
2Fe3++3H2O 黑色晶体 磁性氧化铁 +2、+3难溶于水 稳 定Fe3O4+8H+=
Fe2+ +2Fe3++4H2O2、铁的氢氧化物 Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓ 灰白 色 红褐色 难溶于水 难溶于水 受热易分解易被空气中氧气氧化
成氢氧化铁 4Fe(OH)2+2H2O+O2
=4Fe(OH)3 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 3、三价铁的氧化性(1)Fe3+检验实验现象:FeCl3溶液变为红色
FeCl2溶液无明显变化(2)Fe3+和Fe2+的转化实验现象:1)溶液由黄色变为浅绿色,
加硫氰化钾… 不变为红色
加氯水… 2)溶液变为红色反应的离子方程式:
2Fe3++Fe=3Fe2+ 2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN- =Fe(SCN)3实验探究:铁粉放入FeCl3溶液中…Fe3+和Fe2+的检验现象:白色沉淀
灰绿色 红褐色
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=
4Fe(OH)3现象:红褐色沉淀
Fe3++3OH-=Fe(OH)3↓现象:不变红色,若再通Cl2则变红色 2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
现象:变红色 Fe3++3SCN-
=Fe(SCN)31)与强氧化剂反应(HNO3、Cl2、Br2等)生成Fe3+;
2)与弱氧化剂反应(H+、S、I2、Fe3+、Cu2+等)生成Fe2+的化合物;
3)与O2、H2O(g)反应生成Fe3O44. 铁的化学性质小结5.铁化合物和亚铁化合物的相互转化(1)铁化合物:Fe3+只具有氧化性,遇较强还原剂时会被还原成亚铁化合物。① 2Fe3++2I-=2Fe2++I2 ② 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③ 2Fe3++S2-=2Fe2++S↓ ④ 2Fe3++H2S=2Fe2++S↓+2H+ ⑤ 2Fe3++Cu=2Fe2++Cu2+ ⑥ 2Fe3++Fe=3Fe2+ (2)亚铁化合物 Fe2+既具有氧化性又具有还原性 氧化性:遇强还原剂时被还原成单质铁例:Fe2++ Zn = Zn2++Fe 还原性:遇较强氧化剂时被氧化成三价铁的化合物例:2Fe2++Cl2=2Fe3++2Cl- 4Fe2++O2+4H+=4Fe3++2H2O 3Fe2+ + 4H+ +NO3-(稀)=3Fe3++NO↑+2H2O FeFe2+Fe3+123456弱氧化剂:H+、Cu2+、S、I2、Fe3+等 强氧化剂:Cl2、Br2、HNO3等Cl2、Br2、HNO3、O2等Zn、Fe、Cu、HI等Zn、H2、Al、C等 Zn、CO、Al等练习:下列物质发生反应时,
其离子方程式正确的是( )
A、三氯化铁溶液中加入过量铁粉
Fe3++Fe=2Fe2+
B、向氯化亚铁溶液中通入氯气
2Fe2+ +Cl2 = 2Fe3+ + 2Cl -
C、氯化铁溶液中通入硫化氢
2Fe3+ + S2- = 2Fe2+ + S?
D、向盛硫化亚铁的容器中加入稀硝酸
FeS+2H+=Fe2++H2S↑B
如: CO2、SO2、SO3、Mn2O7等不成盐氧化物 如:CO、NO碱性氧化物:能跟酸反应生成盐和水的氧化物
如:CaO 、Na2O、 MgO 等另外还有过氧化物等 如Na2O2两性氧化物:既能跟酸反应生成盐和水,又能跟碱 反应生成盐和水的氧化物 中学阶段只要求知道Al2O3酸性氧化物的通性1、如果能溶于水生成对应的酸3、跟碱反应生成盐和水2、跟碱性氧化物反应生成盐CO2+H2O=H2CO3CO2+CaO=CaCO3CO2+2NaOH=Na2CO3 +H2OSiO2+2NaOH=Na2SiO3 +H2O碱性氧化物的通性1、如果能溶于水生成对应的碱3、跟酸反应生成盐和水2、跟酸性氧化物反应生成盐氧化钠和过氧化钠的性质比较2Na2O2+4HCl ==2Na2O2+2CO2 ==2Na2O2+2H2O ==
一、钠的氧化物有 和 。Na2ONa2O2Na2O2 的重要用途:用于呼吸面具和潜水艇Na2O+H2O=2NaOHNa2O+CO2=Na2CO3Na2O+2HCl=
2NaCl+H2O4NaOH+O2↑2Na2CO3+O24NaCl+2H2O+O2↑二、碳酸钠和碳酸氢钠的性质碳酸钠俗名纯碱,也叫苏打。碳酸氢钠俗名小苏打。在水中的电离方程式:1.Na2CO3和NaHCO3的溶解性和碱性实验探究白色粉末,加水结变成晶体;放热细小白色粉末,加水部分溶解;感受不到热量变化振荡时间长时可以溶解固体量减小溶液变红(较深)溶液变微红色溶解度大,溶液的碱性比NaHCO3强溶解度小,溶液的碱性比Na2CO3弱2.Na2CO3和NaHCO3的热稳定性稳定不稳定无明显现象产生水珠、气体(使澄清石灰水变浑浊)思考:怎样除去Na2CO3固体中混有的NaHCO3?充分加热到质量不再减少为止(充分加热到不再有气体产生为止)3.Na2CO3和NaHCO3的其它性质(1)与酸反应反应剧烈程度:CO32-+2H+==H2O+CO2↑HCO3-+H+==H2O+CO2↑(2)与碱反应,Na2CO3与碱不反应(生成难溶性盐的除外,例如Ca(OH)2、Ba(OH)2)注意:在水溶液中HCO3—不能与H+大量共存;也不能与OH—大量共存4、碳酸钠和碳酸氢钠的相互转化Na2CO3 + CO2 + H2O == 2NaHCO3焰色反应焰色反应 —— 金属或它们的化合物在灼烧时 使火焰呈现特殊的颜色,叫焰色反应(是物理现象,不是化学变化,没有生成新的物质)。常见金属元素或金属离子的焰色
钠——黄色
钾——紫色(透过蓝色的钴玻璃)
铜——绿色
钙——砖红色应用—— 可用于鉴别物质中含有哪种金属元素、溶液中含有哪种金属阳离子1、现有两瓶失去标签的Na2CO3和NaHCO3
固体,你能用几种方法将它们区分开来? 2、在饱和Na2CO3溶液中,吹入CO2气体,
可能会有什么现象?
(Na2CO3+H2O+CO2==2NaHCO3)答:看状态,溶解性,热稳定性,与酸反
应快慢,强碱溶液等。答:析出白色晶体(溶解度差别)。3、怎样除去碳酸钠中的碳酸氢钠?又
怎样除去碳酸氢钠中的碳酸钠?实验3-5
现象:滴入水后有大量气泡产生;气体使带有火星的木条复燃;试管外壁发热;向溶液里滴入酚酞溶液后,溶液颜色变红,后褪色。 铝是地壳中含量最多的金属元素,它占地壳总质量的7.73%,比铁几乎多1倍,是铜的近千倍。
……
逐渐成为继铁之后又一对人类发展产生重大影响的金属。 :铝 及 其 重 要 化 合 物铝制餐具:
也不宜蒸煮或长时间存放碱性食物。铝制餐具:
不宜蒸煮或长时间存放酸性食物。你知道吗?铝制餐具的兴与衰密度小
导热性好
延展性好铝的
物理性质1、氧化铝的主要性质:(1)物理性质:白色、不溶于水的固体,熔点很高。( 、 的主要成分)红宝石蓝宝石二、铝的化合物: A.和酸反应:
Al2O3 +6HCl = 2AlCl3 + 3H2O
Al2O3 + 6H+ =2Al3+ + 3H2O B.和碱反应:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Al2O3 + 2OH- = 2AlO2- + H2O氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,所以氧化铝是两性氧化物。 (2)化学性质:滴加氨水 Al2(SO4)3溶
液中滴加氨水
最终生成白色胶状沉淀 Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+
3(NH4)2SO4Al(OH)3的制取Al2(SO4)3溶液一滴管2Al3++6NH3·H2O=2Al(OH)3↓+ 6NH4+
(1)物理性质:白色胶状物质,不溶于水,有强的吸附性,能凝聚水中的悬浮物,并能吸附色素。2、氢氧化铝的主要性质: 氢氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,氢氧化铝属于两性氢氧化物。
氢氧化铝不溶于弱酸、弱碱,而溶解在强酸、强碱中。A、与酸反应:Al(OH)3+3HCl=AlCl3+3H2O B、与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O Al(OH)3 + 3H+ = Al3+ + 3H2OAl(OH)3 + OH- = AlO2- + 2H2O偏铝酸钠(2)化学性质: 实验3-8 Al2(SO4)3溶
液中滴加氨水Al2(SO4)3溶液中滴加NaOH溶液最终生成白色胶状沉淀 先出现白色沉淀,后沉淀逐渐溶解Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+
3(NH4)2SO4Al(OH)3+NaOH = NaAlO2+ 2H2OAl2(SO4)3+6NaOH =2 Al(OH)3↓+ 3Na2SO4【学与问】硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子。明矾是常用的净水剂硫酸铝钾 KAl(SO4)2 KAl(SO4)2·12H2O(明矾)某些药物、食物中含有Al的化合物
请设计实验证明其成分和性质:
1、晶体中含有K+的实验为
2、晶体中含有水的实验为
3、晶体中含有Al3+的实验为
4、晶体中含有SO42-的实验为
5、溶液是否有胶体存在的实验为硫酸铝钾 KAl(SO4)2 KAl(SO4)2·12H2O(明矾)无水硫酸铜变蓝 加入过量的氢氧化钠
溶液,先有白色沉淀后消失
先加盐酸,再加氯化钡溶液,有白色沉淀生成 用激光照射,有光亮的通路(丁达尔效应) 灼烧,透过蓝色钴玻璃火焰为紫色(焰色反应)AlAl2O3Al(OH)3Al3+. OH- NH3·H2O 、AlO2- H+ CO2 、Al3+ (4)、铝及其化合物的转化关系小结:[问题]
1.本转化关系的核心知识是什么?答:氧化铝和氢氧化铝的两性实践·应用 :1、铝和铍的性质十分相似,下列关于铍的性质推断不正确的是( )
A.铍能与盐酸或氢氧化钠反应??????????????
B.氢氧化铍可溶于水
C.氧化铍能与盐酸或氢氧化钠反应??
D.氧化铍的化学式为Be2O3B、D2、氧化铝熔点很高,常用于制造耐火材料,例如制作坩埚,下列操作不能在氧化铝坩埚中进行的是( )
A、加热使CuSO4?5H2O失水 B、加热使KMnO4分解 C、加热熔化烧碱 D、加热分解碱式碳酸铜C3、从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是: ( )
A.铝土矿溶于NaOH溶液中
B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体
D.电解熔融的氧化铝
D4、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1:1 B.2:1
C.3:1 D1:3C
5、下列变化不可能一步实验直接完成的是( )
A、Al(OH)3---Al2O3 B、Al2O3---Al(OH)3
C、Al2O3 ---- AlO2- D、Al(OH)3----Al3+
6、有A、B、C、D四种化合物,其中A、B、C、D是铝的化合物。有下列反应:
???①? A+NaOH—D+H2O;②B—A+H2O;
③C+NaOH(适量)—B+NaCl;
④B+NaOH(足量)—D+H2O
A、B、C、D的化学式分别为:
A 、B 、C 、D 。BAl2O3Al(OH)3AlCl3NaAlO2(3)有关Al(OH)3沉淀图像:图像4H++AlO-2= Al3++2H2O
Al3++3AlO-2+6H2O=4Al(OH)3↓AlO2 -+H++H2O=Al(OH)3↓
Al(OH)3+3H+=Al3++2H2O4OH-+Al3+=AlO2- +2H2O
3AlO2- +6H2O+Al3+=4Al(OH)3↓Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O反应先无沉淀,后有沉淀且不消失,先有白色絮状沉淀,过量沉淀消失。先无沉淀,后有沉淀且不消失, 先产生白色絮状沉淀,然后沉淀消失现象将NaAlO2逐滴滴入盐酸中至过量将盐酸逐滴滴入NaAlO2至过量将AlCl3逐滴滴入到NaOH中至过量将NaOH逐滴滴入AlCl3中至过量实验第2节 几种重要的金属化合物(3)FeO是一种黑色粉末,不稳定,在空气里会迅速被氧化为Fe3O4。
Fe3O4是一种复杂的化合物,是具有磁性的黑色晶体,俗称磁性氧化铁,是磁铁矿的主要成分。 Fe2O3是一种红棕色粉末,
俗称铁红.三、铁的重要化合物 1、铁的氧化物 黑色粉末 +2难溶于水 FeO+2H+=
Fe2++H2O 红棕色粉末 铁 红+3难溶于水 不稳定稳 定Fe2O3+6H+=
2Fe3++3H2O 黑色晶体 磁性氧化铁 +2、+3难溶于水 稳 定Fe3O4+8H+=
Fe2+ +2Fe3++4H2O2、铁的氢氧化物 Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓ 灰白 色 红褐色 难溶于水 难溶于水 受热易分解易被空气中氧气氧化
成氢氧化铁 4Fe(OH)2+2H2O+O2
=4Fe(OH)3 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 3、三价铁的氧化性(1)Fe3+检验实验现象:FeCl3溶液变为红色
FeCl2溶液无明显变化(2)Fe3+和Fe2+的转化实验现象:1)溶液由黄色变为浅绿色,
加硫氰化钾… 不变为红色
加氯水… 2)溶液变为红色反应的离子方程式:
2Fe3++Fe=3Fe2+ 2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN- =Fe(SCN)3实验探究:铁粉放入FeCl3溶液中…Fe3+和Fe2+的检验现象:白色沉淀
灰绿色 红褐色
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=
4Fe(OH)3现象:红褐色沉淀
Fe3++3OH-=Fe(OH)3↓现象:不变红色,若再通Cl2则变红色 2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
现象:变红色 Fe3++3SCN-
=Fe(SCN)31)与强氧化剂反应(HNO3、Cl2、Br2等)生成Fe3+;
2)与弱氧化剂反应(H+、S、I2、Fe3+、Cu2+等)生成Fe2+的化合物;
3)与O2、H2O(g)反应生成Fe3O44. 铁的化学性质小结5.铁化合物和亚铁化合物的相互转化(1)铁化合物:Fe3+只具有氧化性,遇较强还原剂时会被还原成亚铁化合物。① 2Fe3++2I-=2Fe2++I2 ② 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ③ 2Fe3++S2-=2Fe2++S↓ ④ 2Fe3++H2S=2Fe2++S↓+2H+ ⑤ 2Fe3++Cu=2Fe2++Cu2+ ⑥ 2Fe3++Fe=3Fe2+ (2)亚铁化合物 Fe2+既具有氧化性又具有还原性 氧化性:遇强还原剂时被还原成单质铁例:Fe2++ Zn = Zn2++Fe 还原性:遇较强氧化剂时被氧化成三价铁的化合物例:2Fe2++Cl2=2Fe3++2Cl- 4Fe2++O2+4H+=4Fe3++2H2O 3Fe2+ + 4H+ +NO3-(稀)=3Fe3++NO↑+2H2O FeFe2+Fe3+123456弱氧化剂:H+、Cu2+、S、I2、Fe3+等 强氧化剂:Cl2、Br2、HNO3等Cl2、Br2、HNO3、O2等Zn、Fe、Cu、HI等Zn、H2、Al、C等 Zn、CO、Al等练习:下列物质发生反应时,
其离子方程式正确的是( )
A、三氯化铁溶液中加入过量铁粉
Fe3++Fe=2Fe2+
B、向氯化亚铁溶液中通入氯气
2Fe2+ +Cl2 = 2Fe3+ + 2Cl -
C、氯化铁溶液中通入硫化氢
2Fe3+ + S2- = 2Fe2+ + S?
D、向盛硫化亚铁的容器中加入稀硝酸
FeS+2H+=Fe2++H2S↑B
