人教版高中化学课件必修二 1.2.2《元素周期律》课件(共51张PPT)
文档属性
| 名称 | 人教版高中化学课件必修二 1.2.2《元素周期律》课件(共51张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 492.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 06:58:34 | ||
图片预览








文档简介
课件51张PPT。元素周期律
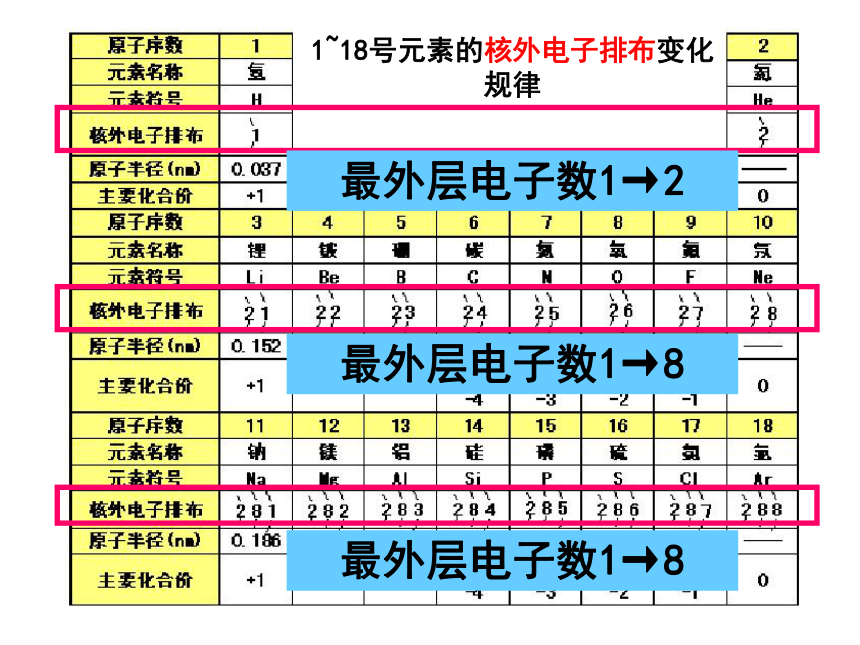
第二节《元素周期律》 1、原子核外电子排布,原子半径,元素化合价递变的规律: 二、元素周期律1~18号元素的核外电子排布变化规律最外层电子数1→2最外层电子数1→8最外层电子数1→8 1、原子核外电子排布,原子半径,元素化合价递变的规律: 二、元素周期律①随着原子序数的递增,元素原子电子层数逐渐增加,最外层电子的排布呈周期性(1-8)变化。规律:同主族元素,随着核电荷数的递增,原子的电子层数逐渐增加;同周期元素,从左到右,随着核电荷数的递增,原子最外层电子数逐渐增加。 1、原子核外电子排布,原子半径,元素化合价递变的规律: 二、元素周期律①随着原子序数的递增,元素原子最外层电子的排布呈周期性(1—8)变化。②随着原子序数的递增,元素原子半径呈周期性(由大到小)变化。规律:同主族元素,随着核电荷数的递增,原子半径越来越大;同周期元素,从左到右,随着核电荷数的递增,原子半径越来越小(稀有气体除外)1~18号元素的原子半径递变规律原子半径 大→小原子半径 大→小 重点延伸:
微粒半径大小比较(用r表示半径)
a.同周期:从左往右,原子半径逐渐减小。核电荷数增加,核对外层电子引力增大,半径减小。
b.同主族:从上到下,原子或者离子的半径逐渐增大。
c.同元素:r(阴离子)>r(原子)
>r(阳离子)
r(低价阳离子)>r(高价阳离子)
d.同结构:电子层结构相同的离子,核电荷数越大,离子半径越小。
eg.r(O2-)>r(F-)>r(Na+>r(Mg2+)>r(Al3+)
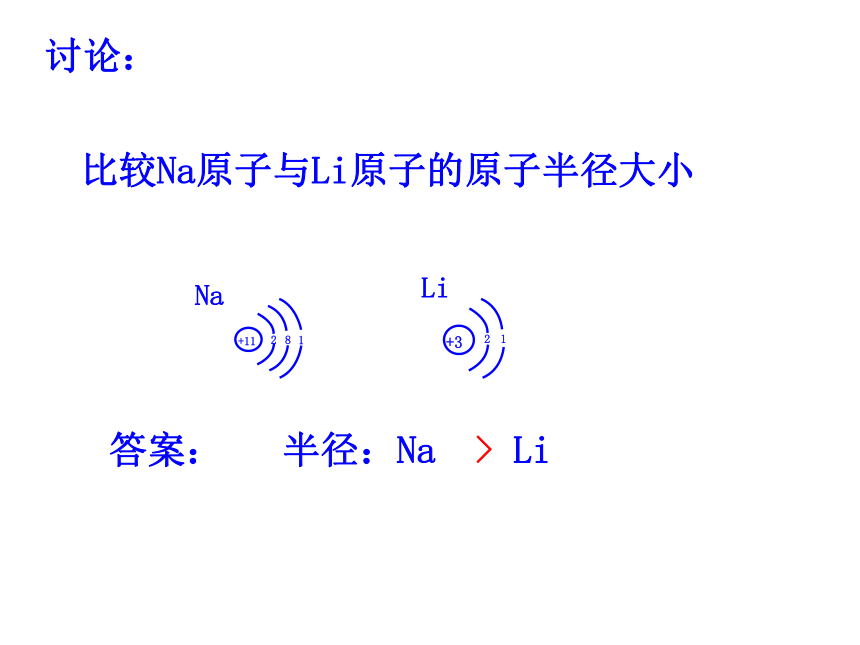
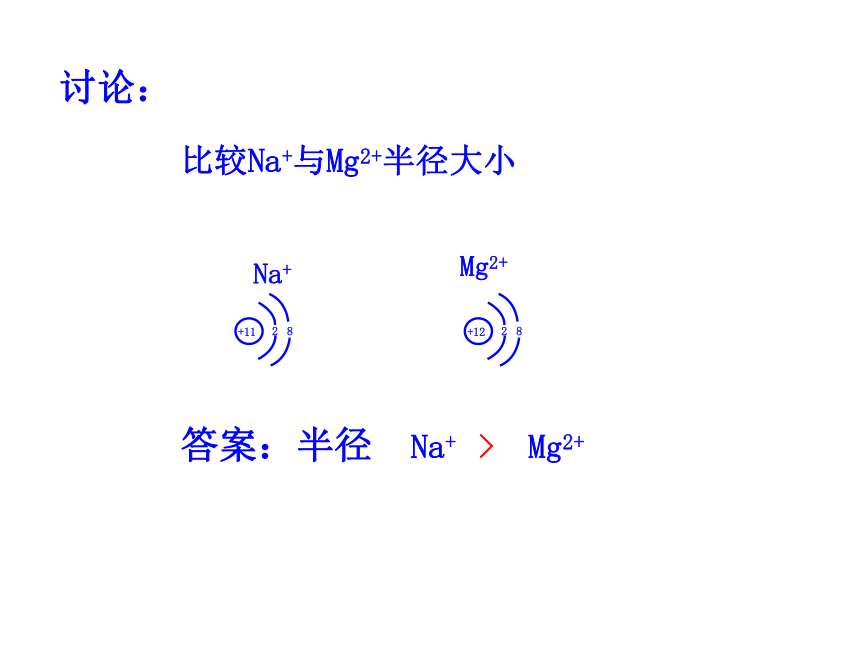
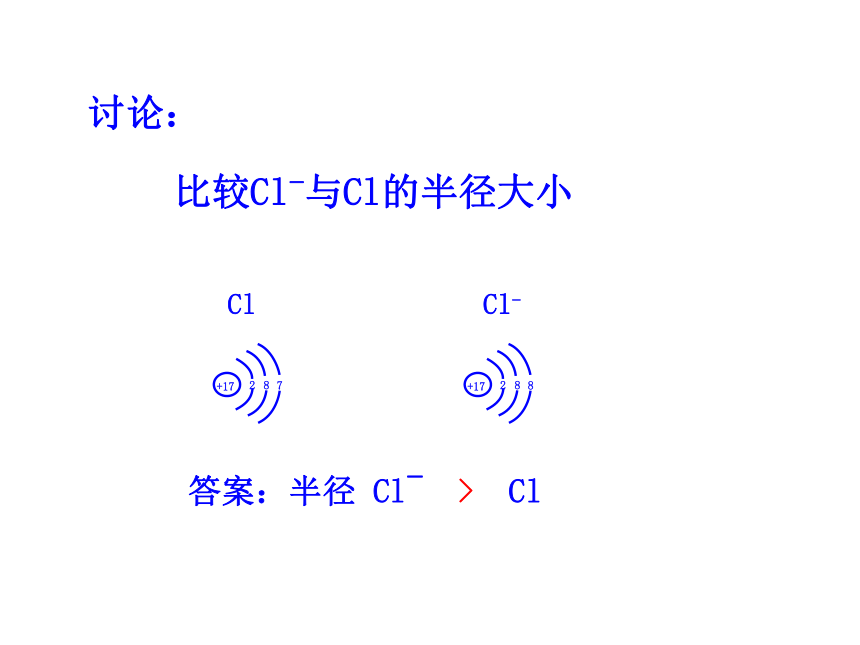
讨论:比较Na原子与Li原子的原子半径大小答案: 半径:Na > Li讨论:比较Na与Na+的半径大小 答案:半径 Na > Na+讨论:比较Na+与Mg2+半径大小答案:半径 Na+ > Mg2+讨论:比较Cl-与Cl的半径大小答案:半径 Cl- > Cl1~18号元素的主要化合价递变规律 主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4 →-1 → 0主要化合价:正价+1→+7,负价:-4 →-1→0 1、原子核外电子排布,原子半径,元素化合价递变的规律: 二、元素周期律①随着原子序数的递增,元素原子最外层电子的排布呈周期性变化。②随着原子序数的递增,元素原子半径呈周期性变化。③随着原子序数的递增,元素的最高正价和最低负价呈周期性变化。a.最高正价=(主族)元素原子最外层电子数
b.最高正价+最低负价的绝对值=8 结论: 随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈周期性变化! 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢? 元素的金属性是指元素的原子失电子难易程度的性质,即元素的原子越易失电子,其金属性越强。 元素的非金属性是指元素的原子得电子难易程度的性质,即元素的原子越易得电子,其非金属性越强。元素金属性强弱判断依据:1.根据金属单质与水或酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2.根据金属元素最高价氧化物对应的水化物碱性强弱。碱性越强,则金属元素的金属性越强。
3.根据对应阳离子氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。元素非金属性强弱判断依据:1.根据非金属单质与H2化合生成氢化物的难易或氢化物的稳定性程度。越容易与H2化合,则生成的氢化物越稳定,非金属性越强。
2.根据非金属元素最高价氧化物对应的水化物酸性强弱。酸性越强,则元素的非金属性越强。
3.根据对应阴离子还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。科学探究: 镁与冷水反应缓慢,滴入酚酞试液粉红色。而镁与沸水反应加快,产生气泡,溶液红色加深。镁的金属性比钠弱与金属钠对比 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究:列表总结:NaOH
强碱Mg(OH)2
中强碱
Al(OH)3
两性
氢氧化物剧烈 迅速 非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化。 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释:核电荷数增多原子半径减小原子失电子能力逐渐减弱,得电子能力逐渐增强同周期元素 从左到右原子核对最外层电子的吸引力增强2、元素金属性、非金属性的递变规律: 3、元素周期律 二、元素周期律从1逐渐增到7(第1周期除外)相同正价由+1→+7 负价由-4→-1最高正价相同逐渐减小(稀有气体除外)逐渐增大金属性减弱,非金属性增强金属性增强,非金属性减弱碱性减弱,酸性增强酸性减弱,碱性增强生成由难到易,稳定性由弱到强生成由易到难,稳定性由强到弱还原性减弱还原性增强失电子由易到难得电子由易到难★比较元素非金属性强弱的常用方法:
①利用非金属元素在元素周期表里的位置比较。
a.同周期中的非金属元素,位置越靠后的非金属性越强
b.同主族中的非金属元素,位置越靠上的非金属性越强
②利用氧化还原反应比较
a.不同的非金属,其他条件相同时,跟氢气化合的条件越低,反应越快,非金属性越强。
b.非金属单质的氧化性越强,则该非金属元素的非金属性越强
c.非金属阴离子的还原性越强,则对应元素的非金属性越弱
③利用化合物的性质比较。
a.最高价氧化物对应水化物的酸性越强,则对应非金属单质的非金属性越强
b.气态氢化物的稳定性越强,则对应非金属单质的非金属性越强★比较元素金属性强弱的常用方法:
①利用金属元素在金属活动性顺序里的位置比较。一般来说,从左到右,元素的金属性逐渐减弱,两种金属之间的距离越大,金属性差别越大
②利用金属在元素周期表里的位置比较
a.同周期中的金属元素,位置越靠前的金属性越强
b.同主族中的金属元素,位置越靠下的金属性越强
③利用氧化还原反应比较
a.不同的金属,其他条件相同时,从水或酸中置换出氢需要的条件越低,反应速率越快,金属的金属性越强。
b.金属单质的还原性越强,则该金属元素的金属性越强
c.金属阳离子的氧化性越强,则对应金属元素的金属性越弱
④利用化合物的性质比较。最高价氧化物对应水化物的碱性越强,则对应金属单质的金属性越强。请你思考同一周期元素的金属性和非金属性变化有何规律? 从左向右,元素的金属性逐渐减弱,非金属性
逐渐增强。试用结构观点解释为什么有这样的变化规律: 同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。请你思考同一主族元素的金属性和非金属性变化有何规律? 自上而下,元素的金属性逐渐增强,非金属性
逐渐减弱。试用结构观点解释为什么有这样的变化规律: 同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强非金属区 金属区零
族
元
素 你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?思考与交流原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数
= 最高正价数8 -最外层电子数= 最低负价数原子结构表中位置元素性质原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。 阅读课文:P17 - 18
为什么说化学的理论对化学研究、工农业生产具有指导作用?三、元素周期表和元素周期律的应用门捷列夫于1869年提出 “元素的性质随着原子量的递增而呈周期性的变化”的元素周期律,并编制了第一张《元素周期表》。 当时已发现的元素仅63种。 有些元素的原子量数据不准确。 门捷列夫修改了铍、铟、铀、锇、铱、铂、钇、
钛八种元素的原子量,并预言了钪、镓和锗三种元素。 门捷列夫不自觉地应用黑格尔的量转化为质
的规律,完成了科学史上一个勋业。— 恩格斯 他写道:“根据元素周期表,应该还有几种类似
氩的元素存在,它们在周期表里组成性质类似的族 。”
……“按照我们老师门捷列夫的榜样,我也尽可能地写
下了这些元素可能有的性质和预见到的各种关系”。 由于按照元素周期表所指示的方向进行探索,他在1898年一年内又发现了和氩性质相似的三种元素氖、氪、氙。 1894年英国人拉姆赛发现了氩(Ar)元素 元素周期表及元素周期律 的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找新的半导体材料、催化剂、耐高温耐腐蚀材料、寻找新的矿物质。(3)实质:元素性质周期性变化是由于______
___________________________ 的必然结果。 (2)内容:元素性质的周期性变化主要体现在
_________________________、_____
________________、______________
___________等方面。(1)定义:____________随着原子________
___________________________的规律叫做元素周期律。元素的性质原子序数原子核外电子排布的周期性变化元素原子元素主要化合价的半径的周期性变化周期性变化的递增而呈现周期性的变化的原子核外电子排布的周期性变化填空例1:下列各组元素性质递变情况错误的是( )
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F 原子半径依次增大
D.Li、Na、K、Rb 的金属性依次增强例2 :某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4例题3:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式是_____
____________________________。 例题4:已知A为ⅡA族元素,B为ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是 ( )
A.n = m+1 B.n = m + 11
C.n = m + 25 D.n = m + 10 例题5:X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
( )
A.2 B.8 C.10 D.18
例题6:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族 练习:1.主族元素的最高正化合价一般等于其_____序数,非金属元素的负化合价等于_____________________。2.卤族元素的原子最外层上的电子数是____,其中,非金属性最强的是____。卤素的最高价氧化物对应水化物的化学式是______(以X表示卤素)。主族 8-主族序数(8-最高正价) 7 F HXO4 注:氟元素无最高价氧化物及其水合物,因为氟元素无正化合价 3.下列性质的递变中,正确的是 ( )?
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱?AB 4.某元素X的原子序数为52,下列叙述正确的是 ( )?
A.X的主要化合价是-2、+4、+6?
B.X可以形成稳定的气态氢化物?
C.X的最高价氧化物对应水化物的酸性
比HBrO4的酸性强?
D.X原子的还原性比碘原子强?AD 5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子
数是8*?
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气 AC 6.X、Y是元素周期表中Ⅶ A族中的两种元素,下列叙述中能说明X的非金属比Y强的是
( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低*
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来CCBCBC6、下列各组物质的性质比较,正确的是( )
A.酸性:HClO4>H3PO4 > H2SO4
B.氢化物稳定性:H2S> HF> H2O
C.碱性:NaOH >Mg(OH)2 >Ca(OH)2
D.氧化性:F2 >Cl2 >Br2 >I2D7B
微粒半径大小比较(用r表示半径)
a.同周期:从左往右,原子半径逐渐减小。核电荷数增加,核对外层电子引力增大,半径减小。
b.同主族:从上到下,原子或者离子的半径逐渐增大。
c.同元素:r(阴离子)>r(原子)
>r(阳离子)
r(低价阳离子)>r(高价阳离子)
d.同结构:电子层结构相同的离子,核电荷数越大,离子半径越小。
eg.r(O2-)>r(F-)>r(Na+>r(Mg2+)>r(Al3+)
讨论:比较Na原子与Li原子的原子半径大小答案: 半径:Na > Li讨论:比较Na与Na+的半径大小 答案:半径 Na > Na+讨论:比较Na+与Mg2+半径大小答案:半径 Na+ > Mg2+讨论:比较Cl-与Cl的半径大小答案:半径 Cl- > Cl1~18号元素的主要化合价递变规律 主要化合价:正价+1→0主要化合价:正价+1→+5,负价:-4 →-1 → 0主要化合价:正价+1→+7,负价:-4 →-1→0 1、原子核外电子排布,原子半径,元素化合价递变的规律: 二、元素周期律①随着原子序数的递增,元素原子最外层电子的排布呈周期性变化。②随着原子序数的递增,元素原子半径呈周期性变化。③随着原子序数的递增,元素的最高正价和最低负价呈周期性变化。a.最高正价=(主族)元素原子最外层电子数
b.最高正价+最低负价的绝对值=8 结论: 随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈周期性变化! 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢? 元素的金属性是指元素的原子失电子难易程度的性质,即元素的原子越易失电子,其金属性越强。 元素的非金属性是指元素的原子得电子难易程度的性质,即元素的原子越易得电子,其非金属性越强。元素金属性强弱判断依据:1.根据金属单质与水或酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。
2.根据金属元素最高价氧化物对应的水化物碱性强弱。碱性越强,则金属元素的金属性越强。
3.根据对应阳离子氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。元素非金属性强弱判断依据:1.根据非金属单质与H2化合生成氢化物的难易或氢化物的稳定性程度。越容易与H2化合,则生成的氢化物越稳定,非金属性越强。
2.根据非金属元素最高价氧化物对应的水化物酸性强弱。酸性越强,则元素的非金属性越强。
3.根据对应阴离子还原性强弱判断。阴离子还原性越弱,则元素非金属性越强。科学探究: 镁与冷水反应缓慢,滴入酚酞试液粉红色。而镁与沸水反应加快,产生气泡,溶液红色加深。镁的金属性比钠弱与金属钠对比 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究:列表总结:NaOH
强碱Mg(OH)2
中强碱
Al(OH)3
两性
氢氧化物剧烈 迅速 非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化。 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强用结构观点解释:核电荷数增多原子半径减小原子失电子能力逐渐减弱,得电子能力逐渐增强同周期元素 从左到右原子核对最外层电子的吸引力增强2、元素金属性、非金属性的递变规律: 3、元素周期律 二、元素周期律从1逐渐增到7(第1周期除外)相同正价由+1→+7 负价由-4→-1最高正价相同逐渐减小(稀有气体除外)逐渐增大金属性减弱,非金属性增强金属性增强,非金属性减弱碱性减弱,酸性增强酸性减弱,碱性增强生成由难到易,稳定性由弱到强生成由易到难,稳定性由强到弱还原性减弱还原性增强失电子由易到难得电子由易到难★比较元素非金属性强弱的常用方法:
①利用非金属元素在元素周期表里的位置比较。
a.同周期中的非金属元素,位置越靠后的非金属性越强
b.同主族中的非金属元素,位置越靠上的非金属性越强
②利用氧化还原反应比较
a.不同的非金属,其他条件相同时,跟氢气化合的条件越低,反应越快,非金属性越强。
b.非金属单质的氧化性越强,则该非金属元素的非金属性越强
c.非金属阴离子的还原性越强,则对应元素的非金属性越弱
③利用化合物的性质比较。
a.最高价氧化物对应水化物的酸性越强,则对应非金属单质的非金属性越强
b.气态氢化物的稳定性越强,则对应非金属单质的非金属性越强★比较元素金属性强弱的常用方法:
①利用金属元素在金属活动性顺序里的位置比较。一般来说,从左到右,元素的金属性逐渐减弱,两种金属之间的距离越大,金属性差别越大
②利用金属在元素周期表里的位置比较
a.同周期中的金属元素,位置越靠前的金属性越强
b.同主族中的金属元素,位置越靠下的金属性越强
③利用氧化还原反应比较
a.不同的金属,其他条件相同时,从水或酸中置换出氢需要的条件越低,反应速率越快,金属的金属性越强。
b.金属单质的还原性越强,则该金属元素的金属性越强
c.金属阳离子的氧化性越强,则对应金属元素的金属性越弱
④利用化合物的性质比较。最高价氧化物对应水化物的碱性越强,则对应金属单质的金属性越强。请你思考同一周期元素的金属性和非金属性变化有何规律? 从左向右,元素的金属性逐渐减弱,非金属性
逐渐增强。试用结构观点解释为什么有这样的变化规律: 同一周期元素,电子层数相同。从左向右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强。请你思考同一主族元素的金属性和非金属性变化有何规律? 自上而下,元素的金属性逐渐增强,非金属性
逐渐减弱。试用结构观点解释为什么有这样的变化规律: 同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。 1B Al SiGeAs Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强非金属区 金属区零
族
元
素 你能理解“位(位置)——构(结构)——性(性质)”三者之间的关系吗?思考与交流原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数
= 最高正价数8 -最外层电子数= 最低负价数原子结构表中位置元素性质原子结构决定元素在周期表中的位置和性质。元素在周期表中的位置,反映了元素的原子结构和元素的性质。1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。 阅读课文:P17 - 18
为什么说化学的理论对化学研究、工农业生产具有指导作用?三、元素周期表和元素周期律的应用门捷列夫于1869年提出 “元素的性质随着原子量的递增而呈周期性的变化”的元素周期律,并编制了第一张《元素周期表》。 当时已发现的元素仅63种。 有些元素的原子量数据不准确。 门捷列夫修改了铍、铟、铀、锇、铱、铂、钇、
钛八种元素的原子量,并预言了钪、镓和锗三种元素。 门捷列夫不自觉地应用黑格尔的量转化为质
的规律,完成了科学史上一个勋业。— 恩格斯 他写道:“根据元素周期表,应该还有几种类似
氩的元素存在,它们在周期表里组成性质类似的族 。”
……“按照我们老师门捷列夫的榜样,我也尽可能地写
下了这些元素可能有的性质和预见到的各种关系”。 由于按照元素周期表所指示的方向进行探索,他在1898年一年内又发现了和氩性质相似的三种元素氖、氪、氙。 1894年英国人拉姆赛发现了氩(Ar)元素 元素周期表及元素周期律 的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找新的半导体材料、催化剂、耐高温耐腐蚀材料、寻找新的矿物质。(3)实质:元素性质周期性变化是由于______
___________________________ 的必然结果。 (2)内容:元素性质的周期性变化主要体现在
_________________________、_____
________________、______________
___________等方面。(1)定义:____________随着原子________
___________________________的规律叫做元素周期律。元素的性质原子序数原子核外电子排布的周期性变化元素原子元素主要化合价的半径的周期性变化周期性变化的递增而呈现周期性的变化的原子核外电子排布的周期性变化填空例1:下列各组元素性质递变情况错误的是( )
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F 原子半径依次增大
D.Li、Na、K、Rb 的金属性依次增强例2 :某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4例题3:周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式是_____
____________________________。 例题4:已知A为ⅡA族元素,B为ⅢA族元素,它们的原子序数分别为m和n,且A、B为同一周期元素。下列关系式错误的是 ( )
A.n = m+1 B.n = m + 11
C.n = m + 25 D.n = m + 10 例题5:X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值
( )
A.2 B.8 C.10 D.18
例题6:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族 练习:1.主族元素的最高正化合价一般等于其_____序数,非金属元素的负化合价等于_____________________。2.卤族元素的原子最外层上的电子数是____,其中,非金属性最强的是____。卤素的最高价氧化物对应水化物的化学式是______(以X表示卤素)。主族 8-主族序数(8-最高正价) 7 F HXO4 注:氟元素无最高价氧化物及其水合物,因为氟元素无正化合价 3.下列性质的递变中,正确的是 ( )?
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱?AB 4.某元素X的原子序数为52,下列叙述正确的是 ( )?
A.X的主要化合价是-2、+4、+6?
B.X可以形成稳定的气态氢化物?
C.X的最高价氧化物对应水化物的酸性
比HBrO4的酸性强?
D.X原子的还原性比碘原子强?AD 5.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径?
B.氯化铍化学式中铍原子的最外层电子
数是8*?
C.氢氧化铍的碱性比氢氧化钙的弱?
D.单质铍跟冷水反应产生氢气 AC 6.X、Y是元素周期表中Ⅶ A族中的两种元素,下列叙述中能说明X的非金属比Y强的是
( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低*
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来CCBCBC6、下列各组物质的性质比较,正确的是( )
A.酸性:HClO4>H3PO4 > H2SO4
B.氢化物稳定性:H2S> HF> H2O
C.碱性:NaOH >Mg(OH)2 >Ca(OH)2
D.氧化性:F2 >Cl2 >Br2 >I2D7B
