人教版高中化学必修一课件 2.3氧化还原反应(共19张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件 2.3氧化还原反应(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 254.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 07:01:58 | ||
图片预览






文档简介
课件19张PPT。第一章 化学反应及其能量变化 燃料的
充分燃烧 化学反应燃烧产物对大气造成的 污染及防治 化学反应中 的
能量变化燃烧第一节 氧化还原反应化合反应氧化还原反应1、基本反应类型 化合反应
分解反应
置换反应
复分解反应一、化学反应的类型A+B=AB AB=A+B A+BC=AC+B AB+CD=AD+CB2、氧化反应和还原反应 按下列要求各举一个符合条件的化学
反应,并写出化学方程式讨论 Fe2O3 + 3CO = 2Fe + 3CO2的反应属于
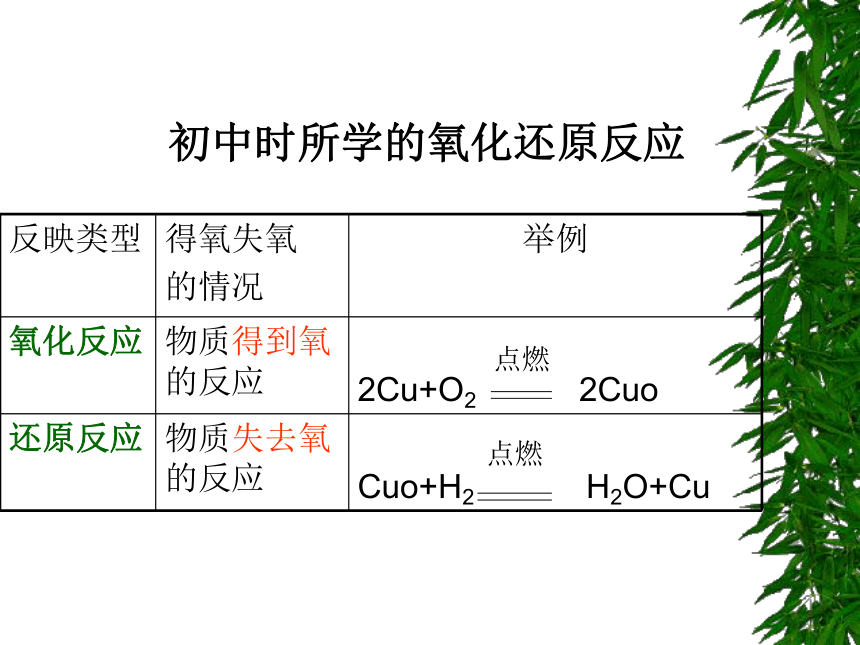
哪种基本反应类型?氢气还原氧化铜是氧化反应还是还原反应?点燃点燃初中时所学的氧化还原反应讨论结果同一个化学反应用不同的分类方法去分析,结果也不相同。四种基本反映类型并不能包括所有的反应。
初中所学的氧化还原反应比较片面,不能真实地反映氧化还原反应的本质。
对于这一反应,谁得到氧,谁失去氧,得到氧与失去氧的数目关系怎样。哪种元素化合价升高?哪种元素化合价降低?升高的化合价降低的化合价关系怎样?二、氧化还原反应1、什么叫氧化还原反应?2、特征:反应前后化合价发生变化(也是判断依据)一种物质被氧化,同时另一种物质被还原的反应[练习] 用化合价升降的观点去判断下面的反 应,哪些是氧化还原反应?①MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
②2KClO3 2KCl+3O2↑
③H2+ Cl2 2HCl
④NaCl固+H2SO4浓==NaHSO4+HCl关键:1)正确判断各反应物、生成物各元素的化合价及其变化;2)凡是有化合价升降的化学反应都是氧化还原反应在氧化还原反应中,为什么会发生化合价的变化呢?[小结] 从NaCl的形成看化合价升降的根本原因是电子的
得失,即氧化还原反应的实质是有电子的得失。4. 实质:电子发生转移(得失或偏移)
有电子转移的化学反应都是氧化还原反应3. 氧化反应,失e、价升;还原反应,得e、价降用双线桥应注意的事项: 正确判断各反应物、生成物各元素的化合价及其变化 两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。 电子符号用“e-”来表示 得失电子总数表示:原子个数 × 每个原子得失电子数
注意:反应中失去电子的总数等于得到电子的总数5. 氧化还原反应的表示(氧化还原反应、 化合价升降、电子得失)[练习] 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。① Fe2O3 + 3CO 2Fe + 3CO2
②Zn + 2HCl == ZnCl2 + H2 ↑
③SO2 + 2H2S == 2H2O + 3S
④2KClO3 2KCl+3O2↑
⑤3Cl2 + 8NH3 == 6NH4Cl + N2
⑥MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
[练习] 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。① MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
② Cu + 2H2SO4(浓) = CuSO4 + SO2 ↑+2H2O
③ SO2 + 2H2S == 2H2O + 3S
④ 3Cl2 + 8NH3 == 6NH4Cl + N2
三、氧化还原反应与基本反应类型的关系及一般规律1.化合反应:有单质参加的是氧化还原反应。
2.分解反应:有单质生成的是氧化还原反应。
3.置换反应:全部是氧化还原反应。
4.复分解反应:都是非氧化还原反应。
四、氧化剂和还原剂氧化剂: 得到电子(元素化合价降低)的物质, 被还原。1. 定义说明: (1) 氧化剂和还原剂均是指反应物质,是一种化学试剂, 不是
某一种元素。
(2) 氧化剂本身被还原,发生还原反应,得到的产物是还原产 物;
还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。还原剂: 失去电子(元素化合价升高)的物质,被氧化。小结:(1)氧化剂和还原剂分别是不同的物质(2)氧化剂和还原剂都是同一种物质(3)氧化剂和还原剂都是同一种物质,而且被氧化与被还原的元素都是相同价态的同种元素(4)反应物参加反应的总量中仅有一部分为氧化剂,另一部分为反应介质2. 常见的氧化剂和还原剂氧化剂: O2、Cl2、浓硫酸、HNO3、KMnO4、 FeCl3等还原剂:Al、Zn、Fe、C、H2、CO等3. 氧化性、还原性强弱判断 氧化剂的氧化性 > 氧化产物的氧化性。
还原剂的还原性 > 还原产物的还原性。(1)原子或离子的得电子能力越强,物质氧化性越强一般规律:(2)原子或离子的失电子能力越强,物质还原性越强
充分燃烧 化学反应燃烧产物对大气造成的 污染及防治 化学反应中 的
能量变化燃烧第一节 氧化还原反应化合反应氧化还原反应1、基本反应类型 化合反应
分解反应
置换反应
复分解反应一、化学反应的类型A+B=AB AB=A+B A+BC=AC+B AB+CD=AD+CB2、氧化反应和还原反应 按下列要求各举一个符合条件的化学
反应,并写出化学方程式讨论 Fe2O3 + 3CO = 2Fe + 3CO2的反应属于
哪种基本反应类型?氢气还原氧化铜是氧化反应还是还原反应?点燃点燃初中时所学的氧化还原反应讨论结果同一个化学反应用不同的分类方法去分析,结果也不相同。四种基本反映类型并不能包括所有的反应。
初中所学的氧化还原反应比较片面,不能真实地反映氧化还原反应的本质。
对于这一反应,谁得到氧,谁失去氧,得到氧与失去氧的数目关系怎样。哪种元素化合价升高?哪种元素化合价降低?升高的化合价降低的化合价关系怎样?二、氧化还原反应1、什么叫氧化还原反应?2、特征:反应前后化合价发生变化(也是判断依据)一种物质被氧化,同时另一种物质被还原的反应[练习] 用化合价升降的观点去判断下面的反 应,哪些是氧化还原反应?①MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
②2KClO3 2KCl+3O2↑
③H2+ Cl2 2HCl
④NaCl固+H2SO4浓==NaHSO4+HCl关键:1)正确判断各反应物、生成物各元素的化合价及其变化;2)凡是有化合价升降的化学反应都是氧化还原反应在氧化还原反应中,为什么会发生化合价的变化呢?[小结] 从NaCl的形成看化合价升降的根本原因是电子的
得失,即氧化还原反应的实质是有电子的得失。4. 实质:电子发生转移(得失或偏移)
有电子转移的化学反应都是氧化还原反应3. 氧化反应,失e、价升;还原反应,得e、价降用双线桥应注意的事项: 正确判断各反应物、生成物各元素的化合价及其变化 两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。 电子符号用“e-”来表示 得失电子总数表示:原子个数 × 每个原子得失电子数
注意:反应中失去电子的总数等于得到电子的总数5. 氧化还原反应的表示(氧化还原反应、 化合价升降、电子得失)[练习] 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。① Fe2O3 + 3CO 2Fe + 3CO2
②Zn + 2HCl == ZnCl2 + H2 ↑
③SO2 + 2H2S == 2H2O + 3S
④2KClO3 2KCl+3O2↑
⑤3Cl2 + 8NH3 == 6NH4Cl + N2
⑥MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
[练习] 用双线桥表示下列氧化还原反应的化合价升降及电子转移情况。① MnO2+4HCl浓 MnCl2+Cl2↑+2H2O
② Cu + 2H2SO4(浓) = CuSO4 + SO2 ↑+2H2O
③ SO2 + 2H2S == 2H2O + 3S
④ 3Cl2 + 8NH3 == 6NH4Cl + N2
三、氧化还原反应与基本反应类型的关系及一般规律1.化合反应:有单质参加的是氧化还原反应。
2.分解反应:有单质生成的是氧化还原反应。
3.置换反应:全部是氧化还原反应。
4.复分解反应:都是非氧化还原反应。
四、氧化剂和还原剂氧化剂: 得到电子(元素化合价降低)的物质, 被还原。1. 定义说明: (1) 氧化剂和还原剂均是指反应物质,是一种化学试剂, 不是
某一种元素。
(2) 氧化剂本身被还原,发生还原反应,得到的产物是还原产 物;
还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。还原剂: 失去电子(元素化合价升高)的物质,被氧化。小结:(1)氧化剂和还原剂分别是不同的物质(2)氧化剂和还原剂都是同一种物质(3)氧化剂和还原剂都是同一种物质,而且被氧化与被还原的元素都是相同价态的同种元素(4)反应物参加反应的总量中仅有一部分为氧化剂,另一部分为反应介质2. 常见的氧化剂和还原剂氧化剂: O2、Cl2、浓硫酸、HNO3、KMnO4、 FeCl3等还原剂:Al、Zn、Fe、C、H2、CO等3. 氧化性、还原性强弱判断 氧化剂的氧化性 > 氧化产物的氧化性。
还原剂的还原性 > 还原产物的还原性。(1)原子或离子的得电子能力越强,物质氧化性越强一般规律:(2)原子或离子的失电子能力越强,物质还原性越强
