安徽省黄山市2023-2024学年高二下学期期末质量检测化学试卷(含答案)
文档属性
| 名称 | 安徽省黄山市2023-2024学年高二下学期期末质量检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-09 11:26:43 | ||
图片预览



文档简介
安徽省黄山市2023-2024学年高二下学期7月期末考试化学试题
一、单选题
1.中华五千年传统文化彰显民族自信,也蕴含了许多化学知识。下列说法错误的是
A.“石胆能化铁为铜、成金银”涉及的有湿法炼铜
B.“凡酿酒必资曲药成信”,“曲药”起催化作用
C.“采蒿草之属,晒干烧灰,以水淋之”可得“碱剂”,其主要成分是
D.“司南之勺,投之于地,其柢(勺柄)指南”中“司南之勺”的主要成分是
2.化学使生活更加美好,下列生产活动中,运用相应原理错误的是
A.用重油裂解制备有机化工原料:长链烷烃裂解可得短链烷烃和烯烃
B.利用盐析可分离提纯蛋白质;胶体不能透过半透膜
C.用聚合氯化铝净化生活用水:胶粒具有吸附作用
D.用酒精消毒杀菌:乙醇能使蛋白质变性
3.下列说法错误的是
A.电子排布式违反了泡利原理
B.基态原子电子排布式违反了能量最低原理
C.根据构造原理可知原子核外电子填充顺序为…、、、、…
D.的电子排布式为,违反了洪特规则
4.下列离子方程式书写正确的是
A.向中通入少量:
B.向苯酚钠溶液中少量通入:
C.向澄清石灰水中加入少量溶液:
D.用碳酸钠溶液处理水垢中的硫酸钙:
5.分子式为的有机物共有(不含立体异构)
A.5种 B.6种 C.7种 D.8种
6.某有机化合物键线式如图所示,有关该有机物说法正确的是
A.该有机物的分子式为
B.该有机物最多有16个原子共面
C.该有机物最多能与发生加成反应
D.该有机物可与碳酸钠反应,也可以发生消去反应
7.为阿伏加德罗常数的值,下列说法正确的是
A.乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为
B.的溶液,含的数目为
C.用电解粗铜的方法精炼铜,当电路中通过的电子数为时,阳极应有转化为
D.标准状况下,溶于水,溶液中、和的微粒数之和为
8.利用下列实验方案,能达到探究目的的是
选项 A B C D
探究目的 还原性: 结合的能力: 验证乙烯的还原性 溶液中含有或
实验方法 向溶液中通入,充分反应后,再滴加几滴淀粉溶液,溶液变蓝 室温下,测定浓度均为的与溶液的,溶液的大 向无水乙醇中加入浓硫酸,加热,将产生的气体直接通入酸性溶液,紫红色褪去 向某溶液中滴加浓盐酸,将产生气体通入石蕊试液,溶液先变红后褪色
A.A B.B C.C D.D
9.我国科学家成功利用人工合成淀粉,使淀粉生产方式从农耕种植转变为工业制造成为可能,其部分转化过程如下:
已知:是两性氧化物;水解可制得。下列有关物质关系的说法正确的是
A.反应①~③在高温下速率更快
B.反应③中发生了取代反应
C.等物质的量的和分子,含有相同的电子数
D.反应①中
10.短周期主族元素、、、的原子序数依次增大,原子半径。与同主族,原子最外层电子数是其内层电子总数的3倍,原子的核电荷数等于、原子核电荷数之和。下列说法正确的是
A.工业上常用电解的方法制备的单质
B.的第一电离能大于
C.仅由、、三种元素形成的化合物的水溶液一定呈碱性
D.化合物与都含有离子键
11.由软锰矿(主要成分,及少量、)制备的工艺流程如下:
已知:“沉锰”所得在空气中“焙烧”时转化为、、的混合物,酸性条件下易发生歧化反应。下列说法正确的是
A.“浸取”时利用了的还原性,反应中氧化剂与还原剂物质的量之比为
B.“除杂”后的溶液中主要存在的阳离子有、、、、
C.“沉锰”时反应的离子方程式为
D.“酸浸”时每反应转移电子为
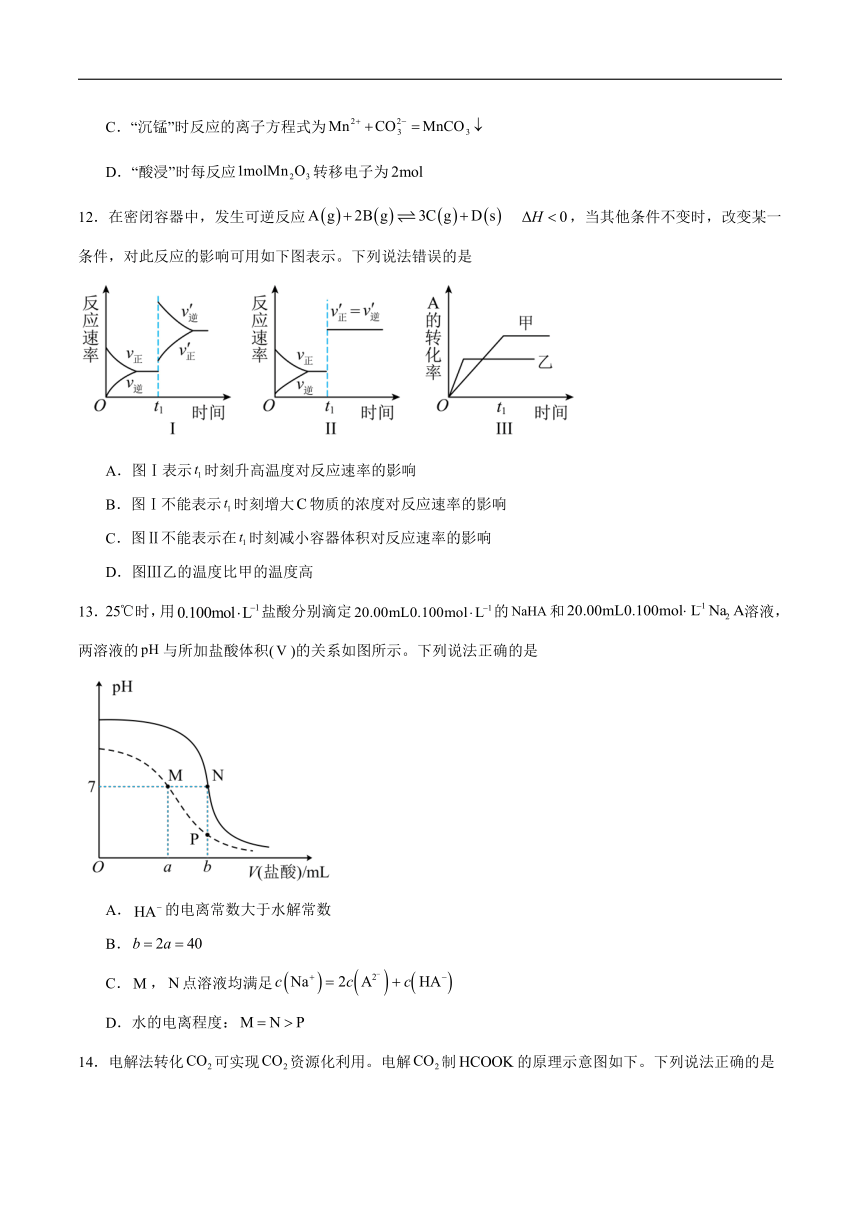
12.在密闭容器中,发生可逆反应 ,当其他条件不变时,改变某一条件,对此反应的影响可用如下图表示。下列说法错误的是
A.图Ⅰ表示时刻升高温度对反应速率的影响
B.图Ⅰ不能表示时刻增大物质的浓度对反应速率的影响
C.图Ⅱ不能表示在时刻减小容器体积对反应速率的影响
D.图Ⅲ乙的温度比甲的温度高
13.时,用盐酸分别滴定的和溶液,两溶液的与所加盐酸体积()的关系如图所示。下列说法正确的是
A.的电离常数大于水解常数
B.
C.,点溶液均满足
D.水的电离程度:
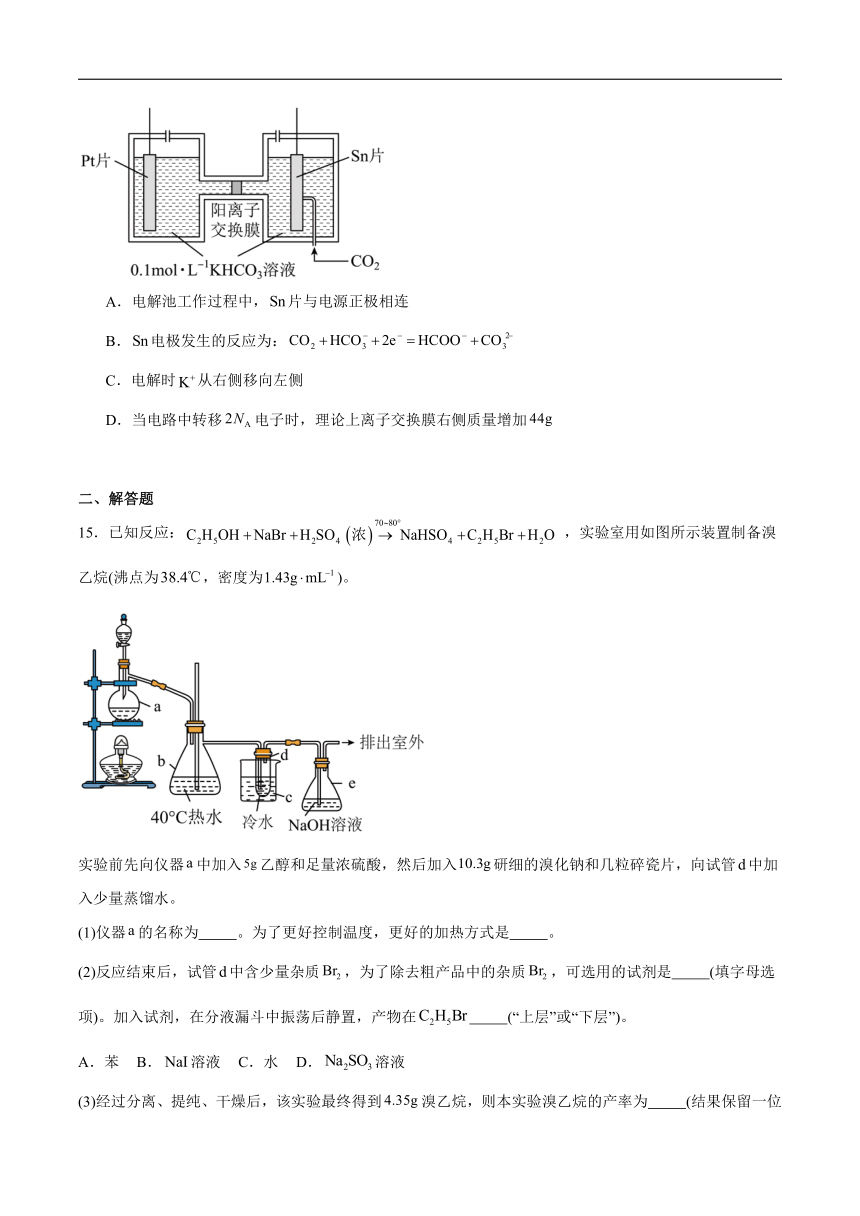
14.电解法转化可实现资源化利用。电解制的原理示意图如下。下列说法正确的是
A.电解池工作过程中,片与电源正极相连
B.电极发生的反应为:
C.电解时从右侧移向左侧
D.当电路中转移电子时,理论上离子交换膜右侧质量增加
二、解答题
15.已知反应:,实验室用如图所示装置制备溴乙烷(沸点为,密度为)。
实验前先向仪器中加入乙醇和足量浓硫酸,然后加入研细的溴化钠和几粒碎瓷片,向试管中加入少量蒸馏水。
(1)仪器的名称为 。为了更好控制温度,更好的加热方式是 。
(2)反应结束后,试管中含少量杂质,为了除去粗产品中的杂质,可选用的试剂是 (填字母选项)。加入试剂,在分液漏斗中振荡后静置,产物在 (“上层”或“下层”)。
A.苯 B.溶液 C.水 D.溶液
(3)经过分离、提纯、干燥后,该实验最终得到溴乙烷,则本实验溴乙烷的产率为 (结果保留一位小数)。
(4)乙二醇可用于生产汽车防冻液。溴乙烷可以通过①消去②加成③水解三步反制取乙二醇。制取过程中步骤①的反应条件为 ;步骤③的化学方程式为 。
16.某小组探究三草酸合铁酸钾晶体()的热分解产物,按图所示装置进行实验。
(1)实验中观察到装置变浑浊、中固体变为红色、变浑浊,由此可判断分解产物一定有和 ,装置的作用 。
(2)小组成员们仔细分析装置,觉得实验装置存在缺陷,其缺陷为 。
(3)样品完全分解后,装置中的残留固体有,和,且与的物质的量之比为。再结合以上信息,写出三草酸合铁酸钾晶体完全分解的化学方程式 。
(4)为测定和溶液中铁元素的总含量,实验操作如下:准确量取溶液于带塞锥形瓶中,加入足量,调节,加热除去过量;加入过量充分反应,再用硫代硫酸钠标准液滴定至终点,消耗标准液(已知)。
①加热除去过量的目的是 。
②加入溶液发生的离子方程式 。
③溶液中铁元素的总含量为
17.用化学反应原理研究、元素的化合物有着重要的意义。
(1)已知:一定温度下
写出和反应生成和的热化学方程式 。
(2)一定温度下,分别向、容器中充入和,保持恒容,保持恒压。发生反应[不考虑],起始时、的体积均为。
①下列能说明、容器均达到平衡状态的是 。
a.、容器的压强均不发生变化
b.、容器中气体的颜色均不发生变化
c.、容器中气体的密度不再发生变化
d.、容器中气体的平均摩尔质量不再发生变化
②时,、容器均达到平衡状态时,中的浓度为,则的转化率为 ,中反应的平衡常数 。
(3)将一定量的和通入容器中,测得的浓度随时间变化如图实线所示。
①、、三段平均反应速率最大的是 。
②仅改变某一个条件,测得的浓度随时间变化如图中虚线所示,则改变的条件是 。
③如图电解装置可将雾霾中的、转化为,则阳极的电极反应式为 。
18.白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
(1)有机物的名称是 ,它在整个合成路径中的作用是 。
(2)的反应类型为 。
(3)的结构简式为 。
(4)白花丹酸分子中常混有如下图所示杂质分子,同时满足下列条件的有机物结构有 种;
①比上图杂质分子的相对分子质量小14.
②与溶液能发生显色反应,且该物质最多能与反应。
写出其中有四种不同化学环境的氢,且个数比为的结构简式 ;
(5)已知:。根据已有知识并结合相关信息写出以苯酚和乙醇为原料制备的合成路线流程图 。
参考答案
1.D
2.B
3.C
4.D
5.C
6.B
7.A
8.B
9.C
10.A
11.A
12.C
13.D
14.B
15.(1) 蒸馏烧瓶 水浴加热
(2) 下层
(3)
(4) 醇溶液,加热
16.(1) 除去混合气体中的
(2)缺少尾气处理装置
(3)
(4) 防止氧化,影响铁含量的测定
17.(1)
(2)
(3) 加入催化剂
18.(1) 环己酮 保护两个酚羟基
(2)氧化反应
(3)
(4) 19种
(5)
一、单选题
1.中华五千年传统文化彰显民族自信,也蕴含了许多化学知识。下列说法错误的是
A.“石胆能化铁为铜、成金银”涉及的有湿法炼铜
B.“凡酿酒必资曲药成信”,“曲药”起催化作用
C.“采蒿草之属,晒干烧灰,以水淋之”可得“碱剂”,其主要成分是
D.“司南之勺,投之于地,其柢(勺柄)指南”中“司南之勺”的主要成分是
2.化学使生活更加美好,下列生产活动中,运用相应原理错误的是
A.用重油裂解制备有机化工原料:长链烷烃裂解可得短链烷烃和烯烃
B.利用盐析可分离提纯蛋白质;胶体不能透过半透膜
C.用聚合氯化铝净化生活用水:胶粒具有吸附作用
D.用酒精消毒杀菌:乙醇能使蛋白质变性
3.下列说法错误的是
A.电子排布式违反了泡利原理
B.基态原子电子排布式违反了能量最低原理
C.根据构造原理可知原子核外电子填充顺序为…、、、、…
D.的电子排布式为,违反了洪特规则
4.下列离子方程式书写正确的是
A.向中通入少量:
B.向苯酚钠溶液中少量通入:
C.向澄清石灰水中加入少量溶液:
D.用碳酸钠溶液处理水垢中的硫酸钙:
5.分子式为的有机物共有(不含立体异构)
A.5种 B.6种 C.7种 D.8种
6.某有机化合物键线式如图所示,有关该有机物说法正确的是
A.该有机物的分子式为
B.该有机物最多有16个原子共面
C.该有机物最多能与发生加成反应
D.该有机物可与碳酸钠反应,也可以发生消去反应
7.为阿伏加德罗常数的值,下列说法正确的是
A.乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为
B.的溶液,含的数目为
C.用电解粗铜的方法精炼铜,当电路中通过的电子数为时,阳极应有转化为
D.标准状况下,溶于水,溶液中、和的微粒数之和为
8.利用下列实验方案,能达到探究目的的是
选项 A B C D
探究目的 还原性: 结合的能力: 验证乙烯的还原性 溶液中含有或
实验方法 向溶液中通入,充分反应后,再滴加几滴淀粉溶液,溶液变蓝 室温下,测定浓度均为的与溶液的,溶液的大 向无水乙醇中加入浓硫酸,加热,将产生的气体直接通入酸性溶液,紫红色褪去 向某溶液中滴加浓盐酸,将产生气体通入石蕊试液,溶液先变红后褪色
A.A B.B C.C D.D
9.我国科学家成功利用人工合成淀粉,使淀粉生产方式从农耕种植转变为工业制造成为可能,其部分转化过程如下:
已知:是两性氧化物;水解可制得。下列有关物质关系的说法正确的是
A.反应①~③在高温下速率更快
B.反应③中发生了取代反应
C.等物质的量的和分子,含有相同的电子数
D.反应①中
10.短周期主族元素、、、的原子序数依次增大,原子半径。与同主族,原子最外层电子数是其内层电子总数的3倍,原子的核电荷数等于、原子核电荷数之和。下列说法正确的是
A.工业上常用电解的方法制备的单质
B.的第一电离能大于
C.仅由、、三种元素形成的化合物的水溶液一定呈碱性
D.化合物与都含有离子键
11.由软锰矿(主要成分,及少量、)制备的工艺流程如下:
已知:“沉锰”所得在空气中“焙烧”时转化为、、的混合物,酸性条件下易发生歧化反应。下列说法正确的是
A.“浸取”时利用了的还原性,反应中氧化剂与还原剂物质的量之比为
B.“除杂”后的溶液中主要存在的阳离子有、、、、
C.“沉锰”时反应的离子方程式为
D.“酸浸”时每反应转移电子为
12.在密闭容器中,发生可逆反应 ,当其他条件不变时,改变某一条件,对此反应的影响可用如下图表示。下列说法错误的是
A.图Ⅰ表示时刻升高温度对反应速率的影响
B.图Ⅰ不能表示时刻增大物质的浓度对反应速率的影响
C.图Ⅱ不能表示在时刻减小容器体积对反应速率的影响
D.图Ⅲ乙的温度比甲的温度高
13.时,用盐酸分别滴定的和溶液,两溶液的与所加盐酸体积()的关系如图所示。下列说法正确的是
A.的电离常数大于水解常数
B.
C.,点溶液均满足
D.水的电离程度:
14.电解法转化可实现资源化利用。电解制的原理示意图如下。下列说法正确的是
A.电解池工作过程中,片与电源正极相连
B.电极发生的反应为:
C.电解时从右侧移向左侧
D.当电路中转移电子时,理论上离子交换膜右侧质量增加
二、解答题
15.已知反应:,实验室用如图所示装置制备溴乙烷(沸点为,密度为)。
实验前先向仪器中加入乙醇和足量浓硫酸,然后加入研细的溴化钠和几粒碎瓷片,向试管中加入少量蒸馏水。
(1)仪器的名称为 。为了更好控制温度,更好的加热方式是 。
(2)反应结束后,试管中含少量杂质,为了除去粗产品中的杂质,可选用的试剂是 (填字母选项)。加入试剂,在分液漏斗中振荡后静置,产物在 (“上层”或“下层”)。
A.苯 B.溶液 C.水 D.溶液
(3)经过分离、提纯、干燥后,该实验最终得到溴乙烷,则本实验溴乙烷的产率为 (结果保留一位小数)。
(4)乙二醇可用于生产汽车防冻液。溴乙烷可以通过①消去②加成③水解三步反制取乙二醇。制取过程中步骤①的反应条件为 ;步骤③的化学方程式为 。
16.某小组探究三草酸合铁酸钾晶体()的热分解产物,按图所示装置进行实验。
(1)实验中观察到装置变浑浊、中固体变为红色、变浑浊,由此可判断分解产物一定有和 ,装置的作用 。
(2)小组成员们仔细分析装置,觉得实验装置存在缺陷,其缺陷为 。
(3)样品完全分解后,装置中的残留固体有,和,且与的物质的量之比为。再结合以上信息,写出三草酸合铁酸钾晶体完全分解的化学方程式 。
(4)为测定和溶液中铁元素的总含量,实验操作如下:准确量取溶液于带塞锥形瓶中,加入足量,调节,加热除去过量;加入过量充分反应,再用硫代硫酸钠标准液滴定至终点,消耗标准液(已知)。
①加热除去过量的目的是 。
②加入溶液发生的离子方程式 。
③溶液中铁元素的总含量为
17.用化学反应原理研究、元素的化合物有着重要的意义。
(1)已知:一定温度下
写出和反应生成和的热化学方程式 。
(2)一定温度下,分别向、容器中充入和,保持恒容,保持恒压。发生反应[不考虑],起始时、的体积均为。
①下列能说明、容器均达到平衡状态的是 。
a.、容器的压强均不发生变化
b.、容器中气体的颜色均不发生变化
c.、容器中气体的密度不再发生变化
d.、容器中气体的平均摩尔质量不再发生变化
②时,、容器均达到平衡状态时,中的浓度为,则的转化率为 ,中反应的平衡常数 。
(3)将一定量的和通入容器中,测得的浓度随时间变化如图实线所示。
①、、三段平均反应速率最大的是 。
②仅改变某一个条件,测得的浓度随时间变化如图中虚线所示,则改变的条件是 。
③如图电解装置可将雾霾中的、转化为,则阳极的电极反应式为 。
18.白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
(1)有机物的名称是 ,它在整个合成路径中的作用是 。
(2)的反应类型为 。
(3)的结构简式为 。
(4)白花丹酸分子中常混有如下图所示杂质分子,同时满足下列条件的有机物结构有 种;
①比上图杂质分子的相对分子质量小14.
②与溶液能发生显色反应,且该物质最多能与反应。
写出其中有四种不同化学环境的氢,且个数比为的结构简式 ;
(5)已知:。根据已有知识并结合相关信息写出以苯酚和乙醇为原料制备的合成路线流程图 。
参考答案
1.D
2.B
3.C
4.D
5.C
6.B
7.A
8.B
9.C
10.A
11.A
12.C
13.D
14.B
15.(1) 蒸馏烧瓶 水浴加热
(2) 下层
(3)
(4) 醇溶液,加热
16.(1) 除去混合气体中的
(2)缺少尾气处理装置
(3)
(4) 防止氧化,影响铁含量的测定
17.(1)
(2)
(3) 加入催化剂
18.(1) 环己酮 保护两个酚羟基
(2)氧化反应
(3)
(4) 19种
(5)
同课章节目录
