人教版高中化学课件必修二 1.1 元素周期表 (共64张PPT)
文档属性
| 名称 | 人教版高中化学课件必修二 1.1 元素周期表 (共64张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 10:55:21 | ||
图片预览








文档简介
课件64张PPT。第一章 物质结构 元素周期律
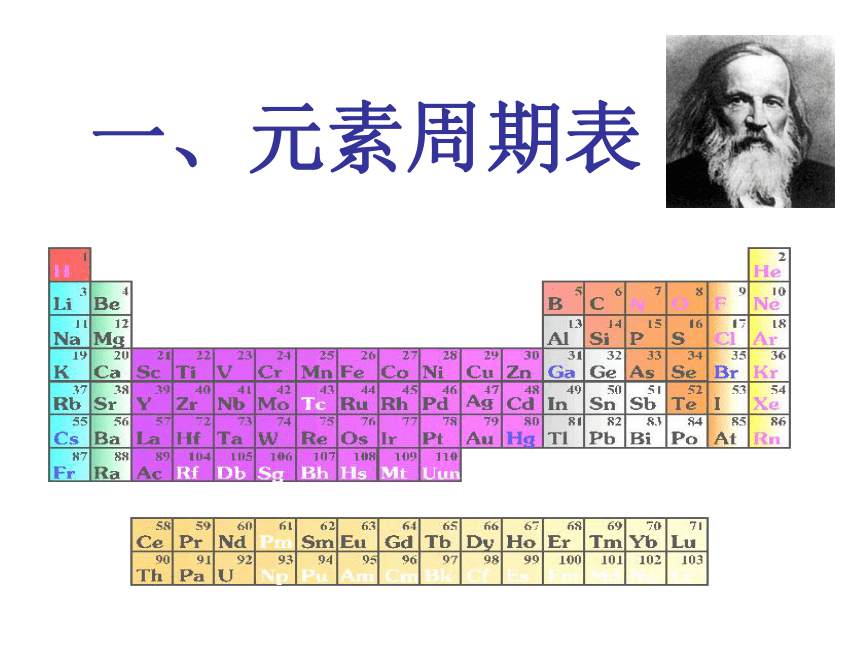
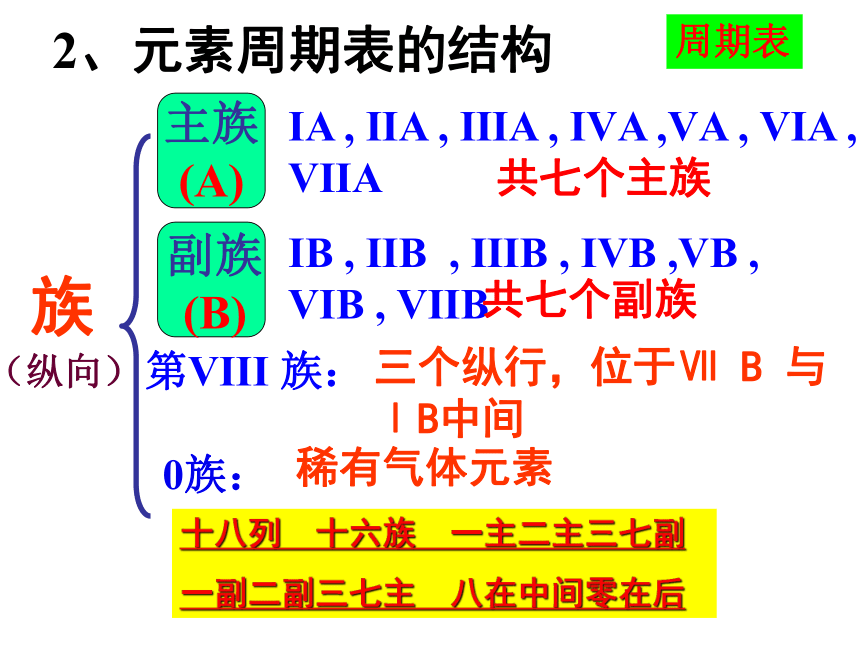
元素周期表2018年11月18日星期日 一、元素周期表1、元素周期表的编排A. 按原子序数递增的顺序排列 B. 将电子层数相同的元素由左到右排列成一个横行,即周期 C. 把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行,即族周期序数=电子层数(1)依据:元素周期律(2)原则:(3)规律:原子序数=核电荷数=质子数=核外电子数2、元素周期表的结构周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素(横向)周期表周期分类及各周期元素种数三短三长一不全2、元素周期表的结构 族ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素(纵向) 0族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族三个纵行,位于Ⅶ B 与ⅠB中间 十八列 十六族 一主二主三七副
一副二副三七主 八在中间零在后周期表主族与副族的对比主族序数 = 最外层电子数 过渡元素:第VIII 族和全部副族元素,通称为过渡元素。也叫做过渡金属?超铀元素:在锕系元素中92号元素铀以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫超铀元素。一线:金属和非金属元素的分界线周期表 根据每一周期元素种数确定起始元素、结束元素的原子序数1……………………..2种……………………………….2
3……………………..8种……………………………….10
11……………………8种………………………………..18
19……………………18种………………………………36
37……………………18种………………………………54
55……………………32种……………………………….86
87……………………26种………………………………112周期序数=电子层数
主族序数=最外层电子层数
从左到右每一列的名称
零族元素的原子序数。
每一周期元素种数:
七个主族和零族的元素符号和名称
两个特殊元素的原子序数和位置:Fe,Br
熟记周期表练习与思考:1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考:2、下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
(A)14、24、34 (B)26、31、35
(C)5、15、20 (D)11、17、18C练习与思考:3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D锂、钠、 钾、铷、铯、钫 Li 、 K、Rb、Cs、FrNa、碱 金 属二、元素的性质与原子结构1、碱金属元素学习方法典型、代表性的化学物质推
广结构相似的一类化学物质递
变
性相
似
性根据原子结构推测:
碱金属元素性质的相似性和递变性认识碱金属根据钠的物理性质推测:
碱金属可能有什么物理性质?最外层只有一个电子逐
渐
增
大逐
渐
增
多逐
渐
增
大银白色金属略带金色柔软,密度小,熔沸点较低,延展性好,导电导热性好逐
渐
增
大
(K
反常)逐
?
渐
?
降
?
低
回忆钠的化学性质1.与非金属单质反应
2.与水反应
3. 与酸的反应
4.与盐溶液反应
5.氧化物的水化物是可溶于水的强碱
2Na + 2H2O === 2NaOH + H2↑2Na+2HCl===2NaCl+H2↑ 2Na+H2SO4===Na2SO4+H2↑Na2O + H2O = 2NaOH 2H2O+2Na+CuSO4=Cu(OH)2↓ +Na2SO4+H2↑碱金属的化学性质推测碱金属是化学性质非常活泼的一类金属
碱金属容易和氧气等非金属、水、酸发生反应,有比较剧烈的现象;
碱金属元素的化学性质虽然相似,但又不完全相同。随着电子层数的增加,碱金属单质失电子能力逐渐增强,还原性逐渐增强。
碱金属氧化物的水化物是可溶于水的强碱。证据和实验验证1、碱金属与非金属的反应钾在空气中燃烧的剧烈程度>钠钾在水中反应比钠剧烈,发生燃烧2K+2H2O==2KOH+H2 ↑铷与水反应视频2、碱金属与水反应铯与水反应视频金属性逐渐增强对应的氢氧化物碱性增强碱金属元素化学性质的相似性和递变性小结:还原性:LiNa+>K+>Rb+>Cs+氢氧化物碱性:LiOH钾在氯气中燃烧:
钾与水反应的离子方程式:
钾与盐酸反应的化学方程式:
钾与硫酸铜溶液反应的化学方程式:二、元素的性质与原子结构氟F、 氯Cl 、溴Br、碘I、砹At2、卤族元素卤素的原子结构 氟 氯 溴 碘 F Cl Br I 9 17 35 53(1)卤素原子结构的特点A.相似性:最外层电子层上都有7个电子。B.递变性(从F到I):
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
离子半径逐渐增大(2)卤素物理性质的特点卤 素 单 质 的 物 理 性 质黄绿色气 体深红棕色液 体紫黑色固 体淡黄绿色气 体逐 渐 增 大逐 渐 升 高反 应226cm34.16g0.029gF2 、Cl2 、Br2 、I2 A.相似性:在水中的溶解度小,易于溶有机溶剂.(苯、汽油、四氯化碳、酒精等) B.递变性:颜色:
状态:
密度:
熔沸点:逐渐加深
由气态→液态→固态逐渐增大逐渐升高C.特殊性:①氟与水反应②溴易挥发(水封保存,玻璃塞)③碘易升华(提纯碘)A、卤素单质与金属的反应规律:F2、Cl2、Br2 与变价金属生成最高价卤化物,
I2生成较低价卤化物(3)卤素单质的化学性质2Fe + 3F2 = 2FeF3B、卤素与氢气的反应(1) F2 + H2 = 2HF(2) Cl2 + H2 = 2HClX2 + H2 = 2HX反应条件剧烈程度生成氢化物的稳定性不断加热暗光照或点燃500 ℃剧烈爆炸爆炸才能反应缓慢进行很稳定稳定不如HCl稳定很不稳定C、卤素跟水的反应剧烈程度逐渐减弱X2 + H2O = HX + HXO
(X=Cl、 Br、 I)D、与碱反应
请写出卤素单质(X2)与NaOH溶液反应的通式X2+2NaOH=NaX+NaXO+H2O
X2+2OH- =X- +XO- +H2O
(X为Cl、Br)3I2+6OH- =5I- +IO3- +3H2OE、卤素单质间的置换反应Br2 > I2Cl2 > Br2(3) Cl2 + 2NaI = 2NaCl + I2(1) Cl2 + 2NaBr = 2NaCl + Br2(2) Br2 + 2NaI = 2NaBr + I2Cl2 > I2在氧化还原反应中,氧化剂 > 氧化产物 的氧化能力 F2 > Cl2 > Br2 > I2 F- < Cl- < Br- < I- HFHCl >HBr>HI氧化性还原性还原性稳定性注意:①HX的酸性:HF ②氢氟酸腐蚀玻璃,所以要用塑料瓶盛装。总 结最外层电子数都是1最外层电子数都是7原子易失1个电子单质都有强还原性原子易得1个电子单质都有强氧化性核电荷数递增电子层数递增原子半径递增核电荷数递增电子层数递增原子半径递增失电子能力递增单质还原性递增得电子能力递减单质氧化性递减(1)碘(I2)单质遇淀粉溶液变蓝色(2)物理特性:升华2、碘的特性:(3)I2与Fe反应生成:FeI2卤素的特殊性:1、氟的特性:(1)与水剧烈反应生成氧气(2)只有氧化性(只有负价)淀粉碘化钾试纸的应用1、什么叫元素?决定元素种类的是什么?思考: 元素是指具有相同核电荷数(质子数)的同一类原子的总称。它以游离态(单质)和化合态存在。只论种类不论个数,没有数量的含义。决定元素种类的是核电荷数(或质子数)2、什么叫原子?3、什么叫分子?原子是化学变化中的最小微粒。分子是保持物质化学性质的一种微粒。 (1)化学变化中的最小粒子是原子,化学变化的实质是
原子的重新组合。原子虽小,还可以再分。1.原子的组成(2)决定元素种类的是:
决定原子种类的是:
决定元素化学
性质的是:质子数质子数和中子数核外电子数,主要是最外层电子数 三、核素1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电原子作为一个整体不显电性。构成原子的粒子及其性质
2.原子核:它由质子和中子构成。(1)电性及电量关系质子: 带正电;一个质子带一个单位的正电荷。
中子: 不带电。
电子: 带负电;一个电子带一个单位的负电荷。}原子核带正电原子核带正电荷总数和核外电子带负电荷总数相等。原子序数=核电荷数 = 核内质子数 = 核外电子数(2)质量关系质子:一个质子的相对质量是1.007,近似整数值为1
中子:一个中子的相对质量是1.008, 近似整数值是1
电子:一个电子的相对质量是1/1836,可忽略。原子的质量主要集中在原子核上。质量数 = 质子数 + 中子数A = Z + N质量数:忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数。质量数与相对原子质量的关系?A——代表质量数;
Z——代表核电荷数;
c——代表离子所带的电荷数;
d——代表化合价
e——代表一个分子中的原子个数O81622-- 1离子电荷原子个数质量数质子数化合价2.填写下表中空白Z171反馈问题3.是不是任何原子核都是由质子和中子构成的? 不是,如上述练习中1H原子,核内无中子,仅有一个质子。 14.假如原子在化学反应中得到或失去电子,它还会显电中性吗?不会,原子失去或得到电子后,成为带电的原子—离子,不显电中性;形成的带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离子。 5.离子所带电荷数与质子数和电子数是什么关系?离子所带电荷数 = 质子数 - 核外电子数6.当质子数(核电荷数)>核外电子数时,该粒子
是 离子,带 电荷。
当质子数(核电荷数) 核外电子数时,该粒子是阴离子,带 电荷。阳正<负7.填写表中空白
课堂练习1.某粒子用ARn-表示,下列关于该粒子的叙述正确的
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.所带电荷=nZ2.某元素Mn+核外有a个电子,该元素的某种原子的质量数为A,则该原子的核内中子数为
A.A-a+n B.A-a-n
C.A+a-n D.A+a+nBCB 氕 氘 氚 重氢 超重氢试比较三种原子的异同,指出它们之间的关系。质子数相同中子数不同,质量数不同属同种元素不同种原子(D)(T) 4、同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素(即同一元素的不同核素互称为同位素)。同位素的性质:(1)同一元素的各种同位素虽然质量数不同,但它们的化学性质几乎完全相同。(2)天然存在的某种元素里,各种同位素所占的原子个数百分比一般是不变的。3、核素:把具有一定数目质子和一定数目中子的一种原子叫做核素,如11H、21H、31H就各为一种核素。 同位素举例及应用(PLAY)(1)H的三种同位素:
(2)U的三种同位素:
是造原子弹及核反应堆的材料。(3)C的三种同位素:
是原子量的标准 是制造氢弹的材料。92U2346C126C12练习1:A、氢的5种同位素 B、5种氢元素
C、氢的五种同素异形体
D、氢元素的5种不同微粒H+、H2是( )同素异形体是指同一种元素形成的多种不同单质 D练习2:A、它们可能是不同的分子
B、可能是相同的原子
C、可能是同位素
D、可能是一种分子和一种离子 一种微粒的质子数和电子数和另一种微粒的质子数和电子数均相等,下列对2种微粒间关系的说法错误的是( )D卤素原子离子半径比较:
元素周期表2018年11月18日星期日 一、元素周期表1、元素周期表的编排A. 按原子序数递增的顺序排列 B. 将电子层数相同的元素由左到右排列成一个横行,即周期 C. 把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行,即族周期序数=电子层数(1)依据:元素周期律(2)原则:(3)规律:原子序数=核电荷数=质子数=核外电子数2、元素周期表的结构周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素(横向)周期表周期分类及各周期元素种数三短三长一不全2、元素周期表的结构 族ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素(纵向) 0族:共七个主族ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族三个纵行,位于Ⅶ B 与ⅠB中间 十八列 十六族 一主二主三七副
一副二副三七主 八在中间零在后周期表主族与副族的对比主族序数 = 最外层电子数 过渡元素:第VIII 族和全部副族元素,通称为过渡元素。也叫做过渡金属?超铀元素:在锕系元素中92号元素铀以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫超铀元素。一线:金属和非金属元素的分界线周期表 根据每一周期元素种数确定起始元素、结束元素的原子序数1……………………..2种……………………………….2
3……………………..8种……………………………….10
11……………………8种………………………………..18
19……………………18种………………………………36
37……………………18种………………………………54
55……………………32种……………………………….86
87……………………26种………………………………112周期序数=电子层数
主族序数=最外层电子层数
从左到右每一列的名称
零族元素的原子序数。
每一周期元素种数:
七个主族和零族的元素符号和名称
两个特殊元素的原子序数和位置:Fe,Br
熟记周期表练习与思考:1、推算原子序数为6、13、34、53、88的元素在周期表中的位置。23457IVAIIIAVIAVIIAIIA练习与思考:2、下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
(A)14、24、34 (B)26、31、35
(C)5、15、20 (D)11、17、18C练习与思考:3、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)D锂、钠、 钾、铷、铯、钫 Li 、 K、Rb、Cs、FrNa、碱 金 属二、元素的性质与原子结构1、碱金属元素学习方法典型、代表性的化学物质推
广结构相似的一类化学物质递
变
性相
似
性根据原子结构推测:
碱金属元素性质的相似性和递变性认识碱金属根据钠的物理性质推测:
碱金属可能有什么物理性质?最外层只有一个电子逐
渐
增
大逐
渐
增
多逐
渐
增
大银白色金属略带金色柔软,密度小,熔沸点较低,延展性好,导电导热性好逐
渐
增
大
(K
反常)逐
?
渐
?
降
?
低
回忆钠的化学性质1.与非金属单质反应
2.与水反应
3. 与酸的反应
4.与盐溶液反应
5.氧化物的水化物是可溶于水的强碱
2Na + 2H2O === 2NaOH + H2↑2Na+2HCl===2NaCl+H2↑ 2Na+H2SO4===Na2SO4+H2↑Na2O + H2O = 2NaOH 2H2O+2Na+CuSO4=Cu(OH)2↓ +Na2SO4+H2↑碱金属的化学性质推测碱金属是化学性质非常活泼的一类金属
碱金属容易和氧气等非金属、水、酸发生反应,有比较剧烈的现象;
碱金属元素的化学性质虽然相似,但又不完全相同。随着电子层数的增加,碱金属单质失电子能力逐渐增强,还原性逐渐增强。
碱金属氧化物的水化物是可溶于水的强碱。证据和实验验证1、碱金属与非金属的反应钾在空气中燃烧的剧烈程度>钠钾在水中反应比钠剧烈,发生燃烧2K+2H2O==2KOH+H2 ↑铷与水反应视频2、碱金属与水反应铯与水反应视频金属性逐渐增强对应的氢氧化物碱性增强碱金属元素化学性质的相似性和递变性小结:还原性:Li
钾与水反应的离子方程式:
钾与盐酸反应的化学方程式:
钾与硫酸铜溶液反应的化学方程式:二、元素的性质与原子结构氟F、 氯Cl 、溴Br、碘I、砹At2、卤族元素卤素的原子结构 氟 氯 溴 碘 F Cl Br I 9 17 35 53(1)卤素原子结构的特点A.相似性:最外层电子层上都有7个电子。B.递变性(从F到I):
核电荷数逐渐增多
电子层数逐渐增多
原子半径逐渐增大
离子半径逐渐增大(2)卤素物理性质的特点卤 素 单 质 的 物 理 性 质黄绿色气 体深红棕色液 体紫黑色固 体淡黄绿色气 体逐 渐 增 大逐 渐 升 高反 应226cm34.16g0.029gF2 、Cl2 、Br2 、I2 A.相似性:在水中的溶解度小,易于溶有机溶剂.(苯、汽油、四氯化碳、酒精等) B.递变性:颜色:
状态:
密度:
熔沸点:逐渐加深
由气态→液态→固态逐渐增大逐渐升高C.特殊性:①氟与水反应②溴易挥发(水封保存,玻璃塞)③碘易升华(提纯碘)A、卤素单质与金属的反应规律:F2、Cl2、Br2 与变价金属生成最高价卤化物,
I2生成较低价卤化物(3)卤素单质的化学性质2Fe + 3F2 = 2FeF3B、卤素与氢气的反应(1) F2 + H2 = 2HF(2) Cl2 + H2 = 2HClX2 + H2 = 2HX反应条件剧烈程度生成氢化物的稳定性不断加热暗光照或点燃500 ℃剧烈爆炸爆炸才能反应缓慢进行很稳定稳定不如HCl稳定很不稳定C、卤素跟水的反应剧烈程度逐渐减弱X2 + H2O = HX + HXO
(X=Cl、 Br、 I)D、与碱反应
请写出卤素单质(X2)与NaOH溶液反应的通式X2+2NaOH=NaX+NaXO+H2O
X2+2OH- =X- +XO- +H2O
(X为Cl、Br)3I2+6OH- =5I- +IO3- +3H2OE、卤素单质间的置换反应Br2 > I2Cl2 > Br2(3) Cl2 + 2NaI = 2NaCl + I2(1) Cl2 + 2NaBr = 2NaCl + Br2(2) Br2 + 2NaI = 2NaBr + I2Cl2 > I2在氧化还原反应中,氧化剂 > 氧化产物 的氧化能力 F2 > Cl2 > Br2 > I2 F- < Cl- < Br- < I- HF
原子的重新组合。原子虽小,还可以再分。1.原子的组成(2)决定元素种类的是:
决定原子种类的是:
决定元素化学
性质的是:质子数质子数和中子数核外电子数,主要是最外层电子数 三、核素1个质子带一个单位正电荷1个电子带一个单位负电荷中子不带电原子作为一个整体不显电性。构成原子的粒子及其性质
2.原子核:它由质子和中子构成。(1)电性及电量关系质子: 带正电;一个质子带一个单位的正电荷。
中子: 不带电。
电子: 带负电;一个电子带一个单位的负电荷。}原子核带正电原子核带正电荷总数和核外电子带负电荷总数相等。原子序数=核电荷数 = 核内质子数 = 核外电子数(2)质量关系质子:一个质子的相对质量是1.007,近似整数值为1
中子:一个中子的相对质量是1.008, 近似整数值是1
电子:一个电子的相对质量是1/1836,可忽略。原子的质量主要集中在原子核上。质量数 = 质子数 + 中子数A = Z + N质量数:忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫做质量数。质量数与相对原子质量的关系?A——代表质量数;
Z——代表核电荷数;
c——代表离子所带的电荷数;
d——代表化合价
e——代表一个分子中的原子个数O81622-- 1离子电荷原子个数质量数质子数化合价2.填写下表中空白Z171反馈问题3.是不是任何原子核都是由质子和中子构成的? 不是,如上述练习中1H原子,核内无中子,仅有一个质子。 14.假如原子在化学反应中得到或失去电子,它还会显电中性吗?不会,原子失去或得到电子后,成为带电的原子—离子,不显电中性;形成的带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离子。 5.离子所带电荷数与质子数和电子数是什么关系?离子所带电荷数 = 质子数 - 核外电子数6.当质子数(核电荷数)>核外电子数时,该粒子
是 离子,带 电荷。
当质子数(核电荷数) 核外电子数时,该粒子是阴离子,带 电荷。阳正<负7.填写表中空白
课堂练习1.某粒子用ARn-表示,下列关于该粒子的叙述正确的
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.所带电荷=nZ2.某元素Mn+核外有a个电子,该元素的某种原子的质量数为A,则该原子的核内中子数为
A.A-a+n B.A-a-n
C.A+a-n D.A+a+nBCB 氕 氘 氚 重氢 超重氢试比较三种原子的异同,指出它们之间的关系。质子数相同中子数不同,质量数不同属同种元素不同种原子(D)(T) 4、同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素(即同一元素的不同核素互称为同位素)。同位素的性质:(1)同一元素的各种同位素虽然质量数不同,但它们的化学性质几乎完全相同。(2)天然存在的某种元素里,各种同位素所占的原子个数百分比一般是不变的。3、核素:把具有一定数目质子和一定数目中子的一种原子叫做核素,如11H、21H、31H就各为一种核素。 同位素举例及应用(PLAY)(1)H的三种同位素:
(2)U的三种同位素:
是造原子弹及核反应堆的材料。(3)C的三种同位素:
是原子量的标准 是制造氢弹的材料。92U2346C126C12练习1:A、氢的5种同位素 B、5种氢元素
C、氢的五种同素异形体
D、氢元素的5种不同微粒H+、H2是( )同素异形体是指同一种元素形成的多种不同单质 D练习2:A、它们可能是不同的分子
B、可能是相同的原子
C、可能是同位素
D、可能是一种分子和一种离子 一种微粒的质子数和电子数和另一种微粒的质子数和电子数均相等,下列对2种微粒间关系的说法错误的是( )D卤素原子离子半径比较:
