高一化学下学期人教版(2019)期末考试模拟B卷(含解析)
文档属性
| 名称 | 高一化学下学期人教版(2019)期末考试模拟B卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 16:46:29 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
高一化学下学期人教版(2019)期末考试模拟B卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.下列说法错误的是( )
A.在葡萄酒酿制过程中添加适量的二氧化硫,可以起到杀菌、抗氧化作用
B.硫酸钡不溶于水和酸,在医疗上可用硫酸钡作X射线透视肠胃的内服药剂
C.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
D.无水硫酸铜可以用来检验酒精中是否含有少量水
2.下列试剂的保存方法错误的是( )
A.氢氟酸通常保存在塑料瓶中
B.液溴应水封保存,并用橡胶塞塞紧瓶口
C.双氧水可以保存在棕色细口瓶中
D.溶液保存时需加入少量铁粉
3.光照条件下,在催化剂表面进行与反应的两种途径如图所示,下列说法正确的是( )
A.在人体内能扩张血管,提高免疫力等,因此大气中的对人体无害
B.氮氧化物随意排放至空气中易形成酸雨
C.途径②中,发生了还原反应
D.选择合适的催化剂,可以使与一步化合生成
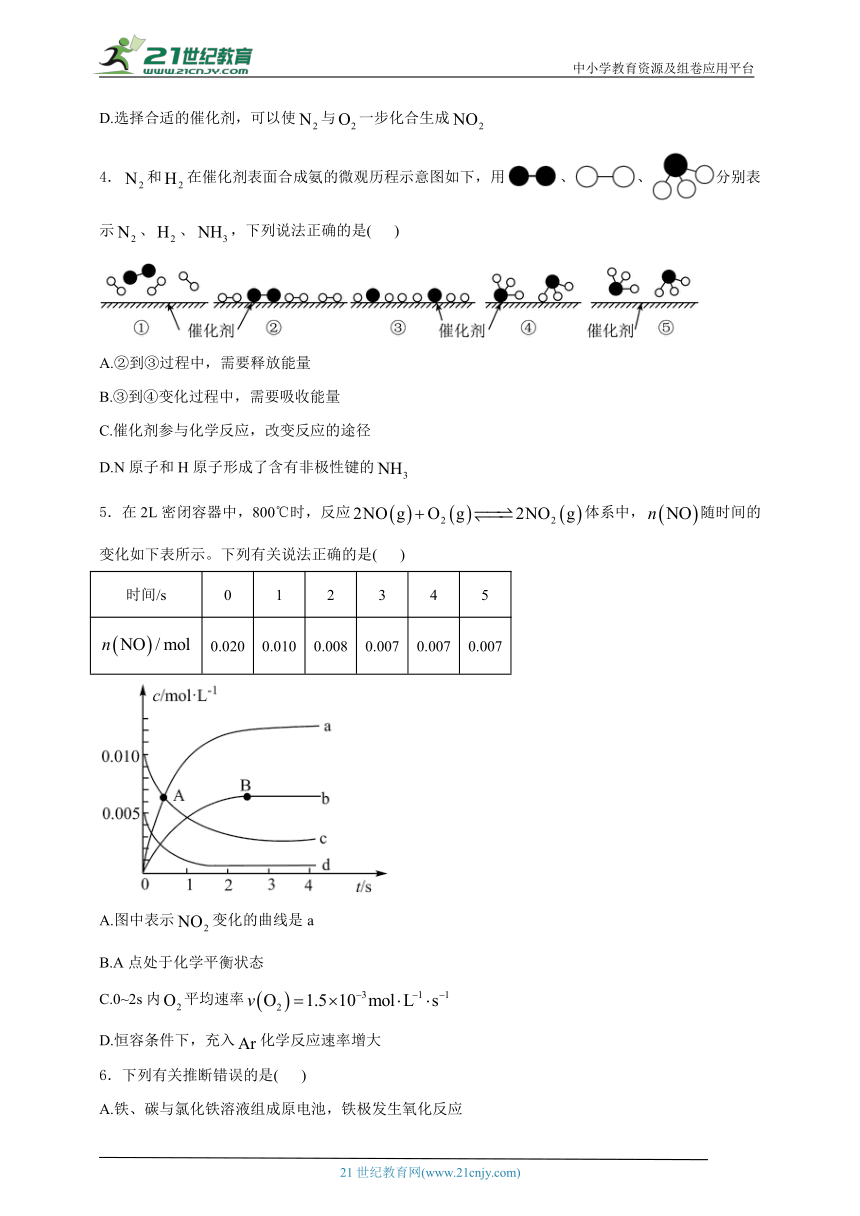
4.和在催化剂表面合成氨的微观历程示意图如下,用、、分别表示、、,下列说法正确的是( )
A.②到③过程中,需要释放能量
B.③到④变化过程中,需要吸收能量
C.催化剂参与化学反应,改变反应的途径
D.N原子和H原子形成了含有非极性键的
5.在2L密闭容器中,800℃时,反应体系中,随时间的变化如下表所示。下列有关说法正确的是( )
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
A.图中表示变化的曲线是a
B.A点处于化学平衡状态
C.0~2s内平均速率
D.恒容条件下,充入化学反应速率增大
6.下列有关推断错误的是( )
A.铁、碳与氯化铁溶液组成原电池,铁极发生氧化反应
B.铁、银与硫酸铜溶液组成的原电池中,和电子均向银极移动
C.盐酸与氢氧化钠反应的能量变化可用图简单表
D.的能量变化如图所示,可推出反应物的键能总和大于生成物的键能总和
7.通过化学实验现象得出相应的结论是探究物质性质的一种重要方法,下列实验操作和现象或结论不正确的是( )
选项 实验操作和现象 结论
A 向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,脱脂棉燃烧 过氧化钠与水反应放热
B 向某未知溶液(不含)中加入足量硝酸酸化的硝酸银溶液,无气体产生,但有白色沉淀出现 未知溶液中含有,一定不含或
C 用铂丝蘸取少量未知固体做焰色试验,火焰呈黄色 固体中一定含,可能含
D 向某溶液中加入盐酸酸化的溶液,有白色沉淀 溶液中一定含有
A.A B.B C.C D.D
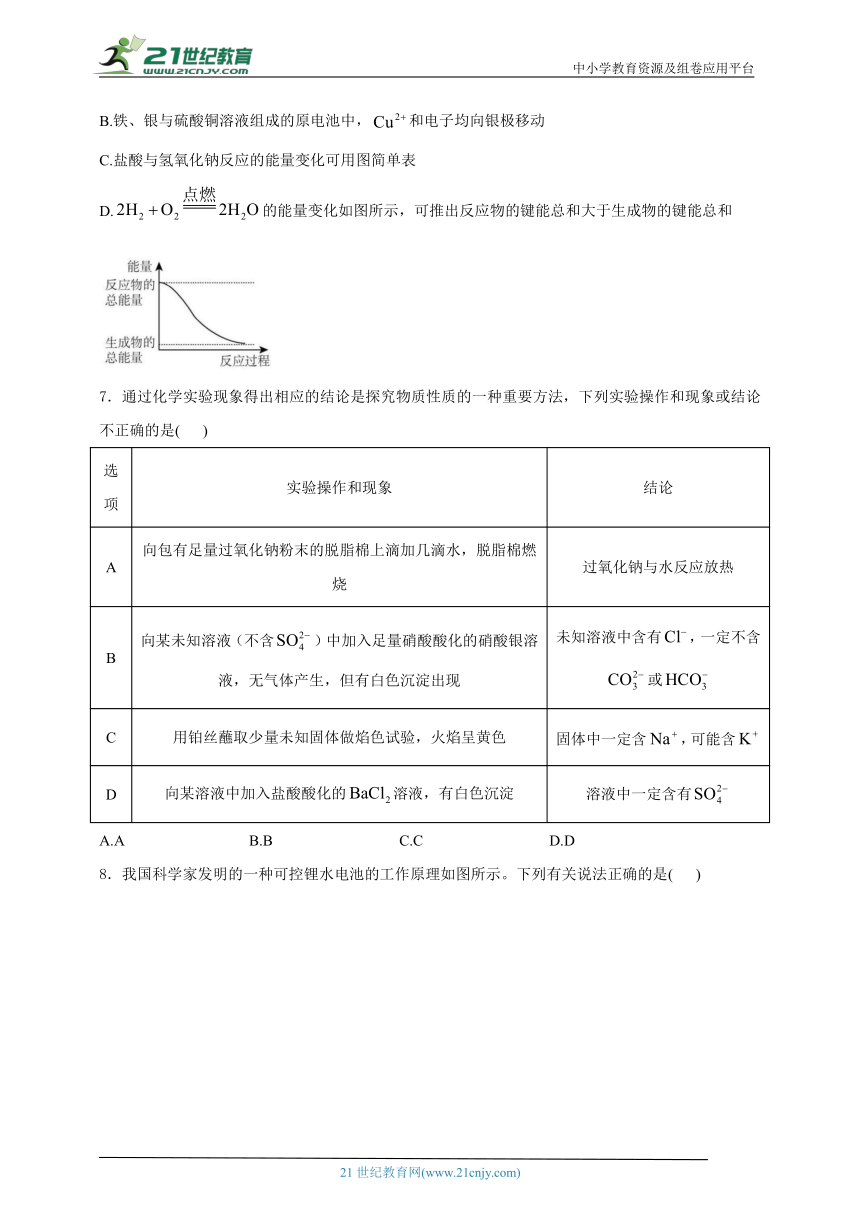
8.我国科学家发明的一种可控锂水电池的工作原理如图所示。下列有关说法正确的是( )
A.锂为负极,发生还原反应
B.移向正极并在正极得电子
C.电子由锂→有机电解质→固体电解质→水溶液→石墨
D.电池工作时的总反应为:
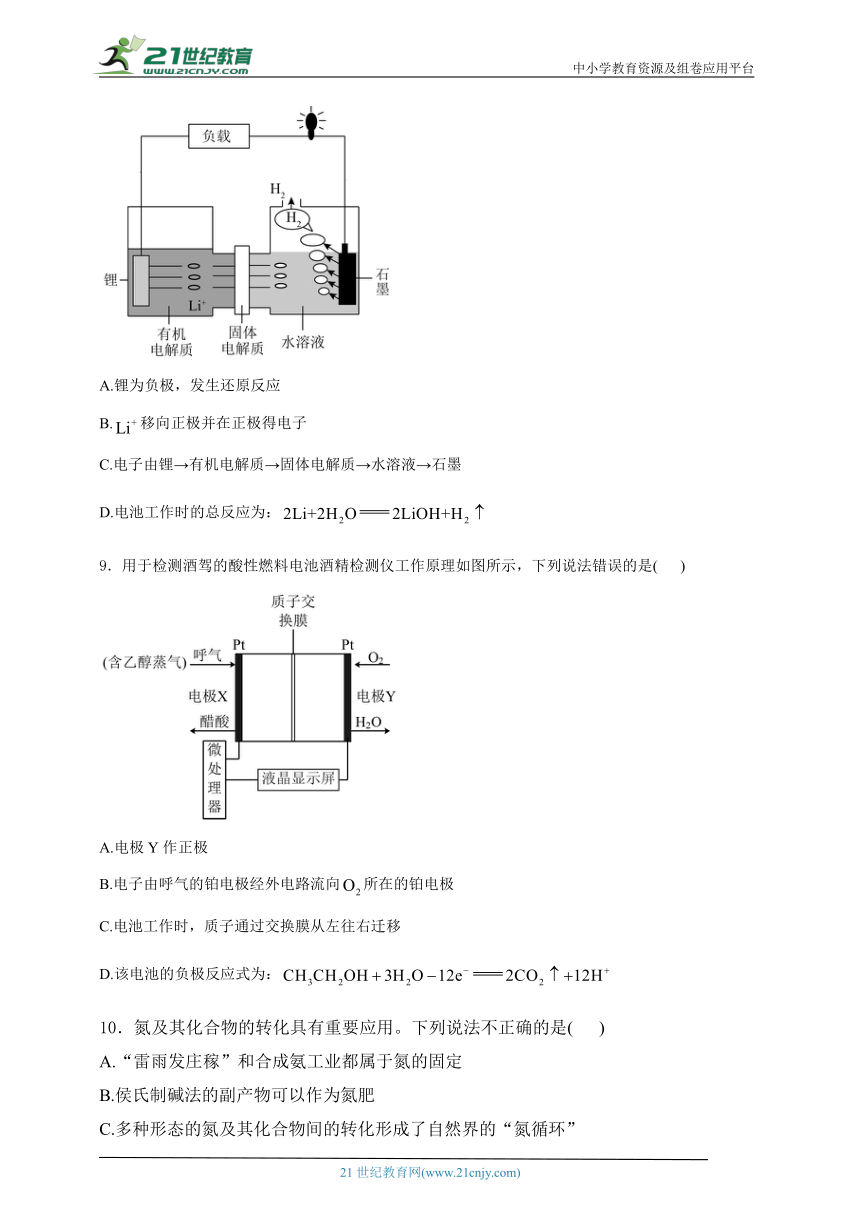
9.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示,下列说法错误的是( )
A.电极Y作正极
B.电子由呼气的铂电极经外电路流向所在的铂电极
C.电池工作时,质子通过交换膜从左往右迁移
D.该电池的负极反应式为:
10.氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A.“雷雨发庄稼”和合成氨工业都属于氮的固定
B.侯氏制碱法的副产物可以作为氮肥
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
D.二氧化硫、氮氧化物溶于雨水会形成酸雨,酸雨的pH约为5.6
11.将12.8 g铜与80 mL 10 mol/L的充分反应后,溶液中含0.1 mol,由此可知( )
A.生成的气体只有二氧化氮
B.反应中转移的电子的物质的量为0.2mol
C.被还原的硝酸的物质的量为0.3 mol
D.反应后溶液中所含的物质的量为0.4 mol
12.下列物质的相关描述和知识均正确的是( )
选项 物质名称 描述 相关知识
A 裂解气 混合物 主要成分为烷烃
B 煤的干馏 物理变化 产品主要为出炉煤气、煤焦油和焦炭
C 水煤气 混合物 可作为化工原料气生产甲醇、二甲醚等
D 淀粉和蛋白质 高分子化合物 二者组成元素相同
A.A B.B C.C D.D
13.,下列叙述不正确的是( )
A.反应过程中能量关系可用右图表示
B.用Fe(s)和(g)表示该反应的化学反应速率时数值相等
C.若将该反应设计成原电池,则负极将发生氧化反应
D.若将该反应设计成原电池,则正极将析出气体
14.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的材料,电池反应为。下列说法错误的是( )
A.石墨烯的作用主要是提高电极a的导电性
B.电池放电时间越长,电池中的量越少
C.电池工作时,正极可发生反应:
D.电池工作时,外电路中流过电子,负极材料减重
15.将38.4gCu与0.22L浓硝酸混合恰好完全反应生成氮的氧化物,这些氧化物恰好与溶液反应得到和的混合溶液,反应过程及有关数据如图所示。下列说法正确的是( )
A.反应Ⅰ中硝酸只体现氧化性
B.反应Ⅱ中作氧化剂
C.混合气体中的物质的量为0.2mol
D.浓硝酸的物质的量浓度为
二、填空题(共4题,55分)
16.汽车尾气中含有、CO,排气管内的催化转化器可实现将污染性气体转化为和。
(1)已知:①
②
③
则与反应生成和的热化学方程式为__________。该反应在__________(填“高温”或“低温”)下可自发进行。
(2)的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应__________(填对应序号);中间产物的化学式为__________。
(3)利用如图装置可测定汽车尾气中CO的含量,电解质为氧化钇和氧化钠,该电池中可以在固体介质(固熔体)内自由移动。
工作时,多孔电极a为__________极,多孔电极b处发生的电极反应为__________。
(4)一定温度下,起始时向的恒容密闭容器中充入、,仅发生反应,起始气体总压强为,时反应达到平衡,此时气体总压强为起始压强的。
①内,__________,NO转化率=__________(保留三位有效数字)%。
②此温度下,该反应的平衡常数__________(是用平衡分压代替平衡浓度计算的平衡常数)。
17.有一种不饱和醇,其结构简式为,请回答下列问题:
(1)写出该化合物中官能团的名称_______。
(2)试推测该化合物可能发生的反应为_______(填序号)。
①与酸性高锰酸钾溶液反应;②与溴水反应;③与反应;④与Na反应;⑤燃烧反应;⑥催化氧化反应
(3)写出该不饱和醇与乙酸及反应⑥的化学方程式
①酯化反应_______;
②催化氧化_______。
18.工业上常以水煤气(CO和)为原料合成甲醇。
(1)已知:
则与制备水煤气的热化学方程式为___________。
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为:。以下各项能说明该反应达到平衡状态的是___________。
A.混合气体的密度保持不变 B.容器内总压强保持不变
C.CO的体积分数保持不变 D.
(3)在2L恒容容器中,分别在、两种温度下模拟工业合成甲醇。两种温度下不同和CO起始组成比[]与CO平衡转化率的关系如图所示:
①温度___________(填“>”、“<”或“=”)。
②时,往恒容容器中充入1molCO、1.5mol,经过5min达到平衡,则5min内用表示的反应速率为___________,反应平衡常数___________。
(4)研究证实,可在酸性溶液中通过电解在阴极生成甲醇,阴极的电极反应式是___________。
19.一定条件下,在容积为2L的密闭容器中发生反应:。开始时加入4molA、6molB、2molC,在2min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率:__________。
(2)在2min末,B的浓度为__________。
(3)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①升高温度,化学反应速率__________。
②充人1molB,化学反应速率__________。
③将容器的容积变为3L,化学反应速率__________。
参考答案
1.答案:C
解析:A.具有还原性,将二氧化硫添加于红酒中,利用了具有杀菌作用和抗氧化特性,故A正确;
B.医疗上可用硫酸钡作x射线透视肠胃的内服药,利用的是硫酸钡不溶于酸的性质,故B正确;
C.碘化钾能溶于水,性质不稳定,故C错误;
D.无水硫酸铜遇水变蓝,能检验酒精中是否含有水,故D正确;
选C。
2.答案:B
解析:A.氢氟酸能够与玻璃中二氧化硅反应,能够腐蚀玻璃,所以通常保存在塑料瓶中,A正确;
B.液溴易挥发,密度大于水的密度,微溶于水,所以保存液溴的试剂瓶中应加水液封,但液溴会腐蚀橡胶,故不能使用橡胶塞塞紧瓶口,B错误;
C.双氧水受热易分解,双氧水应该避光密封保存,故可以保存在棕色细口瓶中,C正确;
D.由于易被氧化为,而,故溶液保存时需加入少量铁粉以防止被氧化,D正确;
故答案为:B。
3.答案:B
A.NOA.NO会影响人体中血红蛋白结合氧气,对人体有毒,故A错误;
B.氮氧化物随意排放到空气中,降雨时会生成硝酸,形成酸雨,故B正确;
C.途径②中,氮氮键断裂与O原子结合逐步形成NO分子,N元素的化合价升高,发生氧化反应,故C错误;
D.由两种反应途径可知,与反应生成NO,NO再与生成,故D错误;
答案选B。
4.答案:C
解析:A.②到③过程为化学键的断裂,则需要吸收能量,故A错误;
B.③到④变化过程为化学键的形成,则有能量放出,故B错误;
C.催化剂参与化学反应,降低反应的活化能,改变反应的途径,故C正确;
D.N原子和H原子形成了含有极性键的,故D错误;
故选:C。
5.答案:C
解析:A.图中表示变化的曲线是b,A错误;
B.A点NO的物质的量浓度在减小,说明反应在向正反应方向进行,未达到化学平衡状态,B错误;
C.内平均速率,C正确;
D.恒容条件下充入Ar,反应物浓度不变,化学反应速率不变,D错误;
答案选C。
6.答案:D
解析:
7.答案:D
解析:A.过氧化钠与水反应是放热反应,向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,反应放热达到脱脂棉的着火点时,脱脂棉可以燃烧,A正确;
B.向某未知溶液(不含)中加入足量硝酸酸化的硝酸银溶液,有白色沉淀出现,则该沉淀一定为AgCl,因为碳酸银可以溶于稀硝酸,无气体产生,说明一定不含或,否则会有气体产生,B正确;
C.K元素的焰色试验必须透过蓝色钴玻璃观察,没有透过蓝色钴玻璃观察,所以不能确定溶液中是否含有钾离子,C正确;
D.向某溶液中加入盐酸酸化的溶液,有白色沉淀,不能说明溶液中一定含有,可能还有干扰,D错误;
故答案为:D。
8.答案:D
解析:Li是活泼金属,锂是负极,石墨是正极,水在正极得电子生成氢气。锂为负极,锂失电子发生氧化反应,故A错误;原电池中阳离子移向正极,移向正极,在正极得电子生成氢气,故B错误;电子的流向为锂→导线→石墨,故C错误;锂在负极失电子生成锂离子,水在正极得电子生成氢气,电池工作时的总反应为,故D正确。
9.答案:D
解析:A.由解题思路可知,电极Y是正极,A正确;
B.该原电池中左侧Pt电极为负极,右侧Pt电极为正极,放电时电子由负极经过导线流向正极,即电子由呼气的铂电极经外电路流向所在的铂电极,B正确;
C.原电池中阳离子向正极移动,即向正极迁移,质子通过交换膜从左往右迁移,C正确;
D.乙醇发生失电子的氧化反应生成醋酸,负极反应式为,D错误;
答案选D。
10.答案:D
解析:A.“雷雨发庄稼”和合成氨工业都是将氮气转化为含氮化合物,都属于氮的固定,故A正确;
B.侯氏制碱法的副产物是氯化铵,可以作为氮肥,故B正确;
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,故C正确;
D.二氧化硫、氮氧化物溶于雨水会形成酸雨,酸雨的pH小于5.6,故D错误;
故选D。
11.答案:C
解析:A.根据0.2mol铜失去0.4mol电子,若生成的气体只有二氧化氮,则应该有0.4mol二氧化氮,但氮氧化物中氮的物质的量只有0.3mol,说明气体不仅只有二氧化氮,故A错误;
B.根据0.2mol铜反应中转移的电子的物质的量为0.4mol,故B错误;
C.根据氮元素守恒及前面解题思路得到被还原的硝酸的物质的量为0.3mol,故C正确;
D.反应后溶液中所含的物质的量为,故D错误。
12.答案:C
解析:裂解气的主要成分为乙烯、丙烯等短链不饱和烃,A错误;煤的干馏是化学变化,不是物理变化,B错误;水煤气为混合物,其主要成分为CO和,可作为化工原料气生产甲醇、二甲醚等,C正确;淀粉由C、H、O三种元素组成,蛋白质主要由C、H、O、N等元素组成组成元素不同,D错误。
13.答案:B
解析:
A.为放热反应,反应物总能量大于生成物总能量,故A正确;
B.Fe为固体,不能用于表示反应速率,故B错误;
C.反应中Fe被氧化生成,当将该反应设计成原电池时,Fe为负极,发生氧化反应,故C正确;
D.将该反应设计成原电池时,正极发生还原反应,正极上析出氢气,故D正确;故选:B。
14.答案:B
解析:
15.答案:D
解析:A.反应I中硝酸中的氮元素一部分转化为+2价和+4价的氮,体现氧化性,同时还会生成硝酸铜和水,体现酸性,A错误;
B.反应Ⅱ中NO中的N元素化合价升高,作还原剂,B错误;
C.由题意可知0.9mol氮的氧化物转化为钠盐的量为1mol,则混合气体中的物质的量为1mol-0.9mol=0.1mol,C错误;
D.由解题思路可知,0.22L浓硝酸的物质的量浓度为,D正确;
故选D。
16.答案:(1);低温
(2)①;、
(3)负;
(4)0.0025;66.7;
解析:(4)①反应达到平衡时气体总压强为。设内生成的的物质的量为。
,
根据题意:,。则,NO转化率100%≈66.7%。
②平衡时气体总物质的量为,则。
17.答案:(1)碳碳双键、羟基
(2)①②③④⑤⑥
(3);
解析:(1)是有机物,含有的官能团有碳碳双键、羟基;
(2)含有碳碳双键、羟基,所以应具备烯烃和醇的性质。①该有机物含有碳碳双键,所以能与酸性高锰酸钾溶液反应,而使高锰酸钾褪色,故正确;②该有机物含有碳碳双键,所以能与溴水发生加成反应,故正确;③该有机物含有碳碳双键,所以能与与发生加成反应,故正确;④该有机物含有羟基,所以能与Na反应生成氢气,故正确;⑤该物质是有机物,所以能发生燃烧反应,故正确;⑥该有机物含有羟基,所以能发生催化氧化反应,故正确;故答案为①②③④⑤⑥;
(3)①该不饱和醇和乙酸反应生成酯,方程式为:;
②催化氧化可以生成醛,方程式为:。
18.答案:(1)
(2)BC
(3)<;;16
(4)
解析:(1)已知:①,
②,根据盖斯定律解题思路,有(①-②)/2得热化学方程式为;
(2)对于反应。
A.在恒容条件下,混合气体的总质量不变,所以混合气体的密度始终保持不变,故不能说明反应达到平衡,故A错误;
B.因为反应前后气体总物质的量不同,所以容器内总压强保持不变可以说明反应达到平衡,故B正确;
C.CO的体积分数保持不变,即CO的浓度不变,可以说明反应达到平衡,故C正确;
D.不符合方程式计量数,不能说明正逆反应速率相等,则不能说明反应达到平衡,故D错误。
故答案为:BC;
(3)在2L恒容容器中,分别在、两种温度下模拟工业合成甲醇。两种温度下不同和CO起始组成比与CO平衡转化率的关系如图所示:
①反应,正反应方向为放热反应,升温有利于平衡逆向移动,一氧化碳的平衡转化率降低,所以温度。
19.答案:(1)
(2)
(3)增大;增大;减小
解析:(1),;
(2),,2min末,B物质浓度:;
(3)①升高温度,化学反应速率增大;
②充人1molB,反应物浓度增大,化学反应速率增大;
③将容器的容积变为3L,容器体积增大,气体反应物浓度减小,化学反应速率减小;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
高一化学下学期人教版(2019)期末考试模拟B卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.下列说法错误的是( )
A.在葡萄酒酿制过程中添加适量的二氧化硫,可以起到杀菌、抗氧化作用
B.硫酸钡不溶于水和酸,在医疗上可用硫酸钡作X射线透视肠胃的内服药剂
C.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
D.无水硫酸铜可以用来检验酒精中是否含有少量水
2.下列试剂的保存方法错误的是( )
A.氢氟酸通常保存在塑料瓶中
B.液溴应水封保存,并用橡胶塞塞紧瓶口
C.双氧水可以保存在棕色细口瓶中
D.溶液保存时需加入少量铁粉
3.光照条件下,在催化剂表面进行与反应的两种途径如图所示,下列说法正确的是( )
A.在人体内能扩张血管,提高免疫力等,因此大气中的对人体无害
B.氮氧化物随意排放至空气中易形成酸雨
C.途径②中,发生了还原反应
D.选择合适的催化剂,可以使与一步化合生成
4.和在催化剂表面合成氨的微观历程示意图如下,用、、分别表示、、,下列说法正确的是( )
A.②到③过程中,需要释放能量
B.③到④变化过程中,需要吸收能量
C.催化剂参与化学反应,改变反应的途径
D.N原子和H原子形成了含有非极性键的
5.在2L密闭容器中,800℃时,反应体系中,随时间的变化如下表所示。下列有关说法正确的是( )
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
A.图中表示变化的曲线是a
B.A点处于化学平衡状态
C.0~2s内平均速率
D.恒容条件下,充入化学反应速率增大
6.下列有关推断错误的是( )
A.铁、碳与氯化铁溶液组成原电池,铁极发生氧化反应
B.铁、银与硫酸铜溶液组成的原电池中,和电子均向银极移动
C.盐酸与氢氧化钠反应的能量变化可用图简单表
D.的能量变化如图所示,可推出反应物的键能总和大于生成物的键能总和
7.通过化学实验现象得出相应的结论是探究物质性质的一种重要方法,下列实验操作和现象或结论不正确的是( )
选项 实验操作和现象 结论
A 向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,脱脂棉燃烧 过氧化钠与水反应放热
B 向某未知溶液(不含)中加入足量硝酸酸化的硝酸银溶液,无气体产生,但有白色沉淀出现 未知溶液中含有,一定不含或
C 用铂丝蘸取少量未知固体做焰色试验,火焰呈黄色 固体中一定含,可能含
D 向某溶液中加入盐酸酸化的溶液,有白色沉淀 溶液中一定含有
A.A B.B C.C D.D
8.我国科学家发明的一种可控锂水电池的工作原理如图所示。下列有关说法正确的是( )
A.锂为负极,发生还原反应
B.移向正极并在正极得电子
C.电子由锂→有机电解质→固体电解质→水溶液→石墨
D.电池工作时的总反应为:
9.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示,下列说法错误的是( )
A.电极Y作正极
B.电子由呼气的铂电极经外电路流向所在的铂电极
C.电池工作时,质子通过交换膜从左往右迁移
D.该电池的负极反应式为:
10.氮及其化合物的转化具有重要应用。下列说法不正确的是( )
A.“雷雨发庄稼”和合成氨工业都属于氮的固定
B.侯氏制碱法的副产物可以作为氮肥
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
D.二氧化硫、氮氧化物溶于雨水会形成酸雨,酸雨的pH约为5.6
11.将12.8 g铜与80 mL 10 mol/L的充分反应后,溶液中含0.1 mol,由此可知( )
A.生成的气体只有二氧化氮
B.反应中转移的电子的物质的量为0.2mol
C.被还原的硝酸的物质的量为0.3 mol
D.反应后溶液中所含的物质的量为0.4 mol
12.下列物质的相关描述和知识均正确的是( )
选项 物质名称 描述 相关知识
A 裂解气 混合物 主要成分为烷烃
B 煤的干馏 物理变化 产品主要为出炉煤气、煤焦油和焦炭
C 水煤气 混合物 可作为化工原料气生产甲醇、二甲醚等
D 淀粉和蛋白质 高分子化合物 二者组成元素相同
A.A B.B C.C D.D
13.,下列叙述不正确的是( )
A.反应过程中能量关系可用右图表示
B.用Fe(s)和(g)表示该反应的化学反应速率时数值相等
C.若将该反应设计成原电池,则负极将发生氧化反应
D.若将该反应设计成原电池,则正极将析出气体
14.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的材料,电池反应为。下列说法错误的是( )
A.石墨烯的作用主要是提高电极a的导电性
B.电池放电时间越长,电池中的量越少
C.电池工作时,正极可发生反应:
D.电池工作时,外电路中流过电子,负极材料减重
15.将38.4gCu与0.22L浓硝酸混合恰好完全反应生成氮的氧化物,这些氧化物恰好与溶液反应得到和的混合溶液,反应过程及有关数据如图所示。下列说法正确的是( )
A.反应Ⅰ中硝酸只体现氧化性
B.反应Ⅱ中作氧化剂
C.混合气体中的物质的量为0.2mol
D.浓硝酸的物质的量浓度为
二、填空题(共4题,55分)
16.汽车尾气中含有、CO,排气管内的催化转化器可实现将污染性气体转化为和。
(1)已知:①
②
③
则与反应生成和的热化学方程式为__________。该反应在__________(填“高温”或“低温”)下可自发进行。
(2)的反应历程如图(图中所有物质均为气态)。
该反应的决速步骤是反应__________(填对应序号);中间产物的化学式为__________。
(3)利用如图装置可测定汽车尾气中CO的含量,电解质为氧化钇和氧化钠,该电池中可以在固体介质(固熔体)内自由移动。
工作时,多孔电极a为__________极,多孔电极b处发生的电极反应为__________。
(4)一定温度下,起始时向的恒容密闭容器中充入、,仅发生反应,起始气体总压强为,时反应达到平衡,此时气体总压强为起始压强的。
①内,__________,NO转化率=__________(保留三位有效数字)%。
②此温度下,该反应的平衡常数__________(是用平衡分压代替平衡浓度计算的平衡常数)。
17.有一种不饱和醇,其结构简式为,请回答下列问题:
(1)写出该化合物中官能团的名称_______。
(2)试推测该化合物可能发生的反应为_______(填序号)。
①与酸性高锰酸钾溶液反应;②与溴水反应;③与反应;④与Na反应;⑤燃烧反应;⑥催化氧化反应
(3)写出该不饱和醇与乙酸及反应⑥的化学方程式
①酯化反应_______;
②催化氧化_______。
18.工业上常以水煤气(CO和)为原料合成甲醇。
(1)已知:
则与制备水煤气的热化学方程式为___________。
(2)工业上通常用水煤气在恒容、催化剂和加热条件下生产甲醇,其热化学方程式为:。以下各项能说明该反应达到平衡状态的是___________。
A.混合气体的密度保持不变 B.容器内总压强保持不变
C.CO的体积分数保持不变 D.
(3)在2L恒容容器中,分别在、两种温度下模拟工业合成甲醇。两种温度下不同和CO起始组成比[]与CO平衡转化率的关系如图所示:
①温度___________(填“>”、“<”或“=”)。
②时,往恒容容器中充入1molCO、1.5mol,经过5min达到平衡,则5min内用表示的反应速率为___________,反应平衡常数___________。
(4)研究证实,可在酸性溶液中通过电解在阴极生成甲醇,阴极的电极反应式是___________。
19.一定条件下,在容积为2L的密闭容器中发生反应:。开始时加入4molA、6molB、2molC,在2min末测得C的物质的量是3mol。
(1)用A的浓度变化表示反应的平均速率:__________。
(2)在2min末,B的浓度为__________。
(3)若改变下列一个条件,推测该反应的速率发生的变化(填“增大”“减小”或“不变”):
①升高温度,化学反应速率__________。
②充人1molB,化学反应速率__________。
③将容器的容积变为3L,化学反应速率__________。
参考答案
1.答案:C
解析:A.具有还原性,将二氧化硫添加于红酒中,利用了具有杀菌作用和抗氧化特性,故A正确;
B.医疗上可用硫酸钡作x射线透视肠胃的内服药,利用的是硫酸钡不溶于酸的性质,故B正确;
C.碘化钾能溶于水,性质不稳定,故C错误;
D.无水硫酸铜遇水变蓝,能检验酒精中是否含有水,故D正确;
选C。
2.答案:B
解析:A.氢氟酸能够与玻璃中二氧化硅反应,能够腐蚀玻璃,所以通常保存在塑料瓶中,A正确;
B.液溴易挥发,密度大于水的密度,微溶于水,所以保存液溴的试剂瓶中应加水液封,但液溴会腐蚀橡胶,故不能使用橡胶塞塞紧瓶口,B错误;
C.双氧水受热易分解,双氧水应该避光密封保存,故可以保存在棕色细口瓶中,C正确;
D.由于易被氧化为,而,故溶液保存时需加入少量铁粉以防止被氧化,D正确;
故答案为:B。
3.答案:B
A.NOA.NO会影响人体中血红蛋白结合氧气,对人体有毒,故A错误;
B.氮氧化物随意排放到空气中,降雨时会生成硝酸,形成酸雨,故B正确;
C.途径②中,氮氮键断裂与O原子结合逐步形成NO分子,N元素的化合价升高,发生氧化反应,故C错误;
D.由两种反应途径可知,与反应生成NO,NO再与生成,故D错误;
答案选B。
4.答案:C
解析:A.②到③过程为化学键的断裂,则需要吸收能量,故A错误;
B.③到④变化过程为化学键的形成,则有能量放出,故B错误;
C.催化剂参与化学反应,降低反应的活化能,改变反应的途径,故C正确;
D.N原子和H原子形成了含有极性键的,故D错误;
故选:C。
5.答案:C
解析:A.图中表示变化的曲线是b,A错误;
B.A点NO的物质的量浓度在减小,说明反应在向正反应方向进行,未达到化学平衡状态,B错误;
C.内平均速率,C正确;
D.恒容条件下充入Ar,反应物浓度不变,化学反应速率不变,D错误;
答案选C。
6.答案:D
解析:
7.答案:D
解析:A.过氧化钠与水反应是放热反应,向包有足量过氧化钠粉末的脱脂棉上滴加几滴水,反应放热达到脱脂棉的着火点时,脱脂棉可以燃烧,A正确;
B.向某未知溶液(不含)中加入足量硝酸酸化的硝酸银溶液,有白色沉淀出现,则该沉淀一定为AgCl,因为碳酸银可以溶于稀硝酸,无气体产生,说明一定不含或,否则会有气体产生,B正确;
C.K元素的焰色试验必须透过蓝色钴玻璃观察,没有透过蓝色钴玻璃观察,所以不能确定溶液中是否含有钾离子,C正确;
D.向某溶液中加入盐酸酸化的溶液,有白色沉淀,不能说明溶液中一定含有,可能还有干扰,D错误;
故答案为:D。
8.答案:D
解析:Li是活泼金属,锂是负极,石墨是正极,水在正极得电子生成氢气。锂为负极,锂失电子发生氧化反应,故A错误;原电池中阳离子移向正极,移向正极,在正极得电子生成氢气,故B错误;电子的流向为锂→导线→石墨,故C错误;锂在负极失电子生成锂离子,水在正极得电子生成氢气,电池工作时的总反应为,故D正确。
9.答案:D
解析:A.由解题思路可知,电极Y是正极,A正确;
B.该原电池中左侧Pt电极为负极,右侧Pt电极为正极,放电时电子由负极经过导线流向正极,即电子由呼气的铂电极经外电路流向所在的铂电极,B正确;
C.原电池中阳离子向正极移动,即向正极迁移,质子通过交换膜从左往右迁移,C正确;
D.乙醇发生失电子的氧化反应生成醋酸,负极反应式为,D错误;
答案选D。
10.答案:D
解析:A.“雷雨发庄稼”和合成氨工业都是将氮气转化为含氮化合物,都属于氮的固定,故A正确;
B.侯氏制碱法的副产物是氯化铵,可以作为氮肥,故B正确;
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,故C正确;
D.二氧化硫、氮氧化物溶于雨水会形成酸雨,酸雨的pH小于5.6,故D错误;
故选D。
11.答案:C
解析:A.根据0.2mol铜失去0.4mol电子,若生成的气体只有二氧化氮,则应该有0.4mol二氧化氮,但氮氧化物中氮的物质的量只有0.3mol,说明气体不仅只有二氧化氮,故A错误;
B.根据0.2mol铜反应中转移的电子的物质的量为0.4mol,故B错误;
C.根据氮元素守恒及前面解题思路得到被还原的硝酸的物质的量为0.3mol,故C正确;
D.反应后溶液中所含的物质的量为,故D错误。
12.答案:C
解析:裂解气的主要成分为乙烯、丙烯等短链不饱和烃,A错误;煤的干馏是化学变化,不是物理变化,B错误;水煤气为混合物,其主要成分为CO和,可作为化工原料气生产甲醇、二甲醚等,C正确;淀粉由C、H、O三种元素组成,蛋白质主要由C、H、O、N等元素组成组成元素不同,D错误。
13.答案:B
解析:
A.为放热反应,反应物总能量大于生成物总能量,故A正确;
B.Fe为固体,不能用于表示反应速率,故B错误;
C.反应中Fe被氧化生成,当将该反应设计成原电池时,Fe为负极,发生氧化反应,故C正确;
D.将该反应设计成原电池时,正极发生还原反应,正极上析出氢气,故D正确;故选:B。
14.答案:B
解析:
15.答案:D
解析:A.反应I中硝酸中的氮元素一部分转化为+2价和+4价的氮,体现氧化性,同时还会生成硝酸铜和水,体现酸性,A错误;
B.反应Ⅱ中NO中的N元素化合价升高,作还原剂,B错误;
C.由题意可知0.9mol氮的氧化物转化为钠盐的量为1mol,则混合气体中的物质的量为1mol-0.9mol=0.1mol,C错误;
D.由解题思路可知,0.22L浓硝酸的物质的量浓度为,D正确;
故选D。
16.答案:(1);低温
(2)①;、
(3)负;
(4)0.0025;66.7;
解析:(4)①反应达到平衡时气体总压强为。设内生成的的物质的量为。
,
根据题意:,。则,NO转化率100%≈66.7%。
②平衡时气体总物质的量为,则。
17.答案:(1)碳碳双键、羟基
(2)①②③④⑤⑥
(3);
解析:(1)是有机物,含有的官能团有碳碳双键、羟基;
(2)含有碳碳双键、羟基,所以应具备烯烃和醇的性质。①该有机物含有碳碳双键,所以能与酸性高锰酸钾溶液反应,而使高锰酸钾褪色,故正确;②该有机物含有碳碳双键,所以能与溴水发生加成反应,故正确;③该有机物含有碳碳双键,所以能与与发生加成反应,故正确;④该有机物含有羟基,所以能与Na反应生成氢气,故正确;⑤该物质是有机物,所以能发生燃烧反应,故正确;⑥该有机物含有羟基,所以能发生催化氧化反应,故正确;故答案为①②③④⑤⑥;
(3)①该不饱和醇和乙酸反应生成酯,方程式为:;
②催化氧化可以生成醛,方程式为:。
18.答案:(1)
(2)BC
(3)<;;16
(4)
解析:(1)已知:①,
②,根据盖斯定律解题思路,有(①-②)/2得热化学方程式为;
(2)对于反应。
A.在恒容条件下,混合气体的总质量不变,所以混合气体的密度始终保持不变,故不能说明反应达到平衡,故A错误;
B.因为反应前后气体总物质的量不同,所以容器内总压强保持不变可以说明反应达到平衡,故B正确;
C.CO的体积分数保持不变,即CO的浓度不变,可以说明反应达到平衡,故C正确;
D.不符合方程式计量数,不能说明正逆反应速率相等,则不能说明反应达到平衡,故D错误。
故答案为:BC;
(3)在2L恒容容器中,分别在、两种温度下模拟工业合成甲醇。两种温度下不同和CO起始组成比与CO平衡转化率的关系如图所示:
①反应,正反应方向为放热反应,升温有利于平衡逆向移动,一氧化碳的平衡转化率降低,所以温度。
19.答案:(1)
(2)
(3)增大;增大;减小
解析:(1),;
(2),,2min末,B物质浓度:;
(3)①升高温度,化学反应速率增大;
②充人1molB,反应物浓度增大,化学反应速率增大;
③将容器的容积变为3L,容器体积增大,气体反应物浓度减小,化学反应速率减小;
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
