专题6 化学反应与能量变化——高一化学苏教版(2019)必修二期末考前专题卷(含解析)
文档属性
| 名称 | 专题6 化学反应与能量变化——高一化学苏教版(2019)必修二期末考前专题卷(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 16:54:20 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
专题6 化学反应与能量变化——高一化学苏教版(2019)必修二期末考前专题卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.中国诗词既蕴含人文思想,又焕发理性光辉。对下列诗词划线部分的化学解释不合理的是( )
A.花气袭人知骤暖,喜鹊穿树喜新晴——温度高,分子运动加快
B.千锤万凿出深山,烈火焚烧若等闲——煅烧石灰石,为氧化还原变化
C.烟笼寒水月笼沙,夜泊秦淮近酒家——此处的“烟”实为水雾,为一种气溶胶
D.何意百炼钢,化为绕指柔——生铁经不断煅烧捶打氧化,降低碳的含量,变成钢
2.下列所述变化为吸热反应的是( )
A. B.
C. D.
3.下列反应的能量变化不符合如图所示的是( )
A.镁条与稀盐酸反应 B.盐酸与碳酸氢钠反应
C.通过灼热的炭粉 D.与反应
4.近年来不少城市公交进入氢能产业时代,诸多氢能源汽车纷纷亮相,氢氧燃料电池被誉为氢能源汽车的心脏。某种氢氧燃料电池的内部结构如图所示,下列有关叙述正确的是( )
A.电池每消耗,理论上电路中通过电子
B.该电池工作时,电解质溶液中阴离子向b极移动
C.b电极上发生氧化反应
D.若电解质溶液为溶液,则a电极反应式为:
5.下列热化学方程式书写正确的是( )
A.
B.
C.
D.
6.反应在四种不同情况下的反应速率分别为①;②;③;④,该反应进行的快慢顺序为( )
A.④>③=②>① B.①>②=③>④ C.①>②>③>④ D.④>③>②>①
7.可逆反应,相同条件下的反应速率最快的是( )
A. B.
C. D.
8.已知碘化氢分解吸热,分以下两步完成:;,下列图像最符合上述反应历程的是( )
A. B.
C. D.
9.化学电源在生活、生产和科研中得到广泛地应用,下列装置能产生电流的是( )
A. B. C. D.
10.化学之美无处不在。下列说法正确的是( )
A.舞台上干冰升华时,共价键断裂
B.饱和溶液可析出无水硫酸铜蓝色晶体
C.苯分子是正六边形结构,单双键交替呈现完美对称
D.钠的焰色是激发态电子从高能轨道跃迁至低能轨道时释放出的可见光
11.关于如图所示装置的叙述,错误的是( )
A.锌是负极,其质量逐渐减小
B.氢离子的铜片表面被还原,产生气泡
C.电子从锌片经导线流向铜片
D.电流从锌片经导线流向铜片
12.下列措施中,不能增大化学反应速率的是( )
A.Zn与稀硫酸反应制取时,加入蒸馏水
B.Al在中燃烧生成时,用铝粉替代铝片
C.与稀盐酸反应生成时,适当升高温度
D.用固体分解制取时,固体中添加少量
13.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天青云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
14.下列叙述正确的是( )
A.由图甲可知,
B.图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C.图丙表示燃料燃烧反应的能量变化
D.图丁表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
二、填空题(共4题,55分)
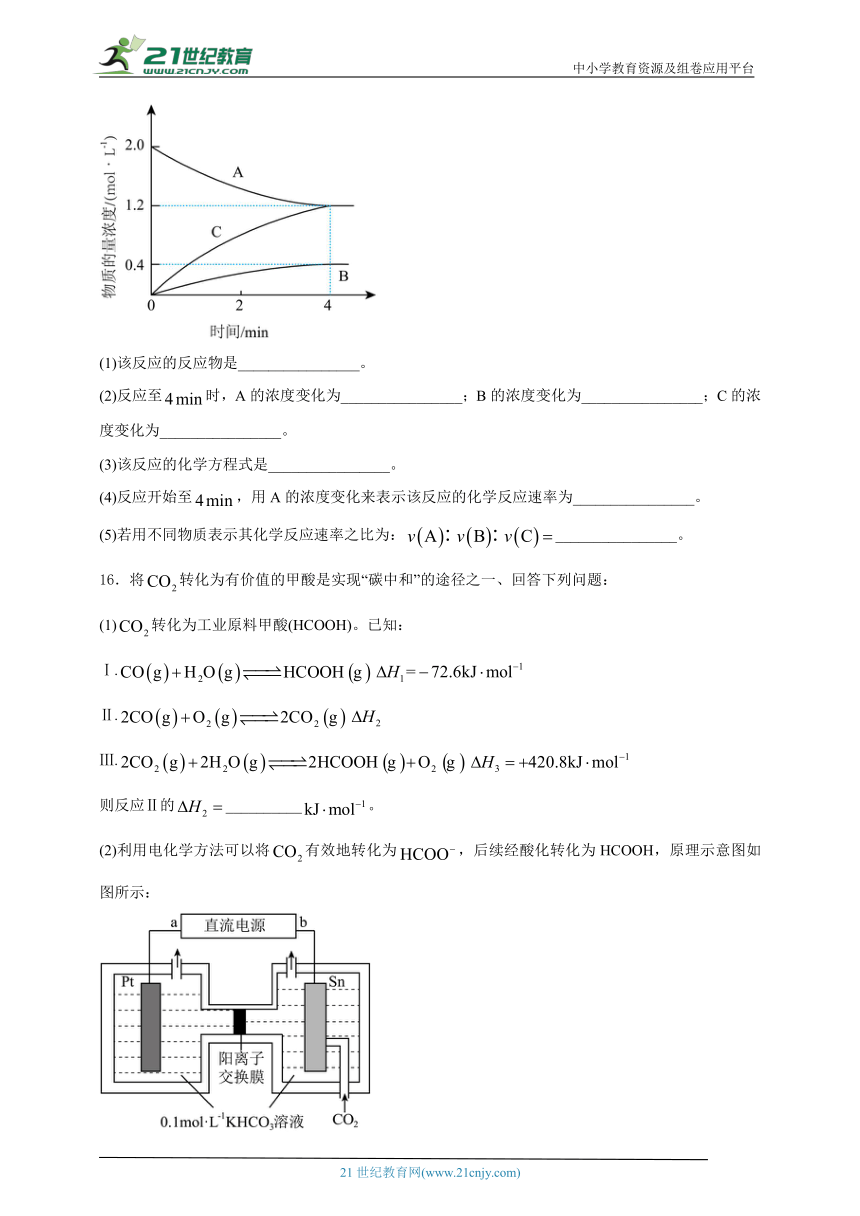
15.如图所示,800℃时,某反应有关的物质A、B、C的物质的量浓度从开始反应至时的变化图像。请回答下列问题。
(1)该反应的反应物是________________。
(2)反应至时,A的浓度变化为________________;B的浓度变化为________________;C的浓度变化为________________。
(3)该反应的化学方程式是________________。
(4)反应开始至,用A的浓度变化来表示该反应的化学反应速率为________________。
(5)若用不同物质表示其化学反应速率之比为:________________。
16.将转化为有价值的甲酸是实现“碳中和”的途径之一、回答下列问题:
(1)转化为工业原料甲酸(HCOOH)。已知:
Ⅰ.
Ⅱ.
Ⅲ.
则反应Ⅱ的__________。
(2)利用电化学方法可以将有效地转化为,后续经酸化转化为HCOOH,原理示意图如图所示:
①电解池的阴极电极反应式为__________;阴极除有生成外,还可能生成副产物__________。
②电解一段时间后,阳极区的溶液浓度降低__________(填“升高”、“不变”或“降低”)。
③若以铅蓄电池为直流电源,则铅蓄电池中a极的电极反应式为__________。
(3)若以HCOOH燃料电池(工作原理如图所示)为直流电源,该离子交换膜为__________(填“阳”或“阴”)离子交换膜;电池负极反应式为__________;虚线框内发生的离子方程式为__________;需补充物质X的化学式为__________。
17.人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息填空。
(1)铅蓄电池在放电时发生的电池反应式为:,负极电极反应式为:__________。
(2)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
①进入的电极为__________极,通__________(填“”或“”)的一极电势较低。
②写出电池工作时的负极反应式:__________。
③若电池工作时转移0.1mol电子,理论上消耗标准状况下__________mL。
(3)若将(2)中燃料电池改为以和为原料进行工作时,负极反应式为__________。
三、实验题
18.某小组同学查到—份研究过氧化氢溶液与氢碘酸(HI)反应的实验资料,具体如下。资料1:室温下,过氧化氢溶液可与氢碘酸反应:
资料2:碘单质溶于水后,溶液为棕黄色。
资料3:实验数据见下表。
实验编号 ① ② ③ ④ ⑤
0.1 0.1 0.1 0.2 0.3
0.1 0.2 0.3 0.1 0.1
从混合到出现棕黄色的时间/s 13 6.5 4.3 6.6 4.4
(1)通过资料3中的数据,可以得出的结论是_____________。
(2)资料3中编号为①的实验中反应继续进行,20s后测得过氧化氢的浓度为,则____________。
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验结论。在实验过程中,未观察到溶液变为棕黄色,却观察到有无色气体产生。于是,该小组同学提出假设:碘化钾可能是过氧化氢分解反应的催化剂。
①该小组同学提出上述假设的依据是____________________________________。
②请设计实验方案验证:碘化钾能提高过氧化氢分解反应的速率(仪器和试剂可自选)。
实验方案:_________________。
参考答案
1.答案:B
解析:A.分子总在不断运动,温度升高,分子运动速率加快,故A正确;
B.煅烧石灰石,碳酸钙分解生成氧化钙和二氧化碳,反应过程中元素的化合价没有发生变化,不属于氧化还原反应,故B错误;
C.“烟笼寒水月笼沙,夜泊秦淮近酒家”中的“烟”指小液滴,也即水雾,水雾是一种气溶胶,故C正确;
D.生铁的含碳量高于钢,生铁经不断煅烧捶打氧化,碳变成二氧化碳气体,含碳量降低,变成钢,故D正确;
故答案选B。
2.答案:A
解析:A项中的图像表示生成物的能量比反应物的能量高,故为吸热反应;
B项中的图像表示反应物的能量比生成物的能量高,故为放热反应;
C项中浓硫酸溶于水放热,不是化学变化;
D项中锌与盐酸反应是放热反应。
3.答案:A
解析:A.镁条与稀盐酸的反应为放热反应,A符合题意;
B.盐酸与碳酸氢钠的反应为吸热反应,B不符题意;
C.通过灼热的炭粉为吸热反应,C不符题意;
D.与反应,D不符题意;
答案选A。
4.答案:D
解析:由电子移动方向可知,电池左端是负极,通入的是氢气,右端是正极,通入的是氧气;
A.没有标况,不确定氢气的物质的量,不能计算电子的量,A错误;
B.原电池中阴离子向负极a端移动,B错误;
C.b为正极,发生还原反应,C错误;
D.若电解质溶液为溶液,则a电极反应为碱性条件下,氢气失去电子发生氧化反应生成水:,D正确;
故选D。
5.答案:D
解析:A.物质的聚集状态对反应的反应热有影响,故书写热化学方程式时,要标出物质的聚集状态,故A错误;
B.碳的燃烧为放热反应,应为负值,故B错误;
C.酸碱中和为放热反应,应为负值,且的单位为,故C错误;
D.氢气在氯气中燃烧为放热反应,故为负值,故D正确。
故选D。
6.答案:A
解析:由反应速率之比等于化学计量数之比可知,四种条件下A物质的反应速率分别为①、②、③、④,则反应进行的快慢顺序为④>③=②>①,故选A。
7.答案:B
解析:A项中;B中,换算成;C中;D中,B项中v(A)的数值最大,速率最快,故答案选B。
8.答案:A
解析:根据题干描述,碘化氢分解的总反应是吸热的,而第二步是成键过程,一定是放热,故第一步必然吸热;
A.结合图像,第一步吸热,第二步放热,总反应吸热,符合上述解题思路,故A符合题意;
B.根据图像,总反应是放热反应,不符合上述解题思路,故B不符合题意;
C.根据图像,第二步吸热,不符合上述解题思路,故C不符合题意;
D.根据图像,第一步放热,第二步吸热,不符合上述解题思路,故D不符合题意。
答案选A。
9.答案:D
解析:A.无水乙醇为非电解质,不导电,不能形成闭合的回路,所以不能产生电流,A不合题意;
B.Al能与NaOH溶液反应,但Mg和Al未用导线连接,不能形成闭合的回路,所以不能产生电流,B不合题意;
C.两电极均为石墨电极,没有自发进行的氧化还原反应,不能产生电流,C不合题意;
D.已知Zn比Pb活泼,能与稀盐酸反应,且形成了闭合回路,则能够形成原电池即产生电流,D符合题意;
故选:D。
10.答案:D
解析:A.干冰升华为物理变化,破坏的是分子间作用力,不是共价键,A错误;
B.析出的是五水合硫酸铜蓝色晶体,不是无水硫酸铜,B错误;
C.苯分子中不存在单双键交替,6个碳碳键完全等同,C错误;
D.激发态电子从高能轨道跃迁到低能轨道,能量以光的形式释放,D正确;
故选D。
11.答案:D
解析:A.铜锌原电池中,锌是负极,,质量逐渐减小,故A正确;
B.铜锌原电池中,铜是正极,正极反应,氢离子的铜片表面被还原,产生气泡,故B正确;
C.电子从负极流出,所以电子从锌片经导线流向铜片,故C正确;
D.电流从正极流向负极,电流从铜片经导线流向锌片,故D错误。
故选D。
12.答案:A
A.ZnA.Zn与稀硫酸反应制取时,加入蒸馏水,硫酸浓度减小,反应速率减小,故A符合题意;
B.Al在中燃烧生成时,用铝粉替代铝片,增大接触面积,反应速率加快,故B不符合题意;
C.与稀盐酸反应生成时,适当升高温度,反应速率加快,故C不符合题意;
D.用固体分解制取时,固体中添加少量作催化剂,反应速率加快,故D不符合题意;
答案选A。
13.答案:A
解析:A项、氧化铁为棕红色固体,瓷器的青色不可能来自氧化铁,故A错误;
B项、秦兵马俑是陶制品,陶制品是由粘土或含有粘土的混合物经混炼、成形、煅烧而制成的,故B正确;
C项、陶瓷的主要原料是取之于自然界的硅酸盐矿物,陶瓷的主要成分是硅酸盐,与水泥、玻璃等同属硅酸盐产品,故C正确;
D项、陶瓷的主要成分是硅酸盐,硅酸盐的化学性质不活泼,具有不与酸或碱反应、抗氧化的特点,故D正确。
故选A。
14.答案:B
解析:A.由图甲可知,反应物总能量低于生成物总能量,该反应为吸热反应,热化学方程式为,故A错误;
B.图乙中反应物总能量低于生成物总能量,该反应为吸热反应,吸热反应的反应物断键吸收的能量大于生成物成键放出的能量,故B正确;
C.图丙中反应物总能量低于生成物总能量,该反应为吸热反应,而燃料燃烧时释放能量,故C错误;
D.图丁中反应物总能量高于生成物总能量,该反应为放热反应,所以图丁应是表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故D错误;
故答案为:B。
15.答案:(1)A
(2)
(3)
(4)0.2mol/(L·min)
(5)2∶1∶3
解析:(1)化学反应中反应物的物质的量浓度减小,生成物的物质的量浓度增大,故反应物为A,生成物为B和C;
(2)由图可知,反应至4min时,A的浓度由2mol/L降低到1.2mol/L,浓度变化为0.8mol/L;B的浓度由0增加至0.4mol/L,浓度变化为0.4mol/L;C的浓度由0增加到1.2mol/L,浓度变化为1.2mol/L;
(3)化学反应的化学计量数之比等于速率之比等于浓度变化之比,故A、B、C的化学计量数之比为0.8∶0.4∶1.2=2∶1∶3,故化学方程式为;
(4)应开始至,用A的浓度变化来表示该反应的化学反应速率v==0.2mol/(L·min);
(5)化学反应的速率之比等于化学计量数之比,故2∶1∶3。
16.答案:(1)-566.0
(2);、CO;降低;
(3)阳;;;
解析:(1);
故答案为: 566.0kJ/mol;
(2)①根据化合价变化,中C元素化合价由+4降低为+2价,,化合价降低可能生成CO,发生还原反应,为阴极反应,b为负极,阴极吸引阳离子发生还原反应,故水中的可能在阴极反应生成氢气,则阴极副产物为氢气、CO;
故答案为:;、CO;
②阳极水中的发生反应,,生成的氢离子与碳酸氢根反应,则碳酸氢钾的浓度降低;
故答案为:降低;
③根据解题思路,a为正极,得电子,;
故答案为:;
(3)根据图示,右侧区转化为,,发生还原反应,则右侧为正极,吸引阳离子;左侧转化为,;虚框内,转化为,,根据电荷守恒可知,需要补充的X为;
故答案为:阳;;;。
17.答案:(1)
(2)正;;;560
(3)
解析:(1)铅蓄电池在放电时发生的电池反应式为,放电时Pb为负极,失去电子后与硫酸根离子结合生成硫酸铅,电极反应式为。
(2)①根据氢氧燃料电池示意图可知,电解质溶液为KOH,总反应为,通入的电极为正极,通入的电极为负极;原电池的两极中,正极电势比负极电势高;
②负极上,失去电子后结合电解质溶液中生成水:;
③根据正极反应可知,得到4mol时消耗1mol,因此转移0.1mol电子时,消耗标准状况下的体积为:。
(3)若将此燃料电池改成以和为原料进行工作时,负极为通的电极,失电子被氧化产生再与结合形成和:。
18.答案:(1)反应速率与成正比关系
(2)
(3)①未观察到溶液变为棕黄色,说明没有碘单质生成,没有与KI发生氧化还原反应;有无色气体产生,说明发生了分解反应,而没有加入KI前,没有观察到无色气体产生
②ⅰ.取两支试管,分别加入的过氧化氢溶液;
ⅱ.向其中一支试管中加入1mLKI溶液,另一支试管中加入1mL蒸馏水;
ⅲ.观察到加入KI溶液的试管中产生气泡的速率快
解析:(2)0~20s,,,则。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
专题6 化学反应与能量变化——高一化学苏教版(2019)必修二期末考前专题卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.中国诗词既蕴含人文思想,又焕发理性光辉。对下列诗词划线部分的化学解释不合理的是( )
A.花气袭人知骤暖,喜鹊穿树喜新晴——温度高,分子运动加快
B.千锤万凿出深山,烈火焚烧若等闲——煅烧石灰石,为氧化还原变化
C.烟笼寒水月笼沙,夜泊秦淮近酒家——此处的“烟”实为水雾,为一种气溶胶
D.何意百炼钢,化为绕指柔——生铁经不断煅烧捶打氧化,降低碳的含量,变成钢
2.下列所述变化为吸热反应的是( )
A. B.
C. D.
3.下列反应的能量变化不符合如图所示的是( )
A.镁条与稀盐酸反应 B.盐酸与碳酸氢钠反应
C.通过灼热的炭粉 D.与反应
4.近年来不少城市公交进入氢能产业时代,诸多氢能源汽车纷纷亮相,氢氧燃料电池被誉为氢能源汽车的心脏。某种氢氧燃料电池的内部结构如图所示,下列有关叙述正确的是( )
A.电池每消耗,理论上电路中通过电子
B.该电池工作时,电解质溶液中阴离子向b极移动
C.b电极上发生氧化反应
D.若电解质溶液为溶液,则a电极反应式为:
5.下列热化学方程式书写正确的是( )
A.
B.
C.
D.
6.反应在四种不同情况下的反应速率分别为①;②;③;④,该反应进行的快慢顺序为( )
A.④>③=②>① B.①>②=③>④ C.①>②>③>④ D.④>③>②>①
7.可逆反应,相同条件下的反应速率最快的是( )
A. B.
C. D.
8.已知碘化氢分解吸热,分以下两步完成:;,下列图像最符合上述反应历程的是( )
A. B.
C. D.
9.化学电源在生活、生产和科研中得到广泛地应用,下列装置能产生电流的是( )
A. B. C. D.
10.化学之美无处不在。下列说法正确的是( )
A.舞台上干冰升华时,共价键断裂
B.饱和溶液可析出无水硫酸铜蓝色晶体
C.苯分子是正六边形结构,单双键交替呈现完美对称
D.钠的焰色是激发态电子从高能轨道跃迁至低能轨道时释放出的可见光
11.关于如图所示装置的叙述,错误的是( )
A.锌是负极,其质量逐渐减小
B.氢离子的铜片表面被还原,产生气泡
C.电子从锌片经导线流向铜片
D.电流从锌片经导线流向铜片
12.下列措施中,不能增大化学反应速率的是( )
A.Zn与稀硫酸反应制取时,加入蒸馏水
B.Al在中燃烧生成时,用铝粉替代铝片
C.与稀盐酸反应生成时,适当升高温度
D.用固体分解制取时,固体中添加少量
13.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天青云破处”所描述的瓷器青色,来自氧化铁
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
14.下列叙述正确的是( )
A.由图甲可知,
B.图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C.图丙表示燃料燃烧反应的能量变化
D.图丁表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
二、填空题(共4题,55分)
15.如图所示,800℃时,某反应有关的物质A、B、C的物质的量浓度从开始反应至时的变化图像。请回答下列问题。
(1)该反应的反应物是________________。
(2)反应至时,A的浓度变化为________________;B的浓度变化为________________;C的浓度变化为________________。
(3)该反应的化学方程式是________________。
(4)反应开始至,用A的浓度变化来表示该反应的化学反应速率为________________。
(5)若用不同物质表示其化学反应速率之比为:________________。
16.将转化为有价值的甲酸是实现“碳中和”的途径之一、回答下列问题:
(1)转化为工业原料甲酸(HCOOH)。已知:
Ⅰ.
Ⅱ.
Ⅲ.
则反应Ⅱ的__________。
(2)利用电化学方法可以将有效地转化为,后续经酸化转化为HCOOH,原理示意图如图所示:
①电解池的阴极电极反应式为__________;阴极除有生成外,还可能生成副产物__________。
②电解一段时间后,阳极区的溶液浓度降低__________(填“升高”、“不变”或“降低”)。
③若以铅蓄电池为直流电源,则铅蓄电池中a极的电极反应式为__________。
(3)若以HCOOH燃料电池(工作原理如图所示)为直流电源,该离子交换膜为__________(填“阳”或“阴”)离子交换膜;电池负极反应式为__________;虚线框内发生的离子方程式为__________;需补充物质X的化学式为__________。
17.人们应用原电池原理制作了多种电池,以满足不同的需要。请根据题中提供的信息填空。
(1)铅蓄电池在放电时发生的电池反应式为:,负极电极反应式为:__________。
(2)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
①进入的电极为__________极,通__________(填“”或“”)的一极电势较低。
②写出电池工作时的负极反应式:__________。
③若电池工作时转移0.1mol电子,理论上消耗标准状况下__________mL。
(3)若将(2)中燃料电池改为以和为原料进行工作时,负极反应式为__________。
三、实验题
18.某小组同学查到—份研究过氧化氢溶液与氢碘酸(HI)反应的实验资料,具体如下。资料1:室温下,过氧化氢溶液可与氢碘酸反应:
资料2:碘单质溶于水后,溶液为棕黄色。
资料3:实验数据见下表。
实验编号 ① ② ③ ④ ⑤
0.1 0.1 0.1 0.2 0.3
0.1 0.2 0.3 0.1 0.1
从混合到出现棕黄色的时间/s 13 6.5 4.3 6.6 4.4
(1)通过资料3中的数据,可以得出的结论是_____________。
(2)资料3中编号为①的实验中反应继续进行,20s后测得过氧化氢的浓度为,则____________。
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验结论。在实验过程中,未观察到溶液变为棕黄色,却观察到有无色气体产生。于是,该小组同学提出假设:碘化钾可能是过氧化氢分解反应的催化剂。
①该小组同学提出上述假设的依据是____________________________________。
②请设计实验方案验证:碘化钾能提高过氧化氢分解反应的速率(仪器和试剂可自选)。
实验方案:_________________。
参考答案
1.答案:B
解析:A.分子总在不断运动,温度升高,分子运动速率加快,故A正确;
B.煅烧石灰石,碳酸钙分解生成氧化钙和二氧化碳,反应过程中元素的化合价没有发生变化,不属于氧化还原反应,故B错误;
C.“烟笼寒水月笼沙,夜泊秦淮近酒家”中的“烟”指小液滴,也即水雾,水雾是一种气溶胶,故C正确;
D.生铁的含碳量高于钢,生铁经不断煅烧捶打氧化,碳变成二氧化碳气体,含碳量降低,变成钢,故D正确;
故答案选B。
2.答案:A
解析:A项中的图像表示生成物的能量比反应物的能量高,故为吸热反应;
B项中的图像表示反应物的能量比生成物的能量高,故为放热反应;
C项中浓硫酸溶于水放热,不是化学变化;
D项中锌与盐酸反应是放热反应。
3.答案:A
解析:A.镁条与稀盐酸的反应为放热反应,A符合题意;
B.盐酸与碳酸氢钠的反应为吸热反应,B不符题意;
C.通过灼热的炭粉为吸热反应,C不符题意;
D.与反应,D不符题意;
答案选A。
4.答案:D
解析:由电子移动方向可知,电池左端是负极,通入的是氢气,右端是正极,通入的是氧气;
A.没有标况,不确定氢气的物质的量,不能计算电子的量,A错误;
B.原电池中阴离子向负极a端移动,B错误;
C.b为正极,发生还原反应,C错误;
D.若电解质溶液为溶液,则a电极反应为碱性条件下,氢气失去电子发生氧化反应生成水:,D正确;
故选D。
5.答案:D
解析:A.物质的聚集状态对反应的反应热有影响,故书写热化学方程式时,要标出物质的聚集状态,故A错误;
B.碳的燃烧为放热反应,应为负值,故B错误;
C.酸碱中和为放热反应,应为负值,且的单位为,故C错误;
D.氢气在氯气中燃烧为放热反应,故为负值,故D正确。
故选D。
6.答案:A
解析:由反应速率之比等于化学计量数之比可知,四种条件下A物质的反应速率分别为①、②、③、④,则反应进行的快慢顺序为④>③=②>①,故选A。
7.答案:B
解析:A项中;B中,换算成;C中;D中,B项中v(A)的数值最大,速率最快,故答案选B。
8.答案:A
解析:根据题干描述,碘化氢分解的总反应是吸热的,而第二步是成键过程,一定是放热,故第一步必然吸热;
A.结合图像,第一步吸热,第二步放热,总反应吸热,符合上述解题思路,故A符合题意;
B.根据图像,总反应是放热反应,不符合上述解题思路,故B不符合题意;
C.根据图像,第二步吸热,不符合上述解题思路,故C不符合题意;
D.根据图像,第一步放热,第二步吸热,不符合上述解题思路,故D不符合题意。
答案选A。
9.答案:D
解析:A.无水乙醇为非电解质,不导电,不能形成闭合的回路,所以不能产生电流,A不合题意;
B.Al能与NaOH溶液反应,但Mg和Al未用导线连接,不能形成闭合的回路,所以不能产生电流,B不合题意;
C.两电极均为石墨电极,没有自发进行的氧化还原反应,不能产生电流,C不合题意;
D.已知Zn比Pb活泼,能与稀盐酸反应,且形成了闭合回路,则能够形成原电池即产生电流,D符合题意;
故选:D。
10.答案:D
解析:A.干冰升华为物理变化,破坏的是分子间作用力,不是共价键,A错误;
B.析出的是五水合硫酸铜蓝色晶体,不是无水硫酸铜,B错误;
C.苯分子中不存在单双键交替,6个碳碳键完全等同,C错误;
D.激发态电子从高能轨道跃迁到低能轨道,能量以光的形式释放,D正确;
故选D。
11.答案:D
解析:A.铜锌原电池中,锌是负极,,质量逐渐减小,故A正确;
B.铜锌原电池中,铜是正极,正极反应,氢离子的铜片表面被还原,产生气泡,故B正确;
C.电子从负极流出,所以电子从锌片经导线流向铜片,故C正确;
D.电流从正极流向负极,电流从铜片经导线流向锌片,故D错误。
故选D。
12.答案:A
A.ZnA.Zn与稀硫酸反应制取时,加入蒸馏水,硫酸浓度减小,反应速率减小,故A符合题意;
B.Al在中燃烧生成时,用铝粉替代铝片,增大接触面积,反应速率加快,故B不符合题意;
C.与稀盐酸反应生成时,适当升高温度,反应速率加快,故C不符合题意;
D.用固体分解制取时,固体中添加少量作催化剂,反应速率加快,故D不符合题意;
答案选A。
13.答案:A
解析:A项、氧化铁为棕红色固体,瓷器的青色不可能来自氧化铁,故A错误;
B项、秦兵马俑是陶制品,陶制品是由粘土或含有粘土的混合物经混炼、成形、煅烧而制成的,故B正确;
C项、陶瓷的主要原料是取之于自然界的硅酸盐矿物,陶瓷的主要成分是硅酸盐,与水泥、玻璃等同属硅酸盐产品,故C正确;
D项、陶瓷的主要成分是硅酸盐,硅酸盐的化学性质不活泼,具有不与酸或碱反应、抗氧化的特点,故D正确。
故选A。
14.答案:B
解析:A.由图甲可知,反应物总能量低于生成物总能量,该反应为吸热反应,热化学方程式为,故A错误;
B.图乙中反应物总能量低于生成物总能量,该反应为吸热反应,吸热反应的反应物断键吸收的能量大于生成物成键放出的能量,故B正确;
C.图丙中反应物总能量低于生成物总能量,该反应为吸热反应,而燃料燃烧时释放能量,故C错误;
D.图丁中反应物总能量高于生成物总能量,该反应为放热反应,所以图丁应是表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故D错误;
故答案为:B。
15.答案:(1)A
(2)
(3)
(4)0.2mol/(L·min)
(5)2∶1∶3
解析:(1)化学反应中反应物的物质的量浓度减小,生成物的物质的量浓度增大,故反应物为A,生成物为B和C;
(2)由图可知,反应至4min时,A的浓度由2mol/L降低到1.2mol/L,浓度变化为0.8mol/L;B的浓度由0增加至0.4mol/L,浓度变化为0.4mol/L;C的浓度由0增加到1.2mol/L,浓度变化为1.2mol/L;
(3)化学反应的化学计量数之比等于速率之比等于浓度变化之比,故A、B、C的化学计量数之比为0.8∶0.4∶1.2=2∶1∶3,故化学方程式为;
(4)应开始至,用A的浓度变化来表示该反应的化学反应速率v==0.2mol/(L·min);
(5)化学反应的速率之比等于化学计量数之比,故2∶1∶3。
16.答案:(1)-566.0
(2);、CO;降低;
(3)阳;;;
解析:(1);
故答案为: 566.0kJ/mol;
(2)①根据化合价变化,中C元素化合价由+4降低为+2价,,化合价降低可能生成CO,发生还原反应,为阴极反应,b为负极,阴极吸引阳离子发生还原反应,故水中的可能在阴极反应生成氢气,则阴极副产物为氢气、CO;
故答案为:;、CO;
②阳极水中的发生反应,,生成的氢离子与碳酸氢根反应,则碳酸氢钾的浓度降低;
故答案为:降低;
③根据解题思路,a为正极,得电子,;
故答案为:;
(3)根据图示,右侧区转化为,,发生还原反应,则右侧为正极,吸引阳离子;左侧转化为,;虚框内,转化为,,根据电荷守恒可知,需要补充的X为;
故答案为:阳;;;。
17.答案:(1)
(2)正;;;560
(3)
解析:(1)铅蓄电池在放电时发生的电池反应式为,放电时Pb为负极,失去电子后与硫酸根离子结合生成硫酸铅,电极反应式为。
(2)①根据氢氧燃料电池示意图可知,电解质溶液为KOH,总反应为,通入的电极为正极,通入的电极为负极;原电池的两极中,正极电势比负极电势高;
②负极上,失去电子后结合电解质溶液中生成水:;
③根据正极反应可知,得到4mol时消耗1mol,因此转移0.1mol电子时,消耗标准状况下的体积为:。
(3)若将此燃料电池改成以和为原料进行工作时,负极为通的电极,失电子被氧化产生再与结合形成和:。
18.答案:(1)反应速率与成正比关系
(2)
(3)①未观察到溶液变为棕黄色,说明没有碘单质生成,没有与KI发生氧化还原反应;有无色气体产生,说明发生了分解反应,而没有加入KI前,没有观察到无色气体产生
②ⅰ.取两支试管,分别加入的过氧化氢溶液;
ⅱ.向其中一支试管中加入1mLKI溶液,另一支试管中加入1mL蒸馏水;
ⅲ.观察到加入KI溶液的试管中产生气泡的速率快
解析:(2)0~20s,,,则。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
