高中化学人教版选择性必修2考前专题特训卷 分子结构和性质(含解析)
文档属性
| 名称 | 高中化学人教版选择性必修2考前专题特训卷 分子结构和性质(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 16:59:58 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
高中化学人教版选择性必修2考前专题特训卷 分子结构和性质
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.人们发现金星大气层有一种被称为羰基硫()的分子,其结构与相似,羰基硫是一种与生命密切相关的物质。下列推测肯定不正确的是( )
A.是含有极性键的共价化合物
B.的沸点比低
C.的结构式为
D.中所有原子最外层都满足8电子稳定结构
2.利用硼烷独特温和的化学选择性可还原羧酸,其机理如下:
下列说法错误的是( )
A.过程①的进行与硼原子的缺电子有关
B.整个过程中硼的杂化方式不发生改变
C.还原过程中一共涉及三种反应类型
D.根据上述机理猜测硼烷还可还原酯基
3.氯的含氧酸根离子有、、、等,关于它们的说法不正确的是( )
A.的中心Cl原子采取杂化
B.的空间结构为三角锥形
C.的空间结构为直线形
D.中Cl原子的杂化类型与相同
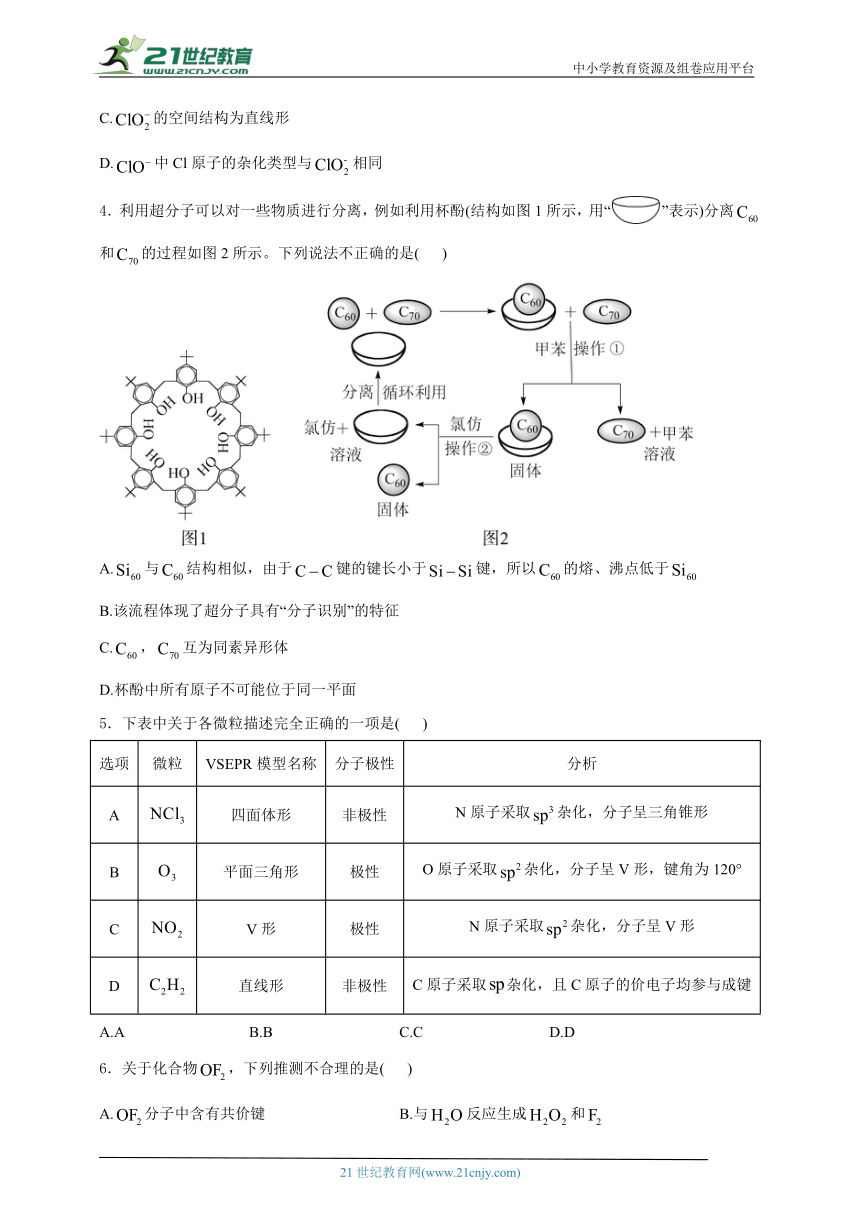
4.利用超分子可以对一些物质进行分离,例如利用杯酚(结构如图1所示,用“”表示)分离和的过程如图2所示。下列说法不正确的是( )
A.与结构相似,由于键的键长小于键,所以的熔、沸点低于
B.该流程体现了超分子具有“分子识别”的特征
C.,互为同素异形体
D.杯酚中所有原子不可能位于同一平面
5.下表中关于各微粒描述完全正确的一项是( )
选项 微粒 VSEPR模型名称 分子极性 分析
A 四面体形 非极性 N原子采取杂化,分子呈三角锥形
B 平面三角形 极性 O原子采取杂化,分子呈V形,键角为120°
C V形 极性 N原子采取杂化,分子呈V形
D 直线形 非极性 C原子采取杂化,且C原子的价电子均参与成键
A.A B.B C.C D.D
6.关于化合物,下列推测不合理的是( )
A.分子中含有共价键 B.与反应生成和
C.具有强氧化性 D.所有原子均满足8电子结构
7.下列含有共价键的化合物是( )
A. B.NaOH C. D.NaCl
8.下列说法正确的是( )
A.分子中只有极性共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.和两种分子中,每个原子的最外层都具有8电子稳定结构
D.氢氧化钠、溶于水均克服分子间作用力
9.下列物质中,含有极性共价键的是( )
A.单质碘 B.氯化镁 C.溴化钾 D.水
10.缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法正确的是( )
A.、、均为缺电子化合物
B.的键角大于的键角
C.与化合反应产物中,B和N的杂化方式相同
D.和都是极性分子
11.白磷在氯气中燃烧能生成、,受热失去两个Cl原子生成,其中分子结构如图所示:
下列叙述正确的是( )
A.分子中所有P-Cl键键能都一样 B.分子的空间构型为平面正三角形
C.、中P原子均为杂化 D.分子中键角(Cl-P-Cl)有3种
12.下列物质中,既含有极性共价键,又含有非极性共价键的是( )
A. B. C. D.
13.基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.理论认为模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.杂化轨道由1个s轨道和3个p轨道混杂而成
14.下列有关物质结构与性质的说法错误的是( )
A.比稳定,是由于分子间存在氢键,而分子间不存在氢键
B.Zn的第一电离能大于Ga,是由于Zn的价层电子排布是全充满的,比较稳定
C.溶于氨水,是由于与反应生成了可溶性配合物
D.金刚石可用作地质钻探钻头,是由于金刚石具有很高的硬度
15.酞菁与钴酞菁的分子结构如图所示,已知酞菁分子中所有原子共平面。下列说法错误的是( )
A.酞菁分子中三种N原子的杂化方式均为
B.酞菁分子中p轨道能提供一对电子的N原子是②
C.钴酞菁中存在配位键
D.钴酞菁中钴离子为+2价
二、填空题(共4题,55分)
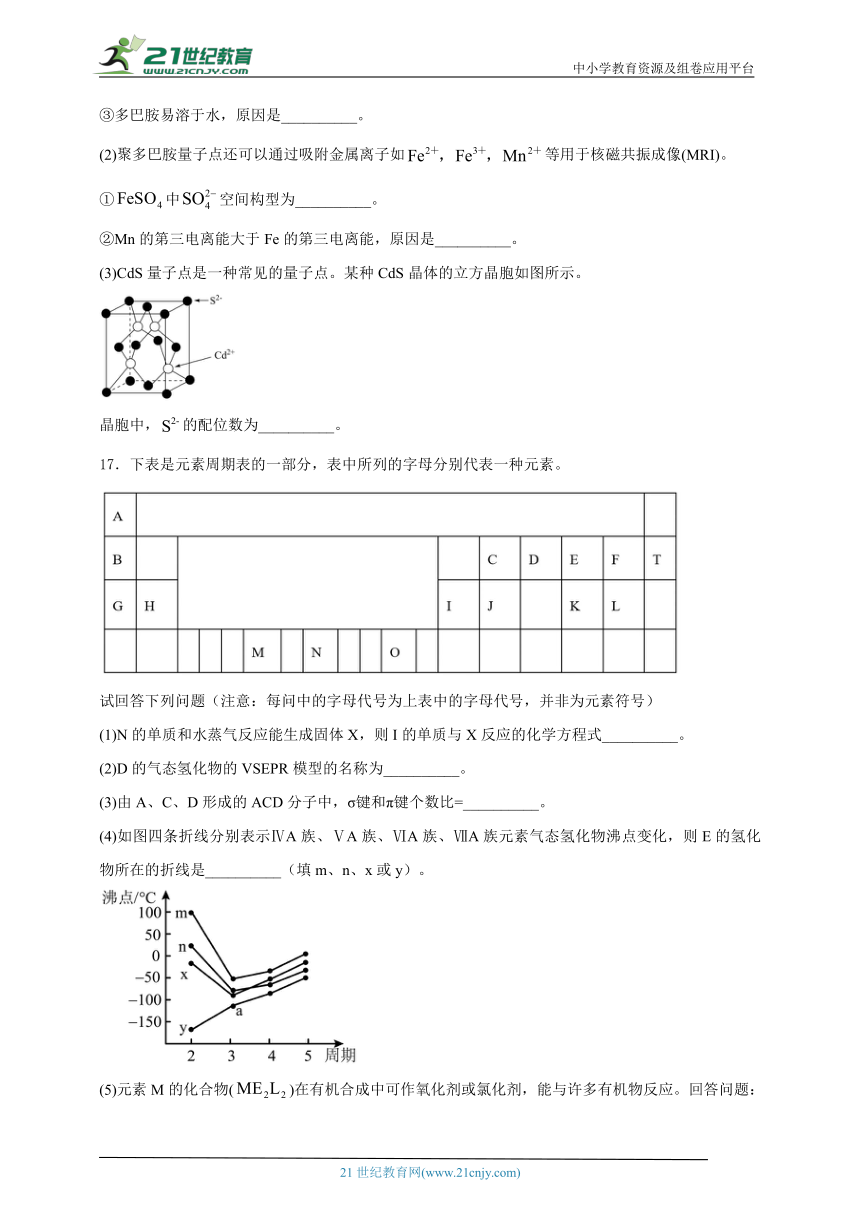
16.量子点又称“人造原子”、“超原子”,在医疗,科技等多个领域有广泛的应用。
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性。多巴胺结构如下图所示。
①基态氮原子的价电子排布式为__________,其核外有__________种运动状态不同的电子。
②多巴胺分子中碳原子的杂化方式为__________,1mol多巴胺中含有σ键的数目为__________。
③多巴胺易溶于水,原因是__________。
(2)聚多巴胺量子点还可以通过吸附金属离子如等用于核磁共振成像(MRI)。
①中空间构型为__________。
②Mn的第三电离能大于Fe的第三电离能,原因是__________。
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如图所示。
晶胞中,的配位数为__________。
17.下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式__________。
(2)D的气态氢化物的VSEPR模型的名称为__________。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比=__________。
(4)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__________(填m、n、x或y)。
(5)元素M的化合物()在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①常温下为深红色液体,能与互溶,据此判断是__________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为__________。
③临床建议服用维生素C促进“亚铁”的吸收,避免生成,从结构角度来看,易被氧化成的原因是__________。
(6)往溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式__________。
(7)若F、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为__________。
18.请回答下列问题。
(1)为什么两个H原子能结合成,而两个He原子不能结合成?
(2)和化合时,为什么只能生成HCl,而不能生成或?
三、实验题
19.是一种优质还原剂,是运载火箭的固体燃料。某实验小组采用“循环利用氯化锂法”制备,实验步骤如下:
①制备LiH:氯化锂、钠、氢气在下反应得到混合物;
②制备:将LiH溶于乙醚后与无水氯化铝反应。制备LiH的实验装置如图所示:
回答下列问题:
(1)实验开始,检验装置气密性,添加药品完毕,加热D装置前应进行的操作是_____________。
(2)B装置中发生反应的离子方程式为_____________,E装置的作用是_____________。
(3)制备的化学方程式为_____________。
(4)乙醚作溶剂的优点是_____________。
(5)采用该方法制备的突出优点是_____________。
(6)的还原能力比强,原因是_____________。
参考答案
1.答案:B
解析:A.是共价化合物,含有的和是极性键,A项正确;
B.由于相对分子质量,且的结构与相似,则的沸点高于,B项错误;
C.相当于分子中的一个氧原子被硫原子取代,电子式是,C项正确;
D.中碳元素的化合价是+4价,氧元素和硫元素的化合价都是-2价,碳原子的原子核外最外层电子数为4,氧原子和硫原子的原子核外最外层电子数均为6,所以中所有原子均满足最外层8电子稳定结构,D项正确;
答案选B。
2.答案:B
解析:过程①中B与O形成配位键,O提供孤电子对,B提供空轨道,A正确;、、中B为杂化,、中B为杂化,B错误;过程①、过程④只有化学键的形成,可看成吸附过程,过程②、过程⑤为加成反应,过程③为消去反应,过程⑥为取代反应,故还原过程中一共涉及三种反应类型,C正确;该反应中硼烷作用于碳氧双键,根据该反应机理,可推测硼烷还可将酯基还原为,D正确。
3.答案:C
解析:A.的中心原子的孤电子对数为0,与中心原子结合的O原子数为4,则原子采取杂化,A正确;
B.的中心原子的价层电子对数为,且含有1个孤电子对,空间结构为三角锥形,B正确;
C.的中心原子的价层电子对数为,且含有2个孤电子对,空间结构为V形,C错误;
D.中原子的孤电子对数为3,与原子结合的O原子数为1,原子采取杂化,中原子的孤电子对数为2,与原子结合的O原子数为2,原子采取杂化,D正确;
故选C。
4.答案:A
解析:A.与的结构相似,相对分子质量比大,其分子间的作用力大,物质的熔沸点就越高,与分子内化学键的键长无关,A错误;
B.由图可知,杯酚与形成超分子,而杯酚与不能形成超分子,反映了超分子具有“分子识别”的特性,B正确;
C.、为同一种元素形成的结构不同的单质,互为同素异形体,C正确;
D.杯酚分子中含有饱和碳原子,饱和碳原子与其相连的4个原子形成四面体结构,所有原子不可能位于同一平面内,D正确;
故选A。
5.答案:D
解析:A.中N原子的价层电子对数为4,VSEPR模型为四面体形,N原子采取杂化,分子呈三角锥形,是极性分子,A项错误;
B.中O原子的价层电子对数为3,VSEPR模型为平面三角形,O原子采取杂化,分子呈V形,键角小于,由于大π键的存在,中心氧原子是呈正电性的,而端位的两个氧原子是呈负电性的,所以是极性分子,B项错误;
C.中N原子的价层电子对数为3,VSEPR模型为平面三角形,中心N原子采取杂化,分子呈V形,是极性分子,C项错误;
D.的两个C原子的价层电子对数均为2,均采取sp杂化,VSEPR模型为直线形,C原子的价电子均参与成键(两个σ键和2个π键),是非极性分子,D项正确;
答案选D。
6.答案:B
解析:
7.答案:B
解析:A.是只含离子键的化合物,A不合题意;
B.NaOH是既含共价键,又含离子键的化合物,B符合题意;
C.是只含共价键的单质,C不合题意;
D.NaCl是只含离子键的化合物,D不合题意
故选B。
8.答案:C
解析:A.分子中存在O-O非极性共价键,A错误;
B.物质在熔融状态下能导电,可能为金属单质等,不一定是离子化合物,因此不一定含离子键,B错误;
C.氮气存在N≡N,且N原子上均有1对孤对电子,则分子中每个原子的最外层都具有8电子稳定结构,分子中C为+4价,原子最外层有4个电子,O为-2价,原子最外层有6个电子,C和O原子之间以双键结合,最外层都具有8电子稳定结构,C正确;
D.氢氧化钠、溶于水分别断裂离子键、共价键,不是克服分子间作用力,D错误;
故选C。
9.答案:D
解析:A.碘属于非金属单质,存在非极性共价键,故A不选;
B.氯化镁属于离子化合物,只存在离子键,故B不选;
C.溴化钾属于离子化合物,只存在离子键,故C不选;
D.水属于共价化合物,存在H-O极性共价键,故D可选;
故选D。
10.答案:C
解析:A.和均不为缺电子化合物,A错误;
B.是三角锥形,键角107°:是平面正三角形结构,键角120°,B错误;
C.与化合反应产物中,B和N都是杂化,C正确;
D.是极性分子,是非极性分子,D错误;
故选C。
11.答案:D
解析:A.由图可知,分子中所有P-C键的键长有两类,故P-C键键能不都一样,A错误;
B.分子中有一对孤电子对和三对成键电子对,故空间构型为三角锥形,B错误;
C.的价层电子对数为4,的价层电子对数为5,C错误;
D.由图可知,键角(Cl-P-Cl)有90°、120°、180°三种,D正确;
故选D。
12.答案:D
解析:A.分子中碳原子和氯原子之间以极性共价键结合,所以中只含极性共价键,A错误;
B.分子中C原子和O原子之间只存在极性共价键,B错误;
C.氯化铵中氯离子和铵根离子之间存在离子键,铵根离子中氮原子和氢原子之间存在极性共价键,所以氯化铵是含有离子键和极性共价键的离子化合物,C错误;
D.分子中氢原子和氧原子之间以极性共价键结合,氧原子和氧原子之间以非极性共价键结合,所以双氧水是含有极性共价键和非极性共价键的共价化合物,D正确;
答案选D。
13.答案:A
A.VSEPRA.VSEPR模型是价层电子对的空间结构模型,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对,当中心原子无孤电子对时,两者空间结构相同,当中心原子有孤电子对时,两者空间结构不同,故A错误;
B.元素的性质随着原子序数的递增而呈现周期性的变化,这一规律叫元素周期律,元素性质的周期性的变化是元素原子的核外电子排布周期性变化的必然结果,故B正确;
C.在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理,故C正确;
D.1个s轨道和3个p轨道混杂形成4个能量相同、方向不同的轨道,称为杂化轨道,故D正确;
故答案为:A。
14.答案:A
解析:中键长小于中键长,中的键能大于中的键能,因此比稳定,氢键影响的熔沸点,A项错误。Zn的第一电离能大于Ga,是由于Zn的价层电子排布式为,是全充满的,比较稳定,B项正确。溶于氨水,是由于与反应生成了可溶性配合物,C项正确。金刚石为共价晶体,具有很高的硬度,可用作地质钻探钻头,D项正确。
15.答案:B
解析:酞菁分子中所有原子共平面,则三种N原子和C原子均为杂化,A项正确。标号为①和②的N原子均形成2个σ键,且有孤电子对占据了一个杂化轨道,则p轨道只能提供1个电子参与形成大π键;标号为③的N原子形成3个σ键,故p轨道能提供一对电子参与形成大π键,B项错误。与N之间形成配位键,C项正确。标号为③的N原子形成的N-H键易断裂从而电离出,钴酞菁分子中,失去了2个的酞菁离子与钴离子通过配位键结合成分子,因此,钴离子的化合价为+2,D项正确。
16.答案:(1);7;、;22mol;多巴胺分子中含有酚羟基、氨基,能和水分子形成氢键
(2)正四面体形;由转化为时,3d能级由较稳定的半充满状态转为不稳定的状态需要的能量较多;而到时,3d能级由不稳定的到稳定的半充满状态,需要的能量相对要少
(3)4
解析:(1)①N的原子序数为7,基态氮原子的电子排布式为,价电子排布式为,其核外有7种运动状态不同的电子;
②多巴胺分子中苯环上的碳原子为杂化、环外饱和碳原子为杂化,即碳原子的杂化方式为、;O-H、C-H、C-C、C-N、N-H单键均为σ键,苯环结构有12个σ键,除此之外还有10个单键,1mol多巴胺中含有σ键的数目为;
③多巴胺中的都能与水形成氢键,因此多巴胺易溶于水;
(2)①的中心原子S原子的价层电子对数为,为杂化,空间构型为正四面体形;
②由转化为时,3d能级由较稳定的半充满状态转为不稳定的状态需要的能量较多;而到时,3d能级由不稳定的到稳定的半充满状态,需要的能量相对要少,故导致Mn的第三电离能大于Fe的第三电离能;
(3)晶胞中,处于构成的四面体中心,配位数为4。
17.答案:(1)
(2)四面体
(3)1:1
(4)m
(5)非极性;;价电子为,3d上有6个电子,易失去一个电子变为半满稳定结构
(6)
(7)正八面体
解析:(1)Fe的单质和水蒸气反应能生成固体,则Al与反应生成Fe和,其化学方程式。
(2)D的气态氢化物的价层电子对数为,VSEPR模型的名称为四面体形。
(3)由A、C、D形成的ACD分子HCN,其结构为H—C≡N,含有2个σ键和2个π键,σ键和π键个数比为1:1。
(4)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,分子间存在氢键,且间形成氢键的个数比HF多,HF形成的氢键强度比强,沸点最高的是,因此m为,n为HF,x为,y为,则E的氢化物为,其所在的折线是m。
(5)①常温下为深红色液体,能与等互溶,是非极性分子,根据相似相溶原理得出是非极性分子;
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成Cu—Al—浓硝酸原电池,则组成负极材料是铜,其外围电子轨道表示式为;
③易被氧化成的原因是:价电子为,3d上有6个电子,易失去一个电子变为半满稳定结构。
(6)往溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,发生的是氢氧化铜和氨水反应生成四氨合铜子、氢氧根和水,其沉淀溶解的离子方程式。
(7)若F、K两种元素形成的化合物中中心原子的价电子全部参与成键则形成,价层电子对数为6+=6,则该化合物的空间构型的名称为正八面体。
18.答案:(1)H原子核外有1个未成对电子,两个带有自旋方向相反的电子的氢原子可以形成,而He原子核外无未成对电子,所以两个He原子不能结合成。
(2)根据共价键的饱和性可知,共价分子中,每个原子的成键数目是一定的。原子中均只有一个未成对电子,所以1个H原子只能结合1个带有自旋方向相反的电子的Cl原子形成HCl。
解析:
19.答案:(1)先打开活塞K,产生的将装置中的空气排净
(2);避免水蒸气进入D装置中
(3)
(4)既可溶解LiH也可溶解,增大二者接触面积,使其充分反应,提高反应速率
(5)LiCl可以循环利用,提高利用率
(6)铝原子半径比硼原子半径大,Al—H键键能小于B—H键,Al—H键更易断裂
解析:(1)根据制备LiH的步骤可知,加热D装置之前应该先利用启普发生器中产生的排净装置内的空气。
(2)ZnS与稀硫酸反应时会生成杂质,用溶液洗气时,会生成CuS沉淀,反应的离子方程式为,E装置可以防止水蒸气进入D装置中。
(3)结合实验步骤②可写出制备的化学方程式为。
(4)LiH和为固体,乙醚既可溶解LiH也可溶解,能有效增大二者接触面积,使其充分反应,提高反应速率;同时也有利于和氢化铝锂分离,便于回收利用。
(5)该实验的原料含LiCl,制备的产物中也含LiCl,则该实验的优点为可以循环利用LiCl,提高原料利用率。
(6)铝原子半径比硼原子半径大,键键能小于键,键更易断裂;或B与H的电负性差值小于Al与H的,故键极性大于键极性,键更易断裂。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
高中化学人教版选择性必修2考前专题特训卷 分子结构和性质
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.人们发现金星大气层有一种被称为羰基硫()的分子,其结构与相似,羰基硫是一种与生命密切相关的物质。下列推测肯定不正确的是( )
A.是含有极性键的共价化合物
B.的沸点比低
C.的结构式为
D.中所有原子最外层都满足8电子稳定结构
2.利用硼烷独特温和的化学选择性可还原羧酸,其机理如下:
下列说法错误的是( )
A.过程①的进行与硼原子的缺电子有关
B.整个过程中硼的杂化方式不发生改变
C.还原过程中一共涉及三种反应类型
D.根据上述机理猜测硼烷还可还原酯基
3.氯的含氧酸根离子有、、、等,关于它们的说法不正确的是( )
A.的中心Cl原子采取杂化
B.的空间结构为三角锥形
C.的空间结构为直线形
D.中Cl原子的杂化类型与相同
4.利用超分子可以对一些物质进行分离,例如利用杯酚(结构如图1所示,用“”表示)分离和的过程如图2所示。下列说法不正确的是( )
A.与结构相似,由于键的键长小于键,所以的熔、沸点低于
B.该流程体现了超分子具有“分子识别”的特征
C.,互为同素异形体
D.杯酚中所有原子不可能位于同一平面
5.下表中关于各微粒描述完全正确的一项是( )
选项 微粒 VSEPR模型名称 分子极性 分析
A 四面体形 非极性 N原子采取杂化,分子呈三角锥形
B 平面三角形 极性 O原子采取杂化,分子呈V形,键角为120°
C V形 极性 N原子采取杂化,分子呈V形
D 直线形 非极性 C原子采取杂化,且C原子的价电子均参与成键
A.A B.B C.C D.D
6.关于化合物,下列推测不合理的是( )
A.分子中含有共价键 B.与反应生成和
C.具有强氧化性 D.所有原子均满足8电子结构
7.下列含有共价键的化合物是( )
A. B.NaOH C. D.NaCl
8.下列说法正确的是( )
A.分子中只有极性共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.和两种分子中,每个原子的最外层都具有8电子稳定结构
D.氢氧化钠、溶于水均克服分子间作用力
9.下列物质中,含有极性共价键的是( )
A.单质碘 B.氯化镁 C.溴化钾 D.水
10.缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法正确的是( )
A.、、均为缺电子化合物
B.的键角大于的键角
C.与化合反应产物中,B和N的杂化方式相同
D.和都是极性分子
11.白磷在氯气中燃烧能生成、,受热失去两个Cl原子生成,其中分子结构如图所示:
下列叙述正确的是( )
A.分子中所有P-Cl键键能都一样 B.分子的空间构型为平面正三角形
C.、中P原子均为杂化 D.分子中键角(Cl-P-Cl)有3种
12.下列物质中,既含有极性共价键,又含有非极性共价键的是( )
A. B. C. D.
13.基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.理论认为模型与分子的空间结构相同
B.元素性质随着原子序数递增而呈周期性变化的规律称为元素周期律
C.泡利原理认为一个原子轨道内最多只能容纳两个自旋相反的电子
D.杂化轨道由1个s轨道和3个p轨道混杂而成
14.下列有关物质结构与性质的说法错误的是( )
A.比稳定,是由于分子间存在氢键,而分子间不存在氢键
B.Zn的第一电离能大于Ga,是由于Zn的价层电子排布是全充满的,比较稳定
C.溶于氨水,是由于与反应生成了可溶性配合物
D.金刚石可用作地质钻探钻头,是由于金刚石具有很高的硬度
15.酞菁与钴酞菁的分子结构如图所示,已知酞菁分子中所有原子共平面。下列说法错误的是( )
A.酞菁分子中三种N原子的杂化方式均为
B.酞菁分子中p轨道能提供一对电子的N原子是②
C.钴酞菁中存在配位键
D.钴酞菁中钴离子为+2价
二、填空题(共4题,55分)
16.量子点又称“人造原子”、“超原子”,在医疗,科技等多个领域有广泛的应用。
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性。多巴胺结构如下图所示。
①基态氮原子的价电子排布式为__________,其核外有__________种运动状态不同的电子。
②多巴胺分子中碳原子的杂化方式为__________,1mol多巴胺中含有σ键的数目为__________。
③多巴胺易溶于水,原因是__________。
(2)聚多巴胺量子点还可以通过吸附金属离子如等用于核磁共振成像(MRI)。
①中空间构型为__________。
②Mn的第三电离能大于Fe的第三电离能,原因是__________。
(3)CdS量子点是一种常见的量子点。某种CdS晶体的立方晶胞如图所示。
晶胞中,的配位数为__________。
17.下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
试回答下列问题(注意:每问中的字母代号为上表中的字母代号,并非为元素符号)
(1)N的单质和水蒸气反应能生成固体X,则I的单质与X反应的化学方程式__________。
(2)D的气态氢化物的VSEPR模型的名称为__________。
(3)由A、C、D形成的ACD分子中,σ键和π键个数比=__________。
(4)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,则E的氢化物所在的折线是__________(填m、n、x或y)。
(5)元素M的化合物()在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。回答问题:
①常温下为深红色液体,能与互溶,据此判断是__________(填“极性”或“非极性”)分子。
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成原电池,则组成负极材料的元素的外围电子轨道表示式为__________。
③临床建议服用维生素C促进“亚铁”的吸收,避免生成,从结构角度来看,易被氧化成的原因是__________。
(6)往溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,写出沉淀溶解的离子方程式__________。
(7)若F、K两种元素形成的化合物中中心原子的价电子全部参与成键,则该化合物的空间构型的名称为__________。
18.请回答下列问题。
(1)为什么两个H原子能结合成,而两个He原子不能结合成?
(2)和化合时,为什么只能生成HCl,而不能生成或?
三、实验题
19.是一种优质还原剂,是运载火箭的固体燃料。某实验小组采用“循环利用氯化锂法”制备,实验步骤如下:
①制备LiH:氯化锂、钠、氢气在下反应得到混合物;
②制备:将LiH溶于乙醚后与无水氯化铝反应。制备LiH的实验装置如图所示:
回答下列问题:
(1)实验开始,检验装置气密性,添加药品完毕,加热D装置前应进行的操作是_____________。
(2)B装置中发生反应的离子方程式为_____________,E装置的作用是_____________。
(3)制备的化学方程式为_____________。
(4)乙醚作溶剂的优点是_____________。
(5)采用该方法制备的突出优点是_____________。
(6)的还原能力比强,原因是_____________。
参考答案
1.答案:B
解析:A.是共价化合物,含有的和是极性键,A项正确;
B.由于相对分子质量,且的结构与相似,则的沸点高于,B项错误;
C.相当于分子中的一个氧原子被硫原子取代,电子式是,C项正确;
D.中碳元素的化合价是+4价,氧元素和硫元素的化合价都是-2价,碳原子的原子核外最外层电子数为4,氧原子和硫原子的原子核外最外层电子数均为6,所以中所有原子均满足最外层8电子稳定结构,D项正确;
答案选B。
2.答案:B
解析:过程①中B与O形成配位键,O提供孤电子对,B提供空轨道,A正确;、、中B为杂化,、中B为杂化,B错误;过程①、过程④只有化学键的形成,可看成吸附过程,过程②、过程⑤为加成反应,过程③为消去反应,过程⑥为取代反应,故还原过程中一共涉及三种反应类型,C正确;该反应中硼烷作用于碳氧双键,根据该反应机理,可推测硼烷还可将酯基还原为,D正确。
3.答案:C
解析:A.的中心原子的孤电子对数为0,与中心原子结合的O原子数为4,则原子采取杂化,A正确;
B.的中心原子的价层电子对数为,且含有1个孤电子对,空间结构为三角锥形,B正确;
C.的中心原子的价层电子对数为,且含有2个孤电子对,空间结构为V形,C错误;
D.中原子的孤电子对数为3,与原子结合的O原子数为1,原子采取杂化,中原子的孤电子对数为2,与原子结合的O原子数为2,原子采取杂化,D正确;
故选C。
4.答案:A
解析:A.与的结构相似,相对分子质量比大,其分子间的作用力大,物质的熔沸点就越高,与分子内化学键的键长无关,A错误;
B.由图可知,杯酚与形成超分子,而杯酚与不能形成超分子,反映了超分子具有“分子识别”的特性,B正确;
C.、为同一种元素形成的结构不同的单质,互为同素异形体,C正确;
D.杯酚分子中含有饱和碳原子,饱和碳原子与其相连的4个原子形成四面体结构,所有原子不可能位于同一平面内,D正确;
故选A。
5.答案:D
解析:A.中N原子的价层电子对数为4,VSEPR模型为四面体形,N原子采取杂化,分子呈三角锥形,是极性分子,A项错误;
B.中O原子的价层电子对数为3,VSEPR模型为平面三角形,O原子采取杂化,分子呈V形,键角小于,由于大π键的存在,中心氧原子是呈正电性的,而端位的两个氧原子是呈负电性的,所以是极性分子,B项错误;
C.中N原子的价层电子对数为3,VSEPR模型为平面三角形,中心N原子采取杂化,分子呈V形,是极性分子,C项错误;
D.的两个C原子的价层电子对数均为2,均采取sp杂化,VSEPR模型为直线形,C原子的价电子均参与成键(两个σ键和2个π键),是非极性分子,D项正确;
答案选D。
6.答案:B
解析:
7.答案:B
解析:A.是只含离子键的化合物,A不合题意;
B.NaOH是既含共价键,又含离子键的化合物,B符合题意;
C.是只含共价键的单质,C不合题意;
D.NaCl是只含离子键的化合物,D不合题意
故选B。
8.答案:C
解析:A.分子中存在O-O非极性共价键,A错误;
B.物质在熔融状态下能导电,可能为金属单质等,不一定是离子化合物,因此不一定含离子键,B错误;
C.氮气存在N≡N,且N原子上均有1对孤对电子,则分子中每个原子的最外层都具有8电子稳定结构,分子中C为+4价,原子最外层有4个电子,O为-2价,原子最外层有6个电子,C和O原子之间以双键结合,最外层都具有8电子稳定结构,C正确;
D.氢氧化钠、溶于水分别断裂离子键、共价键,不是克服分子间作用力,D错误;
故选C。
9.答案:D
解析:A.碘属于非金属单质,存在非极性共价键,故A不选;
B.氯化镁属于离子化合物,只存在离子键,故B不选;
C.溴化钾属于离子化合物,只存在离子键,故C不选;
D.水属于共价化合物,存在H-O极性共价键,故D可选;
故选D。
10.答案:C
解析:A.和均不为缺电子化合物,A错误;
B.是三角锥形,键角107°:是平面正三角形结构,键角120°,B错误;
C.与化合反应产物中,B和N都是杂化,C正确;
D.是极性分子,是非极性分子,D错误;
故选C。
11.答案:D
解析:A.由图可知,分子中所有P-C键的键长有两类,故P-C键键能不都一样,A错误;
B.分子中有一对孤电子对和三对成键电子对,故空间构型为三角锥形,B错误;
C.的价层电子对数为4,的价层电子对数为5,C错误;
D.由图可知,键角(Cl-P-Cl)有90°、120°、180°三种,D正确;
故选D。
12.答案:D
解析:A.分子中碳原子和氯原子之间以极性共价键结合,所以中只含极性共价键,A错误;
B.分子中C原子和O原子之间只存在极性共价键,B错误;
C.氯化铵中氯离子和铵根离子之间存在离子键,铵根离子中氮原子和氢原子之间存在极性共价键,所以氯化铵是含有离子键和极性共价键的离子化合物,C错误;
D.分子中氢原子和氧原子之间以极性共价键结合,氧原子和氧原子之间以非极性共价键结合,所以双氧水是含有极性共价键和非极性共价键的共价化合物,D正确;
答案选D。
13.答案:A
A.VSEPRA.VSEPR模型是价层电子对的空间结构模型,而分子的空间结构指的是成键电子对的空间结构,不包括孤电子对,当中心原子无孤电子对时,两者空间结构相同,当中心原子有孤电子对时,两者空间结构不同,故A错误;
B.元素的性质随着原子序数的递增而呈现周期性的变化,这一规律叫元素周期律,元素性质的周期性的变化是元素原子的核外电子排布周期性变化的必然结果,故B正确;
C.在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理,故C正确;
D.1个s轨道和3个p轨道混杂形成4个能量相同、方向不同的轨道,称为杂化轨道,故D正确;
故答案为:A。
14.答案:A
解析:中键长小于中键长,中的键能大于中的键能,因此比稳定,氢键影响的熔沸点,A项错误。Zn的第一电离能大于Ga,是由于Zn的价层电子排布式为,是全充满的,比较稳定,B项正确。溶于氨水,是由于与反应生成了可溶性配合物,C项正确。金刚石为共价晶体,具有很高的硬度,可用作地质钻探钻头,D项正确。
15.答案:B
解析:酞菁分子中所有原子共平面,则三种N原子和C原子均为杂化,A项正确。标号为①和②的N原子均形成2个σ键,且有孤电子对占据了一个杂化轨道,则p轨道只能提供1个电子参与形成大π键;标号为③的N原子形成3个σ键,故p轨道能提供一对电子参与形成大π键,B项错误。与N之间形成配位键,C项正确。标号为③的N原子形成的N-H键易断裂从而电离出,钴酞菁分子中,失去了2个的酞菁离子与钴离子通过配位键结合成分子,因此,钴离子的化合价为+2,D项正确。
16.答案:(1);7;、;22mol;多巴胺分子中含有酚羟基、氨基,能和水分子形成氢键
(2)正四面体形;由转化为时,3d能级由较稳定的半充满状态转为不稳定的状态需要的能量较多;而到时,3d能级由不稳定的到稳定的半充满状态,需要的能量相对要少
(3)4
解析:(1)①N的原子序数为7,基态氮原子的电子排布式为,价电子排布式为,其核外有7种运动状态不同的电子;
②多巴胺分子中苯环上的碳原子为杂化、环外饱和碳原子为杂化,即碳原子的杂化方式为、;O-H、C-H、C-C、C-N、N-H单键均为σ键,苯环结构有12个σ键,除此之外还有10个单键,1mol多巴胺中含有σ键的数目为;
③多巴胺中的都能与水形成氢键,因此多巴胺易溶于水;
(2)①的中心原子S原子的价层电子对数为,为杂化,空间构型为正四面体形;
②由转化为时,3d能级由较稳定的半充满状态转为不稳定的状态需要的能量较多;而到时,3d能级由不稳定的到稳定的半充满状态,需要的能量相对要少,故导致Mn的第三电离能大于Fe的第三电离能;
(3)晶胞中,处于构成的四面体中心,配位数为4。
17.答案:(1)
(2)四面体
(3)1:1
(4)m
(5)非极性;;价电子为,3d上有6个电子,易失去一个电子变为半满稳定结构
(6)
(7)正八面体
解析:(1)Fe的单质和水蒸气反应能生成固体,则Al与反应生成Fe和,其化学方程式。
(2)D的气态氢化物的价层电子对数为,VSEPR模型的名称为四面体形。
(3)由A、C、D形成的ACD分子HCN,其结构为H—C≡N,含有2个σ键和2个π键,σ键和π键个数比为1:1。
(4)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,分子间存在氢键,且间形成氢键的个数比HF多,HF形成的氢键强度比强,沸点最高的是,因此m为,n为HF,x为,y为,则E的氢化物为,其所在的折线是m。
(5)①常温下为深红色液体,能与等互溶,是非极性分子,根据相似相溶原理得出是非极性分子;
②将N和O的单质用导线连接后插入D的最高价氧化物对应的水化物浓溶液中,可制成Cu—Al—浓硝酸原电池,则组成负极材料是铜,其外围电子轨道表示式为;
③易被氧化成的原因是:价电子为,3d上有6个电子,易失去一个电子变为半满稳定结构。
(6)往溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,发生的是氢氧化铜和氨水反应生成四氨合铜子、氢氧根和水,其沉淀溶解的离子方程式。
(7)若F、K两种元素形成的化合物中中心原子的价电子全部参与成键则形成,价层电子对数为6+=6,则该化合物的空间构型的名称为正八面体。
18.答案:(1)H原子核外有1个未成对电子,两个带有自旋方向相反的电子的氢原子可以形成,而He原子核外无未成对电子,所以两个He原子不能结合成。
(2)根据共价键的饱和性可知,共价分子中,每个原子的成键数目是一定的。原子中均只有一个未成对电子,所以1个H原子只能结合1个带有自旋方向相反的电子的Cl原子形成HCl。
解析:
19.答案:(1)先打开活塞K,产生的将装置中的空气排净
(2);避免水蒸气进入D装置中
(3)
(4)既可溶解LiH也可溶解,增大二者接触面积,使其充分反应,提高反应速率
(5)LiCl可以循环利用,提高利用率
(6)铝原子半径比硼原子半径大,Al—H键键能小于B—H键,Al—H键更易断裂
解析:(1)根据制备LiH的步骤可知,加热D装置之前应该先利用启普发生器中产生的排净装置内的空气。
(2)ZnS与稀硫酸反应时会生成杂质,用溶液洗气时,会生成CuS沉淀,反应的离子方程式为,E装置可以防止水蒸气进入D装置中。
(3)结合实验步骤②可写出制备的化学方程式为。
(4)LiH和为固体,乙醚既可溶解LiH也可溶解,能有效增大二者接触面积,使其充分反应,提高反应速率;同时也有利于和氢化铝锂分离,便于回收利用。
(5)该实验的原料含LiCl,制备的产物中也含LiCl,则该实验的优点为可以循环利用LiCl,提高原料利用率。
(6)铝原子半径比硼原子半径大,键键能小于键,键更易断裂;或B与H的电负性差值小于Al与H的,故键极性大于键极性,键更易断裂。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
