高中化学苏教版选择性必修2考前专题特训卷 分子空间结构与物质性质(含解析)
文档属性
| 名称 | 高中化学苏教版选择性必修2考前专题特训卷 分子空间结构与物质性质(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 17:09:35 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
高中化学苏教版选择性必修2考前专题特训卷 分子空间结构与物质性质
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.生活处处都伴随有化学,以下有关说法不正确的是( )
A.天然金刚石形成于地壳中
B.液晶介于液态和晶态之间,可用于制造显示器
C.细胞双分子膜的两边都亲水
D.生物机体可以产生具有光学活性的分子
2.利用硼烷独特温和的化学选择性可还原羧酸,其机理如下:
下列说法错误的是( )
A.过程①的进行与硼原子的缺电子有关
B.整个过程中硼的杂化方式不发生改变
C.还原过程中一共涉及三种反应类型
D.根据上述机理猜测硼烷还可还原酯基
3.碳原子连有4个不同的原子或原子团时,该碳原子称为手性碳。下列有机物中不含有手性碳的是( )
A.①和④ B.②和③ C.①和③ D.②和④
4.某种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
下列说法错误的是( )
A.1molZ最多能与8molNaOH发生反应
B.1molX最多能与3mol发生取代反应
C.Y分子结构中有3个手性碳原子
D.Y能发生加成、取代、消去、氧化、缩聚反应
5.下列关于物质结构的叙述中,错误的个数为( )
①中碳原子的杂化类型有和两种
②某元素离子的核外电子排布式为,它位于周期表第四周期VIB族,属于d区元素
③非极性分子往往具有高度对称性,如、、这样的分子
④第四周期的金属元素从左往右,元素的金属性依次减弱
⑤乳酸()分子中含有一个手性碳原子
⑥HF晶体沸点高于HCl,是因为HCl共价键键能小于HF
⑦是平面三角形的非极性分子,故在水中的溶解度很小
A.3 B.4 C.5 D.6
6.下列离子的模型与其空间结构一致的是( )
A. B. C. D.
7.可以和两种常见的分子形成A和B两种微粒,A和B的结构如图所示。下列说法不正确的是( )
A.两种配位原子的杂化方式相同,都提供孤电子对形成配位键
B.配位体分子的键角:A>B
C.向溶液中滴加氨水,可以实现A到B的转化
D.将A和B加入酸或碱的溶液中,其结构可能被破坏
8.乙二胺与可形成配离子(如图所示),下列有关说法不正确的是( )
A.该配离子的中心离子是,配位数为2
B.该配离子中既有极性键又有非极性键
C.乙二胺分子中H—N—H的键角小于H—C—H的键角
D.乙二胺分子的沸点高于
9.下列化学用语的表达错误的是( )
A.氢硫酸的电离:
B.HCl分子形成的键原子轨道重叠示意图:
C.过程中不能形成发射光谱
D.N,N-二甲基苯甲酰胺的结构简式:
10.氧化石墨烯是一种淡柠檬黄色、不稳定的新型化合物,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )
A.氧化石墨烯的导电性优于石墨烯
B.氧化石墨烯的抗氧化能力比石墨烯弱
C.氧化石墨烯中C-C键的键能比C-O键大
D.氧化石墨烯中所有C原子均为杂化
11.下列各组粒子中所有原子都可能处于同一平面的是( )
A.、、 B.、、
C.、、 D.、、
12.下列反应的离子方程式正确的是( )
A.向AgCl悬浊液中滴加氨水:
B.向溶液加入过量的NaOH溶液:
C.向硫代硫酸钠溶液中滴入稀硫酸:
D.KClO碱性溶液与反应:
13.下列操作中,最终反应生成的物质不是配合物的是( )
A.往溶液中加入足量的NaOH溶液
B.往少量硫酸铜溶液中滴入足量的氨水
C.AgCl溶解在氨水中
D.往溶液中加入足量的NaOH溶液
14.“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的( )
A.第二周期元素氢化物的稳定性顺序是:;则第三周期元素氢化物的稳定性顺序也是:
B.IVA族元素氢化物沸点顺序是:;则VA族元素氢化物沸点顺序也是:
C.二甲苯的沸点顺序是:邻二甲苯>间二甲苯>对二甲苯;则羟基苯甲醛的沸点顺序也是:邻羟基苯甲醛>对羟基苯甲醛
D.根据“相似相溶”,乙醇能与水以任意比互溶,则戊醇也能与水以任意比互溶
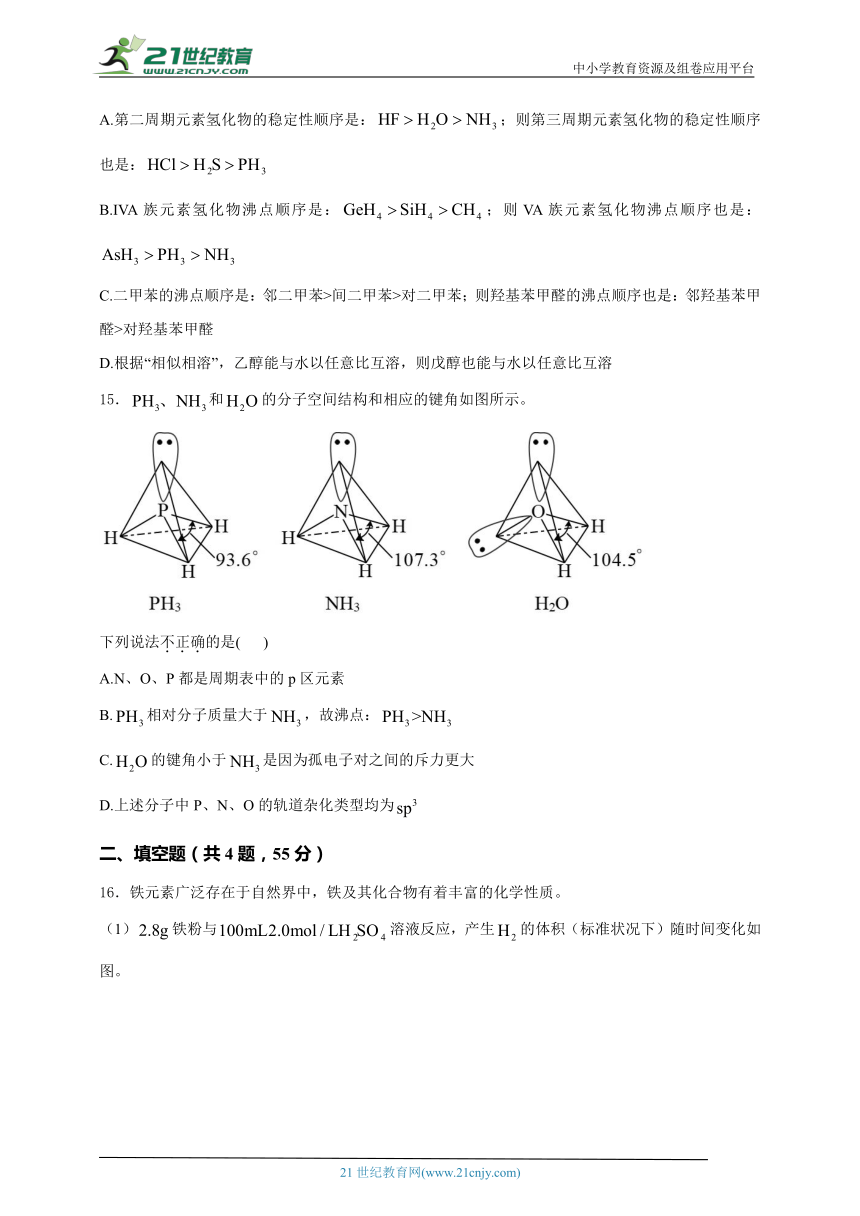
15.和的分子空间结构和相应的键角如图所示。
下列说法不正确的是( )
A.N、O、P都是周期表中的p区元素
B.相对分子质量大于,故沸点:
C.的键角小于是因为孤电子对之间的斥力更大
D.上述分子中P、N、O的轨道杂化类型均为
二、填空题(共4题,55分)
16.铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1)铁粉与溶液反应,产生的体积(标准状况下)随时间变化如图。
①反应平均速率________;
②a、b、c三点反应速率从大到小顺序是:________。
(2)常温下,溶液与溶液反应生成血红色配合物,反应方程式可表示为,下列说法正确的是_______。(填标号)
A.增大溶液的浓度,平衡常数增大
B.向上述平衡体系中加入适量固体,平衡不移动
C.加水稀释,平衡向左移动,且溶液的红色变浅
D.加入少量铁粉,减小
(3)反应在加入催化后,反应进程中的能量变化如下图所示。已知反应机理中有出现。
①写出速控步的热化学方程式:________;
②反应过程中由于浓度较低而不容易被检测到,请回答浓度较低的原因:________。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为。溶液中与邻二氮菲(X,一种双齿配体,其结构见下图)会生成橘黄色的配合物Y,反应为:;取的溶液,加入不同体积浓度均为的X溶液,充分反应后加水定容至,得到系列溶液,测其吸光度,结果如下表:
A
根据此数据,可以推断反应计量数n,并计算k值,且可利用分光光度法测定未知溶液中的浓度。
1.A1.A为吸光度,无单位;k为常数,单位为;c为有色物质的物质的量浓度,单位为(和X吸光度近似为0)。
2.邻二氮菲的结构如图所示:
回答以下问题:
①使用该方法时,需要控制在2~9之间,其原因为:________。
②Y中的配位数为________。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下k值为________。
17.根据要求,回答下列问题。
(1)分子中σ键与π键的个数比为________,其中处于同一平面的碳原子最多有________个。
(2)具有相同化学式的有机物和,沸点较高的是________(填名称),原因是________。
(3)乙醛与银氨溶液反应的化学方程式为________。
(4)有机化合物M常用于食品行业。已知9.0gM在足量中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为。
①M分子的质谱图如图所示,则M的分子式为________。
②经红外光谱测定,M分子中含有羧基。M分子的核磁共振氢谱有4组吸收峰,且峰面积之比是1:1:1:3。M的结构简式为________。
18.铜及其化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)原子核外电子发生跃迁时会吸收或释放不同的光,可以用_______摄取铜元素的原子光谱;基态Cu原子核外电子的空间运动状态有_______种。
(2)可用于防止合成氨反应的催化剂中毒。该化合物中元素的第一电离能最大的是_______,碳原子的杂化轨道类型有_______。除去CO的反应为,该反应中新形成的化学键有________(填标号)。
A.键 B.配位键 C.非极性键 D.σ键
(3)向溶液中通入足量可生成配合物。与互为等电子体的一种分子为________(填化学式);与的空间构型都是三角锥形,但不易与形成配离子的原因是_______。
(4)氧化亚铜可用于陶瓷、固体整流器,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(,,)。则D原子的坐标参数为_______,它代表_______原子。
②若晶胞参数为anm,阿伏加德罗常数的值为,晶体密度ρ为_______。
三、实验题
19.废旧锂电池正极材料(含及少量Al、Fe等)为原料制备溶液,再以溶液、NaOH溶液、氨水和水合肼为原料制得微米级。
已知:
①易与形成配合物;
②水合肼为无色油状液体,具有强还原性,氧化产物为;
③沉淀的生成速率越快,颗粒越小,呈凝乳状胶体,不易过滤。
(1)写出钴基态原子的价层电子排布式_________。
(2)制备溶液。
取一定量废旧锂电池正极材料,粉碎后与溶液混合配成悬浊液,边搅拌边加入1mol/L溶液充分反应。转化为的化学方程式为_________。从分液漏斗中滴入1mol/L时,滴加速率不能太快且需要快速搅拌的原因是_________。
(3)制备微米级
60℃时在搅拌下向500mL1mol/L溶液中加入氨水,调节pH至6后,再加入NaOH溶液,调节pH至9.5左右,一段时间后,过滤、洗涤,真空烘干得微米级。制备时,在加入NaOH溶液前必须先加氨水的原因是_________。
(4)经仪器分析,测得按题(3)步骤制得的晶体结构中含有Co(Ⅲ),进一步用碘量法测得Co(Ⅱ)的氧化程度为8%。因此制备时必须加入一定量的还原剂。为确保制得的产品中不含Co(Ⅲ),制备时至少需加入水合肼的质量为_________g。(写出计算过程)
(5)利用含钴废料(主要成分为,还含有少量的石墨、等杂质)制备碳酸钴。
已知:①几乎不溶于水,微溶于水;
②钴、锂在有机磷萃取剂(HR)中的萃取率与pH的关系如图所示;
③酸性条件下的氧化性强弱顺序为:。
请补充完整实验方案:取一定量含钴废料,粉碎后_________,充分反应后,静置后过滤,洗涤、干燥得到。【实验中必须使用的试剂:2mol/L溶液、2mol/LNaOH溶液、有机磷(HR)、0.5mol/L溶液、30%溶液。】
参考答案
1.答案:A
解析:A.天然金刚石形成于地幔,A错误;
B.液晶介于液态和晶态之间的有机化合物,既具有液体的流动性,又具有晶体的光学性质,可用于制造显示器和高强度纤维,B正确;
C.细胞内外均有大量的水,根据相似相溶原理,磷脂分子的亲水性部分会分布于细胞膜的两侧,疏水部分会集中于磷脂双层的内侧,细胞双分子膜的两边都亲水,C正确;
D.含有手性碳的分子具有光学活性,生物机体可以产生具有光学活性的分子,D正确;
故选A。
2.答案:B
解析:过程①中B与O形成配位键,O提供孤电子对,B提供空轨道,A正确;、、中B为杂化,、中B为杂化,B错误;过程①、过程④只有化学键的形成,可看成吸附过程,过程②、过程⑤为加成反应,过程③为消去反应,过程⑥为取代反应,故还原过程中一共涉及三种反应类型,C正确;该反应中硼烷作用于碳氧双键,根据该反应机理,可推测硼烷还可将酯基还原为,D正确。
3.答案:A
解析:①柠檬酸中没有手性碳原子;
②2—羟基丙腈中与醇羟基直接相连的碳原子为手性碳原子;
③乳酸中与醇羟基直接相连的碳原子为手性碳原子;
④甘氨酸中没有手性碳原子;
不含有手性碳的是①和④,答案选A。
4.答案:B
解析:A.1molZ中含有5mol酚羟基、1mol羧基、1mol酚酯基,1mol酚酯基可消耗2molNaOH,故1molZ最多能与8molNaOH发生反应,故A正确;
B.由结构简式可知,X分子中含有酚羟基,酚羟基的邻、对位能与溴水发生取代反应,则1molX最多能与2mol溴发生取代反应,故B错误;
C.由结构简式可知,Y分子中含有如图*所示的3个手性碳原子:,故C正确;
D.由结构简式可知,Y分子中含有的碳碳双键能发生加成反应、氧化反应,含有的羟基满足发生消去反应的条件,能发生消去反应、氧化反应、取代反应,含有的羟基和羧基一定条件下能发生取代反应和缩聚反应,故D正确;
故选B。
5.答案:B
解析:①中甲基碳原子为杂化,羧基碳原子为杂化,有两种杂化方式,①正确;
②某元素离子的核外电子排布式为,则该元素的原子核外价电子排布式为,为铬元素,位于周期表第四周期第VIB族,属于d区元素,②正确;
③非极性分子往往具有高度对称性,如、等,但属于极性分子,③错误;
④第四周期处于主族的金属元素从左到右金属性依次减弱,但过渡元素比较复杂,如锌在铜的右侧,但金属性比铜强,④错误;
⑤乳酸()分子中含有一个手性碳原子,与羟基、羧基、甲基相连的碳原子是手性碳原子,⑤正确;
⑥HF晶体沸点高于HCl,是因为HF分子间存在氢键,⑥错误;
⑦价层电子对数为,空间构型为平面三角形,属于非极性分子,但能与水反应生成硫酸,因此三氧化硫在水中溶解度较大,⑦错误;
③④⑥⑦错误,答案选B。
6.答案:A
解析:A.中心Cl原子孤电子对数=、价层电子对数=4+0=4,模型为正四面体、空间构型为正四面体形,A符合题意;
B.中心S原子孤电子对数=、价层电子对数=3+1=4,模型为四面体、空间构型为三角锥形,B不符合题意;
C.中心N原子价层电子对数为2+=3,有一对孤电子对,模型为平面三角形,空间构型为V形,C不符合题意;
D.中心Cl原子的价层电子对数为,有一对孤电子对,模型为四面体形,空间结构为三角锥形,D不符合题意;
故选A。
7.答案:C
解析:根据A、B的结构图可知,A为和形成的配离子,B为和形成的配离子,两种配位原子N原子和O原子的价电子对数都是4,所以配位原子都采取杂化,配位原子提供孤电子对,提供空轨道形成配位键,A正确;A的配位体是,B的配位体是,分子中含有1对孤电子对,分子中含有2对孤电子对,孤电子对数目越多,对成键电子对的排斥作用越大,故A中配位体分子的键角大于B中配位体分子的键角,B正确;向溶液中滴加过量氨水,生成,可以实现B到A的转化,C错误;加入酸,酸会和配位体结合,加入碱,碱会和中心原子结合,所以A和B加入酸或碱的溶液中,其结构都可能被破坏,D正确。
8.答案:A
解析:根据结构知中心离子为,与4个N原子形成配位键,配位数为4,A错误;C—N键、C—H键、H—N键为极性键,C—C键为非极性键,B正确;乙二胺分子中N有一对孤电子对,C没有孤电子对,孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,因此乙二胺分子中H—N—H的键角小于H—C—H的键角,C正确;乙二胺分子间存在氢键,分子间不存在氢键,因此乙二胺的沸点高于,D正确。
9.答案:A
解析:A.属于二元弱酸,应该分步电离:,,A错误,A符合题意;
B.HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道“头碰头”重叠而成键,B正确,B不符合题意;
C.与两个原子轨道能层均为L层,能级均为2p亚层,原子轨道的能量一样只不过空间伸展方向不同,过程中不存在电子由较高能级跃回到较低能级释放能量的可能,故不能形成发射光谱,C正确,C不符合题意;
D.N,N-二甲基苯甲酰胺的结构简式正确,D正确,D不符合题意;
选A。
10.答案:B
解析:A.石墨烯变为氧化石墨烯,大π键遭到破坏,故导电性减弱,A项错误;
B.氧化石墨烯中含有碳碳双键和羟基,易被氧化,故抗氧化能力比石墨烯弱,B项正确;
C.氧化石墨烯中C-C键和C-O键均为共价键,C-C键的键长比C-O键长,故C-C键的键能比C-O键小,C项错误;
D.氧化石墨烯中,C原子的杂化方式为和,D项错误;
答案选B。
11.答案:C
解析:A.是正四面体形,所有原子不可能处于同一平面,A错误;
B.是三角锥形,所有原子不可能处于同一平面,B错误;
C.为平面形,、均为平面三角形,所有原子都处于同一平面,C正确;
D.是正四面体形,是三角锥形,所有原子不可能处于同一平面,D错误;
故选C。
12.答案:C
解析:A.向AgCl悬浊液中滴加氨水,沉淀溶解,离子方程式为,故A错误;
B.向溶液加入过量的NaOH溶液,按物质的量之比为1:2反应,离子方程式为,故B错误;
C.向硫代硫酸钠溶液中加入稀硫酸,硫代硫酸根和氢离子发生歧化反应生成硫单质和二氧化硫,离子方程式为:,故C正确;
D.碱性溶液与反应不能生成氢离子,正确的离子反应为:,故D错误;
答案选C。
13.答案:A
解析:A.往溶液中加入足量的NaOH溶液,最终生成沉淀,不是配合物,故A符合题意;
B.往少量硫酸铜溶液中滴入足量的氨水,最终无沉淀,生成,是配合物,B不符合题意;
C.AgCl溶解在氨水中最终生成,是配合物,C不符合题意;
D.往溶液中加入足量的NaOH溶液,生成,是配合物,D不符合题意;
故选A。
14.答案:A
解析:A.非金属性Cl>S>P,非金属性越强氢化物越稳定,故稳定性是:,故A正确;
B.N元素的电负性很强,氨气分子中存在氢键,同族氢化物中氨气的沸点最高,结构相似相对分子质量越大氢化物沸点越高,故沸点是:,故B错误;
C.邻羟基苯甲醛形成分子内氢键,使沸点降低,对羟基苯甲醛形成分子间氢键,使沸点升高,故沸点是:对羟基苯甲醛>邻羟基苯甲醛,故C错误;
D.乙醇分子与水分子之间形成氢键,乙醇与水以任意比例混溶,戊醇中烷基对整个分子的影响很大,不能形成氢键,不能与水以任意比互溶,可部分地溶于水,故D错误;故答案为A。
15.答案:B
解析:A.第ⅢA族到第ⅦA族、0族均为p区元素,N和P是第ⅤA族元素,O是第ⅥA族元素,因此N、O、P都是周期表中的p区元素,A正确;
B.氢键强于范德华力,分子间存在氢键,沸点比高,B错误;
C.孤电子对的斥力大于成键电子对,和的价层电子对互斥模型均为四面体形,分子中O的孤电子对数为2,分子中N的孤电子对数为1,因此的键角小于,即的键角小于是因为孤电子对之间的斥力更大,C正确;
D.由图可知和的层电子对互斥模型均为四面体形,因此P、N、O的轨道杂化类型均为,D正确;
答案选B。
16.答案:(1);
(2)BC
(3);第一步基元反应活化能较高为慢反应,第二步基元反应活化能较小为快反应。第一步反应产生的很快被第二步反应消耗,故浓度较小
(4),浓度较大,邻二氮菲中的N会与结合(形成配位键),导致其与配位能力减弱;,浓度较大,与反应,影响与邻二氮菲配位;C;
解析:(1)①反应平均速率;
②结合纵坐标生成氢气的体积以及曲线的斜率,a、b、c三点反应速率从大到小顺序是。
(2)A.温度不变,平衡常数不变,故增大KSCN溶液的浓度,平衡常数不变,A错误;
B.钾离子、氯离子不参与反应,向上述平衡体系中加入适量固体,平衡不移动,B正确;
C.加水稀释,离子总浓度减小,平衡向离子浓度增大方向移动,故向左移动,且溶液的红色变浅,C正确
D.加入少量铁粉,铁离子和铁粉反应生成亚铁离子,浓度减小,平衡逆向移动,增大,增大,D错误;
故选BC。
(4)由表格数据可知,加入6.00mLX溶液后,吸光度A的不变化,说明溶液中亚铁离子与X溶液完全反应,则n值为=3,则Y的化学式为,由X的结构简式可知,Y中具有空轨道的亚铁离子与6个具有孤对电子的氮原子形成配位键,亚铁离子的配位数为6;由方程式可知,25mLY溶液的浓度为=mol/L,由溶液的稳定吸光度A为0.72可知,常数k==。
①使用该方法时,需要控制在2~9之间,其原因为:,浓度较大,邻二氮菲中的N会与结合(形成配位键),导致其与配位能力减弱;,浓度较大,与反应,影响与邻二氮菲配位。
②由分析可知,Y中亚铁离子的配位数为6,故选C。
③由分析可知,该实验条件下,常数k=1.5×104。
17.答案:(1)15:2;5
(2)对羟基苯甲醛;对羟基苯甲醛分子间形成氢键,而邻羟基苯甲醛形成的是分子内氢键
(3)
(4);
解析:
18.答案:(1)光谱仪;15
(2)N;;BD
(3)(或等);F的电负性大于N,N-F成键电子对偏向F,导致中的N原子核外电子云密度降低,难以形成配位键,故不易与形成配离子
(4)(,,);Cu;
解析:(1)原子核外电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取铜元素的原子光谱;
基态Cu原子核外电子,空间运动状态即为已填入电子的轨道,有1+1+3+1+3+5+1=15;
(2)氮原子2p轨道半充满,比较稳定,较难失去一个电子,第一电离能最大的是N;
其中甲基中的碳原子形成了4个σ键,为杂化,另外一个碳原子形成3个σ键,为杂化;
新形成的键是和,CO和形成的配位键,是σ键,答案为BD;
(3)硫酸根离子有50个电子,5个原子,与互为等电子体的一种分子可以为或;
由于中的氮原子带负电性,易与结合,中的氮原子带正电性,与铜离子相互排斥,因此难以结合;
(4)①把大正方体分成8个小正方体,D在左下角靠前的小正方体的体心,所以D的坐标是(,,);
一个晶胞中D位于正方体内部,有4个,C占据体心和顶点,均摊法计算后有2个,对应化学式为,故D代表铜原子;
②晶体密度
19.答案:(1)
(2);使硫酸与悬浊液充分接触反应,防止局部酸性过强产生二氧化硫逸出(或提高钴的还原率)
(3)形成配离子,降低溶液中的浓度,使与形成的速率降低,从而得到较大颗粒的,防止形成凝乳状沉淀或胶体,便于过滤分离提纯
(4)0.5
(5)向其中加入2mol/L稀硫酸和10%溶液,充分反应后过滤,向溶液中加入有机磷(HR),用2mol/LNaOH溶液调节pH为5.4左右(5.2-5.8之间),(充分振荡后静置)分液,向有机层中滴加2mol/L溶液,调节pH约为2,分液,边搅拌边向水层中滴加0.5mol/L溶液
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
高中化学苏教版选择性必修2考前专题特训卷 分子空间结构与物质性质
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.生活处处都伴随有化学,以下有关说法不正确的是( )
A.天然金刚石形成于地壳中
B.液晶介于液态和晶态之间,可用于制造显示器
C.细胞双分子膜的两边都亲水
D.生物机体可以产生具有光学活性的分子
2.利用硼烷独特温和的化学选择性可还原羧酸,其机理如下:
下列说法错误的是( )
A.过程①的进行与硼原子的缺电子有关
B.整个过程中硼的杂化方式不发生改变
C.还原过程中一共涉及三种反应类型
D.根据上述机理猜测硼烷还可还原酯基
3.碳原子连有4个不同的原子或原子团时,该碳原子称为手性碳。下列有机物中不含有手性碳的是( )
A.①和④ B.②和③ C.①和③ D.②和④
4.某种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
下列说法错误的是( )
A.1molZ最多能与8molNaOH发生反应
B.1molX最多能与3mol发生取代反应
C.Y分子结构中有3个手性碳原子
D.Y能发生加成、取代、消去、氧化、缩聚反应
5.下列关于物质结构的叙述中,错误的个数为( )
①中碳原子的杂化类型有和两种
②某元素离子的核外电子排布式为,它位于周期表第四周期VIB族,属于d区元素
③非极性分子往往具有高度对称性,如、、这样的分子
④第四周期的金属元素从左往右,元素的金属性依次减弱
⑤乳酸()分子中含有一个手性碳原子
⑥HF晶体沸点高于HCl,是因为HCl共价键键能小于HF
⑦是平面三角形的非极性分子,故在水中的溶解度很小
A.3 B.4 C.5 D.6
6.下列离子的模型与其空间结构一致的是( )
A. B. C. D.
7.可以和两种常见的分子形成A和B两种微粒,A和B的结构如图所示。下列说法不正确的是( )
A.两种配位原子的杂化方式相同,都提供孤电子对形成配位键
B.配位体分子的键角:A>B
C.向溶液中滴加氨水,可以实现A到B的转化
D.将A和B加入酸或碱的溶液中,其结构可能被破坏
8.乙二胺与可形成配离子(如图所示),下列有关说法不正确的是( )
A.该配离子的中心离子是,配位数为2
B.该配离子中既有极性键又有非极性键
C.乙二胺分子中H—N—H的键角小于H—C—H的键角
D.乙二胺分子的沸点高于
9.下列化学用语的表达错误的是( )
A.氢硫酸的电离:
B.HCl分子形成的键原子轨道重叠示意图:
C.过程中不能形成发射光谱
D.N,N-二甲基苯甲酰胺的结构简式:
10.氧化石墨烯是一种淡柠檬黄色、不稳定的新型化合物,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )
A.氧化石墨烯的导电性优于石墨烯
B.氧化石墨烯的抗氧化能力比石墨烯弱
C.氧化石墨烯中C-C键的键能比C-O键大
D.氧化石墨烯中所有C原子均为杂化
11.下列各组粒子中所有原子都可能处于同一平面的是( )
A.、、 B.、、
C.、、 D.、、
12.下列反应的离子方程式正确的是( )
A.向AgCl悬浊液中滴加氨水:
B.向溶液加入过量的NaOH溶液:
C.向硫代硫酸钠溶液中滴入稀硫酸:
D.KClO碱性溶液与反应:
13.下列操作中,最终反应生成的物质不是配合物的是( )
A.往溶液中加入足量的NaOH溶液
B.往少量硫酸铜溶液中滴入足量的氨水
C.AgCl溶解在氨水中
D.往溶液中加入足量的NaOH溶液
14.“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的( )
A.第二周期元素氢化物的稳定性顺序是:;则第三周期元素氢化物的稳定性顺序也是:
B.IVA族元素氢化物沸点顺序是:;则VA族元素氢化物沸点顺序也是:
C.二甲苯的沸点顺序是:邻二甲苯>间二甲苯>对二甲苯;则羟基苯甲醛的沸点顺序也是:邻羟基苯甲醛>对羟基苯甲醛
D.根据“相似相溶”,乙醇能与水以任意比互溶,则戊醇也能与水以任意比互溶
15.和的分子空间结构和相应的键角如图所示。
下列说法不正确的是( )
A.N、O、P都是周期表中的p区元素
B.相对分子质量大于,故沸点:
C.的键角小于是因为孤电子对之间的斥力更大
D.上述分子中P、N、O的轨道杂化类型均为
二、填空题(共4题,55分)
16.铁元素广泛存在于自然界中,铁及其化合物有着丰富的化学性质。
(1)铁粉与溶液反应,产生的体积(标准状况下)随时间变化如图。
①反应平均速率________;
②a、b、c三点反应速率从大到小顺序是:________。
(2)常温下,溶液与溶液反应生成血红色配合物,反应方程式可表示为,下列说法正确的是_______。(填标号)
A.增大溶液的浓度,平衡常数增大
B.向上述平衡体系中加入适量固体,平衡不移动
C.加水稀释,平衡向左移动,且溶液的红色变浅
D.加入少量铁粉,减小
(3)反应在加入催化后,反应进程中的能量变化如下图所示。已知反应机理中有出现。
①写出速控步的热化学方程式:________;
②反应过程中由于浓度较低而不容易被检测到,请回答浓度较低的原因:________。
(4)某些有色物质会吸收特定波长的光,吸光度与有色物质的浓度呈正比,这是分光光度法的基本原理,用公式表示为。溶液中与邻二氮菲(X,一种双齿配体,其结构见下图)会生成橘黄色的配合物Y,反应为:;取的溶液,加入不同体积浓度均为的X溶液,充分反应后加水定容至,得到系列溶液,测其吸光度,结果如下表:
A
根据此数据,可以推断反应计量数n,并计算k值,且可利用分光光度法测定未知溶液中的浓度。
1.A1.A为吸光度,无单位;k为常数,单位为;c为有色物质的物质的量浓度,单位为(和X吸光度近似为0)。
2.邻二氮菲的结构如图所示:
回答以下问题:
①使用该方法时,需要控制在2~9之间,其原因为:________。
②Y中的配位数为________。(填标号)
A.2 B.3 C.6 D.8
③该实验条件下k值为________。
17.根据要求,回答下列问题。
(1)分子中σ键与π键的个数比为________,其中处于同一平面的碳原子最多有________个。
(2)具有相同化学式的有机物和,沸点较高的是________(填名称),原因是________。
(3)乙醛与银氨溶液反应的化学方程式为________。
(4)有机化合物M常用于食品行业。已知9.0gM在足量中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为。
①M分子的质谱图如图所示,则M的分子式为________。
②经红外光谱测定,M分子中含有羧基。M分子的核磁共振氢谱有4组吸收峰,且峰面积之比是1:1:1:3。M的结构简式为________。
18.铜及其化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)原子核外电子发生跃迁时会吸收或释放不同的光,可以用_______摄取铜元素的原子光谱;基态Cu原子核外电子的空间运动状态有_______种。
(2)可用于防止合成氨反应的催化剂中毒。该化合物中元素的第一电离能最大的是_______,碳原子的杂化轨道类型有_______。除去CO的反应为,该反应中新形成的化学键有________(填标号)。
A.键 B.配位键 C.非极性键 D.σ键
(3)向溶液中通入足量可生成配合物。与互为等电子体的一种分子为________(填化学式);与的空间构型都是三角锥形,但不易与形成配离子的原因是_______。
(4)氧化亚铜可用于陶瓷、固体整流器,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(,,)。则D原子的坐标参数为_______,它代表_______原子。
②若晶胞参数为anm,阿伏加德罗常数的值为,晶体密度ρ为_______。
三、实验题
19.废旧锂电池正极材料(含及少量Al、Fe等)为原料制备溶液,再以溶液、NaOH溶液、氨水和水合肼为原料制得微米级。
已知:
①易与形成配合物;
②水合肼为无色油状液体,具有强还原性,氧化产物为;
③沉淀的生成速率越快,颗粒越小,呈凝乳状胶体,不易过滤。
(1)写出钴基态原子的价层电子排布式_________。
(2)制备溶液。
取一定量废旧锂电池正极材料,粉碎后与溶液混合配成悬浊液,边搅拌边加入1mol/L溶液充分反应。转化为的化学方程式为_________。从分液漏斗中滴入1mol/L时,滴加速率不能太快且需要快速搅拌的原因是_________。
(3)制备微米级
60℃时在搅拌下向500mL1mol/L溶液中加入氨水,调节pH至6后,再加入NaOH溶液,调节pH至9.5左右,一段时间后,过滤、洗涤,真空烘干得微米级。制备时,在加入NaOH溶液前必须先加氨水的原因是_________。
(4)经仪器分析,测得按题(3)步骤制得的晶体结构中含有Co(Ⅲ),进一步用碘量法测得Co(Ⅱ)的氧化程度为8%。因此制备时必须加入一定量的还原剂。为确保制得的产品中不含Co(Ⅲ),制备时至少需加入水合肼的质量为_________g。(写出计算过程)
(5)利用含钴废料(主要成分为,还含有少量的石墨、等杂质)制备碳酸钴。
已知:①几乎不溶于水,微溶于水;
②钴、锂在有机磷萃取剂(HR)中的萃取率与pH的关系如图所示;
③酸性条件下的氧化性强弱顺序为:。
请补充完整实验方案:取一定量含钴废料,粉碎后_________,充分反应后,静置后过滤,洗涤、干燥得到。【实验中必须使用的试剂:2mol/L溶液、2mol/LNaOH溶液、有机磷(HR)、0.5mol/L溶液、30%溶液。】
参考答案
1.答案:A
解析:A.天然金刚石形成于地幔,A错误;
B.液晶介于液态和晶态之间的有机化合物,既具有液体的流动性,又具有晶体的光学性质,可用于制造显示器和高强度纤维,B正确;
C.细胞内外均有大量的水,根据相似相溶原理,磷脂分子的亲水性部分会分布于细胞膜的两侧,疏水部分会集中于磷脂双层的内侧,细胞双分子膜的两边都亲水,C正确;
D.含有手性碳的分子具有光学活性,生物机体可以产生具有光学活性的分子,D正确;
故选A。
2.答案:B
解析:过程①中B与O形成配位键,O提供孤电子对,B提供空轨道,A正确;、、中B为杂化,、中B为杂化,B错误;过程①、过程④只有化学键的形成,可看成吸附过程,过程②、过程⑤为加成反应,过程③为消去反应,过程⑥为取代反应,故还原过程中一共涉及三种反应类型,C正确;该反应中硼烷作用于碳氧双键,根据该反应机理,可推测硼烷还可将酯基还原为,D正确。
3.答案:A
解析:①柠檬酸中没有手性碳原子;
②2—羟基丙腈中与醇羟基直接相连的碳原子为手性碳原子;
③乳酸中与醇羟基直接相连的碳原子为手性碳原子;
④甘氨酸中没有手性碳原子;
不含有手性碳的是①和④,答案选A。
4.答案:B
解析:A.1molZ中含有5mol酚羟基、1mol羧基、1mol酚酯基,1mol酚酯基可消耗2molNaOH,故1molZ最多能与8molNaOH发生反应,故A正确;
B.由结构简式可知,X分子中含有酚羟基,酚羟基的邻、对位能与溴水发生取代反应,则1molX最多能与2mol溴发生取代反应,故B错误;
C.由结构简式可知,Y分子中含有如图*所示的3个手性碳原子:,故C正确;
D.由结构简式可知,Y分子中含有的碳碳双键能发生加成反应、氧化反应,含有的羟基满足发生消去反应的条件,能发生消去反应、氧化反应、取代反应,含有的羟基和羧基一定条件下能发生取代反应和缩聚反应,故D正确;
故选B。
5.答案:B
解析:①中甲基碳原子为杂化,羧基碳原子为杂化,有两种杂化方式,①正确;
②某元素离子的核外电子排布式为,则该元素的原子核外价电子排布式为,为铬元素,位于周期表第四周期第VIB族,属于d区元素,②正确;
③非极性分子往往具有高度对称性,如、等,但属于极性分子,③错误;
④第四周期处于主族的金属元素从左到右金属性依次减弱,但过渡元素比较复杂,如锌在铜的右侧,但金属性比铜强,④错误;
⑤乳酸()分子中含有一个手性碳原子,与羟基、羧基、甲基相连的碳原子是手性碳原子,⑤正确;
⑥HF晶体沸点高于HCl,是因为HF分子间存在氢键,⑥错误;
⑦价层电子对数为,空间构型为平面三角形,属于非极性分子,但能与水反应生成硫酸,因此三氧化硫在水中溶解度较大,⑦错误;
③④⑥⑦错误,答案选B。
6.答案:A
解析:A.中心Cl原子孤电子对数=、价层电子对数=4+0=4,模型为正四面体、空间构型为正四面体形,A符合题意;
B.中心S原子孤电子对数=、价层电子对数=3+1=4,模型为四面体、空间构型为三角锥形,B不符合题意;
C.中心N原子价层电子对数为2+=3,有一对孤电子对,模型为平面三角形,空间构型为V形,C不符合题意;
D.中心Cl原子的价层电子对数为,有一对孤电子对,模型为四面体形,空间结构为三角锥形,D不符合题意;
故选A。
7.答案:C
解析:根据A、B的结构图可知,A为和形成的配离子,B为和形成的配离子,两种配位原子N原子和O原子的价电子对数都是4,所以配位原子都采取杂化,配位原子提供孤电子对,提供空轨道形成配位键,A正确;A的配位体是,B的配位体是,分子中含有1对孤电子对,分子中含有2对孤电子对,孤电子对数目越多,对成键电子对的排斥作用越大,故A中配位体分子的键角大于B中配位体分子的键角,B正确;向溶液中滴加过量氨水,生成,可以实现B到A的转化,C错误;加入酸,酸会和配位体结合,加入碱,碱会和中心原子结合,所以A和B加入酸或碱的溶液中,其结构都可能被破坏,D正确。
8.答案:A
解析:根据结构知中心离子为,与4个N原子形成配位键,配位数为4,A错误;C—N键、C—H键、H—N键为极性键,C—C键为非极性键,B正确;乙二胺分子中N有一对孤电子对,C没有孤电子对,孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力,因此乙二胺分子中H—N—H的键角小于H—C—H的键角,C正确;乙二胺分子间存在氢键,分子间不存在氢键,因此乙二胺的沸点高于,D正确。
9.答案:A
解析:A.属于二元弱酸,应该分步电离:,,A错误,A符合题意;
B.HCl中的共价键是由氢原子提供的未成对电子的1s原子轨道和氯原子提供的未成对电子的3p原子轨道“头碰头”重叠而成键,B正确,B不符合题意;
C.与两个原子轨道能层均为L层,能级均为2p亚层,原子轨道的能量一样只不过空间伸展方向不同,过程中不存在电子由较高能级跃回到较低能级释放能量的可能,故不能形成发射光谱,C正确,C不符合题意;
D.N,N-二甲基苯甲酰胺的结构简式正确,D正确,D不符合题意;
选A。
10.答案:B
解析:A.石墨烯变为氧化石墨烯,大π键遭到破坏,故导电性减弱,A项错误;
B.氧化石墨烯中含有碳碳双键和羟基,易被氧化,故抗氧化能力比石墨烯弱,B项正确;
C.氧化石墨烯中C-C键和C-O键均为共价键,C-C键的键长比C-O键长,故C-C键的键能比C-O键小,C项错误;
D.氧化石墨烯中,C原子的杂化方式为和,D项错误;
答案选B。
11.答案:C
解析:A.是正四面体形,所有原子不可能处于同一平面,A错误;
B.是三角锥形,所有原子不可能处于同一平面,B错误;
C.为平面形,、均为平面三角形,所有原子都处于同一平面,C正确;
D.是正四面体形,是三角锥形,所有原子不可能处于同一平面,D错误;
故选C。
12.答案:C
解析:A.向AgCl悬浊液中滴加氨水,沉淀溶解,离子方程式为,故A错误;
B.向溶液加入过量的NaOH溶液,按物质的量之比为1:2反应,离子方程式为,故B错误;
C.向硫代硫酸钠溶液中加入稀硫酸,硫代硫酸根和氢离子发生歧化反应生成硫单质和二氧化硫,离子方程式为:,故C正确;
D.碱性溶液与反应不能生成氢离子,正确的离子反应为:,故D错误;
答案选C。
13.答案:A
解析:A.往溶液中加入足量的NaOH溶液,最终生成沉淀,不是配合物,故A符合题意;
B.往少量硫酸铜溶液中滴入足量的氨水,最终无沉淀,生成,是配合物,B不符合题意;
C.AgCl溶解在氨水中最终生成,是配合物,C不符合题意;
D.往溶液中加入足量的NaOH溶液,生成,是配合物,D不符合题意;
故选A。
14.答案:A
解析:A.非金属性Cl>S>P,非金属性越强氢化物越稳定,故稳定性是:,故A正确;
B.N元素的电负性很强,氨气分子中存在氢键,同族氢化物中氨气的沸点最高,结构相似相对分子质量越大氢化物沸点越高,故沸点是:,故B错误;
C.邻羟基苯甲醛形成分子内氢键,使沸点降低,对羟基苯甲醛形成分子间氢键,使沸点升高,故沸点是:对羟基苯甲醛>邻羟基苯甲醛,故C错误;
D.乙醇分子与水分子之间形成氢键,乙醇与水以任意比例混溶,戊醇中烷基对整个分子的影响很大,不能形成氢键,不能与水以任意比互溶,可部分地溶于水,故D错误;故答案为A。
15.答案:B
解析:A.第ⅢA族到第ⅦA族、0族均为p区元素,N和P是第ⅤA族元素,O是第ⅥA族元素,因此N、O、P都是周期表中的p区元素,A正确;
B.氢键强于范德华力,分子间存在氢键,沸点比高,B错误;
C.孤电子对的斥力大于成键电子对,和的价层电子对互斥模型均为四面体形,分子中O的孤电子对数为2,分子中N的孤电子对数为1,因此的键角小于,即的键角小于是因为孤电子对之间的斥力更大,C正确;
D.由图可知和的层电子对互斥模型均为四面体形,因此P、N、O的轨道杂化类型均为,D正确;
答案选B。
16.答案:(1);
(2)BC
(3);第一步基元反应活化能较高为慢反应,第二步基元反应活化能较小为快反应。第一步反应产生的很快被第二步反应消耗,故浓度较小
(4),浓度较大,邻二氮菲中的N会与结合(形成配位键),导致其与配位能力减弱;,浓度较大,与反应,影响与邻二氮菲配位;C;
解析:(1)①反应平均速率;
②结合纵坐标生成氢气的体积以及曲线的斜率,a、b、c三点反应速率从大到小顺序是。
(2)A.温度不变,平衡常数不变,故增大KSCN溶液的浓度,平衡常数不变,A错误;
B.钾离子、氯离子不参与反应,向上述平衡体系中加入适量固体,平衡不移动,B正确;
C.加水稀释,离子总浓度减小,平衡向离子浓度增大方向移动,故向左移动,且溶液的红色变浅,C正确
D.加入少量铁粉,铁离子和铁粉反应生成亚铁离子,浓度减小,平衡逆向移动,增大,增大,D错误;
故选BC。
(4)由表格数据可知,加入6.00mLX溶液后,吸光度A的不变化,说明溶液中亚铁离子与X溶液完全反应,则n值为=3,则Y的化学式为,由X的结构简式可知,Y中具有空轨道的亚铁离子与6个具有孤对电子的氮原子形成配位键,亚铁离子的配位数为6;由方程式可知,25mLY溶液的浓度为=mol/L,由溶液的稳定吸光度A为0.72可知,常数k==。
①使用该方法时,需要控制在2~9之间,其原因为:,浓度较大,邻二氮菲中的N会与结合(形成配位键),导致其与配位能力减弱;,浓度较大,与反应,影响与邻二氮菲配位。
②由分析可知,Y中亚铁离子的配位数为6,故选C。
③由分析可知,该实验条件下,常数k=1.5×104。
17.答案:(1)15:2;5
(2)对羟基苯甲醛;对羟基苯甲醛分子间形成氢键,而邻羟基苯甲醛形成的是分子内氢键
(3)
(4);
解析:
18.答案:(1)光谱仪;15
(2)N;;BD
(3)(或等);F的电负性大于N,N-F成键电子对偏向F,导致中的N原子核外电子云密度降低,难以形成配位键,故不易与形成配离子
(4)(,,);Cu;
解析:(1)原子核外电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取铜元素的原子光谱;
基态Cu原子核外电子,空间运动状态即为已填入电子的轨道,有1+1+3+1+3+5+1=15;
(2)氮原子2p轨道半充满,比较稳定,较难失去一个电子,第一电离能最大的是N;
其中甲基中的碳原子形成了4个σ键,为杂化,另外一个碳原子形成3个σ键,为杂化;
新形成的键是和,CO和形成的配位键,是σ键,答案为BD;
(3)硫酸根离子有50个电子,5个原子,与互为等电子体的一种分子可以为或;
由于中的氮原子带负电性,易与结合,中的氮原子带正电性,与铜离子相互排斥,因此难以结合;
(4)①把大正方体分成8个小正方体,D在左下角靠前的小正方体的体心,所以D的坐标是(,,);
一个晶胞中D位于正方体内部,有4个,C占据体心和顶点,均摊法计算后有2个,对应化学式为,故D代表铜原子;
②晶体密度
19.答案:(1)
(2);使硫酸与悬浊液充分接触反应,防止局部酸性过强产生二氧化硫逸出(或提高钴的还原率)
(3)形成配离子,降低溶液中的浓度,使与形成的速率降低,从而得到较大颗粒的,防止形成凝乳状沉淀或胶体,便于过滤分离提纯
(4)0.5
(5)向其中加入2mol/L稀硫酸和10%溶液,充分反应后过滤,向溶液中加入有机磷(HR),用2mol/LNaOH溶液调节pH为5.4左右(5.2-5.8之间),(充分振荡后静置)分液,向有机层中滴加2mol/L溶液,调节pH约为2,分液,边搅拌边向水层中滴加0.5mol/L溶液
解析:
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
