高中化学苏教版选择性必修3考前专题特训卷 有机化学的发展及研究思路(含解析)
文档属性
| 名称 | 高中化学苏教版选择性必修3考前专题特训卷 有机化学的发展及研究思路(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 17:16:43 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
高中化学苏教版选择性必修3考前专题特训卷 有机化学的发展及研究思路
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.下列关于某些社会热点问题的说法中,不正确的是( )
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.甲醇超标的酒不能饮用
C.进入大气的氟氯代烃会破坏高空臭氧层
D.光化学烟雾的产生与人为排放的烃、氨氧化物有关
2.石油是一种重要的能源,我国面临着石油短缺的问题。从可持续发展的角度看,以下解决能源问题的做法不恰当的是( )
A.大量使用木材作燃料 B.用液氢代替汽油
C.开发风能 D.开发地热能
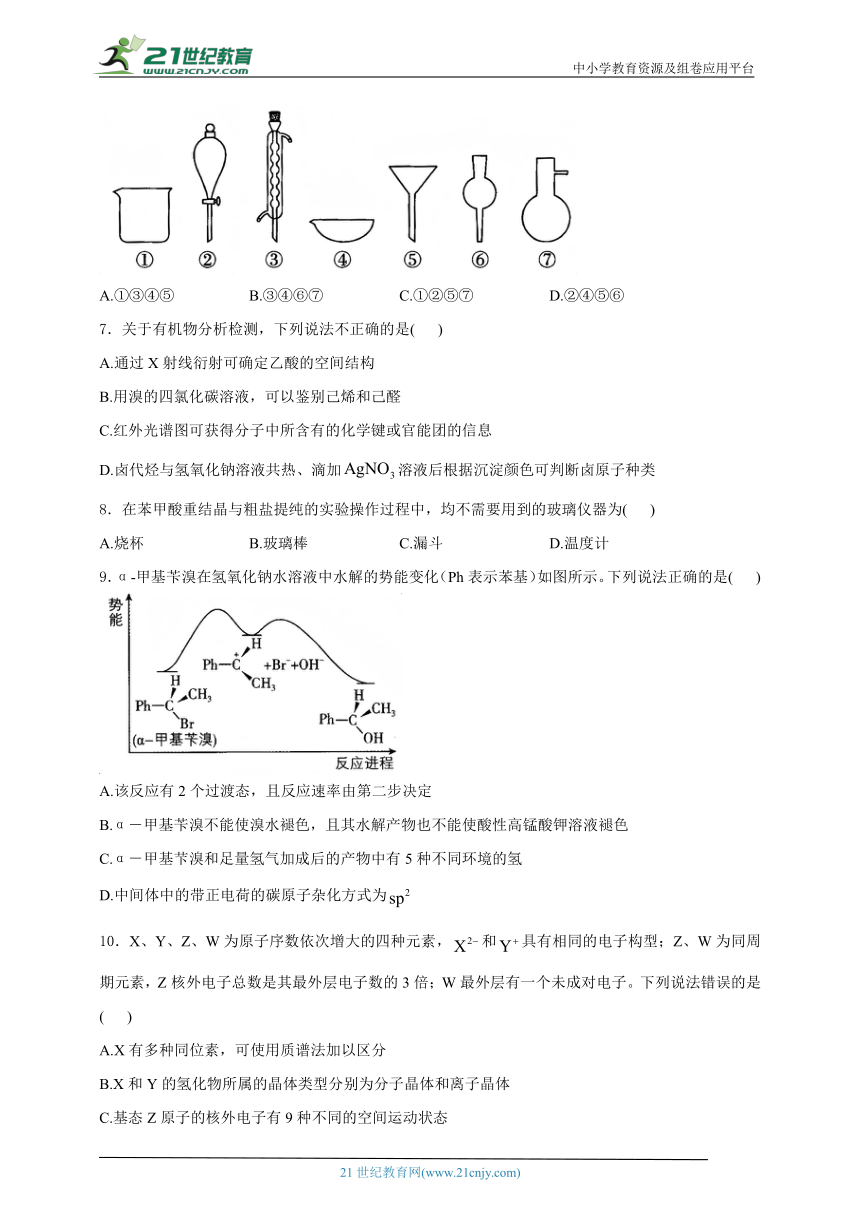
3.已知某有机物A的红外光谱和核磁共振谱如下图所示,下列说法不正确的是( )
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由核磁共振谱无法得知其分子中的氢原子总数
D.若A的化学式为,则其结构简式为
4.1828年,德国化学家维勒在制备无机盐氰酸铵时得到了尿素,第一次通过人工的方法将无机物转变成有机物。下列关于尿素的叙述不正确的是( )
A.氰酸铵属于离子化合物,尿素属于共价化合物
B.尿素是人体新陈代谢的一种产物
C.工业上用氨气和二氧化碳在高温、高压下合成尿素的反应是氧化还原反应
D.尿素与氰酸铵()互为同分异构体
5.下列有关实验方案设计、现象和结论都正确的是( )
实验方案 现象 结论
A 将某烃进行核磁共振氢谱检测 谱图出现两组吸收峰 该烃可能为丙烷
B 将乙醇和浓硫酸共热后生成的气体通入溴水中 溴水褪色 该气体为乙烯
C 向乙醇和酸性重铬酸钾溶液充分反应后的溶液中滴加石蕊 溶液变红 乙醇被氧化为乙酸
D 往废水中滴入氯化铁溶液 出现紫色沉淀 该废水中含有酚类物质
A.A B.B C.C D.D
6.实验室用环己醇和浓磷酸制备环己烯,所得的粗产品可经以下步骤提纯。
下列仪器在环己烯的分离提纯时需要用到的是( )
A.①③④⑤ B.③④⑥⑦ C.①②⑤⑦ D.②④⑤⑥
7.关于有机物分析检测,下列说法不正确的是( )
A.通过X射线衍射可确定乙酸的空间结构
B.用溴的四氯化碳溶液,可以鉴别己烯和己醛
C.红外光谱图可获得分子中所含有的化学键或官能团的信息
D.卤代烃与氢氧化钠溶液共热、滴加溶液后根据沉淀颜色可判断卤原子种类
8.在苯甲酸重结晶与粗盐提纯的实验操作过程中,均不需要用到的玻璃仪器为( )
A.烧杯 B.玻璃棒 C.漏斗 D.温度计
9.α-甲基苄溴在氢氧化钠水溶液中水解的势能变化(Ph表示苯基)如图所示。下列说法正确的是( )
A.该反应有2个过渡态,且反应速率由第二步决定
B.α-甲基苄溴不能使溴水褪色,且其水解产物也不能使酸性高锰酸钾溶液褪色
C.α-甲基芐溴和足量氢气加成后的产物中有5种不同环境的氢
D.中间体中的带正电荷的碳原子杂化方式为
10.X、Y、Z、W为原子序数依次增大的四种元素,和具有相同的电子构型;Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍;W最外层有一个未成对电子。下列说法错误的是( )
A.X有多种同位素,可使用质谱法加以区分
B.X和Y的氢化物所属的晶体类型分别为分子晶体和离子晶体
C.基态Z原子的核外电子有9种不同的空间运动状态
D.工业上可采用电解YW溶液的方式制备单质Y
11.为回收利用含的废液,某小组设计方案如下所示,下列说法不正确的是( )
A.步骤Ⅰ中,加入足量溶液充分反应后,上下两层均为无色
B.步骤Ⅰ中,分液时从分液漏斗下口放出溶液A
C.试剂X可用硫酸
D.粗可用升华法进一步提纯
12.苯甲酸是一种常用的食品防腐剂。某实验小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:
下列说法不正确的是( )
A.操作I中依据苯甲酸的溶解度估算加水量
B.操作Ⅱ趁热过滤的目的是除去泥沙和NaCl
C.操作Ⅲ缓慢冷却结晶可减少杂质被包裹
D.操作Ⅳ可用冷水洗涤晶体
13.科学家应用许多测定分子结构的现代仪器和方法了解分子的结构,下列说法不正确的是( )
A.利用光谱仪获取的特征谱线鉴定元素种类
B.利用红外光谱仪测定共价键的键长和键角
C.利用X射线衍射仪测定晶体中各个原子的位置
D.利用质谱仪测定分子的相对分子质量
14.下列化学用语的表达错误的是( )
A.(一元酸)的结构式:
B.聚苯乙烯的链节:
C.中所有原子都达到8电子稳定结构
D.(碘酸碘)中碘的化合价为+3价、+5价
15.丙醚是无色透明液体,微溶于水,溶于乙醇、乙醚等多数有机溶剂,可用于有机合成的原料和有机溶剂。某实验小组利用下列装置制备少量丙醚,反应的化学方程式为。下列说法正确的是( )
A.该反应可用水浴加热 B.该制备反应为消去反应
C.分水器需预先加水至支管口处 D.得到的粗产品需蒸馏提纯
二、填空题(共4题,55分)
16.按要求填写下列空白:
1.乙烷的实验式:__________。
2.丙烷的结构式:__________。
3.分子中含有30个氢原子的烷烃的分子式:__________,1个分子中含有19个共价键的烷烃的分子式为__________。
4.有机物的结构为分子式为__________,能与溴水发生__________反应。
5.分子中含有四个支链的含碳原子数最少的烷烃的结构简式:__________。
17.噻茶普汀纳是一种具有新型神经化学特征的药剂,能改善认知功能,且对治疗哮喘有明显作用。该药剂的一种合成路线如下图所示:
(1)B中官能团除碳氯键外,还含有__________、__________。(填名称)
(2)能鉴别物质A和B的是_______。(不定项)
A.茚三酮 B.浓溴水 C.希夫试剂 D.红外光谱
(3)反应⑤是__________反应;反应⑥是__________反应。
A.取代 B.消去 C.氧化 D.还原
(4)反应③采用三乙胺作为溶剂可以促进反应正向进行,推测M的结构简式为__________。
(5)上述方法最终得到的J是两种物质的混合物,这两种物质互为__________异构。
A.官能团 B.位置 C.碳链 D.顺反
E.对映
(6)补全反应⑦的化学方程式__________:;从环保的角度来看,最好选用__________替代。
A. B.
(7)科研工作者曾利用7-氨基庚酸进行反应⑧,然而反应很长一段时间后却没有产物生成,可能的原因是__________。
(8)i.对C的一种同分异构体K进行结构分析,得到下列谱图,此谱图的类型为__________。
A.核磁共振氢谱 B.红外光谱 C.质谱 D.原子光谱
ii.写出一种同时满足i和下列条件的K的结构简式:__________。
①分子结构中含有;
②遇溶液显紫色。
(9)结合上述流程,设计以和为原料制备的合成路线__________。(其他无机试剂任选)
18.乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成分。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展水平的重要标志)。
(1)B中含氧官能团的名称是______________:反应②的反应类型是_____________。
(2)A分子的空间构型是____________。
(3)写出下列反应的化学方程式:
反应③:_________________________________________。
反应⑤:__________________________________________。
(4)与足量金属反应,可生成为______________。
(5)绿色化学的核心内容之一是“原子经济性”,即反应物中的原子全部转化为目标,原子的理论利用率为。下列转化符合绿色化学要求的是______________(填序号)。
a.乙醇制取乙醛
b.乙烷制备
c.
三、实验题
19.苯甲酸乙酯()的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知:苯甲酸在100℃会迅速升华。相关有机物的性质如表所示。
名称 相对分子质量 颜色及状态 沸点/℃ 密度/()
苯甲酸 122 无色鳞片状或针状晶体 249 1.2659
苯甲酸乙酯 150 无色澄清液体 212.6 1.05
乙醇 46 无色澄清液体 78.3 0.7893
环己烷 84 无色澄清液体 80.7 0.78
实验步骤如下:
①在圆底烧瓶中加入苯甲酸,乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中的液体后,关闭旋塞继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是________(填序号)。
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中使用分水器不断分离除去水的目的是______________。
(3)步骤②中应控制加热蒸馏的温度为________(填序号)。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入的作用是________________________________;若的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是__________________。
(5)关于步骤③中的萃取分液操作的叙述正确的是________(填序号)。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算可得本实验的产率为________。
参考答案
1.答案:A
解析:铅是重金属,对人体有害,禁止使用含铅汽油是为了防止对环境造成污染,A项错误。
2.答案:A
解析:石油短缺的问题可以通过开发清洁、可再生的新能源来解决。开发氢能、风能、地热能等都是很好的解决办法;大量使用木材作燃料,会破坏生态环境,加剧温室效应,故A项中做法不恰当。
3.答案:D
解析:由红外光谱可知,该有机物中有和三种不同的化学键,A项正确;由核磁共振谱可知,其有三组吸收峰,即该有机物分子中有三种不同化学环境的氢原子,B项正确;核磁共振谱图中吸收峰的面积比等于氢原子个数比,无法得知其分子中的氢原子总数,C项正确;若A的结构简式为,则无键(与题中红外光谱图不符),其核磁共振谱图中应只有一组吸收峰(与题中核磁共振谱图不符),D项错误。
4.答案:C
解析:氰酸铵属于离子化合物,尿素属于共价化合物,A项正确;人的尿液中含有尿素,尿素是人体新陈代谢的一种产物,B项正确;工业上用和合成尿素的化学方程式为,反应前后各元素的化合价均未发生变化,不属于氧化还原反应,C项错误;尿素与氰酸铵的分子式相同,而结构不同,二者互为同分异构体,D项正确。
5.答案:A
解析:A.将某烃进行核磁共振氢谱检测,谱图出现两组吸收峰,说明有两种环境的H原子,丙烷有两种环境的H原子,该烃可能是丙烷,A正确;
B.将乙醇和浓硫酸共热后生成的乙烯气体中混有,也能使溴水褪色,则该操作不能证明气体为乙烯,B错误;乙醇和酸性重铬酸钾溶液充分反应后的溶液呈
C.酸性是因为溶液中原本就存在的,该操作不能说明乙醇被氧化为乙酸,C错误;
D.酚类物质遇溶液,溶液变为紫色,但不是紫色沉淀,D错误。
6.答案:C
解析:由提纯步骤可知,该过程涉及分液、过滤和蒸馏,分液需要分液漏斗和烧杯,过滤需要漏斗、烧杯、玻璃棒,蒸馏需要蒸馏烧瓶、直形冷凝管、温度计、牛角管、锥形瓶,故需要用到的仪器是①、②、⑤、⑦,C项正确。
7.答案:D
解析:X射线衍射实验可以获得晶体结构的有关信息,包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,从而得出分子的空间结构,A项正确;能使溴的四氯化碳溶液褪色的是己烯,不能使溴的四氯化碳溶液褪色的是己醛,B项正确;红外光谱用于测定分子中的化学键及官能团信息,C项正确;检验卤代烃中的卤素种类时,将卤代烃与NaOH溶液共热,反应结束后取上层水溶液滴加稀硝酸酸化,再滴加硝酸银溶液,观察实验现象,D项错误。
8.答案:D
解析:粗盐提纯实验需要经过溶解,过滤及蒸发的操作过程,溶解过程主要使用烧杯和玻璃棒,过滤过程主要使用铁架台,漏斗、烧杯、玻璃棒;蒸发过程主要使用铁架台或三脚架、酒精灯、蒸发皿和玻璃棒。苯甲酸重结晶需要用酒精灯、烧杯、玻璃棒。故不需要用到的玻璃仪器为温度计。
9.答案:D
解析:由题图可知该反应有2个过渡态,第一步活化能更大,则反应速率由第一步决定,A错误;α-甲基苄溴的水解产物与苯环直接相连的C原子上连有H原子,故能使酸性高锰酸钾溶液褪色,B错误;α-甲基芐溴和足量氢气加成后的产物为,其中有6种不同化学环境的氢,如图中标有序号的碳原子连接的氢原子:,C错误;中间体中带正电荷的碳原子价层电子对数为3,采用关淂窅杂化,D正确。
10.答案:D
解析:质谱法是测定相对分子质量的重要方法,可以用于测定不同的同位素,A项正确;常温下为液态,熔、沸点较低,为分子晶体,NaH常温下为固态,熔点较高,为离子晶体,B项正确;基态P原子的核外电子排布式为,其核外电子有9种不同的空间运动状态,C项正确;工业上采用电解熔融NaCl的方式制备单质,D项错误。
11.答案:B
解析:碳酸钠溶液呈碱性,碘单质在碱性溶液中发生歧化反应生成碘离子和碘酸根离子,则在步骤Ⅰ中,加入足量溶液后紫红色磌单质完全反应,上下两层溶液均为无色,A项正确;的密度大于水,故分液时应从分液漏斗上口倒出水层(溶液A),B项错误;步骤Ⅱ的目的是生成粗,碘离子和碘酸根离子在酸性环境中会发生归中反应生成碘单质,故试剂X可用硫酸,C项正确;碘单质受热易升华,故实验制得的粗碘可用升华法进一步提纯,D项正确。
12.答案:B
解析:苯甲酸微溶于冷水,易溶于热水。粗苯甲酸中混有泥沙和氯化钠,加水、加热溶解,苯甲酸、NaCl溶解在水中,泥沙不溶,从而形成悬浊液;趁热过滤出泥沙,同时防止苯甲酸结晶析出;将滤液冷却结晶,大部分苯甲酸结晶析出,氯化钠仍留在母液中;过滤、用冷水洗涤,便可得到纯净的苯甲酸。
A.操作I中,为减少能耗、减少苯甲酸的溶解损失,溶解所用水的量需加以控制,可依据苯甲酸的大致含量、溶解度等估算加水量,A正确;
B.操作Ⅱ趁热过滤的目的,是除去泥沙,同时防止苯甲酸结晶析出,NaCl含量少,通常不结晶析出,B不正确;
C.操作Ⅲ缓慢冷却结晶,可形成较大的苯甲酸晶体颗粒,同时可减少杂质被包裹在晶体颗粒内部,C正确;
D.苯甲酸微溶于冷水,易溶于热水,所以操作Ⅳ可用冷水洗涤晶体,既可去除晶体表面吸附的杂质离子,又能减少溶解损失,D正确;
故选B。
13.答案:B
解析:
A.不同元素原子的吸收光谱和发射光谱都不相同,故光谱仪可以用于测定元素种类,A正确;
B.红外光谱仪适用于测定所含化学键或官能团种类的,不能用于测定共价键的键长和键角,B错误;
C.X射线仪可以利用衍射的X射线,测定各原子的位置,C正确;
D.质谱仪可以获得分子的质荷比,一般最大质荷比等于其相对分子质量,D正确;
故选B。
14.答案:B
解析:为一元酸,含氧酸中羟基H可电离,体现酸性,则分子中只有1个羟基,其结构式为,A正确;聚苯乙烯的链节为,B错误;分子的结构为,所有原子都达到8电子稳定结构,C正确;(碘酸碘)可写成,碘的化合价为+3价、+5价,D正确。
15.答案:D
解析:A.反应温度达到了130-140℃,不能用水浴加热,A错误;
B.反应为取代反应(或缩合反应),B错误;
C.分水器中预先加入的水,其水面略低于分水器的支管口,C错误;
D.产物丙醚溶于醇溶剂中,需要蒸馏提纯,D正确;
故选D。
16.答案:1.
2.
3. ;
4. ;加成
5.或
解析:1.依据实验式、结构式、结构简式等化学用语的含义和书写要求以及烷烃的通式来分析本例。乙烷的分子式是,实验式是。
2.丙烷的分子式是,只含有键和键,没有支链。
3.设含30个原子的烷烃的分子式为,则,。碳链为的烷烃分子中含有个共价键,则时, ,对应烷烃的分子式为。
4.分子结构含6个破原子和1个碳碳双键,能发生加成反应。
5.1个碳原子上最多连有2个支链,4个支链最少连在2个碳原子上,甲基是最小的支链,再加上2个链端碳原子,故最少有8个碳原子。
17.答案:(1)酯基;氨基
(2)D
(3)A;D
(4)
(5)E
(6)和;A
(7)7-氨基庚酸结构中同时含有氨基和羧基,两者可以相互作用形成内盐,从而导致无法参与反应,而将羧基变为酯基后,将氨基游离出来,有利于和氯代物发生取代反应
(8)A;或
(9)
解析:(1)由结构简式可知,的官能团为碳氯键、酯基、氨基,故答案为:酯基;氨基;
(2)由结构简式可知,分子中含有羧基,不含有酯基,而分子中含有酯基,不含有羧基,所以可以利用红外光谱能鉴别物质A和B,故选D;
(3)由分析可知,反应⑤为一定条件下发生取代反应生成和水,故选A;反应⑥为与硼氢化钠发生还原反应生成,故选D;
(4)由分析可知,M的结构简式为,故答案为:;
(5)由题意可知,J是两种物质的混合物,由结构简式可知,J分子中含有如图*所示的手性碳原子:,则两种物质互为对映异构,故选E;
(6)由题意可知,反应⑦为与发生取代反应生成、二氧化硫和氯化氢,二氧化硫有毒,会污染环境,所以从环保的角度来看,最好选用氯化氢代替,故选A,故答案为:和HCl;A;
(7)由结构简式可知,7 氨基庚酸结构中同时含有氨基和羧基,两者可以相互作用形成内盐,从而导致无法参与反应,而将羧基变为酯基后,将氨基游离出来,有利于和氯代物发生取代反应,所以利用7 氨基庚酸进行反应⑧时,会出现反应很长一段时间后却没有产物生成的问题,故答案为:7 氨基庚酸结构中同时含有氨基和羧基,两者可以相互作用形成内盐,从而导致无法参与反应,而将羧基变为酯基后,将氨基游离出来,有利于和氯代物发生取代反应;
(8)i.由图可知,题给谱图是K的核磁共振氢谱,故选A;
ii.由谱图可知,K分子中含有4类氢原子,遇氯化铁溶液显紫色说明K分子中含有酚羟基,则含有磺酸基的结构简式为、,故答案为:或;
(9)由有机物的转化关系可知,以和为原料制备的合成步骤为与四氢合硼酸钠发生还原反应生成,与发生取代反应生成;在氢氧化钠醇溶液中共热发生消去反应生成,与氯化氢共热反应生成,与氢氧化钠反应生成,与发生取代反应生成,合成路线为。
18.答案:(1)羟基、羧基;加成反应
(2)平面结构
(3);
(4)1
(5)c
解析:烃A是衡量一个国家化工水平的重要标志,则A为乙烯;乳酸乙酯在酸性条件下水解,生成乳酸和乙醇,乙烯与水在催化剂的作用下生成C,则C为乙醇,B为乳酸();乙醇与氧气在铜的催化作用下,生成D为乙醛:乙醛在氧气的催化作用下,生成为乙酸;乙酸与乳酸在浓硫酸的催化作用下,生成为,据此分析作答。
(1)B为乳酸(),其中含氧官能团的名称是羟基、羧基:反应②为乙烯与水在催化剂的作用下生成乙醇,反应类型是加成反应。
(2)A为乙烯,空间构型是平面结构。
(3)反应③是乙醇与氧气在铜的催化作用下,生成乙醛,化学方程式为。
反应⑤是乙酸与乳酸在浓硫酸的催化作用下,生成和水,化学方程式为
。
(4)中的羟基和羧基均可以和钠反应生成氢气,则与足量反应,可生成为。
(5)a.乙醇经过催化氧化,生成乙醛和水,原子的理论利用率不是,a项不符合题意;b.乙烷和氯气在光照下生成和,原子的理论利用率不是,b项不符合题意;c.,原子的理论利用率为,c项符合题意。
19.答案:C;提高反应的产率;C;除去浓硫酸和未反应的苯甲酸;苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华;AD;90.02%
解析:(1)圆底烧瓶加热时盛装的液体不超过容积的,所加液体总体积为,故选用100mL的圆底烧瓶,故答案为:C;
(2)根据平衡移动原理,利用分水器不断分离除去反应生成的水,能使反应正向进行,提高反应的产率,故答案:为提高反应的产率;
(3)步骤②的主要目的是蒸出反应液中的环己烷和乙醇,根据上述表格可知,环己烷和乙醇的沸点分别为78.3℃和80.7℃,蒸馏温度应略高于80.7℃,故温度选择85~90℃,故答案为:C;
(4)是具有碱性的强碱弱酸盐,能中和作催化剂的浓硫酸及未反应的苯甲酸,若加入的量不足,则苯甲酸可能未完全除尽,根据已知,苯甲酸受热至100℃时会发生升华,故答案为:除去浓硫酸和未反应的苯甲酸;苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华;
(5)放气时,分液漏应倒置,缓慢打开旋塞,B选项错误;经几次振摇并放气后,静置时应置于铁架台上,不能手持,C选项项错误;故答案为:AD;
(6)根据公式,苯甲酸的物质的量为,根据方程式可得,n(苯甲酸甲酯)=n(苯甲酸),则理论上可得苯甲酸乙酯的质量m(苯甲酸甲酯)=0.1mol×150g/mol=15g,而再根据公式可知,实际得到的苯甲酸乙酯的质量为,则根据产率计算公式,,故答案为90.02%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
高中化学苏教版选择性必修3考前专题特训卷 有机化学的发展及研究思路
本试卷满分100分,考试时间75分钟。
注意事项:
1.请将符合题意的答案填入答题卷相应空格中.
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5
一、单选题(每题3分,共45分)
1.下列关于某些社会热点问题的说法中,不正确的是( )
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.甲醇超标的酒不能饮用
C.进入大气的氟氯代烃会破坏高空臭氧层
D.光化学烟雾的产生与人为排放的烃、氨氧化物有关
2.石油是一种重要的能源,我国面临着石油短缺的问题。从可持续发展的角度看,以下解决能源问题的做法不恰当的是( )
A.大量使用木材作燃料 B.用液氢代替汽油
C.开发风能 D.开发地热能
3.已知某有机物A的红外光谱和核磁共振谱如下图所示,下列说法不正确的是( )
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由核磁共振谱无法得知其分子中的氢原子总数
D.若A的化学式为,则其结构简式为
4.1828年,德国化学家维勒在制备无机盐氰酸铵时得到了尿素,第一次通过人工的方法将无机物转变成有机物。下列关于尿素的叙述不正确的是( )
A.氰酸铵属于离子化合物,尿素属于共价化合物
B.尿素是人体新陈代谢的一种产物
C.工业上用氨气和二氧化碳在高温、高压下合成尿素的反应是氧化还原反应
D.尿素与氰酸铵()互为同分异构体
5.下列有关实验方案设计、现象和结论都正确的是( )
实验方案 现象 结论
A 将某烃进行核磁共振氢谱检测 谱图出现两组吸收峰 该烃可能为丙烷
B 将乙醇和浓硫酸共热后生成的气体通入溴水中 溴水褪色 该气体为乙烯
C 向乙醇和酸性重铬酸钾溶液充分反应后的溶液中滴加石蕊 溶液变红 乙醇被氧化为乙酸
D 往废水中滴入氯化铁溶液 出现紫色沉淀 该废水中含有酚类物质
A.A B.B C.C D.D
6.实验室用环己醇和浓磷酸制备环己烯,所得的粗产品可经以下步骤提纯。
下列仪器在环己烯的分离提纯时需要用到的是( )
A.①③④⑤ B.③④⑥⑦ C.①②⑤⑦ D.②④⑤⑥
7.关于有机物分析检测,下列说法不正确的是( )
A.通过X射线衍射可确定乙酸的空间结构
B.用溴的四氯化碳溶液,可以鉴别己烯和己醛
C.红外光谱图可获得分子中所含有的化学键或官能团的信息
D.卤代烃与氢氧化钠溶液共热、滴加溶液后根据沉淀颜色可判断卤原子种类
8.在苯甲酸重结晶与粗盐提纯的实验操作过程中,均不需要用到的玻璃仪器为( )
A.烧杯 B.玻璃棒 C.漏斗 D.温度计
9.α-甲基苄溴在氢氧化钠水溶液中水解的势能变化(Ph表示苯基)如图所示。下列说法正确的是( )
A.该反应有2个过渡态,且反应速率由第二步决定
B.α-甲基苄溴不能使溴水褪色,且其水解产物也不能使酸性高锰酸钾溶液褪色
C.α-甲基芐溴和足量氢气加成后的产物中有5种不同环境的氢
D.中间体中的带正电荷的碳原子杂化方式为
10.X、Y、Z、W为原子序数依次增大的四种元素,和具有相同的电子构型;Z、W为同周期元素,Z核外电子总数是其最外层电子数的3倍;W最外层有一个未成对电子。下列说法错误的是( )
A.X有多种同位素,可使用质谱法加以区分
B.X和Y的氢化物所属的晶体类型分别为分子晶体和离子晶体
C.基态Z原子的核外电子有9种不同的空间运动状态
D.工业上可采用电解YW溶液的方式制备单质Y
11.为回收利用含的废液,某小组设计方案如下所示,下列说法不正确的是( )
A.步骤Ⅰ中,加入足量溶液充分反应后,上下两层均为无色
B.步骤Ⅰ中,分液时从分液漏斗下口放出溶液A
C.试剂X可用硫酸
D.粗可用升华法进一步提纯
12.苯甲酸是一种常用的食品防腐剂。某实验小组设计粗苯甲酸(含有少量NaCl和泥沙)的提纯方案如下:
下列说法不正确的是( )
A.操作I中依据苯甲酸的溶解度估算加水量
B.操作Ⅱ趁热过滤的目的是除去泥沙和NaCl
C.操作Ⅲ缓慢冷却结晶可减少杂质被包裹
D.操作Ⅳ可用冷水洗涤晶体
13.科学家应用许多测定分子结构的现代仪器和方法了解分子的结构,下列说法不正确的是( )
A.利用光谱仪获取的特征谱线鉴定元素种类
B.利用红外光谱仪测定共价键的键长和键角
C.利用X射线衍射仪测定晶体中各个原子的位置
D.利用质谱仪测定分子的相对分子质量
14.下列化学用语的表达错误的是( )
A.(一元酸)的结构式:
B.聚苯乙烯的链节:
C.中所有原子都达到8电子稳定结构
D.(碘酸碘)中碘的化合价为+3价、+5价
15.丙醚是无色透明液体,微溶于水,溶于乙醇、乙醚等多数有机溶剂,可用于有机合成的原料和有机溶剂。某实验小组利用下列装置制备少量丙醚,反应的化学方程式为。下列说法正确的是( )
A.该反应可用水浴加热 B.该制备反应为消去反应
C.分水器需预先加水至支管口处 D.得到的粗产品需蒸馏提纯
二、填空题(共4题,55分)
16.按要求填写下列空白:
1.乙烷的实验式:__________。
2.丙烷的结构式:__________。
3.分子中含有30个氢原子的烷烃的分子式:__________,1个分子中含有19个共价键的烷烃的分子式为__________。
4.有机物的结构为分子式为__________,能与溴水发生__________反应。
5.分子中含有四个支链的含碳原子数最少的烷烃的结构简式:__________。
17.噻茶普汀纳是一种具有新型神经化学特征的药剂,能改善认知功能,且对治疗哮喘有明显作用。该药剂的一种合成路线如下图所示:
(1)B中官能团除碳氯键外,还含有__________、__________。(填名称)
(2)能鉴别物质A和B的是_______。(不定项)
A.茚三酮 B.浓溴水 C.希夫试剂 D.红外光谱
(3)反应⑤是__________反应;反应⑥是__________反应。
A.取代 B.消去 C.氧化 D.还原
(4)反应③采用三乙胺作为溶剂可以促进反应正向进行,推测M的结构简式为__________。
(5)上述方法最终得到的J是两种物质的混合物,这两种物质互为__________异构。
A.官能团 B.位置 C.碳链 D.顺反
E.对映
(6)补全反应⑦的化学方程式__________:;从环保的角度来看,最好选用__________替代。
A. B.
(7)科研工作者曾利用7-氨基庚酸进行反应⑧,然而反应很长一段时间后却没有产物生成,可能的原因是__________。
(8)i.对C的一种同分异构体K进行结构分析,得到下列谱图,此谱图的类型为__________。
A.核磁共振氢谱 B.红外光谱 C.质谱 D.原子光谱
ii.写出一种同时满足i和下列条件的K的结构简式:__________。
①分子结构中含有;
②遇溶液显紫色。
(9)结合上述流程,设计以和为原料制备的合成路线__________。(其他无机试剂任选)
18.乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成分。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展水平的重要标志)。
(1)B中含氧官能团的名称是______________:反应②的反应类型是_____________。
(2)A分子的空间构型是____________。
(3)写出下列反应的化学方程式:
反应③:_________________________________________。
反应⑤:__________________________________________。
(4)与足量金属反应,可生成为______________。
(5)绿色化学的核心内容之一是“原子经济性”,即反应物中的原子全部转化为目标,原子的理论利用率为。下列转化符合绿色化学要求的是______________(填序号)。
a.乙醇制取乙醛
b.乙烷制备
c.
三、实验题
19.苯甲酸乙酯()的别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,有芳香气味,用于配制香水、香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知:苯甲酸在100℃会迅速升华。相关有机物的性质如表所示。
名称 相对分子质量 颜色及状态 沸点/℃ 密度/()
苯甲酸 122 无色鳞片状或针状晶体 249 1.2659
苯甲酸乙酯 150 无色澄清液体 212.6 1.05
乙醇 46 无色澄清液体 78.3 0.7893
环己烷 84 无色澄清液体 80.7 0.78
实验步骤如下:
①在圆底烧瓶中加入苯甲酸,乙醇(过量),20mL环己烷以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装置装好仪器,控制温度在65~70℃加热回流2h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中的液体后,关闭旋塞继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入至溶液呈中性。用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是________(填序号)。
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中使用分水器不断分离除去水的目的是______________。
(3)步骤②中应控制加热蒸馏的温度为________(填序号)。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入的作用是________________________________;若的加入量不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是__________________。
(5)关于步骤③中的萃取分液操作的叙述正确的是________(填序号)。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算可得本实验的产率为________。
参考答案
1.答案:A
解析:铅是重金属,对人体有害,禁止使用含铅汽油是为了防止对环境造成污染,A项错误。
2.答案:A
解析:石油短缺的问题可以通过开发清洁、可再生的新能源来解决。开发氢能、风能、地热能等都是很好的解决办法;大量使用木材作燃料,会破坏生态环境,加剧温室效应,故A项中做法不恰当。
3.答案:D
解析:由红外光谱可知,该有机物中有和三种不同的化学键,A项正确;由核磁共振谱可知,其有三组吸收峰,即该有机物分子中有三种不同化学环境的氢原子,B项正确;核磁共振谱图中吸收峰的面积比等于氢原子个数比,无法得知其分子中的氢原子总数,C项正确;若A的结构简式为,则无键(与题中红外光谱图不符),其核磁共振谱图中应只有一组吸收峰(与题中核磁共振谱图不符),D项错误。
4.答案:C
解析:氰酸铵属于离子化合物,尿素属于共价化合物,A项正确;人的尿液中含有尿素,尿素是人体新陈代谢的一种产物,B项正确;工业上用和合成尿素的化学方程式为,反应前后各元素的化合价均未发生变化,不属于氧化还原反应,C项错误;尿素与氰酸铵的分子式相同,而结构不同,二者互为同分异构体,D项正确。
5.答案:A
解析:A.将某烃进行核磁共振氢谱检测,谱图出现两组吸收峰,说明有两种环境的H原子,丙烷有两种环境的H原子,该烃可能是丙烷,A正确;
B.将乙醇和浓硫酸共热后生成的乙烯气体中混有,也能使溴水褪色,则该操作不能证明气体为乙烯,B错误;乙醇和酸性重铬酸钾溶液充分反应后的溶液呈
C.酸性是因为溶液中原本就存在的,该操作不能说明乙醇被氧化为乙酸,C错误;
D.酚类物质遇溶液,溶液变为紫色,但不是紫色沉淀,D错误。
6.答案:C
解析:由提纯步骤可知,该过程涉及分液、过滤和蒸馏,分液需要分液漏斗和烧杯,过滤需要漏斗、烧杯、玻璃棒,蒸馏需要蒸馏烧瓶、直形冷凝管、温度计、牛角管、锥形瓶,故需要用到的仪器是①、②、⑤、⑦,C项正确。
7.答案:D
解析:X射线衍射实验可以获得晶体结构的有关信息,包括晶胞形状和大小、分子或原子在微观空间有序排列呈现的对称类型、原子在晶胞里的数目和位置等,从而得出分子的空间结构,A项正确;能使溴的四氯化碳溶液褪色的是己烯,不能使溴的四氯化碳溶液褪色的是己醛,B项正确;红外光谱用于测定分子中的化学键及官能团信息,C项正确;检验卤代烃中的卤素种类时,将卤代烃与NaOH溶液共热,反应结束后取上层水溶液滴加稀硝酸酸化,再滴加硝酸银溶液,观察实验现象,D项错误。
8.答案:D
解析:粗盐提纯实验需要经过溶解,过滤及蒸发的操作过程,溶解过程主要使用烧杯和玻璃棒,过滤过程主要使用铁架台,漏斗、烧杯、玻璃棒;蒸发过程主要使用铁架台或三脚架、酒精灯、蒸发皿和玻璃棒。苯甲酸重结晶需要用酒精灯、烧杯、玻璃棒。故不需要用到的玻璃仪器为温度计。
9.答案:D
解析:由题图可知该反应有2个过渡态,第一步活化能更大,则反应速率由第一步决定,A错误;α-甲基苄溴的水解产物与苯环直接相连的C原子上连有H原子,故能使酸性高锰酸钾溶液褪色,B错误;α-甲基芐溴和足量氢气加成后的产物为,其中有6种不同化学环境的氢,如图中标有序号的碳原子连接的氢原子:,C错误;中间体中带正电荷的碳原子价层电子对数为3,采用关淂窅杂化,D正确。
10.答案:D
解析:质谱法是测定相对分子质量的重要方法,可以用于测定不同的同位素,A项正确;常温下为液态,熔、沸点较低,为分子晶体,NaH常温下为固态,熔点较高,为离子晶体,B项正确;基态P原子的核外电子排布式为,其核外电子有9种不同的空间运动状态,C项正确;工业上采用电解熔融NaCl的方式制备单质,D项错误。
11.答案:B
解析:碳酸钠溶液呈碱性,碘单质在碱性溶液中发生歧化反应生成碘离子和碘酸根离子,则在步骤Ⅰ中,加入足量溶液后紫红色磌单质完全反应,上下两层溶液均为无色,A项正确;的密度大于水,故分液时应从分液漏斗上口倒出水层(溶液A),B项错误;步骤Ⅱ的目的是生成粗,碘离子和碘酸根离子在酸性环境中会发生归中反应生成碘单质,故试剂X可用硫酸,C项正确;碘单质受热易升华,故实验制得的粗碘可用升华法进一步提纯,D项正确。
12.答案:B
解析:苯甲酸微溶于冷水,易溶于热水。粗苯甲酸中混有泥沙和氯化钠,加水、加热溶解,苯甲酸、NaCl溶解在水中,泥沙不溶,从而形成悬浊液;趁热过滤出泥沙,同时防止苯甲酸结晶析出;将滤液冷却结晶,大部分苯甲酸结晶析出,氯化钠仍留在母液中;过滤、用冷水洗涤,便可得到纯净的苯甲酸。
A.操作I中,为减少能耗、减少苯甲酸的溶解损失,溶解所用水的量需加以控制,可依据苯甲酸的大致含量、溶解度等估算加水量,A正确;
B.操作Ⅱ趁热过滤的目的,是除去泥沙,同时防止苯甲酸结晶析出,NaCl含量少,通常不结晶析出,B不正确;
C.操作Ⅲ缓慢冷却结晶,可形成较大的苯甲酸晶体颗粒,同时可减少杂质被包裹在晶体颗粒内部,C正确;
D.苯甲酸微溶于冷水,易溶于热水,所以操作Ⅳ可用冷水洗涤晶体,既可去除晶体表面吸附的杂质离子,又能减少溶解损失,D正确;
故选B。
13.答案:B
解析:
A.不同元素原子的吸收光谱和发射光谱都不相同,故光谱仪可以用于测定元素种类,A正确;
B.红外光谱仪适用于测定所含化学键或官能团种类的,不能用于测定共价键的键长和键角,B错误;
C.X射线仪可以利用衍射的X射线,测定各原子的位置,C正确;
D.质谱仪可以获得分子的质荷比,一般最大质荷比等于其相对分子质量,D正确;
故选B。
14.答案:B
解析:为一元酸,含氧酸中羟基H可电离,体现酸性,则分子中只有1个羟基,其结构式为,A正确;聚苯乙烯的链节为,B错误;分子的结构为,所有原子都达到8电子稳定结构,C正确;(碘酸碘)可写成,碘的化合价为+3价、+5价,D正确。
15.答案:D
解析:A.反应温度达到了130-140℃,不能用水浴加热,A错误;
B.反应为取代反应(或缩合反应),B错误;
C.分水器中预先加入的水,其水面略低于分水器的支管口,C错误;
D.产物丙醚溶于醇溶剂中,需要蒸馏提纯,D正确;
故选D。
16.答案:1.
2.
3. ;
4. ;加成
5.或
解析:1.依据实验式、结构式、结构简式等化学用语的含义和书写要求以及烷烃的通式来分析本例。乙烷的分子式是,实验式是。
2.丙烷的分子式是,只含有键和键,没有支链。
3.设含30个原子的烷烃的分子式为,则,。碳链为的烷烃分子中含有个共价键,则时, ,对应烷烃的分子式为。
4.分子结构含6个破原子和1个碳碳双键,能发生加成反应。
5.1个碳原子上最多连有2个支链,4个支链最少连在2个碳原子上,甲基是最小的支链,再加上2个链端碳原子,故最少有8个碳原子。
17.答案:(1)酯基;氨基
(2)D
(3)A;D
(4)
(5)E
(6)和;A
(7)7-氨基庚酸结构中同时含有氨基和羧基,两者可以相互作用形成内盐,从而导致无法参与反应,而将羧基变为酯基后,将氨基游离出来,有利于和氯代物发生取代反应
(8)A;或
(9)
解析:(1)由结构简式可知,的官能团为碳氯键、酯基、氨基,故答案为:酯基;氨基;
(2)由结构简式可知,分子中含有羧基,不含有酯基,而分子中含有酯基,不含有羧基,所以可以利用红外光谱能鉴别物质A和B,故选D;
(3)由分析可知,反应⑤为一定条件下发生取代反应生成和水,故选A;反应⑥为与硼氢化钠发生还原反应生成,故选D;
(4)由分析可知,M的结构简式为,故答案为:;
(5)由题意可知,J是两种物质的混合物,由结构简式可知,J分子中含有如图*所示的手性碳原子:,则两种物质互为对映异构,故选E;
(6)由题意可知,反应⑦为与发生取代反应生成、二氧化硫和氯化氢,二氧化硫有毒,会污染环境,所以从环保的角度来看,最好选用氯化氢代替,故选A,故答案为:和HCl;A;
(7)由结构简式可知,7 氨基庚酸结构中同时含有氨基和羧基,两者可以相互作用形成内盐,从而导致无法参与反应,而将羧基变为酯基后,将氨基游离出来,有利于和氯代物发生取代反应,所以利用7 氨基庚酸进行反应⑧时,会出现反应很长一段时间后却没有产物生成的问题,故答案为:7 氨基庚酸结构中同时含有氨基和羧基,两者可以相互作用形成内盐,从而导致无法参与反应,而将羧基变为酯基后,将氨基游离出来,有利于和氯代物发生取代反应;
(8)i.由图可知,题给谱图是K的核磁共振氢谱,故选A;
ii.由谱图可知,K分子中含有4类氢原子,遇氯化铁溶液显紫色说明K分子中含有酚羟基,则含有磺酸基的结构简式为、,故答案为:或;
(9)由有机物的转化关系可知,以和为原料制备的合成步骤为与四氢合硼酸钠发生还原反应生成,与发生取代反应生成;在氢氧化钠醇溶液中共热发生消去反应生成,与氯化氢共热反应生成,与氢氧化钠反应生成,与发生取代反应生成,合成路线为。
18.答案:(1)羟基、羧基;加成反应
(2)平面结构
(3);
(4)1
(5)c
解析:烃A是衡量一个国家化工水平的重要标志,则A为乙烯;乳酸乙酯在酸性条件下水解,生成乳酸和乙醇,乙烯与水在催化剂的作用下生成C,则C为乙醇,B为乳酸();乙醇与氧气在铜的催化作用下,生成D为乙醛:乙醛在氧气的催化作用下,生成为乙酸;乙酸与乳酸在浓硫酸的催化作用下,生成为,据此分析作答。
(1)B为乳酸(),其中含氧官能团的名称是羟基、羧基:反应②为乙烯与水在催化剂的作用下生成乙醇,反应类型是加成反应。
(2)A为乙烯,空间构型是平面结构。
(3)反应③是乙醇与氧气在铜的催化作用下,生成乙醛,化学方程式为。
反应⑤是乙酸与乳酸在浓硫酸的催化作用下,生成和水,化学方程式为
。
(4)中的羟基和羧基均可以和钠反应生成氢气,则与足量反应,可生成为。
(5)a.乙醇经过催化氧化,生成乙醛和水,原子的理论利用率不是,a项不符合题意;b.乙烷和氯气在光照下生成和,原子的理论利用率不是,b项不符合题意;c.,原子的理论利用率为,c项符合题意。
19.答案:C;提高反应的产率;C;除去浓硫酸和未反应的苯甲酸;苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华;AD;90.02%
解析:(1)圆底烧瓶加热时盛装的液体不超过容积的,所加液体总体积为,故选用100mL的圆底烧瓶,故答案为:C;
(2)根据平衡移动原理,利用分水器不断分离除去反应生成的水,能使反应正向进行,提高反应的产率,故答案:为提高反应的产率;
(3)步骤②的主要目的是蒸出反应液中的环己烷和乙醇,根据上述表格可知,环己烷和乙醇的沸点分别为78.3℃和80.7℃,蒸馏温度应略高于80.7℃,故温度选择85~90℃,故答案为:C;
(4)是具有碱性的强碱弱酸盐,能中和作催化剂的浓硫酸及未反应的苯甲酸,若加入的量不足,则苯甲酸可能未完全除尽,根据已知,苯甲酸受热至100℃时会发生升华,故答案为:除去浓硫酸和未反应的苯甲酸;苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华;
(5)放气时,分液漏应倒置,缓慢打开旋塞,B选项错误;经几次振摇并放气后,静置时应置于铁架台上,不能手持,C选项项错误;故答案为:AD;
(6)根据公式,苯甲酸的物质的量为,根据方程式可得,n(苯甲酸甲酯)=n(苯甲酸),则理论上可得苯甲酸乙酯的质量m(苯甲酸甲酯)=0.1mol×150g/mol=15g,而再根据公式可知,实际得到的苯甲酸乙酯的质量为,则根据产率计算公式,,故答案为90.02%。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
