人教版高中化学必修二 课件 2.2第二节 化学能与电能(共38张PPT)
文档属性
| 名称 | 人教版高中化学必修二 课件 2.2第二节 化学能与电能(共38张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 14:01:56 | ||
图片预览





文档简介
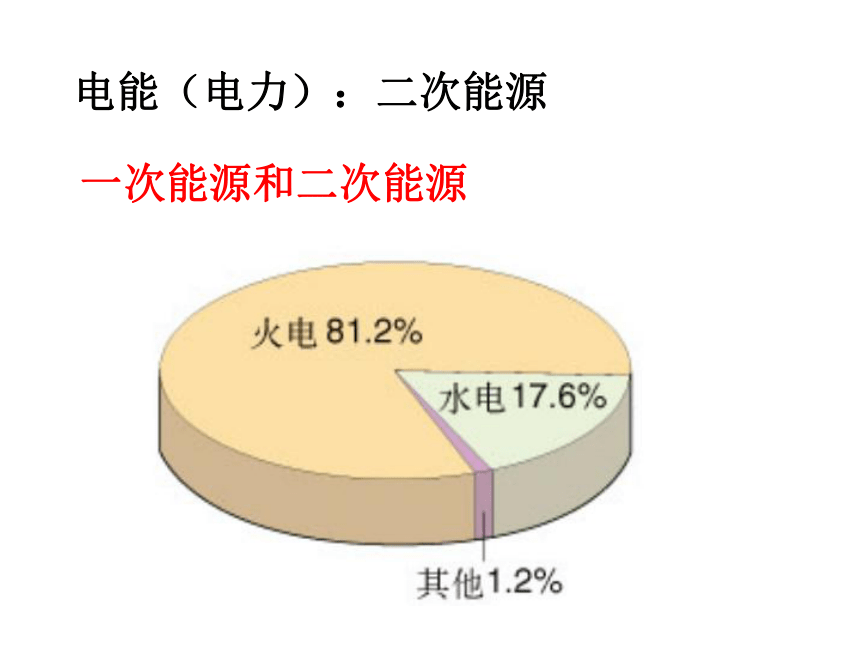
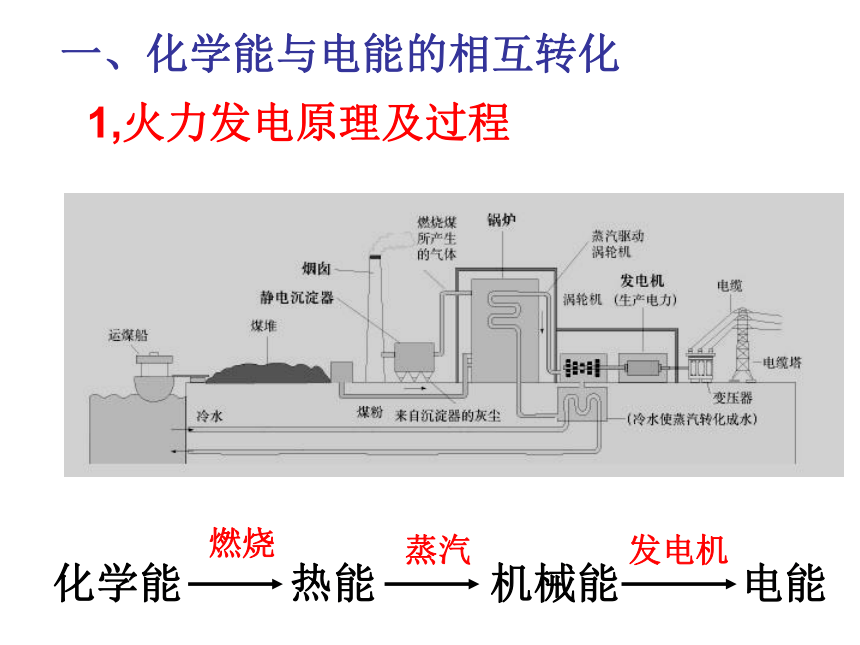
课件38张PPT。第二节 化学能与电能 第二章 化学反应与能量电能(电力):二次能源一次能源和二次能源1,火力发电原理及过程燃烧蒸汽发电机一、化学能与电能的相互转化火力发电优点:a.我国煤炭资源丰富,廉价方便.
b.电能清洁安全,又快捷方便.火力发电缺点:a.排出大量的温室效应气体.
b.有废气可能导致酸雨
c.废料废水
d.储量有限
e.能量转换效率低
1、当氧化剂和还原剂直接接触进行反应时,化学能要经过一系列能量转换才能转换为电能。
2、把氧化剂和还原剂分开,使氧化反应和还原反应在两个不同区域进行。
3、需要在氧化剂和还原剂之间架设桥梁使电子从氧化剂区域流向还原剂区域。
4、考虑氧化反应和还原反应发生的条件和环境,化学物质的选择。
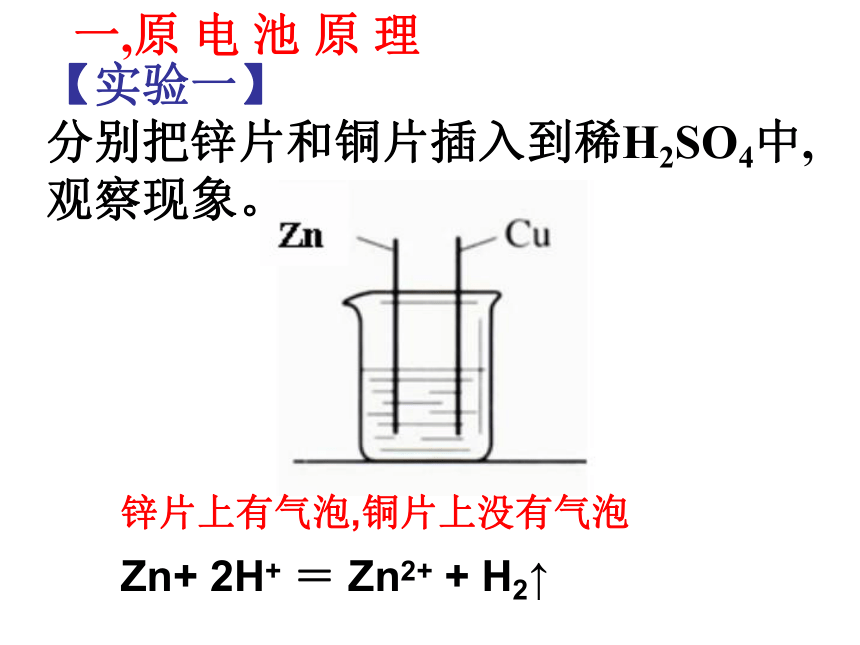
5、从电学角度考虑仪器选择和组装问题。【实验一】
分别把锌片和铜片插入到稀H2SO4中,
观察现象。一,原 电 池 原 理锌片上有气泡,铜片上没有气泡Zn+ 2H+ = Zn2+ + H2↑【实验二】
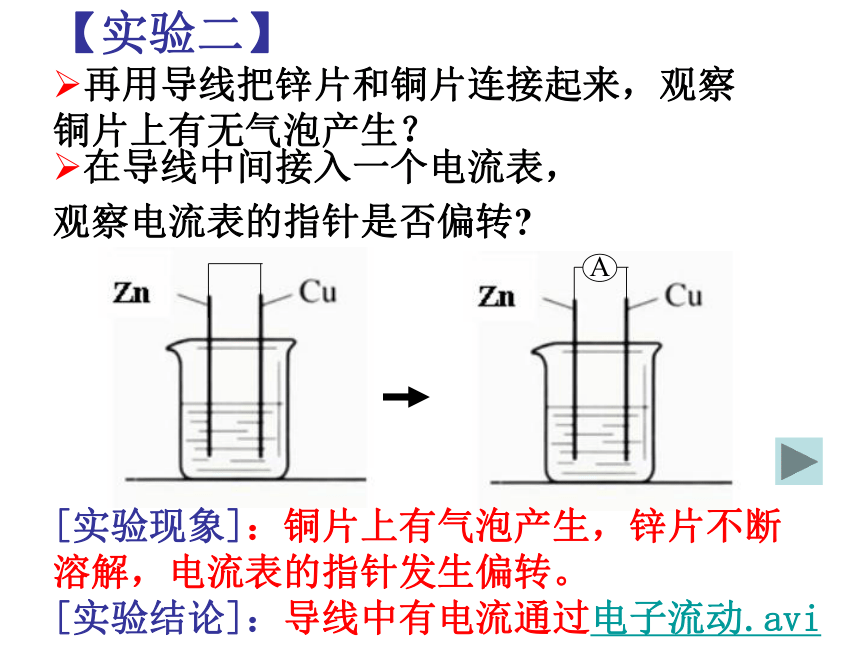
再用导线把锌片和铜片连接起来,观察铜片上有无气泡产生?在导线中间接入一个电流表,
观察电流表的指针是否偏转? [实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。[实验结论]:导线中有电流通过电子流动.avi原电池“负极出电子,电子回正极” 2、变化:
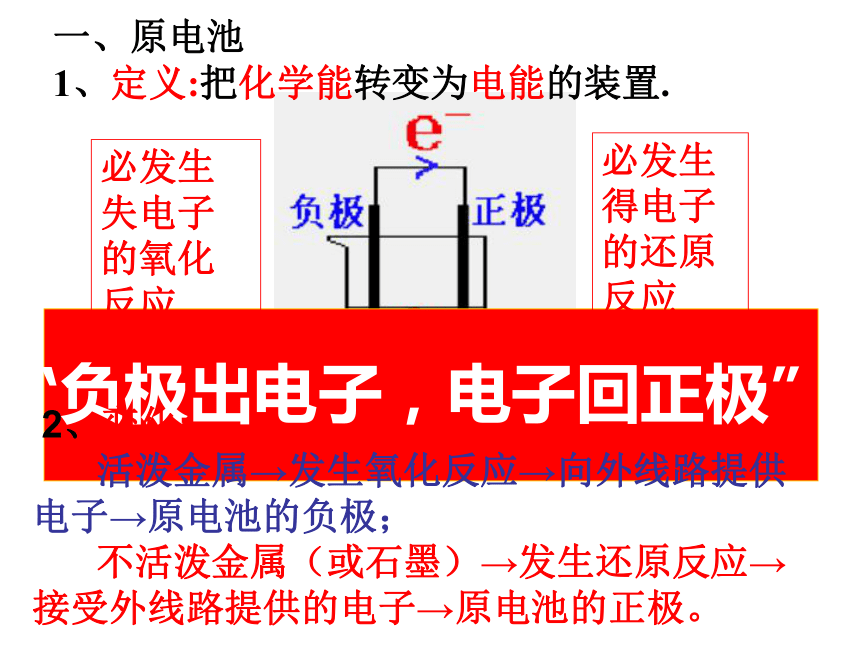
活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;
不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
一、原电池
1、定义:把化学能转变为电能的装置.必发生失电子的氧化反应必发生得电子的还原反应失得Zn-2e-= Zn2+2H++ 2e-= H2↑负极正极Zn+ 2H+ = Zn2+ + H2↑有气体产生Zn片溶解4、原电池的构成条件 ①两种活泼性不同的金属(或一种金属和 另一种非金属导体)构成电极。
②电解质溶液。
③电极用导线相联构成闭合回路。3、化学电池的组成:
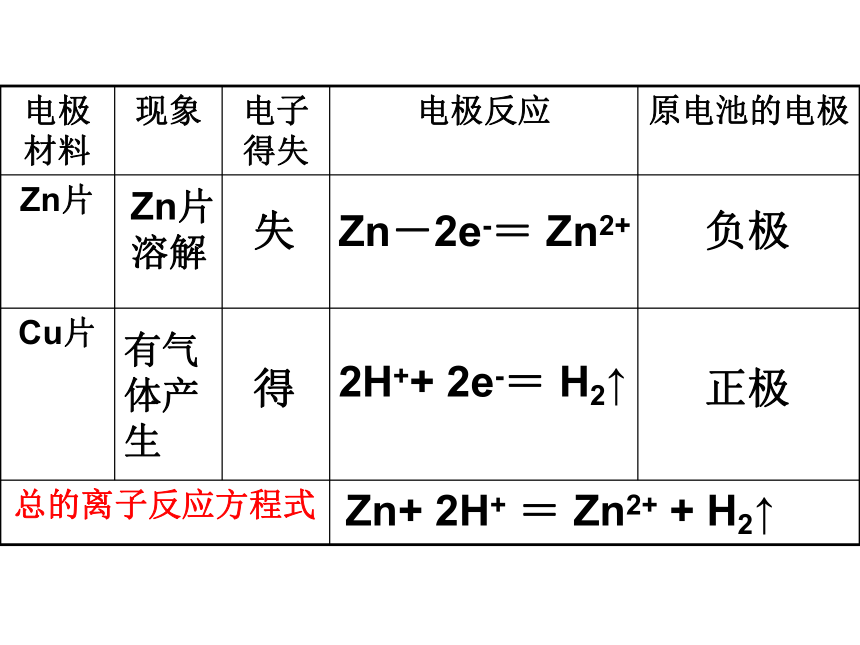
正极、负极、电解质溶液以及容器。5,原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) 氧化还原反应例1: 铜.锌.稀H2SO4组成的原电池 电极反应式:
负极(Zn): Zn -2e- = Zn2+
(氧化反应)[电极本身失去电子].
正极(Cu): 2H++2e- = H2 ↑
(还原反应)[电解质溶液中的阳离子得电子].
注: 得失电子相等, 总反应式:两式相加
2H++ Zn= H2↑ + Zn2+ 或
Zn+ H2SO4=ZnSO4+H2 ↑CH2SO4(不可以)(不可以)(可以)(不可以)例2病 例 分 析例3病 例 分 析病 例 分 析
你能为她开一个药方吗?6,判断原电池正、负极的方法*由组成原电池的两极材料判断:一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极*根据电流方向或电子流动方向判断:电流是由正极流向负极;
电子流动方向是由负极流向正极。
*根据原电池两极发生的变化来判断:原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。判断下列装置是否能构成原电池,并写出相应的电极反应及总反应。1,Zn—Zn与稀硫酸进行实验.
3,Zn—石墨与稀硫酸进行实验.
4,Fe—Zn与稀硫酸进行实验.
5,Cu—Zn与乙醇进行实验.
6,Cu—Zn与一个西红柿(或一个苹果)进行实验.
7,Cu—Zn与两个西红柿进行实验.
8,Cu—Zn与橙汁进行实验.以上组合可以组成原电池3,4,6,8例1例2, 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为: ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B例3, 请根据反应: 2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案?
Fe-Cu FeCl3Fe-C Fe(NO3)3Fe-Ag Fe2(SO4)3
根据反应设计原电池,你有哪些可行方案? ( 2Fe3+ + Fe = 3 Fe 2+ )FeCu
C
AgFeCl3
Fe(NO3)3
Fe2(SO4)3锌片插入稀硫酸中,被腐蚀。(化学腐蚀)锌片在锌,铜(稀硫酸)原电池中作为负极,也被腐蚀。(电化学腐蚀)哪个更快?原电池的负极被腐蚀得更快。分析锌,铁(稀硫酸)原电池中的电极反应。你感受到作为正极,铁被保护了吗?原电池的金属正极被保护。二,发展中的化学电源干电池碱性电池(1)干电池结构及电极反应原理(1)干电池结构及电极反应原理负极:Zn — 2e- == Zn2+正极:2NH4+ + 2e- == 2NH3↑+H2↑Zn + 2NH4+ == Zn2++2NH3↑+H2↑电池总反应式:特点:a:一次性电池,不可逆
b:用KOH代替NH4Cl能提高 性能,延长寿命蓄电池(2)充电电池(又称二次电池)(2)充电电池(又称二次电池)Pb + PbO2 + 2H2SO4 === 2PbSO4 + 2H2O
(-) (+)负极: Pb +SO42- - 2e- == PbSO4 Pb + PbO2 + 4H+ +2SO42- == 2PbSO4 + 2H2O正极:PbO2 + 4H+ +SO42- +2e- == PbSO4 + 2H2O铅蓄电池特点:电池总反应式:二次电池,可再次充电使用氢氧燃料电池(3)燃料电池(3)燃料电池 新型电池中,电极的导电材料一般多孔的金属板,负极是通入还原剂的一方,正极是通入氧化剂的一方。 氢氧燃料电池,电解质溶液为30%的氢
氧化钾溶液.
正极: O2+ 4e + 2H2O === 4OH-
负极: 2H2 – 4e + 4OH-=== 4H2O总反应式: 2H2+O2==2H2O特点:高效,环境污染少,外加设备供给氧化剂例2, 写出甲烷燃料电池(电解质溶液为氢氧
化钾溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 4H2O === 8OH-
负极: CH4 + 10OH- -8e === CO32- + 7H2O
总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O 反应后溶液的pH如何变化?4、镍铬电池 特点:比铅蓄电池耐用,可密封反复使用。 NiO2(S)+Cd(S)+2H2O(L)
=Ni(OH)2(S)+Cd(OH)2(S)Ag2O(S)+Cd(S)+H2O(L)
=2Ag(S)+Cd(OH)2(S)例1,1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
1、a是 极,
b是 极
电极反应式分别为:负正 例2, 写出甲烷燃料电池(电解质溶液为氢氧化钾溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 4H2O === 8OH-
负极: CH4 + 10OH- -8e === CO32- + 7H2O
总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O 反应后溶液的pH如何变化?
b.电能清洁安全,又快捷方便.火力发电缺点:a.排出大量的温室效应气体.
b.有废气可能导致酸雨
c.废料废水
d.储量有限
e.能量转换效率低
1、当氧化剂和还原剂直接接触进行反应时,化学能要经过一系列能量转换才能转换为电能。
2、把氧化剂和还原剂分开,使氧化反应和还原反应在两个不同区域进行。
3、需要在氧化剂和还原剂之间架设桥梁使电子从氧化剂区域流向还原剂区域。
4、考虑氧化反应和还原反应发生的条件和环境,化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。【实验一】
分别把锌片和铜片插入到稀H2SO4中,
观察现象。一,原 电 池 原 理锌片上有气泡,铜片上没有气泡Zn+ 2H+ = Zn2+ + H2↑【实验二】
再用导线把锌片和铜片连接起来,观察铜片上有无气泡产生?在导线中间接入一个电流表,
观察电流表的指针是否偏转? [实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。[实验结论]:导线中有电流通过电子流动.avi原电池“负极出电子,电子回正极” 2、变化:
活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;
不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
一、原电池
1、定义:把化学能转变为电能的装置.必发生失电子的氧化反应必发生得电子的还原反应失得Zn-2e-= Zn2+2H++ 2e-= H2↑负极正极Zn+ 2H+ = Zn2+ + H2↑有气体产生Zn片溶解4、原电池的构成条件 ①两种活泼性不同的金属(或一种金属和 另一种非金属导体)构成电极。
②电解质溶液。
③电极用导线相联构成闭合回路。3、化学电池的组成:
正极、负极、电解质溶液以及容器。5,原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) 氧化还原反应例1: 铜.锌.稀H2SO4组成的原电池 电极反应式:
负极(Zn): Zn -2e- = Zn2+
(氧化反应)[电极本身失去电子].
正极(Cu): 2H++2e- = H2 ↑
(还原反应)[电解质溶液中的阳离子得电子].
注: 得失电子相等, 总反应式:两式相加
2H++ Zn= H2↑ + Zn2+ 或
Zn+ H2SO4=ZnSO4+H2 ↑CH2SO4(不可以)(不可以)(可以)(不可以)例2病 例 分 析例3病 例 分 析病 例 分 析
你能为她开一个药方吗?6,判断原电池正、负极的方法*由组成原电池的两极材料判断:一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极*根据电流方向或电子流动方向判断:电流是由正极流向负极;
电子流动方向是由负极流向正极。
*根据原电池两极发生的变化来判断:原电池的负极总是失电子发生氧化反应,
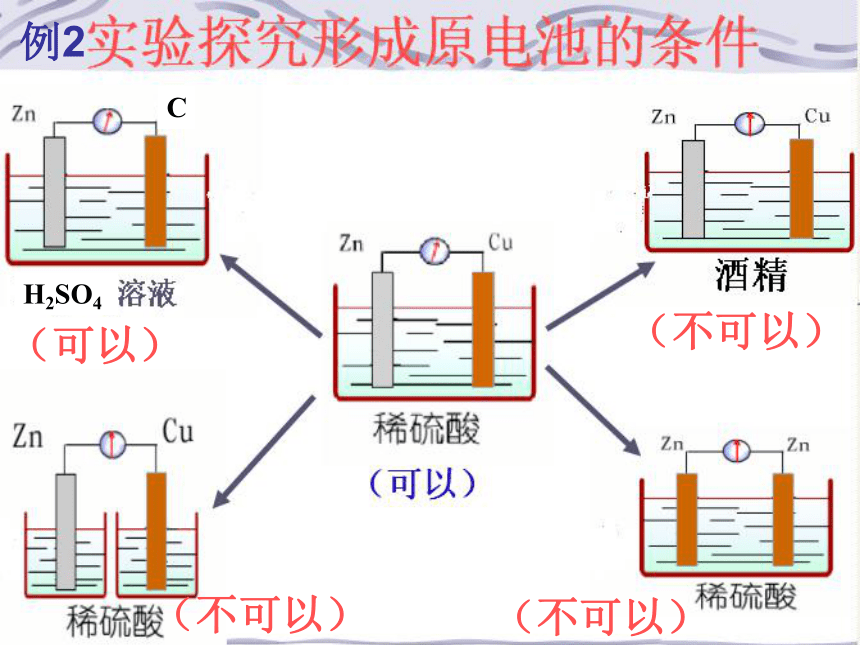
正极总是得电子发生还原反应。判断下列装置是否能构成原电池,并写出相应的电极反应及总反应。1,Zn—Zn与稀硫酸进行实验.
3,Zn—石墨与稀硫酸进行实验.
4,Fe—Zn与稀硫酸进行实验.
5,Cu—Zn与乙醇进行实验.
6,Cu—Zn与一个西红柿(或一个苹果)进行实验.
7,Cu—Zn与两个西红柿进行实验.
8,Cu—Zn与橙汁进行实验.以上组合可以组成原电池3,4,6,8例1例2, 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为: ( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B例3, 请根据反应: 2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案?
Fe-Cu FeCl3Fe-C Fe(NO3)3Fe-Ag Fe2(SO4)3
根据反应设计原电池,你有哪些可行方案? ( 2Fe3+ + Fe = 3 Fe 2+ )FeCu
C
AgFeCl3
Fe(NO3)3
Fe2(SO4)3锌片插入稀硫酸中,被腐蚀。(化学腐蚀)锌片在锌,铜(稀硫酸)原电池中作为负极,也被腐蚀。(电化学腐蚀)哪个更快?原电池的负极被腐蚀得更快。分析锌,铁(稀硫酸)原电池中的电极反应。你感受到作为正极,铁被保护了吗?原电池的金属正极被保护。二,发展中的化学电源干电池碱性电池(1)干电池结构及电极反应原理(1)干电池结构及电极反应原理负极:Zn — 2e- == Zn2+正极:2NH4+ + 2e- == 2NH3↑+H2↑Zn + 2NH4+ == Zn2++2NH3↑+H2↑电池总反应式:特点:a:一次性电池,不可逆
b:用KOH代替NH4Cl能提高 性能,延长寿命蓄电池(2)充电电池(又称二次电池)(2)充电电池(又称二次电池)Pb + PbO2 + 2H2SO4 === 2PbSO4 + 2H2O
(-) (+)负极: Pb +SO42- - 2e- == PbSO4 Pb + PbO2 + 4H+ +2SO42- == 2PbSO4 + 2H2O正极:PbO2 + 4H+ +SO42- +2e- == PbSO4 + 2H2O铅蓄电池特点:电池总反应式:二次电池,可再次充电使用氢氧燃料电池(3)燃料电池(3)燃料电池 新型电池中,电极的导电材料一般多孔的金属板,负极是通入还原剂的一方,正极是通入氧化剂的一方。 氢氧燃料电池,电解质溶液为30%的氢
氧化钾溶液.
正极: O2+ 4e + 2H2O === 4OH-
负极: 2H2 – 4e + 4OH-=== 4H2O总反应式: 2H2+O2==2H2O特点:高效,环境污染少,外加设备供给氧化剂例2, 写出甲烷燃料电池(电解质溶液为氢氧
化钾溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 4H2O === 8OH-
负极: CH4 + 10OH- -8e === CO32- + 7H2O
总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O 反应后溶液的pH如何变化?4、镍铬电池 特点:比铅蓄电池耐用,可密封反复使用。 NiO2(S)+Cd(S)+2H2O(L)
=Ni(OH)2(S)+Cd(OH)2(S)Ag2O(S)+Cd(S)+H2O(L)
=2Ag(S)+Cd(OH)2(S)例1,1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
1、a是 极,
b是 极
电极反应式分别为:负正 例2, 写出甲烷燃料电池(电解质溶液为氢氧化钾溶液)的电极反应式及总方程式: 正极: 2O2 + 8e- + 4H2O === 8OH-
负极: CH4 + 10OH- -8e === CO32- + 7H2O
总反应:CH4 + 2O2 + 2OH- === CO32- + 3H2O 反应后溶液的pH如何变化?
