人教版高中化学必修一课件4.1 无机非金属材料的主角-硅PPT课件(共53张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件4.1 无机非金属材料的主角-硅PPT课件(共53张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 14:10:29 | ||
图片预览








文档简介
课件53张PPT。第四章 非金属及其化合物第一节 无机非金属材料的主角
——硅
第一课时
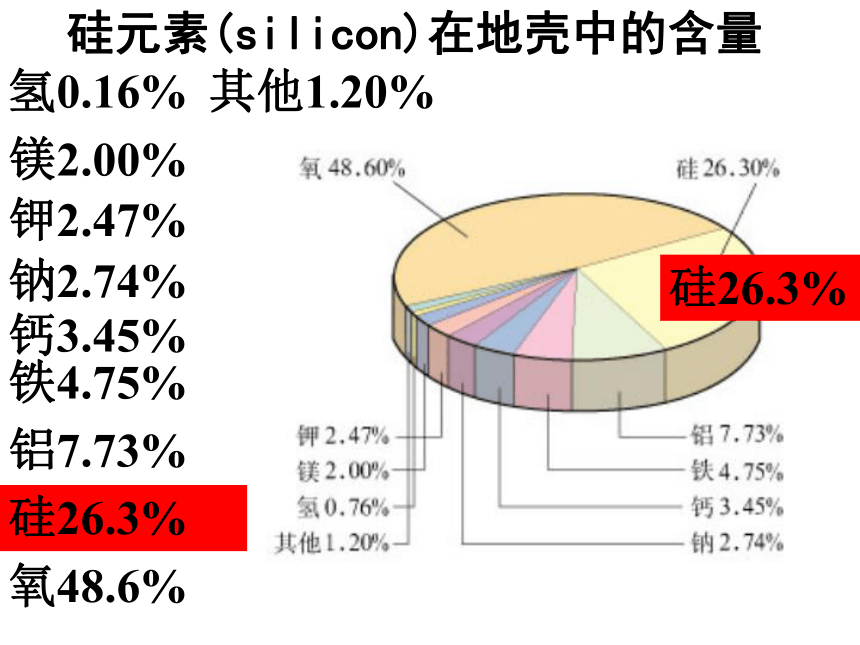
硅元素(silicon)在地壳中的含量氧48.6%硅26.3%铝7.73%铁4.75%钙3.45%钠2.74%钾2.47%镁2.00%氢0.16%其他1.20%硅26.3% 硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。 1、存在:没有游离态,只有化合态
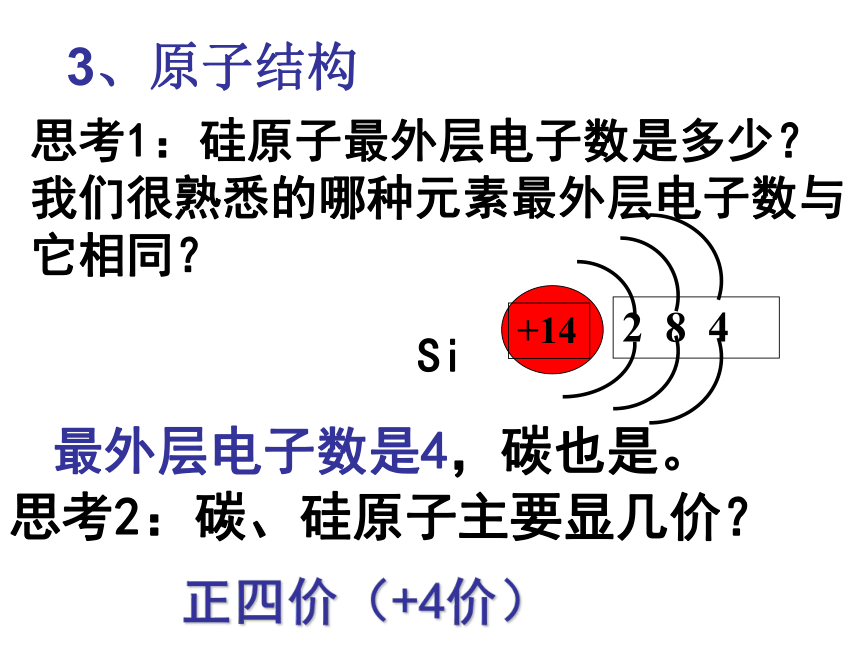
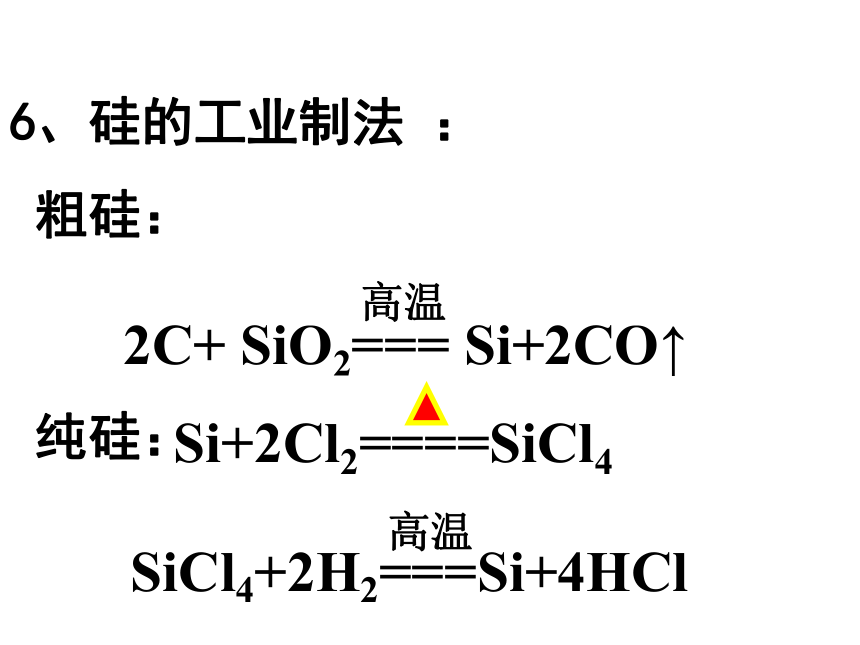
2、分布:自然界中分布广泛,在地壳中居第二位,仅次于氧。是构成矿物和岩石的基本元素。一、硅单质Si最外层电子数是4,碳也是。思考2:碳、硅原子主要显几价?正四价(+4价)思考1:硅原子最外层电子数是多少?我们很熟悉的哪种元素最外层电子数与它相同?3、原子结构4.物理性质结构类似金刚石,为硬而脆的灰黑色固体, 熔点高,硬度大。5.用途 晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,硅是信息技术的关键材料硅太阳能电池利用硅的半导体性能,制成光电池 ,将光能转化为电能。6、硅的工业制法 : 粗硅: 纯硅:太阳能电池电脑的中央处理器(CPU)硅芯片的使用,使计算机的体积已缩小到笔记本一样大小了。大规模集成电路硅的用途非常广泛,可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制太阳能电池,制铝合金、铁合金等多种合金。硅芯片 在美国旧金山,有个最大的高科技工业园区,称之为“硅谷”,它是现代电子工业和计算机发展的基地。这说明硅在电子工业革命中起着非常重要作用。以硅为基础而制成的晶体管是计算机的心脏。 硅在电子工业中重要作用二氧化硅(SiO2) 二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。是一种坚硬难熔的固体。 硅石硅矿山1.二氧化硅的存在二、二氧化硅水晶晶体二氧化硅玛 瑙玛瑙无定形二氧化硅SiO二氧化硅的晶体结构示意图2.二氧化硅的结构.SiO2
原子晶体SiO二氧化硅的晶体结构示意图SiO2是正四面体的空间网状结构,
因此性质很稳定 坚硬难熔的固体,
熔沸点比较高,
不溶于水,
硬度比较大。3.二氧化硅物理性质实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗? 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起。4.二氧化硅化学性质 SiO2+2NaOH=Na2SiO3+H2O 是酸性氧化物SiO2 + 2OH— ==SiO3 2-+ H2O不与酸反应(除氢氟酸以外)SiO2 + 4HF == SiF4 ? + 2H2O玻璃花雕刻工艺和我们化学有什么深厚的合作关系? 特殊性:不能与水反应第四章 非金属及其化合物第一节 无机非金属材料的主角
——硅
第二课时
练习:1.地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是
A.熔点很高 B.与水反应生成对应的酸
C.坚硬 D.可与烧碱反应生成盐
2.下列物质中,主要成分不是SiO2的是
A.金刚砂 B.玛瑙 C.水晶 D.石英BA( )( )3、实验室现提供下列试剂瓶,
①细口磨口塞玻璃瓶
②广口瓶
③细口橡皮塞玻璃瓶
④棕色广口瓶
⑤细口塑料瓶,
如何存放下列药品?依据是什么?
a.二氧化硅__b.氢氧化钠溶液
c.硝酸银晶体__ d.氢氟酸_
e.浓硫酸__②③④⑤①1.二氧化硅的存在二、二氧化硅2.二氧化硅的结构.3.二氧化硅物理性质4.二氧化硅化学性质SiO2的化学性质(很不活泼)2.特性
与HF的反应
SiO2 + 4HF = SiF4↑+ 2H2O
*用途:雕刻玻璃1.酸性氧化物
与碱性氧化物反应生成盐
SiO2+ CaO == CaSiO3
与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸钠
高温高温高温高温5、二氧化硅的用途
由于SiO2具有优良的物理化学性能加上SiO2在自然界的广泛存在,因此从古到今都被人类广泛地应用。光学纤维胃镜 ①石 英 制 品②水晶石英、玛瑙③二氧化硅用来制光导纤维 光导纤维就是比头发丝还细的、能传导光信号的玻璃丝。
制造光导纤维的材料就是二氧化硅。光导纤维主要用于
通讯、传感、测量等,光纤通讯的优点就是通信容量大,
一对光纤上可同时传送3万门电话。 P76实验4-1观察现象并填写下表滴入酚酞溶液显红色,再滴入盐酸红色消失,并有透明胶状物质生成Na2SiO3溶液呈碱性,与酸反应生成了H2SiO3Na2SiO3 + 2HCl = H2SiO3 + 2NaCl三.硅酸 (H2SiO3)1、制备:
可溶性硅酸盐(如Na2SiO3)与酸反应
(1)硅酸的制备Na2SiO3+2HCl=2NaCl+H2SiO3↓
(2)硅酸的性质
①物理性质:白色,胶状,不溶于水的物
②化学性质:弱酸性酸性比碳酸弱.
H2SiO3+2NaOH=2 H2O +Na2SiO3
③不稳定性
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓(3)用途:可作干燥剂和催化剂的载体四、硅酸盐硅酸盐结构复杂的固态化合物,
一般都不溶于水。1.含义:硅酸盐是由硅、氧和金属元素组成的化合物的总称 2.硅酸盐的表示方法: ①化学式法:②氧化物法:硅酸钠:Na2SiO3硅酸钙:CaSiO3硅酸钠:Na2O · SiO2硅酸钙: CaO· SiO2高岭石:Al2O3 · 2SiO2 ·2H2O石棉:CaO · 3MgO· 4SiO2 沸石:Na2 O · Al2O3 · 3SiO2· 2H2O云母: K2O· 3Al2O3 · 6SiO2· 2H2O长石:K2O · Al2O3 · 6SiO2 水泥:3CaO · SiO2 · 2CaO· SiO2 玻璃:Na2 O · CaO· 6SiO2粘土: Al2O3 · 2SiO2· 2H2Ot1.下列物质中属于纯净物的是( )
A.Na2CO3·10H2O B.水泥
C.纯净的盐酸 D.普通玻璃3.下列物质有固定熔点的是( )
A.水泥 B.玻璃 C.Na2O·SiO2 D.水玻璃 2.下列叙述正确的是( )
A.酸均不能与酸性氧化物反应
B.玻璃、陶瓷、水泥容器都不能贮存氢氟酸
C.石灰抹墙、水泥砌墙过程的硬化原理相同
D.石灰窑、玻璃熔炉出来的气体主要成分相同ABDC课堂小测第四章 非金属及其化合物第一节 无机非金属材料的主角
——硅
第三课时
1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是
A.纯碱溶液 B.盐酸
C.硫酸 D.苛性钠溶液
2.在一定条件下,下列物质不能与二氧化硅反应的是 ①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤浓硝酸 ⑥烧碱溶液 ⑦ 氧化钙 ⑧氮气
A.③⑤⑦⑧ B.⑤⑦⑧
C.⑤⑧ D.⑤ 课堂小测3.将过量的CO2分别通入① CaCl2溶液;② Na2SiO3溶液;③ Ca(OH)2溶液;④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是
A.①②③④ B.②④
C.①②③ D.②③
4、 高岭土是制造瓷器的主要原料,其组成可以表示为Al2Si2Ox(OH)y。其中x、y的数
值分别是
A.7、2 B.5、4
C.6、3 D.3、6 5.下列表述正确的是( )
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
B.在医疗上碳酸钠可用于治疗胃酸过多
C.用于现代通讯的光导纤维的主要成分是高纯度的硅
D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH) 3 胶体>FeCl3 溶液 6.下列说法正确的是( )
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到原硅酸.
C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强.
D.二氧化硅是酸性氧化物,它不溶于任何酸
7.用纯净的石英砂与烧碱溶液反应可以制
得水玻璃;将二氧化碳通入水玻璃中可制
得透明胶状物。请写出反应的化学方程式
及离子方程式。
最简单的硅酸盐是硅酸钠(Na2SiO3),
其水溶液俗称为水玻璃,
硅酸钠不能燃烧且不易受腐蚀,
可用作肥皂填料、木材防火剂等 。3.硅酸钠
(Na2SiO3)
关于硅酸盐说明:1.除硅酸钾、硅酸钠、硅酸铵以外均难溶于水2.硅酸钠是常见的可溶性硅酸盐之一,俗称泡花碱;它的水溶液俗称水玻璃,是一种粘合剂;硅酸和二氧化硅的制备:[水玻璃可保存玻璃瓶中,但不能使用玻璃塞,要用橡胶塞]较强酸和可溶性硅酸盐反应制硅酸五、硅酸盐工业
——硅
第一课时
硅元素(silicon)在地壳中的含量氧48.6%硅26.3%铝7.73%铁4.75%钙3.45%钠2.74%钾2.47%镁2.00%氢0.16%其他1.20%硅26.3% 硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。 1、存在:没有游离态,只有化合态
2、分布:自然界中分布广泛,在地壳中居第二位,仅次于氧。是构成矿物和岩石的基本元素。一、硅单质Si最外层电子数是4,碳也是。思考2:碳、硅原子主要显几价?正四价(+4价)思考1:硅原子最外层电子数是多少?我们很熟悉的哪种元素最外层电子数与它相同?3、原子结构4.物理性质结构类似金刚石,为硬而脆的灰黑色固体, 熔点高,硬度大。5.用途 晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,硅是信息技术的关键材料硅太阳能电池利用硅的半导体性能,制成光电池 ,将光能转化为电能。6、硅的工业制法 : 粗硅: 纯硅:太阳能电池电脑的中央处理器(CPU)硅芯片的使用,使计算机的体积已缩小到笔记本一样大小了。大规模集成电路硅的用途非常广泛,可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制太阳能电池,制铝合金、铁合金等多种合金。硅芯片 在美国旧金山,有个最大的高科技工业园区,称之为“硅谷”,它是现代电子工业和计算机发展的基地。这说明硅在电子工业革命中起着非常重要作用。以硅为基础而制成的晶体管是计算机的心脏。 硅在电子工业中重要作用二氧化硅(SiO2) 二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。是一种坚硬难熔的固体。 硅石硅矿山1.二氧化硅的存在二、二氧化硅水晶晶体二氧化硅玛 瑙玛瑙无定形二氧化硅SiO二氧化硅的晶体结构示意图2.二氧化硅的结构.SiO2
原子晶体SiO二氧化硅的晶体结构示意图SiO2是正四面体的空间网状结构,
因此性质很稳定 坚硬难熔的固体,
熔沸点比较高,
不溶于水,
硬度比较大。3.二氧化硅物理性质实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗? 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3,使瓶塞和瓶口粘在一起。4.二氧化硅化学性质 SiO2+2NaOH=Na2SiO3+H2O 是酸性氧化物SiO2 + 2OH— ==SiO3 2-+ H2O不与酸反应(除氢氟酸以外)SiO2 + 4HF == SiF4 ? + 2H2O玻璃花雕刻工艺和我们化学有什么深厚的合作关系? 特殊性:不能与水反应第四章 非金属及其化合物第一节 无机非金属材料的主角
——硅
第二课时
练习:1.地壳中含量第一和第二的两种元素所形成的化合物不具有的性质是
A.熔点很高 B.与水反应生成对应的酸
C.坚硬 D.可与烧碱反应生成盐
2.下列物质中,主要成分不是SiO2的是
A.金刚砂 B.玛瑙 C.水晶 D.石英BA( )( )3、实验室现提供下列试剂瓶,
①细口磨口塞玻璃瓶
②广口瓶
③细口橡皮塞玻璃瓶
④棕色广口瓶
⑤细口塑料瓶,
如何存放下列药品?依据是什么?
a.二氧化硅__b.氢氧化钠溶液
c.硝酸银晶体__ d.氢氟酸_
e.浓硫酸__②③④⑤①1.二氧化硅的存在二、二氧化硅2.二氧化硅的结构.3.二氧化硅物理性质4.二氧化硅化学性质SiO2的化学性质(很不活泼)2.特性
与HF的反应
SiO2 + 4HF = SiF4↑+ 2H2O
*用途:雕刻玻璃1.酸性氧化物
与碱性氧化物反应生成盐
SiO2+ CaO == CaSiO3
与强碱反应生成盐和水
SiO2 + 2NaOH = Na2SiO3 +H2O
硅酸钠
高温高温高温高温5、二氧化硅的用途
由于SiO2具有优良的物理化学性能加上SiO2在自然界的广泛存在,因此从古到今都被人类广泛地应用。光学纤维胃镜 ①石 英 制 品②水晶石英、玛瑙③二氧化硅用来制光导纤维 光导纤维就是比头发丝还细的、能传导光信号的玻璃丝。
制造光导纤维的材料就是二氧化硅。光导纤维主要用于
通讯、传感、测量等,光纤通讯的优点就是通信容量大,
一对光纤上可同时传送3万门电话。 P76实验4-1观察现象并填写下表滴入酚酞溶液显红色,再滴入盐酸红色消失,并有透明胶状物质生成Na2SiO3溶液呈碱性,与酸反应生成了H2SiO3Na2SiO3 + 2HCl = H2SiO3 + 2NaCl三.硅酸 (H2SiO3)1、制备:
可溶性硅酸盐(如Na2SiO3)与酸反应
(1)硅酸的制备Na2SiO3+2HCl=2NaCl+H2SiO3↓
(2)硅酸的性质
①物理性质:白色,胶状,不溶于水的物
②化学性质:弱酸性酸性比碳酸弱.
H2SiO3+2NaOH=2 H2O +Na2SiO3
③不稳定性
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓(3)用途:可作干燥剂和催化剂的载体四、硅酸盐硅酸盐结构复杂的固态化合物,
一般都不溶于水。1.含义:硅酸盐是由硅、氧和金属元素组成的化合物的总称 2.硅酸盐的表示方法: ①化学式法:②氧化物法:硅酸钠:Na2SiO3硅酸钙:CaSiO3硅酸钠:Na2O · SiO2硅酸钙: CaO· SiO2高岭石:Al2O3 · 2SiO2 ·2H2O石棉:CaO · 3MgO· 4SiO2 沸石:Na2 O · Al2O3 · 3SiO2· 2H2O云母: K2O· 3Al2O3 · 6SiO2· 2H2O长石:K2O · Al2O3 · 6SiO2 水泥:3CaO · SiO2 · 2CaO· SiO2 玻璃:Na2 O · CaO· 6SiO2粘土: Al2O3 · 2SiO2· 2H2Ot1.下列物质中属于纯净物的是( )
A.Na2CO3·10H2O B.水泥
C.纯净的盐酸 D.普通玻璃3.下列物质有固定熔点的是( )
A.水泥 B.玻璃 C.Na2O·SiO2 D.水玻璃 2.下列叙述正确的是( )
A.酸均不能与酸性氧化物反应
B.玻璃、陶瓷、水泥容器都不能贮存氢氟酸
C.石灰抹墙、水泥砌墙过程的硬化原理相同
D.石灰窑、玻璃熔炉出来的气体主要成分相同ABDC课堂小测第四章 非金属及其化合物第一节 无机非金属材料的主角
——硅
第三课时
1.要除去SiO2中混有的少量CaO杂质,最适宜的试剂是
A.纯碱溶液 B.盐酸
C.硫酸 D.苛性钠溶液
2.在一定条件下,下列物质不能与二氧化硅反应的是 ①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤浓硝酸 ⑥烧碱溶液 ⑦ 氧化钙 ⑧氮气
A.③⑤⑦⑧ B.⑤⑦⑧
C.⑤⑧ D.⑤ 课堂小测3.将过量的CO2分别通入① CaCl2溶液;② Na2SiO3溶液;③ Ca(OH)2溶液;④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是
A.①②③④ B.②④
C.①②③ D.②③
4、 高岭土是制造瓷器的主要原料,其组成可以表示为Al2Si2Ox(OH)y。其中x、y的数
值分别是
A.7、2 B.5、4
C.6、3 D.3、6 5.下列表述正确的是( )
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
B.在医疗上碳酸钠可用于治疗胃酸过多
C.用于现代通讯的光导纤维的主要成分是高纯度的硅
D.分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH) 3 胶体>FeCl3 溶液 6.下列说法正确的是( )
A.二氧化硅溶于水显酸性
B.二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到原硅酸.
C.因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强.
D.二氧化硅是酸性氧化物,它不溶于任何酸
7.用纯净的石英砂与烧碱溶液反应可以制
得水玻璃;将二氧化碳通入水玻璃中可制
得透明胶状物。请写出反应的化学方程式
及离子方程式。
最简单的硅酸盐是硅酸钠(Na2SiO3),
其水溶液俗称为水玻璃,
硅酸钠不能燃烧且不易受腐蚀,
可用作肥皂填料、木材防火剂等 。3.硅酸钠
(Na2SiO3)
关于硅酸盐说明:1.除硅酸钾、硅酸钠、硅酸铵以外均难溶于水2.硅酸钠是常见的可溶性硅酸盐之一,俗称泡花碱;它的水溶液俗称水玻璃,是一种粘合剂;硅酸和二氧化硅的制备:[水玻璃可保存玻璃瓶中,但不能使用玻璃塞,要用橡胶塞]较强酸和可溶性硅酸盐反应制硅酸五、硅酸盐工业
