人教版高中化学必修一课件4.2 富集在海水中的元素-氯 PPT课件(共44张PPT)
文档属性
| 名称 | 人教版高中化学必修一课件4.2 富集在海水中的元素-氯 PPT课件(共44张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 14:11:16 | ||
图片预览









文档简介
课件44张PPT。富集在海水中的元素
——氯 (第一课时)海水中含盐3%,主要为氯化钠;
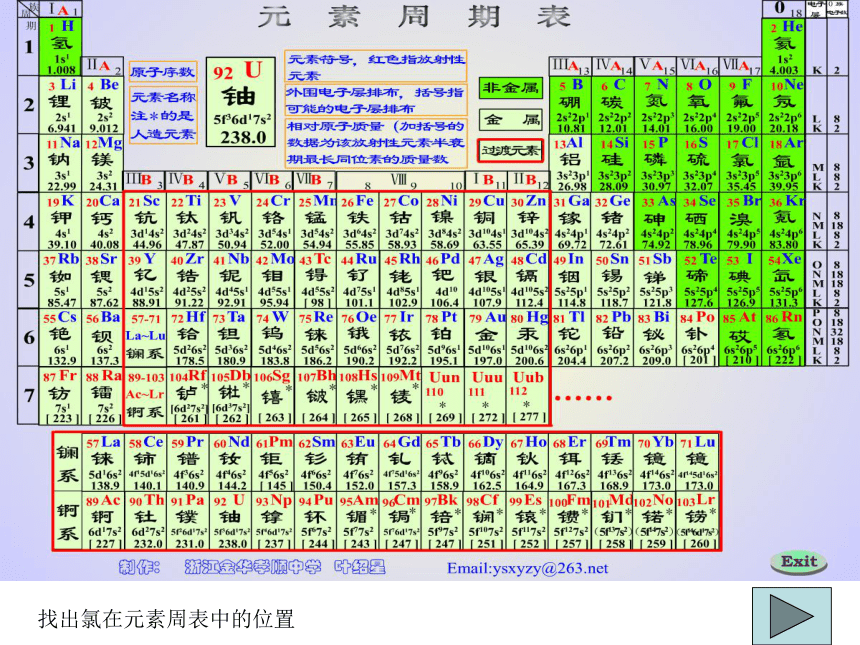
还含有氯化镁、硫酸镁等。若将海水中的盐结晶后平于陆地上,可使陆地平均升高 150米找出氯在元素周表中的位置一、氯元素
1.存在:在海水中主要以NaCl的形式存在。Cl2.原子结构第二节 富集在海水中的元素——氯性质:最外层有7e-,易得到1个电子形成Cl-,性质很活泼,表现为典型的非金属性。请根据氯元素的原
子结构示意图,
推测其化学性质?自然界中有没有游离态的氯?如果
没有,人们是怎样制得氯气的呢? 舍勒 (1742~1786)瑞典化学家。
1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称
来自希腊文,有“绿色”的意思。我国早
年译文将其译成“绿气”,后改为氯气。氯气化学式:Cl2思
考
与
交
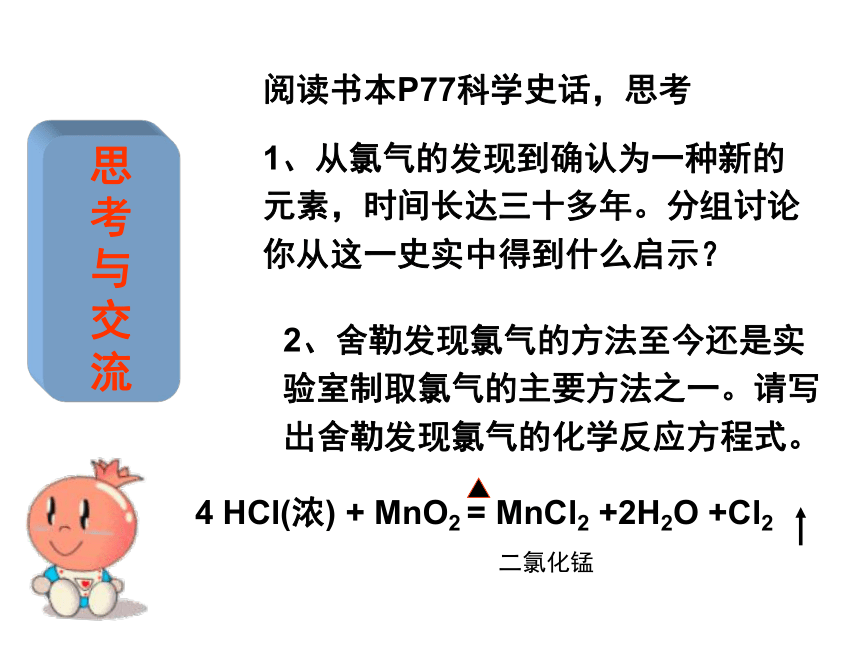
流阅读书本P77科学史话,思考
1、从氯气的发现到确认为一种新的元素,时间长达三十多年。分组讨论你从这一史实中得到什么启示?2、舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式。 京沪高速公路氯气泄漏事件 新华网报道:2005年3月29日,京沪高速公路淮安段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : "一股黄绿色的气体就像探照灯光一样,‘唰’地射向高空,足有5米高,并有刺鼻的味道,眼睛也熏得有些睁不开 。” 事发后消防队员不断地用水枪喷射,但时值西南风,氯气迅速向西南方扩散 ,造成350 人中毒进医院救治, 另有28人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。氯气的物理性质物理性质黄绿色
气体密度比
空气大在水中溶解度不大(1:2)有刺激
性气味有毒 较低(易液化)在实验室里闻氯气时,必须十分小心,应该用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。当闻其它的气体气味时,也应该采用这种方法。 请观察放在桌子上的一瓶氯气,回答氯气有何 物理性质 ?不能用排水集气法
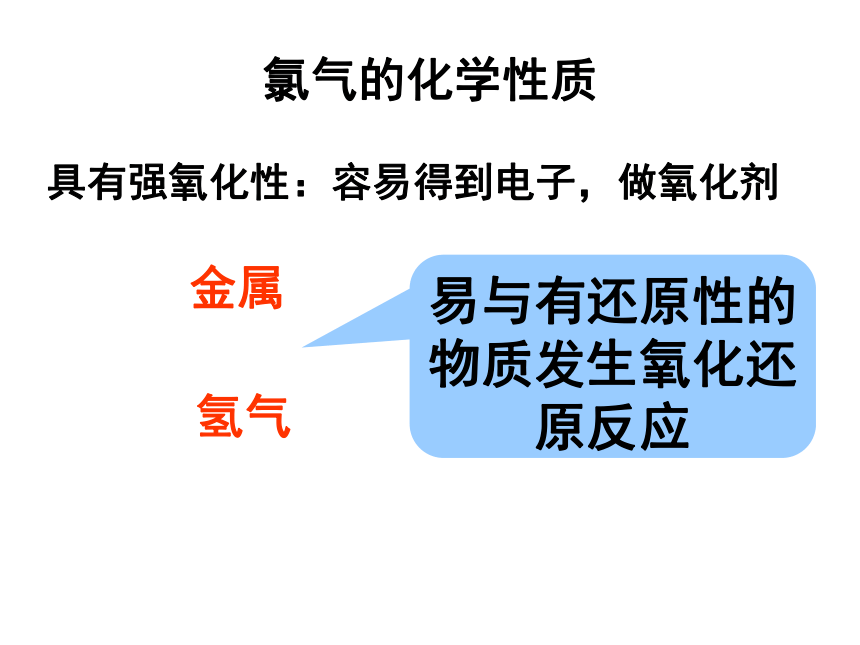
收集氯气黄绿色气体有刺激性气味有毒密度比空气大可溶于水一、氯气的物理性质:氯气的化学性质具有强氧化性:容易得到电子,做氧化剂金属氢气易与有还原性的物质发生氧化还原反应氯气的强氧化性1、与金属反应氯气的强氧化性1、与金属反应二、氯气的化学性质:1、Cl2与金属的反应:2Na + Cl2 === 2 NaCl2Fe + 3Cl2 === 2FeCl3Cl2 + Cu === CuCl2(有黄色火焰,形成白烟)(棕黄色烟,蓝绿色溶液)(发红热,形成棕褐色烟;溶于水后溶液呈棕黄色 )点燃点燃点燃小结:大多数金属都能在一定条件下与氯气化合生成相应的金属氯化物(盐) ,在反应中氯气均作氧化剂,体现出强氧化性 。2、 Cl2与氢气反应现象:
反应式:H2在Cl2中安静燃烧,发出苍白色火焰,产生白雾。 H2+ Cl2 == 2HCl (工业制盐酸)点燃实验4-3 Cl2与氢气反应的实验,
注意观察现象通过对H2在Cl2中燃烧的实验,你对燃烧的条件及本质有什么新的认识? (1)燃烧不一定有氧气参加。
(2)所有发光放热的剧烈的化学 反应都叫做燃烧。
(3)燃烧的本质是发生了氧化还原反应.思考与交流 你是否试过打开自来水,会闻到一股刺激性的气味?这是什么原因?3、氯气与水反应Cl2 + H2O = HCl + HClOHClO是比碳酸还弱的酸,易分解,具有强氧化性,漂白性和杀菌能力。2HClO==2HCl+O2 ↑光照干燥红纸没有褪色,润湿红纸褪色。实验4-4及4-5现象:氯水性质小结:1、氯水:氯气的水溶液;黄绿色。2、氯水的强氧化性—次氯酸具有强氧化性。3、氯水的不稳定性—次氯酸不稳定。4、氯水的酸性—盐酸、次氯酸电离出H+。5、氯水的成份:分子(H2O Cl2 HCl0)
离子(H+ Cl- ClO- OH- )氯水的性质氯水的成分
Cl2
HClO
H+
Cl-氧化性:2KI + Cl2 = 2KCl + I2
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-漂白性:使有色布条、品红褪色酸性:使石蕊变红
Zn + 2H+ = Zn2+ + H2Cl- + Ag+ = AgCl↓1、下列关于氯水的叙述正确的是(??? )。
A 新制氯水中只含Cl2和H2O分子
B 新制氯水可使紫色石蕊试液先变红,后褪色
C 光照氯水有气泡逸出,该气体是Cl2
D 氯水放置数天后pH值变小
2、将下列物质分别滴加到干燥的红色布条上,不能使其褪色的是(??? )。
A、新制的氯水 B 、盐酸
C、液氯???? D、盐酸与次氯酸钠的混合溶液
随堂练习3、氯气能使湿润的蓝色石蕊试纸
A、褪色 B、变成红色
C、先褪色后变红 D、先变红后褪色 ①一元弱酸 (酸性比碳酸还弱)
②强氧化性 (杀菌、消毒)
③漂白性 (强氧化性的表现)
④不稳定易分解1.下列叙述正确的是( )
A.氯原子和氯离子的化学性质相同。
B.氯离子比氯原子多一个电子。
C.氯气有毒,氯离子也有毒。
D.氯气和氯离子都呈黄绿色。练习:2.下列氯化物中,能直接利用金属与稀盐酸反应得到的是( )
A.氯化铁 B.氯化铜
C.氯化银 D.氯化亚铁BD4. 氯气的实验室制备(原理、试剂、仪器、装置、验满、尾气处理)5. 氯气的用途 P79新制的氯水有什么性质?
能与那些物质发生反应?方案一:检验Cl-( )
方案二:检验H+ ( )酸化的硝酸银酸碱指示剂如何验证氯气与水发生了反应?思考新制氯水与久置氯水有何区别?关于氯水的成分,新制氯水与久置的氯水相比,成分相同吗?
干燥的氯气与湿润的氯气在性质上有区别吗?
液氯与氯水是否相同?富集在海水中的元素——氯
第二课时复习:上节课学习了氯气的哪些重要化学性质?这节课我们继续学习氯气的另一种重要的化学性质。 二、氯气的化学性质 4、与碱反应 实 验
将滴有酚酞的氢氧化钠溶液
滴入充满氯气的集气瓶中,振荡思考:氯气能与碱反应吗?
+ +
NaOH NaOH
NaCl+H2O NaClO+H2O
总式 Cl2+2NaOH=NaCl+NaClO+H2O
(漂白液的制取原理)Cl2+H2O====HCl + HClO有毒的氯气尾气用NaOH溶液进行尾气吸收处理2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO) 2 +2H2O制漂白粉: 练习:
请写出氯气与熟石灰
反应的化学方程式次氯酸钙有
效
成
份漂白粉以上充分反应可得较多的Ca(ClO) 2 (制漂粉精)Ca(ClO) 2 +H2O+ CO2= CaCO3 ↓+2HClO漂白粉起效时:次氯酸钙次氯酸次氯酸盐比次氯酸稳定更有利于贮存和运输课后习题5
你认为购置漂白粉或
漂白粉精时应注意哪些问题?练习漂白精
漂白粉
漂白液
比较下列三者的异同氯气的检验:用润湿的KI-淀粉试纸,当存在氯气时试纸由白色变为蓝色 如果你在氯气事故
现场,你该采取哪
些应急措施?2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
Cl2 + 2Br- == 2Cl- + Br2
Cl2 + 2 I- == 2Cl- + I2 2 == 2NaCl + Br2
2 == 2NaCl + I2(5) 与盐溶液的反应与FeCl2 、NaBr、KI等盐溶液反应 2FeCl2 + Cl2 == 2FeCl3--- 氯气的强氧化性Cl2+ NaBr
Cl2+ NaI阅读80页《科学视野》三、氯离子的检验实验:P74实验4-6方法:先加稀硝酸,后加硝酸银溶液
或:先加硝酸银溶液,后加稀硝酸
生成白色沉淀不溶于稀硝酸
结论:检验试剂—硝酸银、干扰离子— CO32-等排除干扰试剂—硝酸1、下列关于氯水的叙述正确的是(??? )。
A 新制氯水中只含Cl2和H2O分子
B 新制氯水可使紫色石蕊试液先变红,后褪色
C 光照氯水有气泡逸出,该气体是Cl2
D 氯水放置数天后pH值变小
2、将下列物质分别滴加到干燥的红色布条上,不能使其褪色的是(??? )。
A、新制的氯水 B 、盐酸
C、液氯???? D、盐酸与次氯酸钠的混合溶液
随堂练习3、当有大量Cl2逸出在周围空间时,可以用含有一定浓度某种物质的水溶液的毛巾捂住鼻子,该物质最好是:
A、NaOH B、NaCl
C、KBr D、Na2CO34、下列物质既能由两种单质化合而生成,又能由单质与酸反应而生成的是:
A、FeCl2 B、CuCl2
C、AlCl3 D、FeCl35、氯气能使湿润的蓝色石蕊试纸
A、褪色 B、变成红色
C、先褪色后变红 D、先变红后褪色 ①一元弱酸 (酸性比碳酸还弱)
②强氧化性 (杀菌、消毒)
③漂白性 (强氧化性的表现)
④不稳定易分解4. 氯气的实验室制备(原理、试剂、仪器、装置、验满、尾气处理)5. 氯气的用途 P79新制的氯水有什么性质?
能与那些物质发生反应?方案一:检验Cl-( )
方案二:检验H+ ( )酸化的硝酸银酸碱指示剂如何验证氯气与水发生了反应?思考新制氯水与久置氯水有何区别?关于氯水的成分,新制氯水与久置的氯水相比,成分相同吗?
干燥的氯气与湿润的氯气在性质上有区别吗?
液氯与氯水是否相同?是HClO还是ClO-有漂白能力?全部是ClO—时,还有漂白性吗?那么,为什么需要碱性环境?实验探究
——氯 (第一课时)海水中含盐3%,主要为氯化钠;
还含有氯化镁、硫酸镁等。若将海水中的盐结晶后平于陆地上,可使陆地平均升高 150米找出氯在元素周表中的位置一、氯元素
1.存在:在海水中主要以NaCl的形式存在。Cl2.原子结构第二节 富集在海水中的元素——氯性质:最外层有7e-,易得到1个电子形成Cl-,性质很活泼,表现为典型的非金属性。请根据氯元素的原
子结构示意图,
推测其化学性质?自然界中有没有游离态的氯?如果
没有,人们是怎样制得氯气的呢? 舍勒 (1742~1786)瑞典化学家。
1774年舍勒 发现氯气
他将这种元素命名为Chlorine,这个名称
来自希腊文,有“绿色”的意思。我国早
年译文将其译成“绿气”,后改为氯气。氯气化学式:Cl2思
考
与
交
流阅读书本P77科学史话,思考
1、从氯气的发现到确认为一种新的元素,时间长达三十多年。分组讨论你从这一史实中得到什么启示?2、舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式。 京沪高速公路氯气泄漏事件 新华网报道:2005年3月29日,京沪高速公路淮安段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : "一股黄绿色的气体就像探照灯光一样,‘唰’地射向高空,足有5米高,并有刺鼻的味道,眼睛也熏得有些睁不开 。” 事发后消防队员不断地用水枪喷射,但时值西南风,氯气迅速向西南方扩散 ,造成350 人中毒进医院救治, 另有28人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。氯气的物理性质物理性质黄绿色
气体密度比
空气大在水中溶解度不大(1:2)有刺激
性气味有毒 较低(易液化)在实验室里闻氯气时,必须十分小心,应该用手在瓶口轻轻地扇动,仅使极少量的氯气飘入鼻孔。当闻其它的气体气味时,也应该采用这种方法。 请观察放在桌子上的一瓶氯气,回答氯气有何 物理性质 ?不能用排水集气法
收集氯气黄绿色气体有刺激性气味有毒密度比空气大可溶于水一、氯气的物理性质:氯气的化学性质具有强氧化性:容易得到电子,做氧化剂金属氢气易与有还原性的物质发生氧化还原反应氯气的强氧化性1、与金属反应氯气的强氧化性1、与金属反应二、氯气的化学性质:1、Cl2与金属的反应:2Na + Cl2 === 2 NaCl2Fe + 3Cl2 === 2FeCl3Cl2 + Cu === CuCl2(有黄色火焰,形成白烟)(棕黄色烟,蓝绿色溶液)(发红热,形成棕褐色烟;溶于水后溶液呈棕黄色 )点燃点燃点燃小结:大多数金属都能在一定条件下与氯气化合生成相应的金属氯化物(盐) ,在反应中氯气均作氧化剂,体现出强氧化性 。2、 Cl2与氢气反应现象:
反应式:H2在Cl2中安静燃烧,发出苍白色火焰,产生白雾。 H2+ Cl2 == 2HCl (工业制盐酸)点燃实验4-3 Cl2与氢气反应的实验,
注意观察现象通过对H2在Cl2中燃烧的实验,你对燃烧的条件及本质有什么新的认识? (1)燃烧不一定有氧气参加。
(2)所有发光放热的剧烈的化学 反应都叫做燃烧。
(3)燃烧的本质是发生了氧化还原反应.思考与交流 你是否试过打开自来水,会闻到一股刺激性的气味?这是什么原因?3、氯气与水反应Cl2 + H2O = HCl + HClOHClO是比碳酸还弱的酸,易分解,具有强氧化性,漂白性和杀菌能力。2HClO==2HCl+O2 ↑光照干燥红纸没有褪色,润湿红纸褪色。实验4-4及4-5现象:氯水性质小结:1、氯水:氯气的水溶液;黄绿色。2、氯水的强氧化性—次氯酸具有强氧化性。3、氯水的不稳定性—次氯酸不稳定。4、氯水的酸性—盐酸、次氯酸电离出H+。5、氯水的成份:分子(H2O Cl2 HCl0)
离子(H+ Cl- ClO- OH- )氯水的性质氯水的成分
Cl2
HClO
H+
Cl-氧化性:2KI + Cl2 = 2KCl + I2
2Fe2+ + Cl2 = 2Fe3+ + 2Cl-漂白性:使有色布条、品红褪色酸性:使石蕊变红
Zn + 2H+ = Zn2+ + H2Cl- + Ag+ = AgCl↓1、下列关于氯水的叙述正确的是(??? )。
A 新制氯水中只含Cl2和H2O分子
B 新制氯水可使紫色石蕊试液先变红,后褪色
C 光照氯水有气泡逸出,该气体是Cl2
D 氯水放置数天后pH值变小
2、将下列物质分别滴加到干燥的红色布条上,不能使其褪色的是(??? )。
A、新制的氯水 B 、盐酸
C、液氯???? D、盐酸与次氯酸钠的混合溶液
随堂练习3、氯气能使湿润的蓝色石蕊试纸
A、褪色 B、变成红色
C、先褪色后变红 D、先变红后褪色 ①一元弱酸 (酸性比碳酸还弱)
②强氧化性 (杀菌、消毒)
③漂白性 (强氧化性的表现)
④不稳定易分解1.下列叙述正确的是( )
A.氯原子和氯离子的化学性质相同。
B.氯离子比氯原子多一个电子。
C.氯气有毒,氯离子也有毒。
D.氯气和氯离子都呈黄绿色。练习:2.下列氯化物中,能直接利用金属与稀盐酸反应得到的是( )
A.氯化铁 B.氯化铜
C.氯化银 D.氯化亚铁BD4. 氯气的实验室制备(原理、试剂、仪器、装置、验满、尾气处理)5. 氯气的用途 P79新制的氯水有什么性质?
能与那些物质发生反应?方案一:检验Cl-( )
方案二:检验H+ ( )酸化的硝酸银酸碱指示剂如何验证氯气与水发生了反应?思考新制氯水与久置氯水有何区别?关于氯水的成分,新制氯水与久置的氯水相比,成分相同吗?
干燥的氯气与湿润的氯气在性质上有区别吗?
液氯与氯水是否相同?富集在海水中的元素——氯
第二课时复习:上节课学习了氯气的哪些重要化学性质?这节课我们继续学习氯气的另一种重要的化学性质。 二、氯气的化学性质 4、与碱反应 实 验
将滴有酚酞的氢氧化钠溶液
滴入充满氯气的集气瓶中,振荡思考:氯气能与碱反应吗?
+ +
NaOH NaOH
NaCl+H2O NaClO+H2O
总式 Cl2+2NaOH=NaCl+NaClO+H2O
(漂白液的制取原理)Cl2+H2O====HCl + HClO有毒的氯气尾气用NaOH溶液进行尾气吸收处理2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO) 2 +2H2O制漂白粉: 练习:
请写出氯气与熟石灰
反应的化学方程式次氯酸钙有
效
成
份漂白粉以上充分反应可得较多的Ca(ClO) 2 (制漂粉精)Ca(ClO) 2 +H2O+ CO2= CaCO3 ↓+2HClO漂白粉起效时:次氯酸钙次氯酸次氯酸盐比次氯酸稳定更有利于贮存和运输课后习题5
你认为购置漂白粉或
漂白粉精时应注意哪些问题?练习漂白精
漂白粉
漂白液
比较下列三者的异同氯气的检验:用润湿的KI-淀粉试纸,当存在氯气时试纸由白色变为蓝色 如果你在氯气事故
现场,你该采取哪
些应急措施?2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
Cl2 + 2Br- == 2Cl- + Br2
Cl2 + 2 I- == 2Cl- + I2 2 == 2NaCl + Br2
2 == 2NaCl + I2(5) 与盐溶液的反应与FeCl2 、NaBr、KI等盐溶液反应 2FeCl2 + Cl2 == 2FeCl3--- 氯气的强氧化性Cl2+ NaBr
Cl2+ NaI阅读80页《科学视野》三、氯离子的检验实验:P74实验4-6方法:先加稀硝酸,后加硝酸银溶液
或:先加硝酸银溶液,后加稀硝酸
生成白色沉淀不溶于稀硝酸
结论:检验试剂—硝酸银、干扰离子— CO32-等排除干扰试剂—硝酸1、下列关于氯水的叙述正确的是(??? )。
A 新制氯水中只含Cl2和H2O分子
B 新制氯水可使紫色石蕊试液先变红,后褪色
C 光照氯水有气泡逸出,该气体是Cl2
D 氯水放置数天后pH值变小
2、将下列物质分别滴加到干燥的红色布条上,不能使其褪色的是(??? )。
A、新制的氯水 B 、盐酸
C、液氯???? D、盐酸与次氯酸钠的混合溶液
随堂练习3、当有大量Cl2逸出在周围空间时,可以用含有一定浓度某种物质的水溶液的毛巾捂住鼻子,该物质最好是:
A、NaOH B、NaCl
C、KBr D、Na2CO34、下列物质既能由两种单质化合而生成,又能由单质与酸反应而生成的是:
A、FeCl2 B、CuCl2
C、AlCl3 D、FeCl35、氯气能使湿润的蓝色石蕊试纸
A、褪色 B、变成红色
C、先褪色后变红 D、先变红后褪色 ①一元弱酸 (酸性比碳酸还弱)
②强氧化性 (杀菌、消毒)
③漂白性 (强氧化性的表现)
④不稳定易分解4. 氯气的实验室制备(原理、试剂、仪器、装置、验满、尾气处理)5. 氯气的用途 P79新制的氯水有什么性质?
能与那些物质发生反应?方案一:检验Cl-( )
方案二:检验H+ ( )酸化的硝酸银酸碱指示剂如何验证氯气与水发生了反应?思考新制氯水与久置氯水有何区别?关于氯水的成分,新制氯水与久置的氯水相比,成分相同吗?
干燥的氯气与湿润的氯气在性质上有区别吗?
液氯与氯水是否相同?是HClO还是ClO-有漂白能力?全部是ClO—时,还有漂白性吗?那么,为什么需要碱性环境?实验探究
