人教版高中化学课件 选修三2.1 共价键 (共32张PPT)
文档属性
| 名称 | 人教版高中化学课件 选修三2.1 共价键 (共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 562.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 14:15:39 | ||
图片预览










文档简介
课件32张PPT。第一节 共价键氢原子的1s电子云的物理意义是什么?如何描述氮原子的核外电子排布情况?
提示 处于1s轨道上的电子在空间出现的概率分布呈球形对称,而且电子在原子核附近单位体积内出现的概率大,离核越远,单位体积内电子出现的概率越小。
氮原子的核外电子排布情况可用核外电子排布式1s22s22p3来表示。1.化学反应的实质是什么?化学反应为什么会伴随能量的变化?
提示 化学反应的实质是旧键的断裂和新键的形成。
旧键的断裂需要吸收能量,新键的形成需要释放能量,所以化学反应会吸收或释放能量,物质变化的同时伴有能量的变化。
2.1.知道共价键的类型,理解σ键和π键的特征。
2.掌握键能、键长、键角等键参数与共价键及分子性质
的关系。
3.知道等电子原理,并能解释有关的现象。σ键
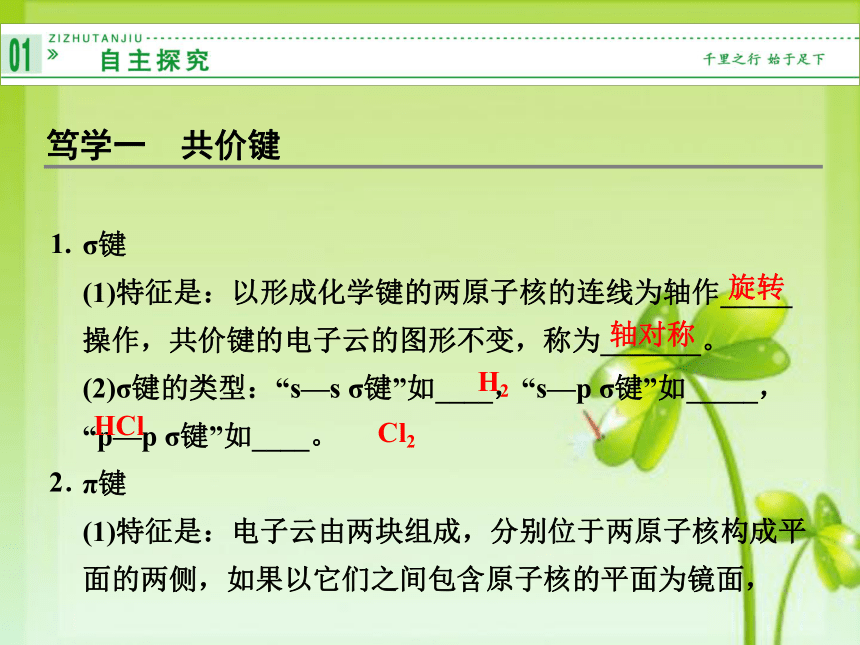
(1)特征是:以形成化学键的两原子核的连线为轴作_____操作,共价键的电子云的图形不变,称为_______。
(2)σ键的类型:“s—s σ键”如____,“s—p σ键”如_____,“p—p σ键”如____。
π键
(1)特征是:电子云由两块组成,分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,笃学一 共价键1.2.旋转轴对称H2HClCl2它们互为_____,称为_________。
(2)π键的类型:常见的:p—p π键。
(3)强度:不如σ键大,易______。
σ键、π键的存在规律
共价单键为___键;共价双键中有一个___键、一个___
键;共价三键由一个___键和两个___键组成。
3.镜像镜像对称断裂σσπσπ键能:______________________化学键释放的________。
键能越___,化学键越______。
键长:形成共价键的两个原子之间的________。键长越___,键能越___,共价键越_____。
键角:在原子数_______的分子中,___________的夹角。键角是描述分子__________的重要参数。
笃学二 键参数1.2.3.气态基态原子形成1mol大稳定核间距短大稳定最低能量超过2两个共价键立体结构等电子原理是指_________相同、___________相同的分子具有相似的化学键特征,它们的许多性质(主要是物理性质)是相近的。笃学三 等电子原理原子总数价电子总数 画出H2中σ键的形成过程示意图。
提示
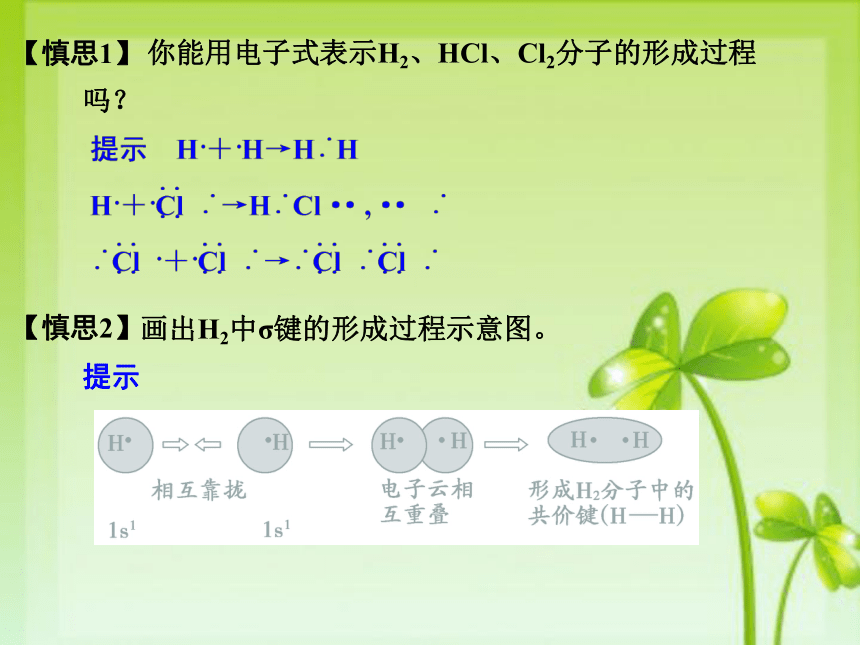
【慎思2】 你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
【慎思1】 N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
提示 由教材表2-1中键能的数值可知:H—F>H—O>H—N,而键长:H—F<H—O<H—N,说明分子的稳定性:HF>H2O>NH3,所以N2、O2、F2跟H2的反应能力依次增强。【慎思4】 画出p电子和p电子形成π键的过程示意图。
提示
【慎思3】要点一 | σ键与π键特点的比较 下列说法中,不正确的是 ( )。
A.σ键比π键的重叠程度大,形成的共价键强度大
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键、2个π键
解析 本题考查的是σ键、π键的区别与联系。从原子轨道重叠程度看,π键轨道的重叠程度比σ键轨道的重叠程度小,故π键的稳定性弱于σ键;在单质分子中存在σ键(如Cl2、H2)、π键(如N2中存在σ键和π键);稀有气体为单原子分子,不存在化学键。故正确答案为C。
答案 C
【例1】? 下列有关σ键和π键的说法错误的是 ( )。
A.含有π键的分子在反应时,π键是化学反应的积极参与
者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不
能形成π键
D.在分子中,化学键可能只有π键而没有σ键
【体验1】?解析 本题主要考查σ键和π键的形成。由于π键的键能小于σ键的键能,所以反应时易断裂,A项正确;在分子形成时为了使其能量最低,必然首先形成σ键,根据形成的原子的核外电子排布来判断是否形成π键,所以B项正确,D项错误;像H、Cl原子跟其他原子只能形成σ键,故C项正确。
答案 D
共价键的键能和键长反映了共价键的强弱程度,键长和键角常被用来描述分子的空间构型。
一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。如HF、HCl、HBr、HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI,氧族元素气态氢化物的稳定性递变规律可用类似的方法加以解释。同理,可用共价键牢固程度解释酸性HF<HCl<HBr<HI及H2S<H2Se<H2Te。
要点二 | 键参数的应用1.2.当两个原子形成共价键时,原子轨道发生重叠,重叠程度越大,键长越短,键能越大。
有机物中碳原子与碳原子形成的共价键的键长规律如下:C—C>C===C>CC。
键能与化学反应过程中的能量关系
化学反应的实质是反应物分子内旧化学键的断裂和生成物分子内新化学键的形成。
化学反应过程中,旧键断裂所吸收的总能量大于新键形成所放出的总能量,反应为吸热反应,否则,反应为放热反应。
3.4.5. 关于键长,键能和键角,下列说法中不正确的是 ( )。
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.C===C键等于C—C键键能的2倍
D.因为O—H键的键能小于H—F键的键能,所以O2、F2与
H2反应的能力逐渐增强
【例2】?解析 键角是描述分子立体结构的重要参数,如H2O中两个H—O键的键角为105°,故H2O为V形分子,A项正确;键长的大小与成键原子的半径有关,如Cl的原子半径小于I的原子半径,Cl—Cl键的键长小于I—I键的键长,此外,键长还和成键数目有关,如乙烯分子中C===C键的键长比乙炔分子中CC键的键长要大,B项正确;C===C键的键能为615 kJ·mol-1,C—C键的键能为347.7 kJ·mol-1,二者不是2倍的关系,C项错误;O —H键的键能为462.8 kJ·mol-1,H —F键的键能为568 kJ·mol-1,O—H键与H—F键的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定,O2、F2跟H2反应的能力依次增强,D项正确。
答案 C
下列说法中正确的是 ( )。
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的第I A族(除H外)和第ⅦA族元素的原
子间可能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键的键能为467 kJ·mol-1,即18 g H2O分解成H2和
O2时,消耗能量为934 kJ【体验2】?解析 D项中,H—O键键能为467 kJ·mol-1,指的是气态基态氢原子和氧原子形成1 mol H—O 键时释放的最低能量,则拆开 1 mol H—O键形成气态氢原子和氧原子所需吸收的能量也为467 kJ,18 g H2O即 1 mol H2O中含2 mol H—O键,断开时需吸收934 kJ的能量形成气态氢原子和氧原子,再进一步形成H2和O2时,还需释放出一部分能量,故需知H—H键和O===O键的键能,D项错误;查表知Li 的电负性为1.0,I的电负性为2.5,其差值为1.5<1.7,所以LiI中存在共价键,B项正确。
答案 B
判断方法:原子总数相同,价电子总数相同的分子。
应用:等电子体的许多性质是相近的,空间构型是相同的。利用等电子体可以:
(1)判断一些简单分子或离子的立体构型;
(2)利用等电子体在性质上的相似性制造新材料;
(3)利用等电子原理针对某物质找等电子体。
要点三 | 等电子体的判断和应用1.2.一些常见的等电子体
二原子10电子的等电子体:N2、CO、CN-、C22-
二原子11电子的等电子体:NO、O2+
三原子16电子的等电子体:CO2、CS2、N2O、CNO-、
N3-
三原子18电子的等电子体:NO2-、O3、SO2
四原子24电子的等电子体:NO3-、CO32-、BF3、SO3(g)
3. (1)根据等电子原理,仅由第二周期元素组成的共价分子中,互为等电子体的是: 和 ; 和 。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 。【例3】?解析 (1)仅由第二周期元素组成的共价分子中,即C、N、O、F组成的共价分子,如N2与CO价电子总数均为10,CO2与N2O价电子总数均为16个电子。
(2)依题意,只要原子数相同,各原子最外层电子数之和也相同,可互称等电子体,NO2-为三原子,各原子最外层电子数之和为(5+6×2+1),SO2、O3也为三原子,各原子最外层电子数之和为6×3=18。
答案 (1)N2 CO CO2 N2O (2)SO2、O3
1991年,Langmuir提出:“凡原子数与价电子总数均相等的物质,其结构相同,物理性质相近”,称为等电子原理。相应的物质,互称为等电子体。化学科学家常用“等电子体”来预测不同物质的结构与性质。例如,CH4与NH4+有相同的价电子数及空间构型。
请你根据等电子原理在下表空格处填上相应的化学式:
【体验3】?解析 本题考查等电子原理的应用。等电子体的要求是必须具有相同的原子总数和价电子总数,分子与离子也可以是等电子体。N2H62+是含有8个原子和14个价电子的微粒,比NH4+多3个原子和6个价电子,NH4+与CH4互为等电子体,而比CH4多3个原子和6个价电子的微粒为C2H6,同理可得其他几组答案。
答案 见下表:
概念
在元素符号周围用小黑点(·)或叉(×)表示原子或离子的最外层电子的式子叫做电子式。
原子的电子式
书写原子的电子式时,一般将原子的最外层电子写在元素符号上、下、左、右四个位置上。如:
氢原子 钙原子 氮原子 氧原子 氯原子
【探究原理】1.2.实验探究三 电子式的书写方法离子的电子式
书写离子的电子式时,由于简单阳离子是原子失去最外层电子后形成的,故只写其元素符号,并在元素符号的右上角注明所带电荷数,如Na+、Mg2+等;由于简单阴离子得到电子后最外层一般为8电子稳定结构,书写时要在元素符号周围标出电子,用“[ ]”括起来,并在右上角注明所带电荷数,如 等;较复杂的阴、阳离子一般也要用“[ ]”括起来,例如
等。
3.用电子式表示共价化合物、离子化合物的形成过程。例如:
4.氰(CN)2、(硫氰(SCN)2、氧氰(OCN)2的性质相似,在化学上称为拟卤素。CN-、SCN-、OCN-的性质与卤素离子的性质相似。已知,不同卤素原子能形成卤素互化物,如IBr。HSCN为强酸,HClO、HCN为弱酸。试回答下列问题:
(1)下列物质的电子式,错误的是 ( )。
C.CN-:[··C??N··]-
D.(CN)2:··N??C··C??N··
【问题探究】(2)已知(OCN)2的电子式
则SCN-的电子式为
( )。
答案 (1)B (2)C
提示 处于1s轨道上的电子在空间出现的概率分布呈球形对称,而且电子在原子核附近单位体积内出现的概率大,离核越远,单位体积内电子出现的概率越小。
氮原子的核外电子排布情况可用核外电子排布式1s22s22p3来表示。1.化学反应的实质是什么?化学反应为什么会伴随能量的变化?
提示 化学反应的实质是旧键的断裂和新键的形成。
旧键的断裂需要吸收能量,新键的形成需要释放能量,所以化学反应会吸收或释放能量,物质变化的同时伴有能量的变化。
2.1.知道共价键的类型,理解σ键和π键的特征。
2.掌握键能、键长、键角等键参数与共价键及分子性质
的关系。
3.知道等电子原理,并能解释有关的现象。σ键
(1)特征是:以形成化学键的两原子核的连线为轴作_____操作,共价键的电子云的图形不变,称为_______。
(2)σ键的类型:“s—s σ键”如____,“s—p σ键”如_____,“p—p σ键”如____。
π键
(1)特征是:电子云由两块组成,分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,笃学一 共价键1.2.旋转轴对称H2HClCl2它们互为_____,称为_________。
(2)π键的类型:常见的:p—p π键。
(3)强度:不如σ键大,易______。
σ键、π键的存在规律
共价单键为___键;共价双键中有一个___键、一个___
键;共价三键由一个___键和两个___键组成。
3.镜像镜像对称断裂σσπσπ键能:______________________化学键释放的________。
键能越___,化学键越______。
键长:形成共价键的两个原子之间的________。键长越___,键能越___,共价键越_____。
键角:在原子数_______的分子中,___________的夹角。键角是描述分子__________的重要参数。
笃学二 键参数1.2.3.气态基态原子形成1mol大稳定核间距短大稳定最低能量超过2两个共价键立体结构等电子原理是指_________相同、___________相同的分子具有相似的化学键特征,它们的许多性质(主要是物理性质)是相近的。笃学三 等电子原理原子总数价电子总数 画出H2中σ键的形成过程示意图。
提示
【慎思2】 你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
【慎思1】 N2、O2、F2跟H2的反应能力依次增强,从键能的角度应如何理解这一化学事实?
提示 由教材表2-1中键能的数值可知:H—F>H—O>H—N,而键长:H—F<H—O<H—N,说明分子的稳定性:HF>H2O>NH3,所以N2、O2、F2跟H2的反应能力依次增强。【慎思4】 画出p电子和p电子形成π键的过程示意图。
提示
【慎思3】要点一 | σ键与π键特点的比较 下列说法中,不正确的是 ( )。
A.σ键比π键的重叠程度大,形成的共价键强度大
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键、2个π键
解析 本题考查的是σ键、π键的区别与联系。从原子轨道重叠程度看,π键轨道的重叠程度比σ键轨道的重叠程度小,故π键的稳定性弱于σ键;在单质分子中存在σ键(如Cl2、H2)、π键(如N2中存在σ键和π键);稀有气体为单原子分子,不存在化学键。故正确答案为C。
答案 C
【例1】? 下列有关σ键和π键的说法错误的是 ( )。
A.含有π键的分子在反应时,π键是化学反应的积极参与
者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不
能形成π键
D.在分子中,化学键可能只有π键而没有σ键
【体验1】?解析 本题主要考查σ键和π键的形成。由于π键的键能小于σ键的键能,所以反应时易断裂,A项正确;在分子形成时为了使其能量最低,必然首先形成σ键,根据形成的原子的核外电子排布来判断是否形成π键,所以B项正确,D项错误;像H、Cl原子跟其他原子只能形成σ键,故C项正确。
答案 D
共价键的键能和键长反映了共价键的强弱程度,键长和键角常被用来描述分子的空间构型。
一般来讲,形成共价键的两原子半径之和越小,共用电子对数越多,则共价键越牢固,含有该共价键的分子越稳定。如HF、HCl、HBr、HI中,分子的共用电子对数相同(1对),因F、Cl、Br、I的原子半径依次增大,故共价键牢固程度H—F>H—Cl>H—Br>H—I,因此,稳定性HF>HCl>HBr>HI,氧族元素气态氢化物的稳定性递变规律可用类似的方法加以解释。同理,可用共价键牢固程度解释酸性HF<HCl<HBr<HI及H2S<H2Se<H2Te。
要点二 | 键参数的应用1.2.当两个原子形成共价键时,原子轨道发生重叠,重叠程度越大,键长越短,键能越大。
有机物中碳原子与碳原子形成的共价键的键长规律如下:C—C>C===C>CC。
键能与化学反应过程中的能量关系
化学反应的实质是反应物分子内旧化学键的断裂和生成物分子内新化学键的形成。
化学反应过程中,旧键断裂所吸收的总能量大于新键形成所放出的总能量,反应为吸热反应,否则,反应为放热反应。
3.4.5. 关于键长,键能和键角,下列说法中不正确的是 ( )。
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.C===C键等于C—C键键能的2倍
D.因为O—H键的键能小于H—F键的键能,所以O2、F2与
H2反应的能力逐渐增强
【例2】?解析 键角是描述分子立体结构的重要参数,如H2O中两个H—O键的键角为105°,故H2O为V形分子,A项正确;键长的大小与成键原子的半径有关,如Cl的原子半径小于I的原子半径,Cl—Cl键的键长小于I—I键的键长,此外,键长还和成键数目有关,如乙烯分子中C===C键的键长比乙炔分子中CC键的键长要大,B项正确;C===C键的键能为615 kJ·mol-1,C—C键的键能为347.7 kJ·mol-1,二者不是2倍的关系,C项错误;O —H键的键能为462.8 kJ·mol-1,H —F键的键能为568 kJ·mol-1,O—H键与H—F键的键能依次增大,意味着形成这些键时放出的能量依次增大,化学键越来越稳定,O2、F2跟H2反应的能力依次增强,D项正确。
答案 C
下列说法中正确的是 ( )。
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的第I A族(除H外)和第ⅦA族元素的原
子间可能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键的键能为467 kJ·mol-1,即18 g H2O分解成H2和
O2时,消耗能量为934 kJ【体验2】?解析 D项中,H—O键键能为467 kJ·mol-1,指的是气态基态氢原子和氧原子形成1 mol H—O 键时释放的最低能量,则拆开 1 mol H—O键形成气态氢原子和氧原子所需吸收的能量也为467 kJ,18 g H2O即 1 mol H2O中含2 mol H—O键,断开时需吸收934 kJ的能量形成气态氢原子和氧原子,再进一步形成H2和O2时,还需释放出一部分能量,故需知H—H键和O===O键的键能,D项错误;查表知Li 的电负性为1.0,I的电负性为2.5,其差值为1.5<1.7,所以LiI中存在共价键,B项正确。
答案 B
判断方法:原子总数相同,价电子总数相同的分子。
应用:等电子体的许多性质是相近的,空间构型是相同的。利用等电子体可以:
(1)判断一些简单分子或离子的立体构型;
(2)利用等电子体在性质上的相似性制造新材料;
(3)利用等电子原理针对某物质找等电子体。
要点三 | 等电子体的判断和应用1.2.一些常见的等电子体
二原子10电子的等电子体:N2、CO、CN-、C22-
二原子11电子的等电子体:NO、O2+
三原子16电子的等电子体:CO2、CS2、N2O、CNO-、
N3-
三原子18电子的等电子体:NO2-、O3、SO2
四原子24电子的等电子体:NO3-、CO32-、BF3、SO3(g)
3. (1)根据等电子原理,仅由第二周期元素组成的共价分子中,互为等电子体的是: 和 ; 和 。
(2)根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子有: 。【例3】?解析 (1)仅由第二周期元素组成的共价分子中,即C、N、O、F组成的共价分子,如N2与CO价电子总数均为10,CO2与N2O价电子总数均为16个电子。
(2)依题意,只要原子数相同,各原子最外层电子数之和也相同,可互称等电子体,NO2-为三原子,各原子最外层电子数之和为(5+6×2+1),SO2、O3也为三原子,各原子最外层电子数之和为6×3=18。
答案 (1)N2 CO CO2 N2O (2)SO2、O3
1991年,Langmuir提出:“凡原子数与价电子总数均相等的物质,其结构相同,物理性质相近”,称为等电子原理。相应的物质,互称为等电子体。化学科学家常用“等电子体”来预测不同物质的结构与性质。例如,CH4与NH4+有相同的价电子数及空间构型。
请你根据等电子原理在下表空格处填上相应的化学式:
【体验3】?解析 本题考查等电子原理的应用。等电子体的要求是必须具有相同的原子总数和价电子总数,分子与离子也可以是等电子体。N2H62+是含有8个原子和14个价电子的微粒,比NH4+多3个原子和6个价电子,NH4+与CH4互为等电子体,而比CH4多3个原子和6个价电子的微粒为C2H6,同理可得其他几组答案。
答案 见下表:
概念
在元素符号周围用小黑点(·)或叉(×)表示原子或离子的最外层电子的式子叫做电子式。
原子的电子式
书写原子的电子式时,一般将原子的最外层电子写在元素符号上、下、左、右四个位置上。如:
氢原子 钙原子 氮原子 氧原子 氯原子
【探究原理】1.2.实验探究三 电子式的书写方法离子的电子式
书写离子的电子式时,由于简单阳离子是原子失去最外层电子后形成的,故只写其元素符号,并在元素符号的右上角注明所带电荷数,如Na+、Mg2+等;由于简单阴离子得到电子后最外层一般为8电子稳定结构,书写时要在元素符号周围标出电子,用“[ ]”括起来,并在右上角注明所带电荷数,如 等;较复杂的阴、阳离子一般也要用“[ ]”括起来,例如
等。
3.用电子式表示共价化合物、离子化合物的形成过程。例如:
4.氰(CN)2、(硫氰(SCN)2、氧氰(OCN)2的性质相似,在化学上称为拟卤素。CN-、SCN-、OCN-的性质与卤素离子的性质相似。已知,不同卤素原子能形成卤素互化物,如IBr。HSCN为强酸,HClO、HCN为弱酸。试回答下列问题:
(1)下列物质的电子式,错误的是 ( )。
C.CN-:[··C??N··]-
D.(CN)2:··N??C··C??N··
【问题探究】(2)已知(OCN)2的电子式
则SCN-的电子式为
( )。
答案 (1)B (2)C
