人教版高中化学课件 选修三3.3 金属晶体(共40张PPT)
文档属性
| 名称 | 人教版高中化学课件 选修三3.3 金属晶体(共40张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1004.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 21:56:23 | ||
图片预览









文档简介
课件40张PPT。 第三节金属晶体
第二课时重点:
金属晶体的四种堆积模型及简单计算1、下列生活中的问题,不能用金属键知识解释的是 ( )
A、用铁制品做炊具
B、用金属铝制成导线
C、用铂金做首饰
D、铁易生锈D回顾练习回顾练习2、下列物质中含有金属键的是 ( )
A、金属铝 B、合金
C、NaOH D、NH4ClAB3、金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强;与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是 ( )
A、Li Na K B、Na Mg Al
C、Li Be Mg D、Li Na MgB回顾练习回顾练习4、下列有关金属晶体叙述正确的是( )
A、常温下金属单质都以金属晶体形式存在
B、金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C、钙的熔、沸点低于钾
D、温度越高,金属的导电性越好B三、金属晶体的原子堆积模型
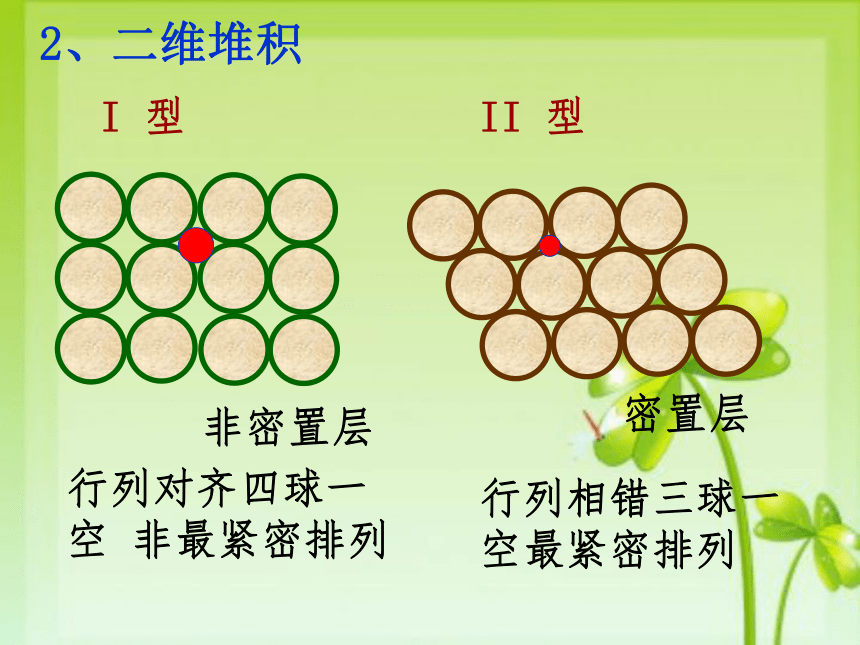
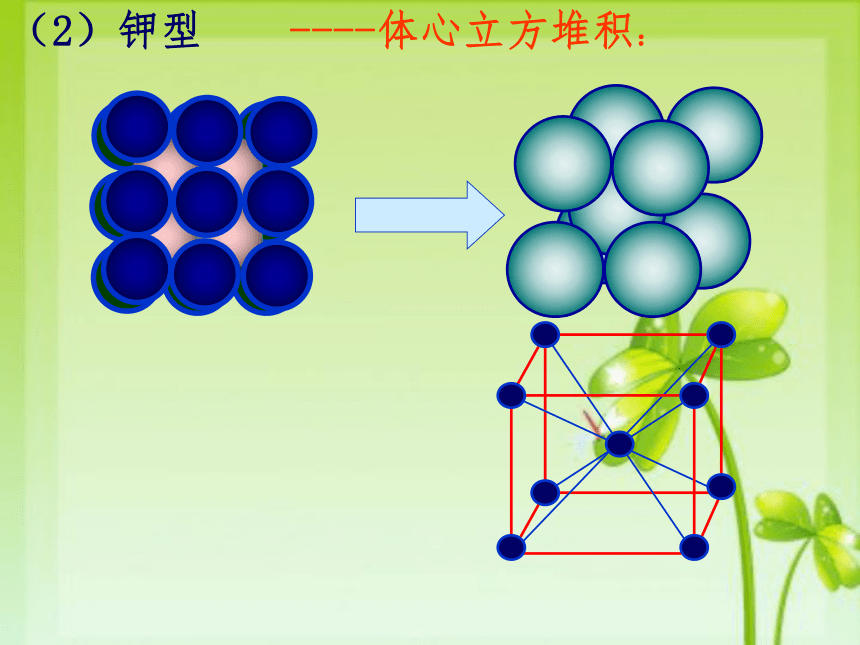
由于金属键没有方向性,每个金属原子中的电子分布基本是球对称的,所以可以把金属晶体看成是由直径相等的圆球的三维空间堆积而成的。1、理论基础:2、二维堆积I 型II 型行列对齐四球一空 非最紧密排列行列相错三球一空最紧密排列密置层非密置层3、三维堆积密置层非密置层(1).简单立方堆积:4、金属晶体基本构型 非最紧密堆积,空间利用率低(52%)配位数是 个.只有金属(Po)采取这种堆积方式(2)钾型----体心立方堆积:
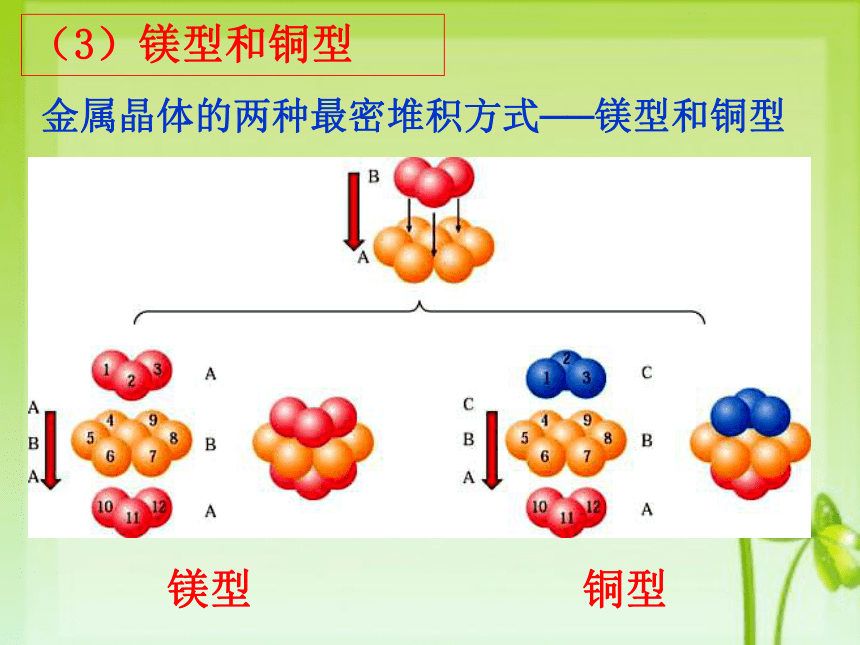
这种堆积晶胞是一个体心立方,每个晶胞每个晶胞含 个原子,空间利用率不高(68%),属于非密置层堆积,配位数为 ,许多金属(如Na、K、Fe等)采取这种堆积方式。12345678金属晶体的两种最密堆积方式──镁型和铜型(3)镁型和铜型镁型铜型镁型铜型 下图是镁型紧密堆积的前视图A此种立方紧密堆积的前视图A 第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方堆积。 配位数 12 。
( 同层 6, 上下层各 3 ) 下图是铜型型紧密堆积的前视图A
C
B
A
C
B
A镁型(立方紧密堆积)123456789101112 这种堆积晶胞空间利用率高(74%),属于最密置层堆集,配位数为 ,许多金属(如Mg、Zn、Ti等)采取这种堆积方式。平行六面体铜型边长 = 2 r
面对角线 = 4r密置层四、金属晶体中有关计算1.晶胞中微粒数的计算(1)简单立方:在立方体顶点的微粒为8个晶胞共享,空间利用率:(2r)34лr3/3= 52.36%微粒数为:8×1/8 = 1(2)体心立方:在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。微粒数为:8×1/8 + 1 = 2空间利用率:体心立方堆积配位数:8 (3)平行六面体晶胞:在六方体顶点的微粒为6个晶胞共有,在体内的微粒全属于该晶胞。微粒数为:2 个 (4)面心立方:在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。微粒数为:
8×1/8 + 6×1/2 = 4 空间利用率:(2×1.414r)34×4лr3/3= 74.05%2.配位数:每个小球周围距离最近的小球数简单立方堆积:体心立方堆积:六方紧密堆积:面心立方紧密堆积:681212面心立方最密堆积堆积方式及性质小结简单立方堆积体心立方密堆积六方最密堆积面心立方六方体心立方简单立方74%74%68%52%121286Cu、Ag、AuMg、Zn、TiNa、K、FePo 例、已知金属铜为面心立方晶体,如图所示,铜的相对原子质量为63.54,密度为8.936g/cm3,试求
(1)图中正方形边长 a,
(2)铜的金属半径 raarrorr提示:
数出面心立方中的铜的个数:在金属晶体中最常见的三种堆积方式有:(1)配位数为8的 堆积,
(2)配位数为 的是立方面心堆积,(3)配位数为 的 堆积。其中以ABAB方式堆积的 和以ABCABC方式堆积的 空间利用率相等,就的堆积层来看,二者的区别是在
第 层。
能力训练立方体心1212六方密堆积立方面心堆积六方密堆积三(1)石墨为什么很软?混合型晶体——石墨(2)石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华
力结合,容易滑动,所以石墨很软。 石墨各层均为平面网状结构,碳原子
之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。石墨晶体结构模型石墨晶体结构俯视图8、右图是石墨的晶体示意图,试思考
回答下列问题
(1)石墨晶体是正六边形的层状结构,
在同一层中,每个碳原子形成几个共价键?键角是多大?
(2)同一层中,平均拥有的碳原子数与共价键的数目比是多少?
(3)石墨是一种质软的物质,可作润滑剂,但它的熔点比金刚石还高。
试从结构上解释
①用它与粘土混合制铅笔芯
②可作电极
③熔点比金刚石高(4)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g) == CO2(g);ΔH=-393.51kJ·mol-1 C(金刚石)+O2(g)==CO2(g);ΔH=-395.41kJ·mol-1据此推理所得到的下列结论中,正确的是
A.金刚石的燃烧热比石墨的燃烧热小
B.石墨晶体中碳碳键的强度小于金刚石
C.石墨的能量比金刚石的能量高
D.由石墨制备金刚石一定是吸热反应
第二课时重点:
金属晶体的四种堆积模型及简单计算1、下列生活中的问题,不能用金属键知识解释的是 ( )
A、用铁制品做炊具
B、用金属铝制成导线
C、用铂金做首饰
D、铁易生锈D回顾练习回顾练习2、下列物质中含有金属键的是 ( )
A、金属铝 B、合金
C、NaOH D、NH4ClAB3、金属键的强弱与金属价电子数的多少有关,价电子数越多金属键越强;与金属阳离子的半径大小也有关,金属阳离子的半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是 ( )
A、Li Na K B、Na Mg Al
C、Li Be Mg D、Li Na MgB回顾练习回顾练习4、下列有关金属晶体叙述正确的是( )
A、常温下金属单质都以金属晶体形式存在
B、金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C、钙的熔、沸点低于钾
D、温度越高,金属的导电性越好B三、金属晶体的原子堆积模型
由于金属键没有方向性,每个金属原子中的电子分布基本是球对称的,所以可以把金属晶体看成是由直径相等的圆球的三维空间堆积而成的。1、理论基础:2、二维堆积I 型II 型行列对齐四球一空 非最紧密排列行列相错三球一空最紧密排列密置层非密置层3、三维堆积密置层非密置层(1).简单立方堆积:4、金属晶体基本构型 非最紧密堆积,空间利用率低(52%)配位数是 个.只有金属(Po)采取这种堆积方式(2)钾型----体心立方堆积:
这种堆积晶胞是一个体心立方,每个晶胞每个晶胞含 个原子,空间利用率不高(68%),属于非密置层堆积,配位数为 ,许多金属(如Na、K、Fe等)采取这种堆积方式。12345678金属晶体的两种最密堆积方式──镁型和铜型(3)镁型和铜型镁型铜型镁型铜型 下图是镁型紧密堆积的前视图A此种立方紧密堆积的前视图A 第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方堆积。 配位数 12 。
( 同层 6, 上下层各 3 ) 下图是铜型型紧密堆积的前视图A
C
B
A
C
B
A镁型(立方紧密堆积)123456789101112 这种堆积晶胞空间利用率高(74%),属于最密置层堆集,配位数为 ,许多金属(如Mg、Zn、Ti等)采取这种堆积方式。平行六面体铜型边长 = 2 r
面对角线 = 4r密置层四、金属晶体中有关计算1.晶胞中微粒数的计算(1)简单立方:在立方体顶点的微粒为8个晶胞共享,空间利用率:(2r)34лr3/3= 52.36%微粒数为:8×1/8 = 1(2)体心立方:在立方体顶点的微粒为8个晶胞共享,处于体心的金属原子全部属于该晶胞。微粒数为:8×1/8 + 1 = 2空间利用率:体心立方堆积配位数:8 (3)平行六面体晶胞:在六方体顶点的微粒为6个晶胞共有,在体内的微粒全属于该晶胞。微粒数为:2 个 (4)面心立方:在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有。微粒数为:
8×1/8 + 6×1/2 = 4 空间利用率:(2×1.414r)34×4лr3/3= 74.05%2.配位数:每个小球周围距离最近的小球数简单立方堆积:体心立方堆积:六方紧密堆积:面心立方紧密堆积:681212面心立方最密堆积堆积方式及性质小结简单立方堆积体心立方密堆积六方最密堆积面心立方六方体心立方简单立方74%74%68%52%121286Cu、Ag、AuMg、Zn、TiNa、K、FePo 例、已知金属铜为面心立方晶体,如图所示,铜的相对原子质量为63.54,密度为8.936g/cm3,试求
(1)图中正方形边长 a,
(2)铜的金属半径 raarrorr提示:
数出面心立方中的铜的个数:在金属晶体中最常见的三种堆积方式有:(1)配位数为8的 堆积,
(2)配位数为 的是立方面心堆积,(3)配位数为 的 堆积。其中以ABAB方式堆积的 和以ABCABC方式堆积的 空间利用率相等,就的堆积层来看,二者的区别是在
第 层。
能力训练立方体心1212六方密堆积立方面心堆积六方密堆积三(1)石墨为什么很软?混合型晶体——石墨(2)石墨的熔沸点为什么很高?石墨为层状结构,各层之间是范德华
力结合,容易滑动,所以石墨很软。 石墨各层均为平面网状结构,碳原子
之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。石墨晶体结构模型石墨晶体结构俯视图8、右图是石墨的晶体示意图,试思考
回答下列问题
(1)石墨晶体是正六边形的层状结构,
在同一层中,每个碳原子形成几个共价键?键角是多大?
(2)同一层中,平均拥有的碳原子数与共价键的数目比是多少?
(3)石墨是一种质软的物质,可作润滑剂,但它的熔点比金刚石还高。
试从结构上解释
①用它与粘土混合制铅笔芯
②可作电极
③熔点比金刚石高(4)已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(石墨)+O2(g) == CO2(g);ΔH=-393.51kJ·mol-1 C(金刚石)+O2(g)==CO2(g);ΔH=-395.41kJ·mol-1据此推理所得到的下列结论中,正确的是
A.金刚石的燃烧热比石墨的燃烧热小
B.石墨晶体中碳碳键的强度小于金刚石
C.石墨的能量比金刚石的能量高
D.由石墨制备金刚石一定是吸热反应
