1.1反应热 课件(共40张PPT) 2024-2025学年人教版(2019)高中化学选择性必修1
文档属性
| 名称 | 1.1反应热 课件(共40张PPT) 2024-2025学年人教版(2019)高中化学选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 11:11:40 | ||
图片预览








文档简介
(共40张PPT)
第一章 化学反应的热效应
第一节 反应热
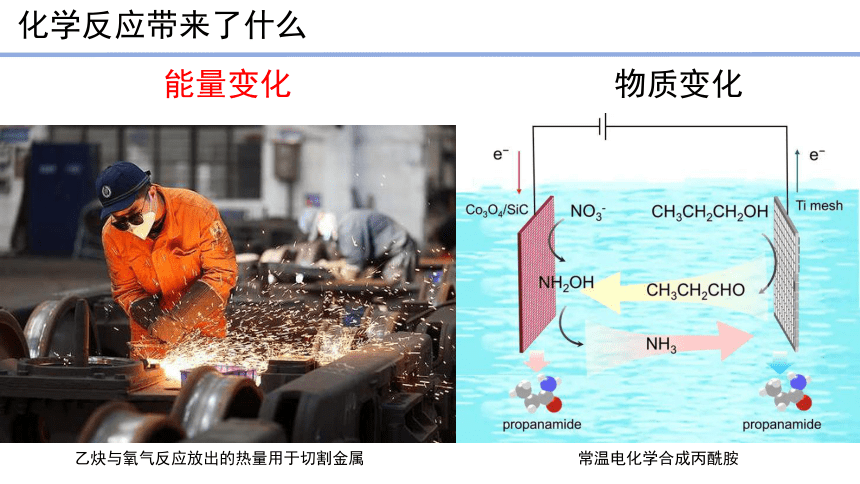
乙炔与氧气反应放出的热量用于切割金属
常温电化学合成丙酰胺
能量变化
物质变化
化学反应带来了什么
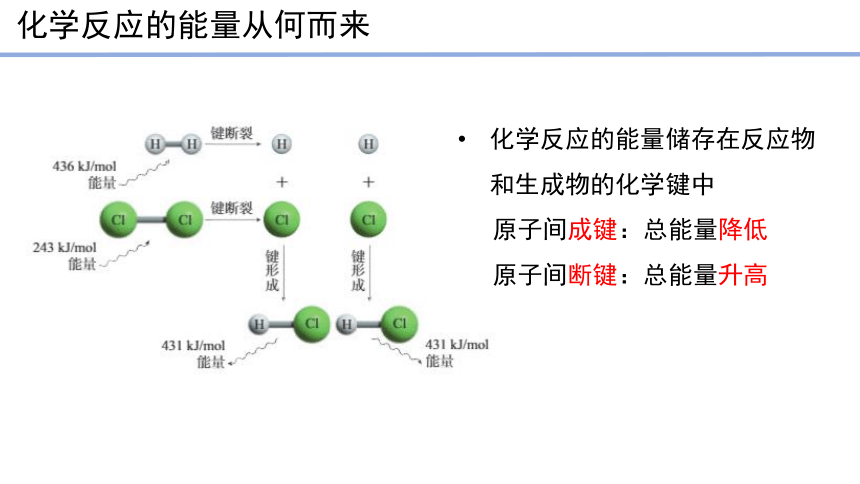
化学反应的能量从何而来
化学反应的能量储存在反应物和生成物的化学键中
原子间成键:总能量降低
原子间断键:总能量升高
能量既不会凭空产生,也不会凭空消失,它只会从一种形式转化为另一种形式,或者从一个物体转移到其它物体,而能量的总量保持不变。能量守恒定律是自然界普遍的基本定律之一。
能量守恒定律
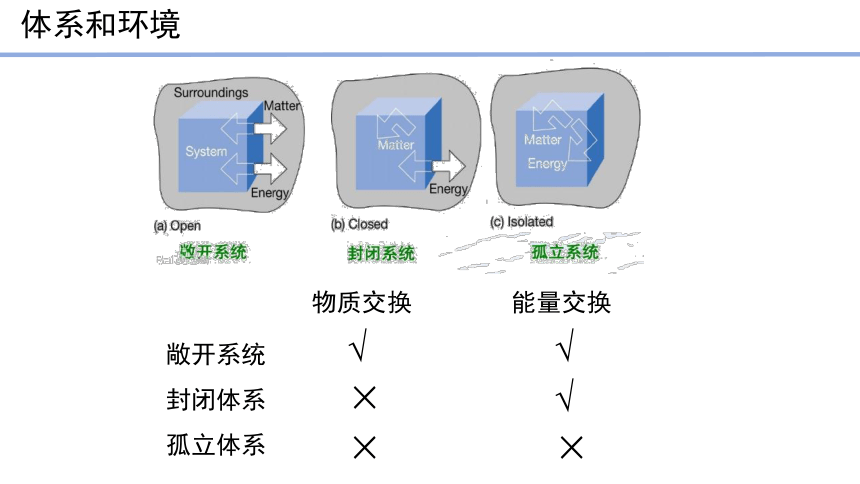
体系和环境
体系:盐酸,NaOH溶液及所发
生的化学反应
HCl + NaOH = NaCl + H2O
环境:试管、试管以外的空气等
研究对象
体系和环境
敞开系统
封闭体系
孤立体系
物质交换
能量交换
√
√
√
×
×
×
反应热
热量的释放或吸收是化学反应中能量变化的常见形式
常见的吸热反应和放热反应
吸热反应
Ba(OH)2 10H2O和NH4Cl的反应
大多数分解反应
C + H2O = CO + H2(制备水煤气)
C + CO2 = 2CO
特例:2H2O2 = 2H2O +O2 ↑
放热反应
燃烧反应
大多数化合反应
酸碱中和反应
金属与酸或水的反应
特例:C + CO2 = 2CO
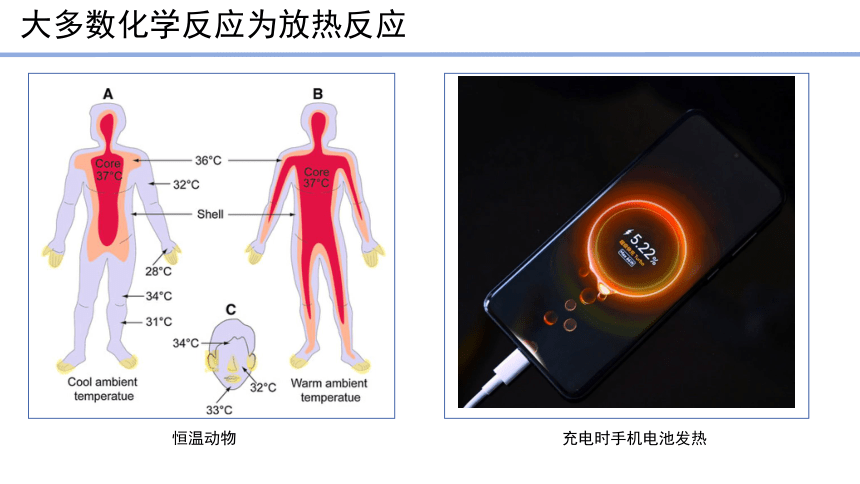
大多数化学反应为放热反应
恒温动物
充电时手机电池发热
反应热
在等温条件下,化学反应体系向环境释放或从环境吸收的热量。称为化学反应的热效应,简称反应热。
反应后体系的温度恢复到室温
反应热的测定
HCl + NaOH = NaCl + H2O
中和反应,放热反应。
测量反应放出的热量?
测量反应前后的温度差。
热量和温度之间有什么关系?
Q = c · m ·Δt,c是比热容,m是反应体系的质量,Δt是温度差。
在实验过程中需要注意什么?
防止反应放出的热量散失(保温)
中和反应反应热的测定
① 反应物温度(t1 ℃)的测量
用一量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度,取两温度平均值为t1 ℃。
为保证盐酸完全被中和,采用稍过量的NaOH。
② 反应后体系温度(t2 ℃)的测量
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度t2 ℃。
中和反应反应热的测定
③ 重复上述实验操作3次,记录每次的实验数据,取其平均值作为计算依据,其中如果有数据明显偏离正常值,该数据应舍去。
中和反应反应热的测定
数据处理
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm-3,反应后溶液的比热容c=4.18 J/(g·℃)。盐酸、氢氧化钠溶液的质量均为50g,m=100g;温度差Δt=(t1-t2)。
Q = c · m ·Δt
生成0.025mol H2O时放出的热量
生成1mol H2O时放出的热量
×40
Q
×40
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
中和反应反应热的测定
【例题】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题。
(1) 所用NaOH溶液要稍过量的目的是________________________________。
保证盐酸完全被中和
(2) 倒入NaOH溶液的正确操作是________(填字母,下同)。
A. 沿玻璃棒缓慢倒入 B. 分三次倒入 C. 一次迅速倒入
(3) 使盐酸与NaOH溶液混合均匀的正确操作是________。
A. 用温度计小心搅拌
B. 揭开硬纸片用玻璃棒搅拌
C.用金属搅拌棒搅拌
D. 轻轻地振荡烧杯
E.用套在温度计上的玻璃搅拌器轻轻地搅动
中和反应反应热的测定
C
E
(4) 假设盐酸和氢氧化钠溶液的密度都是 1 g/cm3,又知反应后溶液的比热容c=4.18 J/(g·℃)。为了计算反应热,某学生实验记录数据如下:
实验 序号 起始温度T1/ ℃ 终止温度T2/ ℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该学生的实验数据计算:该反应生成1molH2O时放出的热量为_________(结果保留一位小数)。
中和反应反应热的测定
52.7kJ
(5)哪些操作可能导致测量结果偏小?
导致热量损失的操作,都有可能使测量结果偏小。
50 mL 0.50 mol/L盐酸
50 mL 0.55 mol/L NaOH溶液
20.25 ℃
23.4 ℃
中和反应反应热的测定
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
由于弱酸和弱碱的电离会吸热,因此,弱酸、弱碱在发生中和反应生成1mol水时,放出的热量小于57.3 kJ。
反应热的表示
等压条件下进行的化学反应,其反应热等于焓变。符号为ΔH,单位是kJ/mol(或kJ mol-1)
大多数化学反应是在等压条件下进行的。
对于反应体系而言:
反应吸热,体系的焓增大,ΔH为正值(ΔH>0)
反应放热,体系的焓减小,ΔH为负值(ΔH<0)
放热反应
吸热反应
H <0
H >0
H
反应物
生成物
反应物
生成物
H
反应热的表示
25 ℃和101 kPa下,1mol C(石墨) 与1mol H2O(g)反应,生成1mol CO和1mol H2(g)时吸收131.5kJ的热量。
C(s) + H2O(g) = CO(g) +H2 (g)
ΔH= + 131.5 kJ/mol
25 ℃和101 kPa下,1mol H2 与1mol Cl2 反应生成2mol HCl时放出186.4kJ的热量。
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
指1mol化学反应
从微观角度理解反应热的实质
H2(g)+Cl2(g) = 2HCl(g)
化学反应的本质是旧键断裂,新键形成
对反应体系来说:
旧键断裂吸收能量,焓增大;
新键形成释放能量,焓减小;
ΔH= + Q 吸 - Q 放
ΔH= (436kJ/mol +243kJ/mol)- 431kJ/mol ×2 = - 186.4 kJ/mol
从微观角度理解反应热的实质
【例题】已知:
(1)1mol N2(g)中的化学键断裂时需要吸收946 kJ的能量。
(2)1mol O2(g)中的化学键断裂时需要吸收498kJ的能量。
(3)1mol NO(g)中的化学键形成时要释放632kJ的能量。
请计算下列反应的ΔH。
N2(g) + O2(g) = 2NO(g)
ΔH= +180 kJ/mol
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
化学反应能量变化的表示
热化学方程式:表明反应所释放或吸收的热量的化学方程式。
体现了化学反应的物质变化和能量变化(主)
1mol气态H2与1mol气态Cl2反应生成2mol气态HCl时,放出184.6kJ的能量。
热化学方程式
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
书写热化学方程式需要注明物质聚集状态。
固体:s 液体:l 气体:g 溶液:aq
H2(g) + O2(g) = H2O ( g ) H= 241.8 kJ/mol
H2(g)+ O2(g) = H2O ( l ) H= 285.8 kJ/mol
1
2
1
2
固态水
液态水
吸收热量
气态水
吸收热量
物质聚集状态与物质能量的关系
同一物质,不同聚集状态的能量,有如下关系:
气态 > 液态> 固态
物质聚集状态与物质能量的关系
同一物质,不同聚集状态的能量,有如下关系:
气态 > 液态> 固态
能量
生成液态水时,放出的热量多。
书写热化学方程式时,应注明反应体系所处的温度和压强,若为25℃、101 kPa时可省略。
热化学方程式
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
该反应在25℃、101 kPa下进行
H2 (g) + I2(g) 2HI(g)
ΔH= - 14.9 kJ/mol
200℃
101kPa
H2(g) + Cl2(g) = HCl(g) ΔH= -92.3 kJ/mol
1
2
1
2
热化学方程式
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
热化学方程式中,各物质的系数可以是整数也可以是分数(系数表示物质的量)。系数扩大(或缩小)相应倍数,ΔH的数值也扩大(或缩小)相应的倍数,但ΔH的符号不变。
热化学方程式
【例题】已知,在298K时,由于氢气和氮气反应生成1mol NH3(g)放热46.1kJ,将下列热化学方程式补充完整。
N2(g) + H2(g) = NH3(g)
3
2
1
2
N2(g) + 3H2(g) = 2NH3(g)
NH3(g)= N2(g) + H2(g)
3
2
1
2
(1)
(2)
(3)
反应逆向进行,ΔH改变符号,但数值不变。
ΔH= - 46.1 kJ/mol
ΔH= - 92.2 kJ/mol
ΔH= + 46.1 kJ/mol
热化学方程式的书写(小结)
需要注明物质聚集状态。
注明反应体系所处的温度和压强,若为25℃、101 kPa时可省略。
物质的系数可以是整数也可以是分数(系数表示物质的量)。
系数扩大(或缩小)相应倍数,ΔH的数值也扩大(或缩小)相应的倍数,但ΔH的符号不变。
反应逆向进行,ΔH改变符号,但数值不变。
【例题】依据事实,写出下列反应的热化学方程式。
(1) 1 mol Cu(s)与适量O2(g)反应生成CuO(s),放出157.3kJ的热量。
(2)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411.0kJ的热量。
(3)1molC(s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.5kJ的热量。
热化学方程式的书写
Cu(s) + O2(g) = CuO(s) H= 157.3 kJ/mol
1
2
C2H4(g) +3O2(g) = 2CO2(g) + 2H2O(l) H= 1411.0 kJ/mol
C(s) + H2O(g) = CO(g) + H2(g) H=+131.5 kJ/mol
燃烧热
C(s) + O2(g) CO2(g) H= 393.5 kJ/mol
燃料热:在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。单位:kJ/mol
C(石墨)燃烧热的热化学方程式
H2(g)燃烧热的热化学方程式
H2(g) + O2(g) = H2O(l) H= 285.8 kJ/mol
1
2
燃烧热
燃料热:在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。单位:kJ/mol
S(硫元素)
SO2(g)
C(碳元素)
CO2(g)
H(氢元素)
H2O(l)
N(氮元素)
N2(g)
【注意】燃烧热对应的 H的符号一定是负值
【例题】适量H2(g)在1 mol O2(g)中完全燃烧,生成2 mol H2O(l),放出571.6k的热量。请写出表示H2燃烧热的热化学方程式。
燃烧热
H2(g) + O2(g) = H2O(l) H= 285.8 kJ/mol
1
2
【例题】煤(C)、石油(C8H8)、天然气是当今世界重要的化石燃料,其储备影响着国际形势。其主要成分分别是碳单质[ C(s) ]、辛烷[C8H8 (l)]、甲烷[CH4(g)],查阅资料得到在25℃,101kPa时,碳、辛烷、甲烷的燃烧热分别为393.5kJ/mol,5518kJ/mol、890.3kJ/mol。请写出上述三种物质燃烧热的热化学方程式。
燃烧热
C(s) + O2(g) = CO2(g) H= 393.5 kJ/mol
C8H8 (l) + O2(g) =8CO2(g) + 9H2O(l) H= 5518 kJ/mol
25
2
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) H= 890.3 kJ/mol
燃料燃烧热对应的热化学方程式(小结)
燃料必须为1 mol。
相应元素必须转化为指定产物。
燃烧热对应的 H一定是负值。
H大小比较
【例题】在相同条件下,质量相等的两份H2(g)与足量的O2(g)充分反应,分别生成液态水(反应①)和水蒸气(反应②)。下列说法正确的是( )
A.反应①放出的热量多
B.反应②放出的热量多
C.反应①、②放出的热量一样多
D.无法比较反应①、②)放出的热量
H大小比较
对于放热反应,因为 H<0(负值),所以放热越多, H越小。
H大小比较
能量
对于吸热反应,因为 H>0(正值),所以吸热越多, H越大。
1.根据下图所示的过程中的能量变化情况,判断下列说法不正确的是
A.转化为氯原子是一个吸热过程
B.和的总能量比的总能量高
C.1个分子中的化学键断裂时需要吸收能量
D.和反应生成的反应热
3.C
【详解】A. 转化为氯原子是化学键断裂的过程,需要吸收热量,是一个吸热过程,A正确;
B. 和 反应生成 的反应热ΔH=反应物的总键能-生成物的总键能=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,属于放热反应,因此1molH2和1molCl2的总能量比2molHCl的总能量高,B正确;
C.1mol分子中化学键断裂时需要吸收431kJ能量,而不是1个HCl(g)分子中的化学键断裂时需要吸收431kJ能量,C错误;
D.由B分析可知, 和 反应生成的反应热 ,D正确;
故选C。
2.十氢萘( )是具有高储氢密度的氢能载体,一定条件下,在某催化剂作用下,依次经历反应i和反应ii释放氢气:
反应i.
反应ii.
脱氢过程中的能量变化如图所示。
下列叙述错误的是
A.反应i的活化能大于反应ii的活化能
B.萘()的储氢过程是放热反应
C.“低压、高温”条件下,能提高十氢萘的脱氢率
D.十氢萘脱氢反应达平衡时,适当升高温度,反应体系中 增大
2.D
【详解】A.活化能是指化学反应中由反应物分子到达活化分子所需的最小能量,由图可判断,反应i的活化能大于反应ii的活化能,A正确;
B.由图可判断,十氢萘脱氢时的两步反应中反应物的总能量小于生成物的总能量,均为吸热反应,则萘( )的储氢过程是放热反应,B正确;
C.反应i、ii均为气体体积增大的吸热反应,“低压、高温”条件下,有利于反应i、ii向正反应方向进行,能提高十氢萘的脱氢率,C正确;
D.反应i、ii均为气体体积增大的吸热反应,衡时,适当升高温度,反应i、ii均向正反应方向移动,则 减小,D错误;故选D。
第一章 化学反应的热效应
第一节 反应热
乙炔与氧气反应放出的热量用于切割金属
常温电化学合成丙酰胺
能量变化
物质变化
化学反应带来了什么
化学反应的能量从何而来
化学反应的能量储存在反应物和生成物的化学键中
原子间成键:总能量降低
原子间断键:总能量升高
能量既不会凭空产生,也不会凭空消失,它只会从一种形式转化为另一种形式,或者从一个物体转移到其它物体,而能量的总量保持不变。能量守恒定律是自然界普遍的基本定律之一。
能量守恒定律
体系和环境
体系:盐酸,NaOH溶液及所发
生的化学反应
HCl + NaOH = NaCl + H2O
环境:试管、试管以外的空气等
研究对象
体系和环境
敞开系统
封闭体系
孤立体系
物质交换
能量交换
√
√
√
×
×
×
反应热
热量的释放或吸收是化学反应中能量变化的常见形式
常见的吸热反应和放热反应
吸热反应
Ba(OH)2 10H2O和NH4Cl的反应
大多数分解反应
C + H2O = CO + H2(制备水煤气)
C + CO2 = 2CO
特例:2H2O2 = 2H2O +O2 ↑
放热反应
燃烧反应
大多数化合反应
酸碱中和反应
金属与酸或水的反应
特例:C + CO2 = 2CO
大多数化学反应为放热反应
恒温动物
充电时手机电池发热
反应热
在等温条件下,化学反应体系向环境释放或从环境吸收的热量。称为化学反应的热效应,简称反应热。
反应后体系的温度恢复到室温
反应热的测定
HCl + NaOH = NaCl + H2O
中和反应,放热反应。
测量反应放出的热量?
测量反应前后的温度差。
热量和温度之间有什么关系?
Q = c · m ·Δt,c是比热容,m是反应体系的质量,Δt是温度差。
在实验过程中需要注意什么?
防止反应放出的热量散失(保温)
中和反应反应热的测定
① 反应物温度(t1 ℃)的测量
用一量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度,取两温度平均值为t1 ℃。
为保证盐酸完全被中和,采用稍过量的NaOH。
② 反应后体系温度(t2 ℃)的测量
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度t2 ℃。
中和反应反应热的测定
③ 重复上述实验操作3次,记录每次的实验数据,取其平均值作为计算依据,其中如果有数据明显偏离正常值,该数据应舍去。
中和反应反应热的测定
数据处理
盐酸、氢氧化钠溶液为稀溶液,其密度近似地认为都是1 g·cm-3,反应后溶液的比热容c=4.18 J/(g·℃)。盐酸、氢氧化钠溶液的质量均为50g,m=100g;温度差Δt=(t1-t2)。
Q = c · m ·Δt
生成0.025mol H2O时放出的热量
生成1mol H2O时放出的热量
×40
Q
×40
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
中和反应反应热的测定
【例题】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题。
(1) 所用NaOH溶液要稍过量的目的是________________________________。
保证盐酸完全被中和
(2) 倒入NaOH溶液的正确操作是________(填字母,下同)。
A. 沿玻璃棒缓慢倒入 B. 分三次倒入 C. 一次迅速倒入
(3) 使盐酸与NaOH溶液混合均匀的正确操作是________。
A. 用温度计小心搅拌
B. 揭开硬纸片用玻璃棒搅拌
C.用金属搅拌棒搅拌
D. 轻轻地振荡烧杯
E.用套在温度计上的玻璃搅拌器轻轻地搅动
中和反应反应热的测定
C
E
(4) 假设盐酸和氢氧化钠溶液的密度都是 1 g/cm3,又知反应后溶液的比热容c=4.18 J/(g·℃)。为了计算反应热,某学生实验记录数据如下:
实验 序号 起始温度T1/ ℃ 终止温度T2/ ℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该学生的实验数据计算:该反应生成1molH2O时放出的热量为_________(结果保留一位小数)。
中和反应反应热的测定
52.7kJ
(5)哪些操作可能导致测量结果偏小?
导致热量损失的操作,都有可能使测量结果偏小。
50 mL 0.50 mol/L盐酸
50 mL 0.55 mol/L NaOH溶液
20.25 ℃
23.4 ℃
中和反应反应热的测定
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
由于弱酸和弱碱的电离会吸热,因此,弱酸、弱碱在发生中和反应生成1mol水时,放出的热量小于57.3 kJ。
反应热的表示
等压条件下进行的化学反应,其反应热等于焓变。符号为ΔH,单位是kJ/mol(或kJ mol-1)
大多数化学反应是在等压条件下进行的。
对于反应体系而言:
反应吸热,体系的焓增大,ΔH为正值(ΔH>0)
反应放热,体系的焓减小,ΔH为负值(ΔH<0)
放热反应
吸热反应
H <0
H >0
H
反应物
生成物
反应物
生成物
H
反应热的表示
25 ℃和101 kPa下,1mol C(石墨) 与1mol H2O(g)反应,生成1mol CO和1mol H2(g)时吸收131.5kJ的热量。
C(s) + H2O(g) = CO(g) +H2 (g)
ΔH= + 131.5 kJ/mol
25 ℃和101 kPa下,1mol H2 与1mol Cl2 反应生成2mol HCl时放出186.4kJ的热量。
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
指1mol化学反应
从微观角度理解反应热的实质
H2(g)+Cl2(g) = 2HCl(g)
化学反应的本质是旧键断裂,新键形成
对反应体系来说:
旧键断裂吸收能量,焓增大;
新键形成释放能量,焓减小;
ΔH= + Q 吸 - Q 放
ΔH= (436kJ/mol +243kJ/mol)- 431kJ/mol ×2 = - 186.4 kJ/mol
从微观角度理解反应热的实质
【例题】已知:
(1)1mol N2(g)中的化学键断裂时需要吸收946 kJ的能量。
(2)1mol O2(g)中的化学键断裂时需要吸收498kJ的能量。
(3)1mol NO(g)中的化学键形成时要释放632kJ的能量。
请计算下列反应的ΔH。
N2(g) + O2(g) = 2NO(g)
ΔH= +180 kJ/mol
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
化学反应能量变化的表示
热化学方程式:表明反应所释放或吸收的热量的化学方程式。
体现了化学反应的物质变化和能量变化(主)
1mol气态H2与1mol气态Cl2反应生成2mol气态HCl时,放出184.6kJ的能量。
热化学方程式
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
书写热化学方程式需要注明物质聚集状态。
固体:s 液体:l 气体:g 溶液:aq
H2(g) + O2(g) = H2O ( g ) H= 241.8 kJ/mol
H2(g)+ O2(g) = H2O ( l ) H= 285.8 kJ/mol
1
2
1
2
固态水
液态水
吸收热量
气态水
吸收热量
物质聚集状态与物质能量的关系
同一物质,不同聚集状态的能量,有如下关系:
气态 > 液态> 固态
物质聚集状态与物质能量的关系
同一物质,不同聚集状态的能量,有如下关系:
气态 > 液态> 固态
能量
生成液态水时,放出的热量多。
书写热化学方程式时,应注明反应体系所处的温度和压强,若为25℃、101 kPa时可省略。
热化学方程式
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
该反应在25℃、101 kPa下进行
H2 (g) + I2(g) 2HI(g)
ΔH= - 14.9 kJ/mol
200℃
101kPa
H2(g) + Cl2(g) = HCl(g) ΔH= -92.3 kJ/mol
1
2
1
2
热化学方程式
H2 (g) + Cl2(g) = 2HCl(g)
ΔH= - 186.4 kJ/mol
热化学方程式中,各物质的系数可以是整数也可以是分数(系数表示物质的量)。系数扩大(或缩小)相应倍数,ΔH的数值也扩大(或缩小)相应的倍数,但ΔH的符号不变。
热化学方程式
【例题】已知,在298K时,由于氢气和氮气反应生成1mol NH3(g)放热46.1kJ,将下列热化学方程式补充完整。
N2(g) + H2(g) = NH3(g)
3
2
1
2
N2(g) + 3H2(g) = 2NH3(g)
NH3(g)= N2(g) + H2(g)
3
2
1
2
(1)
(2)
(3)
反应逆向进行,ΔH改变符号,但数值不变。
ΔH= - 46.1 kJ/mol
ΔH= - 92.2 kJ/mol
ΔH= + 46.1 kJ/mol
热化学方程式的书写(小结)
需要注明物质聚集状态。
注明反应体系所处的温度和压强,若为25℃、101 kPa时可省略。
物质的系数可以是整数也可以是分数(系数表示物质的量)。
系数扩大(或缩小)相应倍数,ΔH的数值也扩大(或缩小)相应的倍数,但ΔH的符号不变。
反应逆向进行,ΔH改变符号,但数值不变。
【例题】依据事实,写出下列反应的热化学方程式。
(1) 1 mol Cu(s)与适量O2(g)反应生成CuO(s),放出157.3kJ的热量。
(2)1 mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411.0kJ的热量。
(3)1molC(s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.5kJ的热量。
热化学方程式的书写
Cu(s) + O2(g) = CuO(s) H= 157.3 kJ/mol
1
2
C2H4(g) +3O2(g) = 2CO2(g) + 2H2O(l) H= 1411.0 kJ/mol
C(s) + H2O(g) = CO(g) + H2(g) H=+131.5 kJ/mol
燃烧热
C(s) + O2(g) CO2(g) H= 393.5 kJ/mol
燃料热:在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。单位:kJ/mol
C(石墨)燃烧热的热化学方程式
H2(g)燃烧热的热化学方程式
H2(g) + O2(g) = H2O(l) H= 285.8 kJ/mol
1
2
燃烧热
燃料热:在101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。单位:kJ/mol
S(硫元素)
SO2(g)
C(碳元素)
CO2(g)
H(氢元素)
H2O(l)
N(氮元素)
N2(g)
【注意】燃烧热对应的 H的符号一定是负值
【例题】适量H2(g)在1 mol O2(g)中完全燃烧,生成2 mol H2O(l),放出571.6k的热量。请写出表示H2燃烧热的热化学方程式。
燃烧热
H2(g) + O2(g) = H2O(l) H= 285.8 kJ/mol
1
2
【例题】煤(C)、石油(C8H8)、天然气是当今世界重要的化石燃料,其储备影响着国际形势。其主要成分分别是碳单质[ C(s) ]、辛烷[C8H8 (l)]、甲烷[CH4(g)],查阅资料得到在25℃,101kPa时,碳、辛烷、甲烷的燃烧热分别为393.5kJ/mol,5518kJ/mol、890.3kJ/mol。请写出上述三种物质燃烧热的热化学方程式。
燃烧热
C(s) + O2(g) = CO2(g) H= 393.5 kJ/mol
C8H8 (l) + O2(g) =8CO2(g) + 9H2O(l) H= 5518 kJ/mol
25
2
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) H= 890.3 kJ/mol
燃料燃烧热对应的热化学方程式(小结)
燃料必须为1 mol。
相应元素必须转化为指定产物。
燃烧热对应的 H一定是负值。
H大小比较
【例题】在相同条件下,质量相等的两份H2(g)与足量的O2(g)充分反应,分别生成液态水(反应①)和水蒸气(反应②)。下列说法正确的是( )
A.反应①放出的热量多
B.反应②放出的热量多
C.反应①、②放出的热量一样多
D.无法比较反应①、②)放出的热量
H大小比较
对于放热反应,因为 H<0(负值),所以放热越多, H越小。
H大小比较
能量
对于吸热反应,因为 H>0(正值),所以吸热越多, H越大。
1.根据下图所示的过程中的能量变化情况,判断下列说法不正确的是
A.转化为氯原子是一个吸热过程
B.和的总能量比的总能量高
C.1个分子中的化学键断裂时需要吸收能量
D.和反应生成的反应热
3.C
【详解】A. 转化为氯原子是化学键断裂的过程,需要吸收热量,是一个吸热过程,A正确;
B. 和 反应生成 的反应热ΔH=反应物的总键能-生成物的总键能=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,属于放热反应,因此1molH2和1molCl2的总能量比2molHCl的总能量高,B正确;
C.1mol分子中化学键断裂时需要吸收431kJ能量,而不是1个HCl(g)分子中的化学键断裂时需要吸收431kJ能量,C错误;
D.由B分析可知, 和 反应生成的反应热 ,D正确;
故选C。
2.十氢萘( )是具有高储氢密度的氢能载体,一定条件下,在某催化剂作用下,依次经历反应i和反应ii释放氢气:
反应i.
反应ii.
脱氢过程中的能量变化如图所示。
下列叙述错误的是
A.反应i的活化能大于反应ii的活化能
B.萘()的储氢过程是放热反应
C.“低压、高温”条件下,能提高十氢萘的脱氢率
D.十氢萘脱氢反应达平衡时,适当升高温度,反应体系中 增大
2.D
【详解】A.活化能是指化学反应中由反应物分子到达活化分子所需的最小能量,由图可判断,反应i的活化能大于反应ii的活化能,A正确;
B.由图可判断,十氢萘脱氢时的两步反应中反应物的总能量小于生成物的总能量,均为吸热反应,则萘( )的储氢过程是放热反应,B正确;
C.反应i、ii均为气体体积增大的吸热反应,“低压、高温”条件下,有利于反应i、ii向正反应方向进行,能提高十氢萘的脱氢率,C正确;
D.反应i、ii均为气体体积增大的吸热反应,衡时,适当升高温度,反应i、ii均向正反应方向移动,则 减小,D错误;故选D。
