2.2分子的空间结构 课件(共35张PPT) 2024-2025学年人教版(2019)高中化学选择性必修2
文档属性
| 名称 | 2.2分子的空间结构 课件(共35张PPT) 2024-2025学年人教版(2019)高中化学选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 11:09:31 | ||
图片预览




文档简介
(共35张PPT)
2.2 分子的空间结构
分子结构的测定
多样的分子空间结构
价层电子对互斥模型
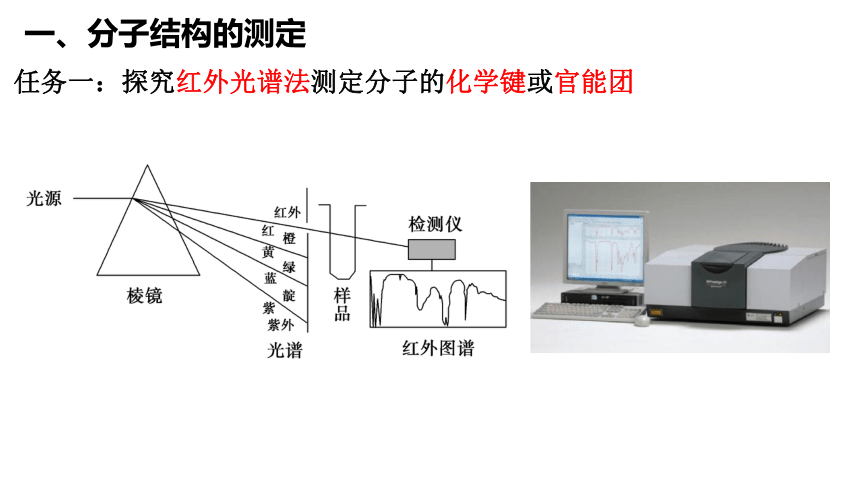
一、分子结构的测定
任务一:探究红外光谱法测定分子的化学键或官能团
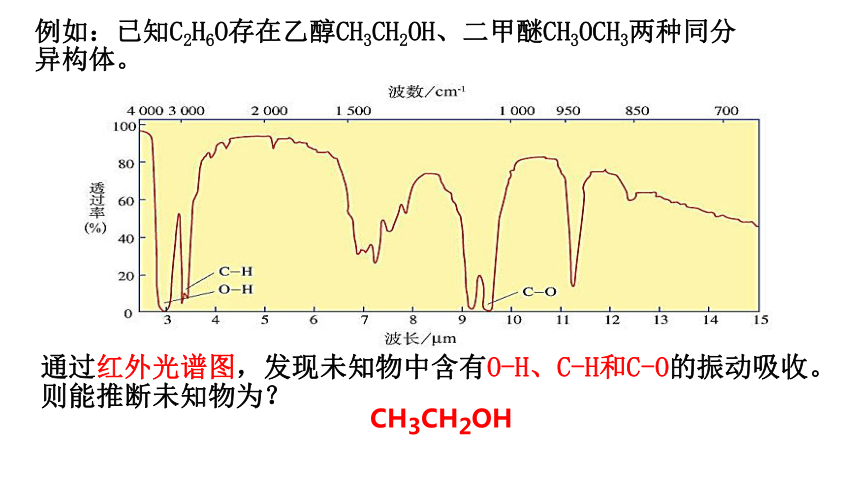
例如:已知C2H6O存在乙醇CH3CH2OH、二甲醚CH3OCH3两种同分异构体。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收。则能推断未知物为?
CH3CH2OH
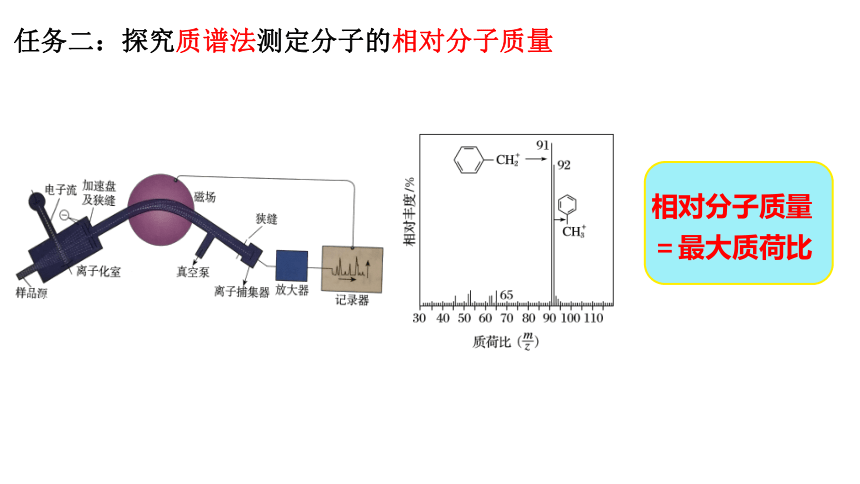
任务二:探究质谱法测定分子的相对分子质量
相对分子质量
=最大质荷比
对应训练
【典例1】在研究有机物的组成和结构时,可用于确定化学键和官能团
信息的方法是( )
A.质谱法 B.红外光谱法 C.核磁共振氢谱法 D.燃烧法
B
【典例2】能够快速、微量、精确测定有机物相对分子质量的物理方法
是 ( )
A.红外光谱法 B.质谱法 C.核磁共振氢谱法 D.色谱法
B
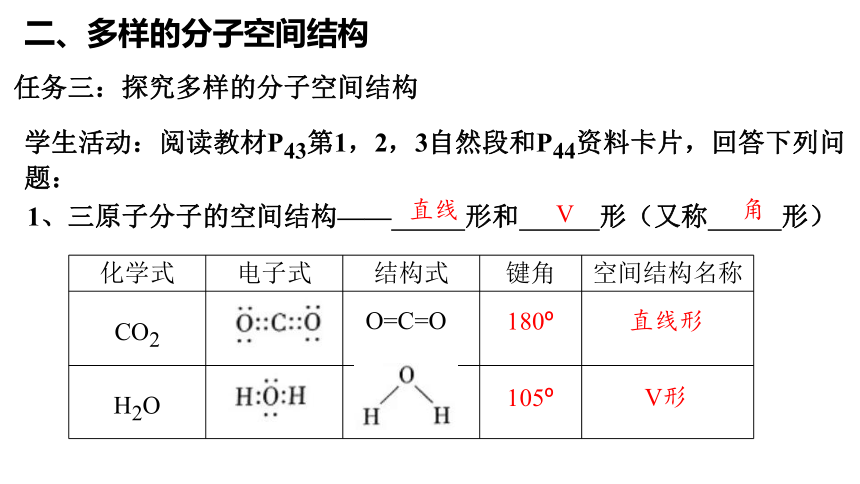
二、多样的分子空间结构
任务三:探究多样的分子空间结构
学生活动:阅读教材P43第1,2,3自然段和P44资料卡片,回答下列问题:
1、三原子分子的空间结构—— 形和 形(又称 形)
化学式 电子式 结构式 键角 空间结构名称
CO2
H2O
直线
V
角
O=C=O
180
105
直线形
V形
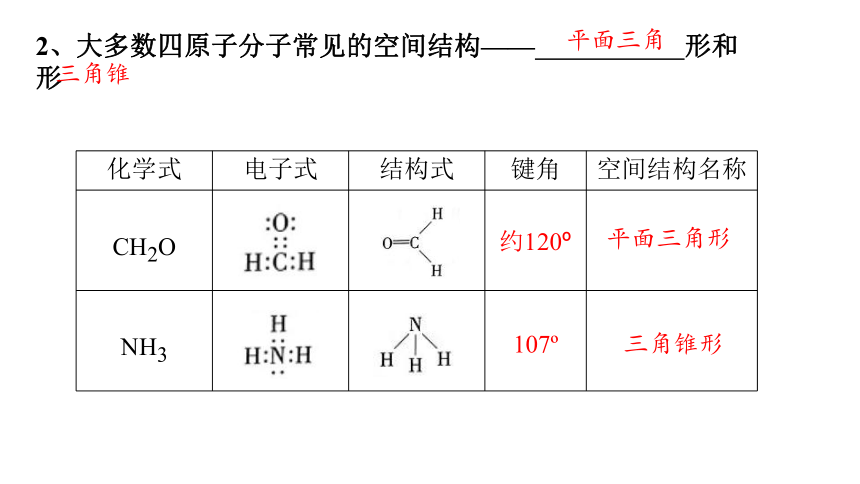
2、大多数四原子分子常见的空间结构—— 形和 形
化学式 电子式 结构式 键角 空间结构名称
CH2O
NH3
平面三角
三角锥
约120
107
平面三角形
三角锥形
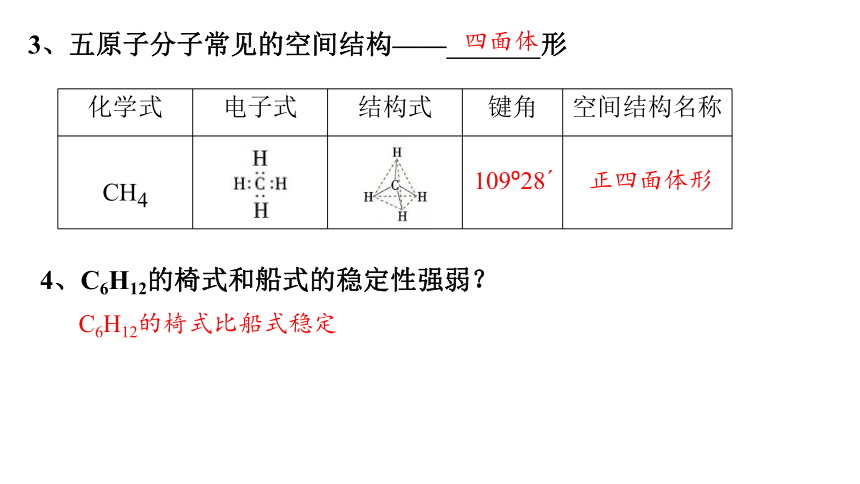
3、五原子分子常见的空间结构—— 形
化学式 电子式 结构式 键角 空间结构名称
CH4
4、C6H12的椅式和船式的稳定性强弱?
C6H12的椅式比船式稳定
四面体
109 28
正四面体形
对应训练
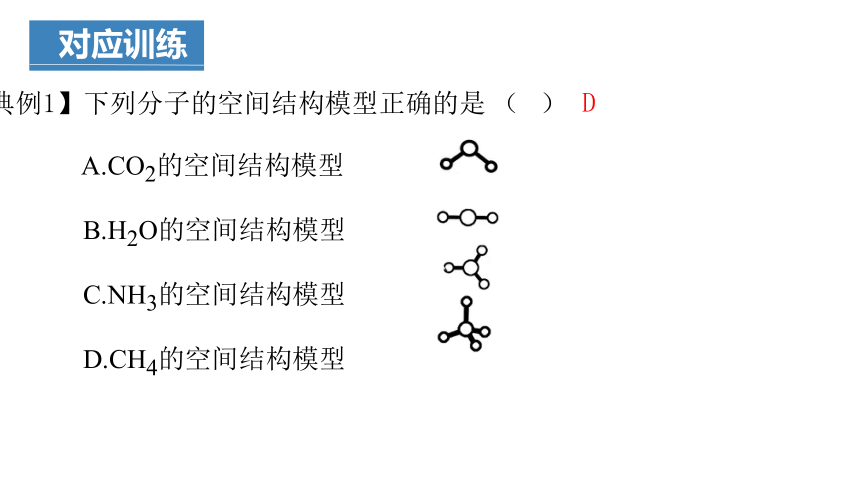
【典例1】下列分子的空间结构模型正确的是 ( )
A.CO2的空间结构模型
B.H2O的空间结构模型
C.NH3的空间结构模型
D.CH4的空间结构模型
D
【典例2】下列分子的空间结构与分子中共价键键角对应正确
的是 ( )
A.V形:105° B.平面正三角形:120°
C.三角锥形:109°28 D.正四面体形:109°28
B
【典例3】下列物质分子的空间结构与CH4相同的是( )
A. H2O B. P4 C. NH3 D. CO2
B
三、价层电子对互斥模型(VSEPR model)
任务四:探究价层电子对互斥模型的相关内容
1.内容
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
2.价层电子对
价层电子对数=σ键电子对数+中心原子上的孤电子对数
注意:多重键只计其中σ键的电子对,不计π键电子对。
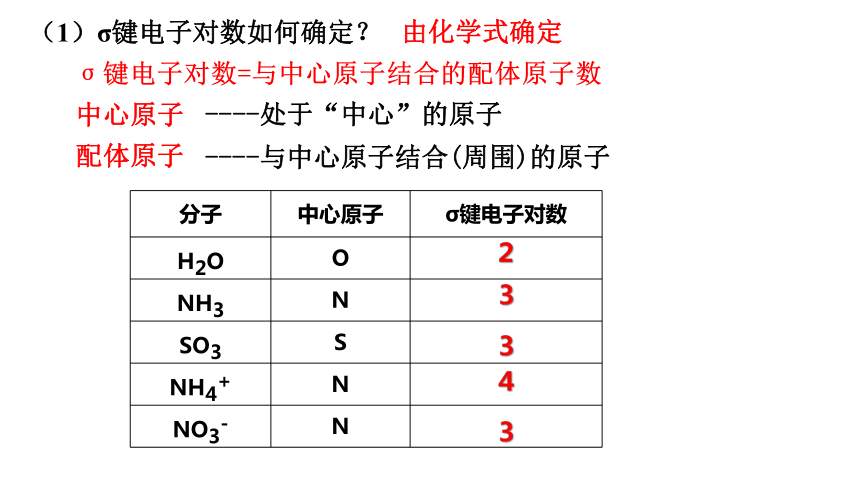
(1)σ键电子对数如何确定?
由化学式确定
σ键电子对数=与中心原子结合的配体原子数
中心原子
配体原子
----处于“中心”的原子
----与中心原子结合(周围)的原子
分子 中心原子 σ键电子对数
H2O O
NH3 N
SO3 S
NH4+ N
NO3- N
2
3
3
4
3
(2)中心原子上的孤电子对数的确定
【特别提醒】
价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
a:中心原子的价层电子数
主族元素
阳离子
阴离子
x:与中心原子结合的原子数
b:与中心原子结合的原子最多能接受的电子数
H
其他原子
最外层电子数
中心原子的价电子数-离子的电荷数
中心原子的价电子数+︱离子的电荷数︱
1
8-该原子的价层电子数
中心原子上的孤电子对数=1/2(a-xb)
对应训练
【典例1】下列分子或离子中含有孤电子对的是( )
A.H2O B. CH4 C. SiH4 D.NH4+
A
【典例2】SO32—的中心原子孤电子对计算公式为1/2(a-xb)中,下列对
应的数值正确的是( )
A.a=8 x=3 b=2 B.a=6 x=3 b=2
C.a=4 x=2 b=3 D.a=6 x=2 b=3
A
【典例3】下列有关价层电子对互斥模型的描述正确的是( )
A.价层电子对就是σ键电子对
B.孤电子对数由分子式来确定
C.分子的空间结构是价层电子对互斥的结果
D.孤电子对数等于π键数
C
任务五:探究用价层电子对互斥模型判断分子的空间结构
价层电子对所对应的价层电子对互斥模型(即VSEPR模型)
价层电子对: 2 3 4
VSEPR模型:
直线形
平面三角形
(正)四面体形
价层电子对数
判断VSEPR理想模型
略去孤电子对得到分子空间结构
中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。如CH4分子
若有:先判断VSEPR理想模型,后略去孤电子对,便可得到分子的空间结构。如NH3分子
NH3
化学式
电子式
分子的 VSEPR 模型
分子立体构型
常见分子或离子的空间结构的推测
分子或离子 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型 VSEPR模型名称 空间结构 空间结构名称
CO2、BeCl2 0 2 直线形 直线形
CO32—、BF3 0 3 平面三角形 平面三角形
SO2、PbCl2 1 V形
CH4、CCl4 0 4 正四面体形 正四面体形
NH3、NF3 1 四面体形 三角锥形
H2O、H2S 2 V形
【思考与讨论】确定BF3、NH4+和SO32-的VSEPR模型和它们的空间结构,并与同学讨论。(课本P47)
(1)BF3的σ键电子对数为3,中心原子B的孤电子对数为0,所以BF3的价层电子对数为3。BF3的VSEPR模型为平面三角形,BF3的空间结构为平面三角形。
(2)NH4+的σ键电子对数为4,中心原子N的孤电子对数为0,所以NH4+的价层电子对数为4。NH4+的VSEPR模型为正四面体形,NH4+的空间结构为正四面体形。
(3)SO32-的σ键电子对数为3,中心原子S的孤电子对数为1,所以SO32-的价层电子对数为4。SO32-的VSEPR模型为四面体形,SO32-的空间结构为三角锥形。
对应训练
【典例1】用价层电子对互斥模型预测H2S和COCl2的空间结构,两个
结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
D
【典例2】下列分子的空间结构为正四面体形的是( )
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A.①③④⑤ B.①③④⑤⑥ C.①③④ D.④⑤
C
【典例3】用 VSEPR模型预测下列分子或离子的空间结构,其中不正
确的是( )
A. NH4+为正四面体形 B.CS2为直线形
C.HCN为V形 D.PCl3为三角锥形
C
2.2 分子的空间结构
杂化轨道理论简介
新课导入
请同学们回顾一下甲烷的分子式、电子式、结构式,碳原子的轨道表示式以及甲烷的空间结构是什么样的?
CH4
正四面体形
任务一:探究杂化轨道理论
学生活动:阅读教材P47第2、3、4、5自然段和P48图2-15和图2-16,小组合作,回答下列问题:
1、杂化轨道类型:
类型 形成过程 夹角 空间结构
sp3杂化轨道是由 个s轨道和 个p轨道杂化形成的
sp2杂化轨道是由 个s轨道和 个p轨道杂化而成的
sp杂化轨道是由 个s轨道和 个p轨道杂化而成的
2、原子轨道发生sp、sp2杂化时,还有未参与杂化的p轨道,可用于形成 键,而杂化轨道用于形成 键或用来容纳
sp3
sp2
sp
1
3
1
2
1
1
109°28′
120°
180°
正四面体形
平面三角形
直线形
π
σ
未参与成键的孤电子对
说明:
1、轨道的杂化:
在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程
2、杂化轨道:
原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道
3、原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子
4、原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子不可能发生杂化
5、只有能量相近的原子轨道才能杂化(如2s、2p)
6、杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同
7、杂化使原子的成键能力增加,形成的共价键更牢固
8、杂化轨道成键时仍具有共价键的特征——方向性和饱和性
9、杂化轨道数=中心原子上的孤电子对数+与中心原子结合的原子数
任务二:探究杂化轨道类型与分子的空间结构的关系
学生活动:阅读教材P48自然段和P49表2-5,补充下列表格:
VSEPR模型
中心原子的杂化轨道类型 sp sp2 sp3
直线形
平面三角形
四面体形
任务三:探究杂化轨道类型的判断方法
学生活动:从价层电子对数、VSEPR模型、杂化轨道间的夹角三个方面填写表格,总结判断杂化轨道类型的方法。
1、利用价层电子对数进行判断
价层电子对数 杂化轨道类型
2
3
4
sp
sp2
sp3
3、利用杂化轨道间的夹角进行判断
杂化轨道间的夹角 杂化轨道类型
109 28
120
180
2、利用空间构型进行判断
VSEPR模型 直线形 平面三角形 四面体形
中心原子的杂化轨道类型
sp
sp2
sp3
sp
sp2
sp3
4.以碳原子为中心原子的分子中碳原子的杂化类型
(1)碳中四个单键,为sp3杂化:
CH4、CCl4、
(2)形成双键,为sp2杂化:
CH2=CH2、苯(大π键)、
、
(3)形成两个双键或一个三键,为sp杂化:
CH≡CH、O=C=O(CO2)、S=C=S(CS2)
思考与讨论(课本P49):确定BF3和H3O+的中心原子的杂化轨道类型,并与同学讨论
BF3的中心原子B的孤电子对数为0,价层电子对数为3,VSEPR模型为平面三角形,中心原子B的杂化轨道类型为sp2杂化。同理,H3O+的中心原子O的孤电子对数为1,价层电子对数为4,VSEPR模型为四面体形,中心原子O的杂化轨道类型为sp3杂化。
对应训练
【典例1】下列关于杂化轨道的说法错误的是( )
A.并不是所有的原子轨道都参与杂化
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道数与杂化前后轨道数不相同
D
【典例2】杂化轨道理论是鲍林为了解释分子的空间结构提出的。下列
关于sp、sp2、sp3杂化轨道的夹角的比较正确的是( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp、sp2、sp3杂化轨道的夹角相等
A
【典例3】下列中心原子的杂化轨道类型和分子的空间结构不正确的
是( )
A.CCl4中C原子为sp3杂化,为正四面体形
B.H2S分子中S原子为sp2杂化,为直线形
C.CS2中C原子为sp杂化,为直线形
D.BF3中B原子为sp2杂化,为平面三角形
B
课本P51 第9题 完成下表中的空白:
原子总数 粒子 中心原子孤电子对数 中心原子的杂化轨道类型 空间结构
3 CO2
SO2
H2O
HCN
4 BF3
NH3
H3O+
CH2O
5 CH4
SO42-
0
1
2
0
0
1
1
0
0
0
sp
sp2
sp3
sp
sp2
sp3
sp3
sp2
sp3
sp3
直线形
V形
V形
直线形
平面三角形
三角锥形
三角锥形
平面三角形
正四面体形
正四面体形
2.2 分子的空间结构
分子结构的测定
多样的分子空间结构
价层电子对互斥模型
一、分子结构的测定
任务一:探究红外光谱法测定分子的化学键或官能团
例如:已知C2H6O存在乙醇CH3CH2OH、二甲醚CH3OCH3两种同分异构体。
通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收。则能推断未知物为?
CH3CH2OH
任务二:探究质谱法测定分子的相对分子质量
相对分子质量
=最大质荷比
对应训练
【典例1】在研究有机物的组成和结构时,可用于确定化学键和官能团
信息的方法是( )
A.质谱法 B.红外光谱法 C.核磁共振氢谱法 D.燃烧法
B
【典例2】能够快速、微量、精确测定有机物相对分子质量的物理方法
是 ( )
A.红外光谱法 B.质谱法 C.核磁共振氢谱法 D.色谱法
B
二、多样的分子空间结构
任务三:探究多样的分子空间结构
学生活动:阅读教材P43第1,2,3自然段和P44资料卡片,回答下列问题:
1、三原子分子的空间结构—— 形和 形(又称 形)
化学式 电子式 结构式 键角 空间结构名称
CO2
H2O
直线
V
角
O=C=O
180
105
直线形
V形
2、大多数四原子分子常见的空间结构—— 形和 形
化学式 电子式 结构式 键角 空间结构名称
CH2O
NH3
平面三角
三角锥
约120
107
平面三角形
三角锥形
3、五原子分子常见的空间结构—— 形
化学式 电子式 结构式 键角 空间结构名称
CH4
4、C6H12的椅式和船式的稳定性强弱?
C6H12的椅式比船式稳定
四面体
109 28
正四面体形
对应训练
【典例1】下列分子的空间结构模型正确的是 ( )
A.CO2的空间结构模型
B.H2O的空间结构模型
C.NH3的空间结构模型
D.CH4的空间结构模型
D
【典例2】下列分子的空间结构与分子中共价键键角对应正确
的是 ( )
A.V形:105° B.平面正三角形:120°
C.三角锥形:109°28 D.正四面体形:109°28
B
【典例3】下列物质分子的空间结构与CH4相同的是( )
A. H2O B. P4 C. NH3 D. CO2
B
三、价层电子对互斥模型(VSEPR model)
任务四:探究价层电子对互斥模型的相关内容
1.内容
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。
2.价层电子对
价层电子对数=σ键电子对数+中心原子上的孤电子对数
注意:多重键只计其中σ键的电子对,不计π键电子对。
(1)σ键电子对数如何确定?
由化学式确定
σ键电子对数=与中心原子结合的配体原子数
中心原子
配体原子
----处于“中心”的原子
----与中心原子结合(周围)的原子
分子 中心原子 σ键电子对数
H2O O
NH3 N
SO3 S
NH4+ N
NO3- N
2
3
3
4
3
(2)中心原子上的孤电子对数的确定
【特别提醒】
价层电子对互斥模型不能用于预测以过渡金属为中心原子的分子
a:中心原子的价层电子数
主族元素
阳离子
阴离子
x:与中心原子结合的原子数
b:与中心原子结合的原子最多能接受的电子数
H
其他原子
最外层电子数
中心原子的价电子数-离子的电荷数
中心原子的价电子数+︱离子的电荷数︱
1
8-该原子的价层电子数
中心原子上的孤电子对数=1/2(a-xb)
对应训练
【典例1】下列分子或离子中含有孤电子对的是( )
A.H2O B. CH4 C. SiH4 D.NH4+
A
【典例2】SO32—的中心原子孤电子对计算公式为1/2(a-xb)中,下列对
应的数值正确的是( )
A.a=8 x=3 b=2 B.a=6 x=3 b=2
C.a=4 x=2 b=3 D.a=6 x=2 b=3
A
【典例3】下列有关价层电子对互斥模型的描述正确的是( )
A.价层电子对就是σ键电子对
B.孤电子对数由分子式来确定
C.分子的空间结构是价层电子对互斥的结果
D.孤电子对数等于π键数
C
任务五:探究用价层电子对互斥模型判断分子的空间结构
价层电子对所对应的价层电子对互斥模型(即VSEPR模型)
价层电子对: 2 3 4
VSEPR模型:
直线形
平面三角形
(正)四面体形
价层电子对数
判断VSEPR理想模型
略去孤电子对得到分子空间结构
中心原子无孤电子对的分子:VSEPR理想模型就是其分子的空间结构。如CH4分子
若有:先判断VSEPR理想模型,后略去孤电子对,便可得到分子的空间结构。如NH3分子
NH3
化学式
电子式
分子的 VSEPR 模型
分子立体构型
常见分子或离子的空间结构的推测
分子或离子 中心原子上的孤电子对数 中心原子上的价层电子对数 VSEPR模型 VSEPR模型名称 空间结构 空间结构名称
CO2、BeCl2 0 2 直线形 直线形
CO32—、BF3 0 3 平面三角形 平面三角形
SO2、PbCl2 1 V形
CH4、CCl4 0 4 正四面体形 正四面体形
NH3、NF3 1 四面体形 三角锥形
H2O、H2S 2 V形
【思考与讨论】确定BF3、NH4+和SO32-的VSEPR模型和它们的空间结构,并与同学讨论。(课本P47)
(1)BF3的σ键电子对数为3,中心原子B的孤电子对数为0,所以BF3的价层电子对数为3。BF3的VSEPR模型为平面三角形,BF3的空间结构为平面三角形。
(2)NH4+的σ键电子对数为4,中心原子N的孤电子对数为0,所以NH4+的价层电子对数为4。NH4+的VSEPR模型为正四面体形,NH4+的空间结构为正四面体形。
(3)SO32-的σ键电子对数为3,中心原子S的孤电子对数为1,所以SO32-的价层电子对数为4。SO32-的VSEPR模型为四面体形,SO32-的空间结构为三角锥形。
对应训练
【典例1】用价层电子对互斥模型预测H2S和COCl2的空间结构,两个
结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
D
【典例2】下列分子的空间结构为正四面体形的是( )
①P4 ②NH3 ③CCl4 ④CH4 ⑤H2S ⑥CO2
A.①③④⑤ B.①③④⑤⑥ C.①③④ D.④⑤
C
【典例3】用 VSEPR模型预测下列分子或离子的空间结构,其中不正
确的是( )
A. NH4+为正四面体形 B.CS2为直线形
C.HCN为V形 D.PCl3为三角锥形
C
2.2 分子的空间结构
杂化轨道理论简介
新课导入
请同学们回顾一下甲烷的分子式、电子式、结构式,碳原子的轨道表示式以及甲烷的空间结构是什么样的?
CH4
正四面体形
任务一:探究杂化轨道理论
学生活动:阅读教材P47第2、3、4、5自然段和P48图2-15和图2-16,小组合作,回答下列问题:
1、杂化轨道类型:
类型 形成过程 夹角 空间结构
sp3杂化轨道是由 个s轨道和 个p轨道杂化形成的
sp2杂化轨道是由 个s轨道和 个p轨道杂化而成的
sp杂化轨道是由 个s轨道和 个p轨道杂化而成的
2、原子轨道发生sp、sp2杂化时,还有未参与杂化的p轨道,可用于形成 键,而杂化轨道用于形成 键或用来容纳
sp3
sp2
sp
1
3
1
2
1
1
109°28′
120°
180°
正四面体形
平面三角形
直线形
π
σ
未参与成键的孤电子对
说明:
1、轨道的杂化:
在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程
2、杂化轨道:
原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道
3、原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子
4、原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子不可能发生杂化
5、只有能量相近的原子轨道才能杂化(如2s、2p)
6、杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同
7、杂化使原子的成键能力增加,形成的共价键更牢固
8、杂化轨道成键时仍具有共价键的特征——方向性和饱和性
9、杂化轨道数=中心原子上的孤电子对数+与中心原子结合的原子数
任务二:探究杂化轨道类型与分子的空间结构的关系
学生活动:阅读教材P48自然段和P49表2-5,补充下列表格:
VSEPR模型
中心原子的杂化轨道类型 sp sp2 sp3
直线形
平面三角形
四面体形
任务三:探究杂化轨道类型的判断方法
学生活动:从价层电子对数、VSEPR模型、杂化轨道间的夹角三个方面填写表格,总结判断杂化轨道类型的方法。
1、利用价层电子对数进行判断
价层电子对数 杂化轨道类型
2
3
4
sp
sp2
sp3
3、利用杂化轨道间的夹角进行判断
杂化轨道间的夹角 杂化轨道类型
109 28
120
180
2、利用空间构型进行判断
VSEPR模型 直线形 平面三角形 四面体形
中心原子的杂化轨道类型
sp
sp2
sp3
sp
sp2
sp3
4.以碳原子为中心原子的分子中碳原子的杂化类型
(1)碳中四个单键,为sp3杂化:
CH4、CCl4、
(2)形成双键,为sp2杂化:
CH2=CH2、苯(大π键)、
、
(3)形成两个双键或一个三键,为sp杂化:
CH≡CH、O=C=O(CO2)、S=C=S(CS2)
思考与讨论(课本P49):确定BF3和H3O+的中心原子的杂化轨道类型,并与同学讨论
BF3的中心原子B的孤电子对数为0,价层电子对数为3,VSEPR模型为平面三角形,中心原子B的杂化轨道类型为sp2杂化。同理,H3O+的中心原子O的孤电子对数为1,价层电子对数为4,VSEPR模型为四面体形,中心原子O的杂化轨道类型为sp3杂化。
对应训练
【典例1】下列关于杂化轨道的说法错误的是( )
A.并不是所有的原子轨道都参与杂化
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道数与杂化前后轨道数不相同
D
【典例2】杂化轨道理论是鲍林为了解释分子的空间结构提出的。下列
关于sp、sp2、sp3杂化轨道的夹角的比较正确的是( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp、sp2、sp3杂化轨道的夹角相等
A
【典例3】下列中心原子的杂化轨道类型和分子的空间结构不正确的
是( )
A.CCl4中C原子为sp3杂化,为正四面体形
B.H2S分子中S原子为sp2杂化,为直线形
C.CS2中C原子为sp杂化,为直线形
D.BF3中B原子为sp2杂化,为平面三角形
B
课本P51 第9题 完成下表中的空白:
原子总数 粒子 中心原子孤电子对数 中心原子的杂化轨道类型 空间结构
3 CO2
SO2
H2O
HCN
4 BF3
NH3
H3O+
CH2O
5 CH4
SO42-
0
1
2
0
0
1
1
0
0
0
sp
sp2
sp3
sp
sp2
sp3
sp3
sp2
sp3
sp3
直线形
V形
V形
直线形
平面三角形
三角锥形
三角锥形
平面三角形
正四面体形
正四面体形
