人教版初中化学九年级上册 3.2 原子的结构 课件(共22张PPT)
文档属性
| 名称 | 人教版初中化学九年级上册 3.2 原子的结构 课件(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 353.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 22:05:38 | ||
图片预览




文档简介
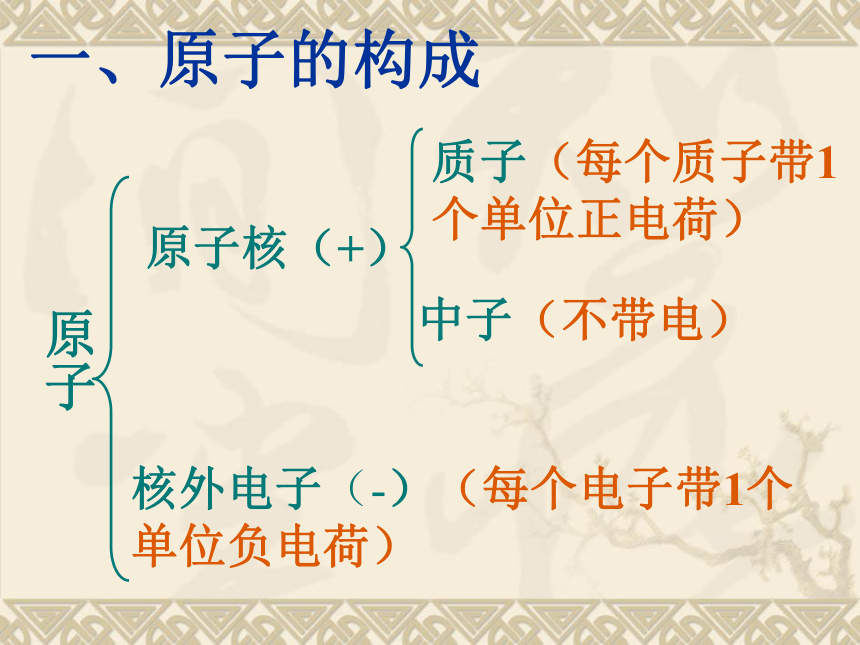
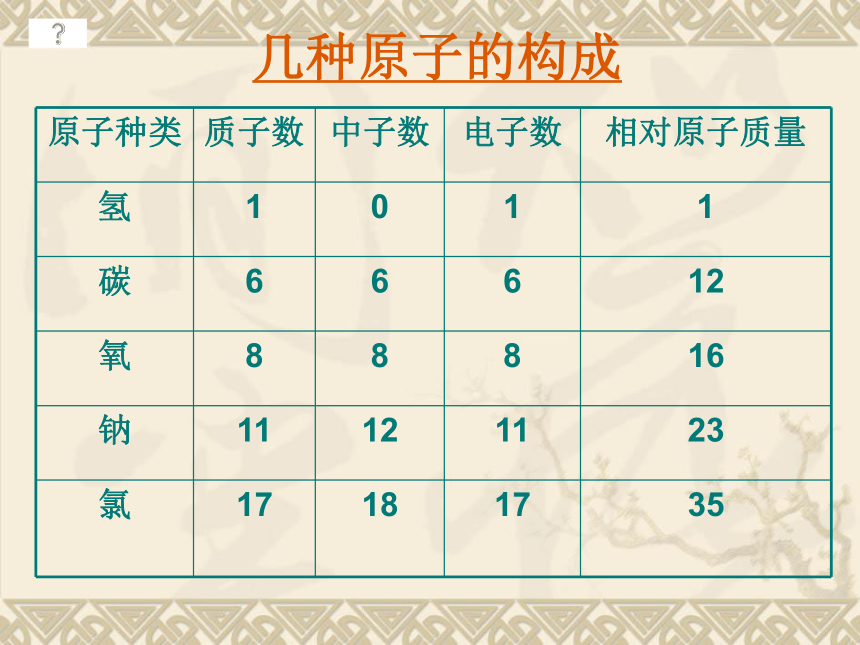
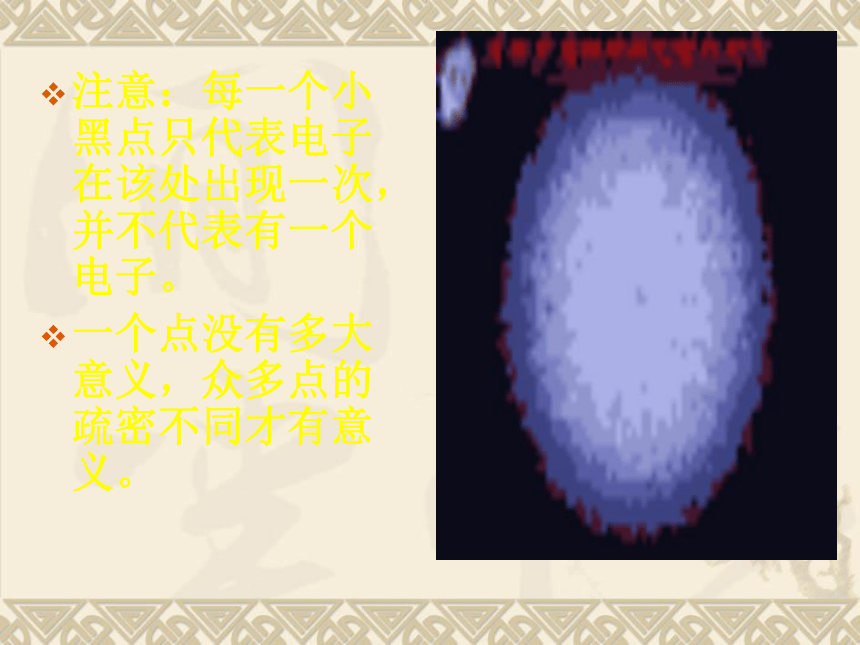
课件22张PPT。第三单元 物质构成的奥秘课题2 原子的结构一、原子的构成原子原子核(+)核外电子(-)(每个电子带1个单位负电荷)质子(每个质子带1个单位正电荷)中子(不带电)几种原子的构成原子不显电性的原因:由于核内的质子数与核外的电子数相等,电性相反,因此原子不显电性。核电荷数=质子数=核外电子数核外电子绕核高速运动二、原子核外电子的排布电子云模型注意:每一个小黑点只代表电子在该处出现一次,并不代表有一个电子。
一个点没有多大意义,众多点的疏密不同才有意义。
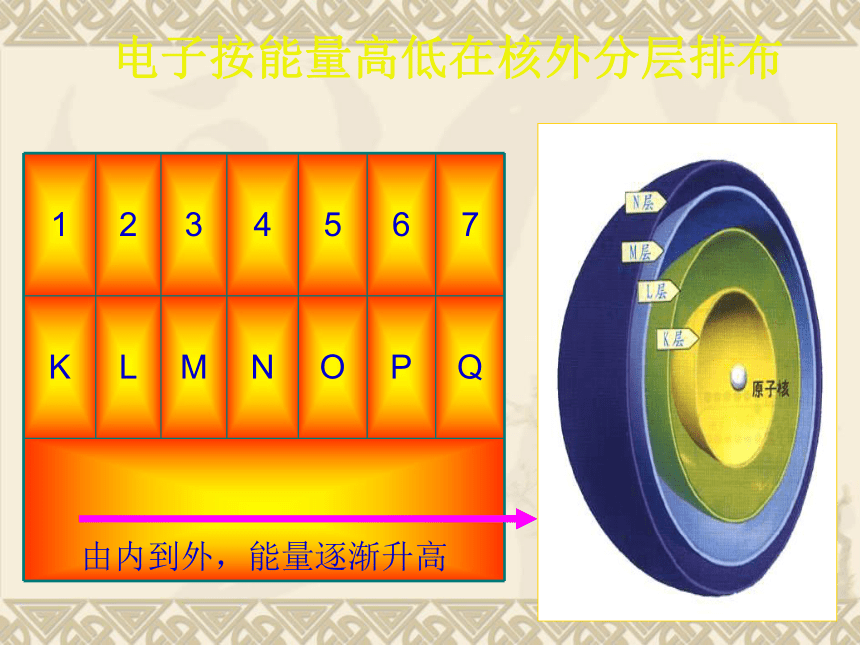
电子按能量高低在核外分层排布电子总是尽先排布在能量最低的电子层里。
1.排 布 规 律每个电子层最多只能排布2n 个电子。
当K层为最外层时,最多只能容纳2个电子。
次外层最多不超过18个电子。
最外层的电子最多只能容纳8个电子。
22.原子结构示意图+112 81第一层电子数为2最外层电子数为1 圆圈表示原子核核内质子数为11,带正电弧线表示电子层第二层电子数为8画出下列原子的结构示意图氢原子 硫原子 氯原子 钠原子练一练 3.离子 离子:带电的原子(或原子团)。
阳离子: 带正电的离子。
阴离子: 带负电的离子。
钠离子结构示意图阳离子:质子数>核外电子数失去1个电子钠原子结构示意图氯离子结构示意图阴离子:质子数<核外电子数氯原子结构示意图得到1个电子 阴离子(带负电的离子)稀有气体原子(已达稳定结构)不易形成离子
金属原子非金属原子阳离子(带正电的离子)
原子在反应中的倾向:
一般情况下,总是使自己的最外层电子达到
稳定结构
+离子和原子的区别与联系: 氯化钠(NaCl)的形成三、相对原子质量以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量。相对原子质量=某元素一个原子的质量一种碳原子的质量×1/12相对原子质量=质子数+中子数擂台过招1.1991年我国著名化学家张青莲教授与另一位科学家合作,测定了铟(In)元素的相对原子质量新值。铟(In)元素的核电荷数为49,相对原子质量为115。铟(In)原子的核外电子数为( )
A.115 B.49 C.66 D.164
2.有两种不同的铀原子,一种原子核内有92个质子和143个中子,另一种原子核内有92个质子和146个中子,则它们不相等的是( )
A.原子的质量 B.核电荷数
C.核内质子数 D.核外电子数
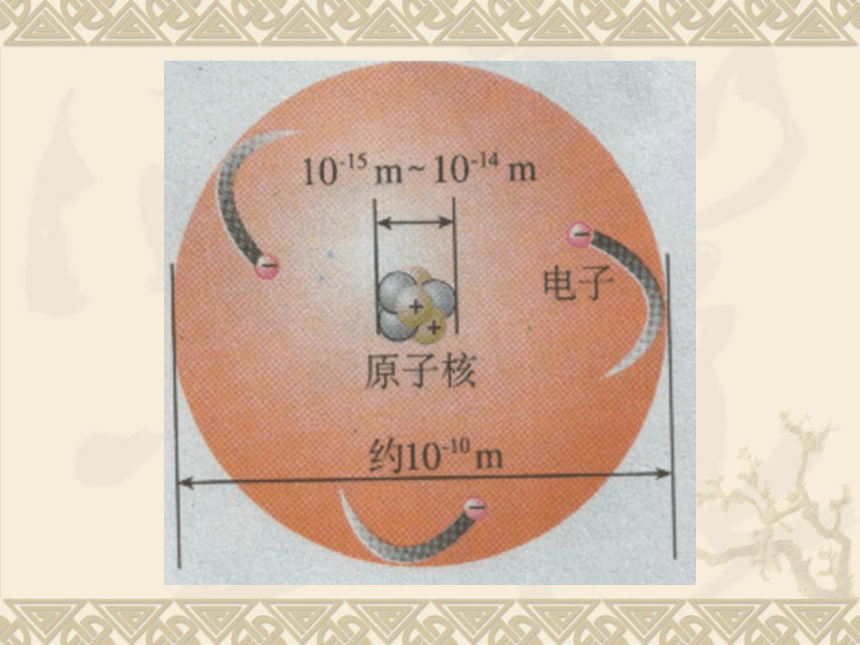
3.原子是由原子核和电子构成的。原子核在原子中所占体积极小,其半径约为原子半径的十万分之一,因此,相对而言,原子里有很大的空间。@ 粒子是带两个单位正电荷的氦原子。1911年,科学家用一束平行、高速运动的@粒子轰击金箔时,发现三种实验现象:
(1)有一小部分@粒子改变了原来的运动路径,原因是 @粒子途径金原子核附近时,受到斥力而稍微改变了运动方向。
(2)大多数 @粒子不改变原来的运动方向,原因是
(3)极少数@粒子被弹了回来,原因是4. 一个原子的原子核里一定含有的是( )
A.中子 B.质子 C.电子 D.质子和中子
一个点没有多大意义,众多点的疏密不同才有意义。
电子按能量高低在核外分层排布电子总是尽先排布在能量最低的电子层里。
1.排 布 规 律每个电子层最多只能排布2n 个电子。
当K层为最外层时,最多只能容纳2个电子。
次外层最多不超过18个电子。
最外层的电子最多只能容纳8个电子。
22.原子结构示意图+112 81第一层电子数为2最外层电子数为1 圆圈表示原子核核内质子数为11,带正电弧线表示电子层第二层电子数为8画出下列原子的结构示意图氢原子 硫原子 氯原子 钠原子练一练 3.离子 离子:带电的原子(或原子团)。
阳离子: 带正电的离子。
阴离子: 带负电的离子。
钠离子结构示意图阳离子:质子数>核外电子数失去1个电子钠原子结构示意图氯离子结构示意图阴离子:质子数<核外电子数氯原子结构示意图得到1个电子 阴离子(带负电的离子)稀有气体原子(已达稳定结构)不易形成离子
金属原子非金属原子阳离子(带正电的离子)
原子在反应中的倾向:
一般情况下,总是使自己的最外层电子达到
稳定结构
+离子和原子的区别与联系: 氯化钠(NaCl)的形成三、相对原子质量以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量。相对原子质量=某元素一个原子的质量一种碳原子的质量×1/12相对原子质量=质子数+中子数擂台过招1.1991年我国著名化学家张青莲教授与另一位科学家合作,测定了铟(In)元素的相对原子质量新值。铟(In)元素的核电荷数为49,相对原子质量为115。铟(In)原子的核外电子数为( )
A.115 B.49 C.66 D.164
2.有两种不同的铀原子,一种原子核内有92个质子和143个中子,另一种原子核内有92个质子和146个中子,则它们不相等的是( )
A.原子的质量 B.核电荷数
C.核内质子数 D.核外电子数
3.原子是由原子核和电子构成的。原子核在原子中所占体积极小,其半径约为原子半径的十万分之一,因此,相对而言,原子里有很大的空间。@ 粒子是带两个单位正电荷的氦原子。1911年,科学家用一束平行、高速运动的@粒子轰击金箔时,发现三种实验现象:
(1)有一小部分@粒子改变了原来的运动路径,原因是 @粒子途径金原子核附近时,受到斥力而稍微改变了运动方向。
(2)大多数 @粒子不改变原来的运动方向,原因是
(3)极少数@粒子被弹了回来,原因是4. 一个原子的原子核里一定含有的是( )
A.中子 B.质子 C.电子 D.质子和中子
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
