人教版初中化学九年级上册 6.3 二氧化碳和一氧化碳 课件(共43张PPT)
文档属性
| 名称 | 人教版初中化学九年级上册 6.3 二氧化碳和一氧化碳 课件(共43张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 22:11:33 | ||
图片预览








文档简介
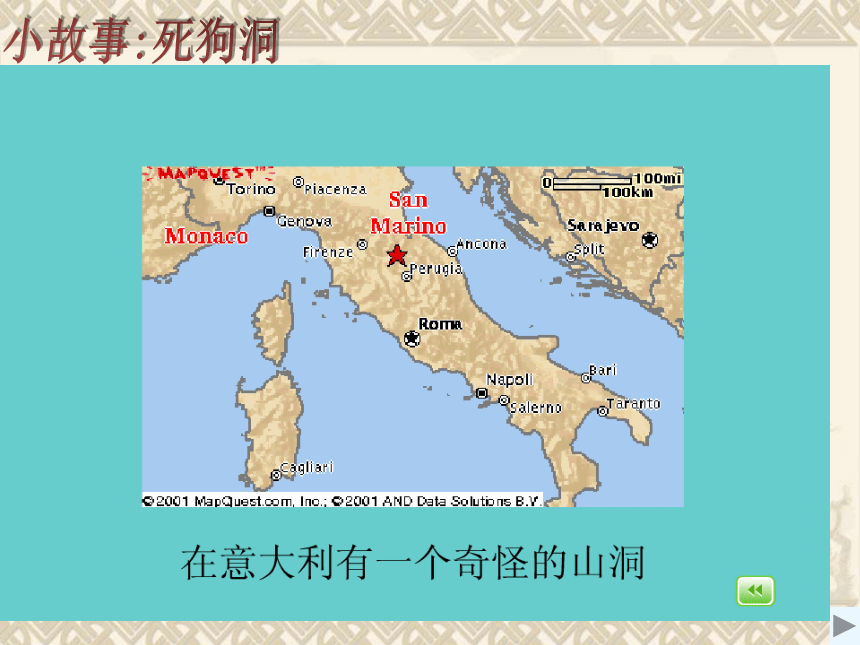
课件43张PPT。3 二氧化碳和一氧化碳
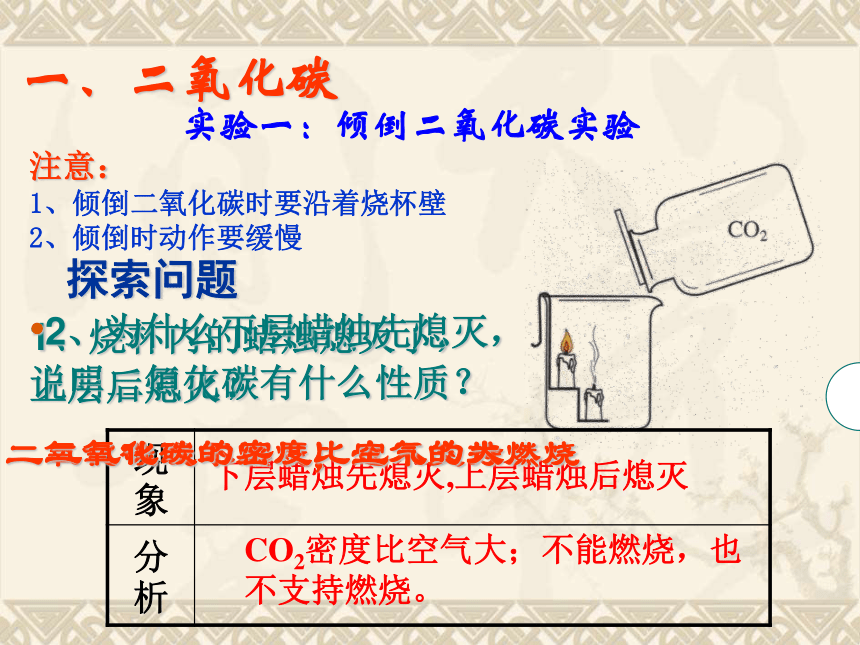
小故事:死狗洞下层蜡烛先熄灭,上层蜡烛后熄灭CO2密度比空气大;不能燃烧,也不支持燃烧。实验一:倾倒二氧化碳实验注意:
1、倾倒二氧化碳时要沿着烧杯壁
2、倾倒时动作要缓慢探索问题1、烧杯内的蜡烛熄灭了,说明二氧化碳有什么性质?二氧化碳既不燃烧,也不支持燃烧
2、为什么下层蜡烛先熄灭,
上层后熄灭?二氧化碳的密度比空气的大一、二氧化碳 想一想:你还能设计出其他的实验方案来证明二氧化碳的密度比空气密度大吗?若能,请简述实验步骤和现象。 向一个收集满二氧化碳气体的塑料瓶中加入一定体积的水,立即盖上瓶盖。振荡 塑料瓶变瘪了。CO2能溶于水,导致瓶内压强小于外界大气压强。实验二:溶解性实验在通常情况下,1体积的水约能溶解1体积的二氧化碳,增大压强会溶解得更多。(生产汽水等碳酸型饮料就是利用二氧化碳能溶于水这一性质制成的)通过上面两个实验,你能归纳出
二氧化碳有哪些物理性质呢?1、无色无味的气体2、密度比空气大3、能溶于水1.物理性质化学性质1、二氧化碳既不燃烧,不支持燃烧
也不能支持呼吸
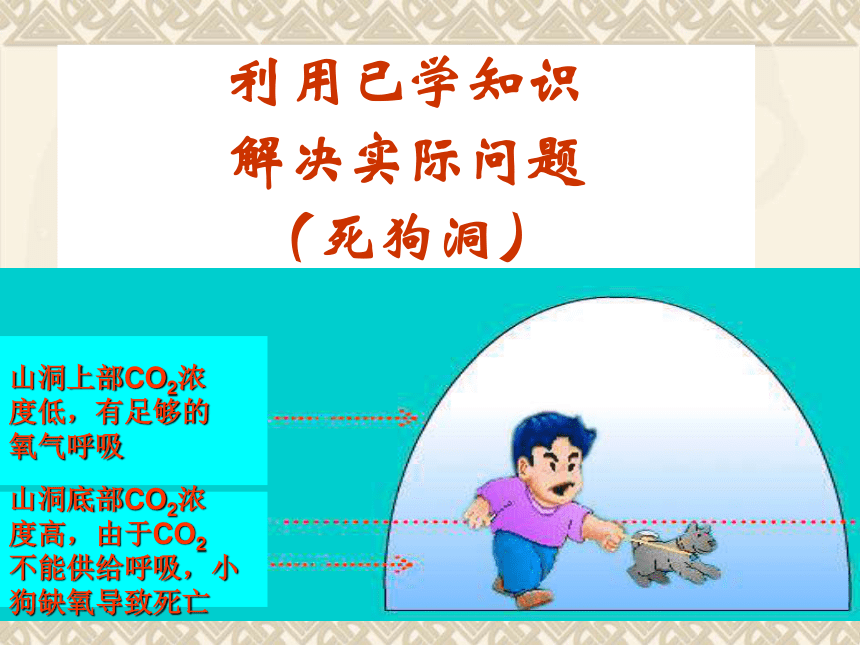
2、化学性质利用已学知识
解决实际问题
(死狗洞)山洞上部CO2浓
度低,有足够的
氧气呼吸山洞底部CO2浓
度高,由于CO2
不能供给呼吸,小
狗缺氧导致死亡提出问题:由日常生活我们知道鱼能在水中生存,是由于水中溶解有少量的氧气,氧气溶于水是物理变化还是化学变化呢?
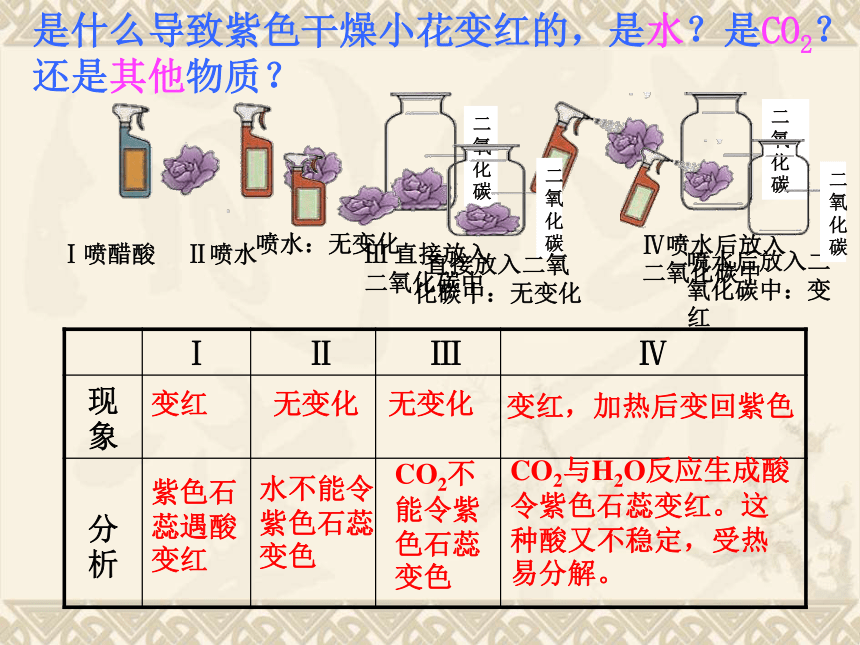
由开始的实验我们得知CO2也能溶于水,那么它溶于水时究竟有没有发生化学变化呢?实验三:探究二氧化碳溶于水石蕊2、二氧化碳与水反应变红无变化紫色石蕊遇酸变红水不能令紫色石蕊变色无变化CO2不能令紫色石蕊变色变红,加热后变回紫色CO2与H2O反应生成酸令紫色石蕊变红。这种酸又不稳定,受热易分解。是什么导致紫色干燥小花变红的,是水?是CO2?还是其他物质?当加热时,碳酸分解,从溶液中逸出二氧化碳,所以
变红色的溶液又变成紫色。以前我们经常说,检验二氧化碳气体选用什么样的试剂?怎样证明它是二氧化碳呢?答:将气体通入澄清石灰水,如果澄清石灰水变浑浊,则该气体是二氧化碳3、二氧化碳与澄清的石灰水发生反应此反应可以用来检验二氧化碳澄清的石灰水主要成分是:Ca(OH)2石灰水变浑浊是由于生成了白色的碳酸钙(CaCO3)沉淀↓讨论:为了使石灰浆抹的墙壁快点干燥常常在室内生个炭火盆,为什么开始放炭火盆时,墙壁反而更加潮湿了?
(用化学方程式表示)CO2+Ca(OH)2=CaCO3 +H2O小结① CO2不能燃烧,也不支持燃烧,不能支持呼吸② CO2 能与水反应生成碳酸2、二氧化碳的化学性质③ CO2能使澄清的石灰水变浑浊。 1、二氧化碳的物理性质通常状态下是无色无味的气体,易溶于水,密
度比空气大。 不同温度和压强情况下的CO2你知道吗?因此“干冰”是?固体二氧化碳干冰的作用③舞台烟幕
升华时产生大量的烟雾①人工降雨
升华时吸收大量的热量②保存食物
升华时使周围温度降低自学课本119--121页,完成以下问题:
(1)进入久未开启的菜窖或干涸的深井之前,为什么要做灯火实验?怎样检验?
(2)二氧化碳在生活和生产中具有哪些广泛用途?各利用了它的哪些性质?
(3)什么原因使空气中的二氧化碳含量越来越高? 二氧化碳过多会造成什么后果?根据二氧化碳的来源,可以采用什么办法来防止温室效应的进一步增强?3、二氧化碳对生活和环境的影响2、 CO2对生活和环境的影响CO2(1) CO2对生活和生产的影响性质决定用途灭火器光合作用汽水二氧化碳用途及相应性质:可做制冷剂,保存食品和人工降雨.(物理性质)可做灭火剂.(即有物理性质又有化学性质)可做气体肥料,促进光合作用.(化学性质)可做化工原料,制纯碱、汽水.(化学性质)(2) CO2对环境的影响(温室效应)a、两极冰川融化,海平面上升。
b 、气候反常,海洋风暴增多 。 c 、土地干旱,沙漠化面积增大。 ①大气中的二氧化碳气体能像温室的玻璃或塑料薄膜那样,使地面吸收的太阳光的能量不易散失,从而使全球变暖,这种现象叫“温室效应”。 ②温室效应增强的原因③危害1、化石燃料的大量使用,排入空气中的CO2增多;
2、森林面积不断减少 a、尽量减少使用化石燃料。
(例如:人们尽量节约用电, 少开私家车,多坐公交车。)
b、利用太阳能、风能等清洁燃料 。
c、大力植树造林,严禁乱砍滥伐。
(例如:减少使用一次性方便木筷,节约纸张,不践踏草坪等行动来保护绿色植物,使它们多吸收二氧化碳来帮助减缓温室效应。 ) 怎样减缓温室效应?课堂练习D1、下列关于二氧化碳的说中,正确的是( )
A、二氧化碳由一个碳原子和两个氧原子构成
B、二氧化碳溶于水是一个物理变化
C、二氧化碳可以使紫色石蕊试液变无色
D、二氧化碳是由碳元素和氧元素组成的2、CO2在下列变化中只发生物理变化的是( )
A、溶于水中 B、溶于石灰水中
C、进行光合作用 D、制成干冰DB3、向一试管中注入5 mL滴有石蕊试液的蒸馏水,通入二氧化碳气体,然后加热,其中颜色变化正确的是:( )
A、红—紫—无 B、紫—红—紫
C、紫—红—无 D、无—红—无 4、二氧化碳使紫色石蕊 试液变红的原因是( ) A、CO2能溶于水
B、CO2在加压降温下变成了干冰
C、CO2跟水反应生成了碳酸
D、CO2跟石蕊试液发生了化学反应 CD5、检验某无色气体是否是二氧化碳的方法是(? )
A、将气体通入紫色石蕊溶液中??
B、将气体从一个容器倒入另一容器中
C、将点燃的木条伸入集气瓶中??
D、将气体通入澄清的石灰水中
6、鉴别CO2、O2、空气三瓶气体时,最简便且可行的方法是( )
A、用燃着的木条分别伸入集气瓶中
B、分别加入石灰水并振荡
C、分别滴入紫色石蕊试液
D、分别加入水并振荡A8、盛石灰水的试剂瓶口常有一层白色的固体物质,该物质的化学式是_________,有关反应的化学方程式是
CO2+Ca(OH)2=CaCO3 +H2O
____________________________________。CaCO3 将二氧化碳通入蒸馏水中,然后滴入紫色的石蕊试液,可看到溶液变为__,这说明二氧化碳能___;而且能与水反应生成__。此反应的化学方程式为______。红色溶于水碳酸 取一玻璃杯,放入洗净的碎鸡蛋壳,然后加入
一些醋精(主要成分醋酸),立即用蘸有澄清石
灰水的玻璃片盖住。仔细观察什么现象发生。试
根据实验现象推测鸡蛋壳里可能含有什么物质。 现象: 1.杯子里面有气泡冒出 2.鸡蛋壳慢慢消失 3.玻璃片上变得模糊 推测鸡蛋壳里含有碳酸钙,与醋酸反应产生二氧化碳,使澄清石灰水变浑浊 3 二氧化碳和一氧化碳(第二课时)一、CO2的物理性质复习 二氧化碳的性质1、通常情况下是无色、无气味的气体。2、能溶于水(1:1)二、CO2的化学性质1、一般情况下,CO2不能燃烧,不能支持燃烧。2、CO2不能供呼吸。3、CO2跟水反应。CO2+H2O = H2CO3H2CO3 = CO2↑ +H2O 4、CO2与石灰水[Ca(OH)2]反应。CO2+ Ca(OH)2 = H2O +CaCO3 ↓三、用途一、CO的物理性质无色无色气态气态无味无味1.997克/升
( 比空气大)能溶于水(1体积水溶解约1体积CO2 )1.250克/升
( 比空气稍小)难溶于水(1体积水 溶解约0.02体积CO)CO与CO2的物理性质 比较表请选择收集CO的方法。CO的性质:⒈ CO难溶于水。⒉ CO密度比空气略小。收集CO的方法:收集 CO只能用排水法。1、一氧化碳有毒性
CO为什么会使人中毒呢?
中毒的生理过程如何?
想一想一氧化碳极易与血液中的血红蛋白结合,从而使血液中的
血红蛋白不能很好地与氧气结合,造成生物体内缺氧,所
以会出现中毒现象,严重时会危机生命。
二. CO的化学性质 写出CO在空气中燃烧的化学方程式CO + O2 == CO2点燃2、CO 有可燃性22燃烧现象CO在空气中燃烧,发出蓝色火焰,烧杯内壁上澄清的的石灰水变浑浊二. CO的化学性质你知道吗?煤炉里的煤在燃烧过程中, 发生了哪些化学反应? 液化气、天然气等含碳燃料在不充分燃烧时都会有CO生成。 CO是许多气体燃料如水煤气的主要成分。3、CO具有还原性 (通点熄停) CO还原性实验实验步骤:在玻璃管中放入氧化铜,通入一氧化碳赶走空气后,
加热。观察现象。
实验现象:
分析:是一氧化碳使CuO 失去氧变成Cu ,发生还原反应,所以说:一氧化碳具有还原性。
实验结论: . A:黑色粉末变成红色,B:澄清石灰水变浑浊,
C:点燃尾气,火焰呈蓝色一氧化碳与氧化铜反应生成铜和二氧化碳;
一氧化碳具有还原性 CuO + CO === Cu + CO2▲三、CO的用途1、CO有可燃性,可以用作燃料;
2、 CO有还原性,可以冶炼金属。1、机动车排放的尾气中,含有碳氢 化合物,CO,CO2,和氮的氧化物(如NO)等物质,因而是城市空气污染源之一。
(1)尾气中的_________能与人体中的血红蛋白结合而使人中毒。
(2)治理尾气的方法之一是在汽车的排气管上装一个“催化转化器”,它的作用是使CO和NO反应,生成两种气体,其中一种可参与植物光合作用,另一种是空气中含量最多的气体。请写出CO和NO反应的化学方程式
__________________________2CO + 2NO === N2 + 2CO2催化剂CO课堂练习2、CO和CO2相同的是 ( )
A、物理性质相同 B、化学性质相同
C、组成元素相同 D、相对分子质量相同
C3、你能说出几种鉴别CO和CO2气体的方法?
(1) 分别通入澄清的石灰水观察石灰水是否变 浑浊
(2)用燃着的木条分别伸入,观察火 焰是否熄灭 (3)分别通入灼热的氧化铜观察是否有红色的铜生成。 任何物质都必须合理运用。请仿照示例填写下表:广泛用于支持燃烧;
供动植物呼吸可用于民用或工业燃料植物的光合作用;
灭火;人工降雨造成食物的腐烂;
钢铁的锈蚀使用不当容易引起中毒事故大气中含量过多会引起“温室效应”
小故事:死狗洞下层蜡烛先熄灭,上层蜡烛后熄灭CO2密度比空气大;不能燃烧,也不支持燃烧。实验一:倾倒二氧化碳实验注意:
1、倾倒二氧化碳时要沿着烧杯壁
2、倾倒时动作要缓慢探索问题1、烧杯内的蜡烛熄灭了,说明二氧化碳有什么性质?二氧化碳既不燃烧,也不支持燃烧
2、为什么下层蜡烛先熄灭,
上层后熄灭?二氧化碳的密度比空气的大一、二氧化碳 想一想:你还能设计出其他的实验方案来证明二氧化碳的密度比空气密度大吗?若能,请简述实验步骤和现象。 向一个收集满二氧化碳气体的塑料瓶中加入一定体积的水,立即盖上瓶盖。振荡 塑料瓶变瘪了。CO2能溶于水,导致瓶内压强小于外界大气压强。实验二:溶解性实验在通常情况下,1体积的水约能溶解1体积的二氧化碳,增大压强会溶解得更多。(生产汽水等碳酸型饮料就是利用二氧化碳能溶于水这一性质制成的)通过上面两个实验,你能归纳出
二氧化碳有哪些物理性质呢?1、无色无味的气体2、密度比空气大3、能溶于水1.物理性质化学性质1、二氧化碳既不燃烧,不支持燃烧
也不能支持呼吸
2、化学性质利用已学知识
解决实际问题
(死狗洞)山洞上部CO2浓
度低,有足够的
氧气呼吸山洞底部CO2浓
度高,由于CO2
不能供给呼吸,小
狗缺氧导致死亡提出问题:由日常生活我们知道鱼能在水中生存,是由于水中溶解有少量的氧气,氧气溶于水是物理变化还是化学变化呢?
由开始的实验我们得知CO2也能溶于水,那么它溶于水时究竟有没有发生化学变化呢?实验三:探究二氧化碳溶于水石蕊2、二氧化碳与水反应变红无变化紫色石蕊遇酸变红水不能令紫色石蕊变色无变化CO2不能令紫色石蕊变色变红,加热后变回紫色CO2与H2O反应生成酸令紫色石蕊变红。这种酸又不稳定,受热易分解。是什么导致紫色干燥小花变红的,是水?是CO2?还是其他物质?当加热时,碳酸分解,从溶液中逸出二氧化碳,所以
变红色的溶液又变成紫色。以前我们经常说,检验二氧化碳气体选用什么样的试剂?怎样证明它是二氧化碳呢?答:将气体通入澄清石灰水,如果澄清石灰水变浑浊,则该气体是二氧化碳3、二氧化碳与澄清的石灰水发生反应此反应可以用来检验二氧化碳澄清的石灰水主要成分是:Ca(OH)2石灰水变浑浊是由于生成了白色的碳酸钙(CaCO3)沉淀↓讨论:为了使石灰浆抹的墙壁快点干燥常常在室内生个炭火盆,为什么开始放炭火盆时,墙壁反而更加潮湿了?
(用化学方程式表示)CO2+Ca(OH)2=CaCO3 +H2O小结① CO2不能燃烧,也不支持燃烧,不能支持呼吸② CO2 能与水反应生成碳酸2、二氧化碳的化学性质③ CO2能使澄清的石灰水变浑浊。 1、二氧化碳的物理性质通常状态下是无色无味的气体,易溶于水,密
度比空气大。 不同温度和压强情况下的CO2你知道吗?因此“干冰”是?固体二氧化碳干冰的作用③舞台烟幕
升华时产生大量的烟雾①人工降雨
升华时吸收大量的热量②保存食物
升华时使周围温度降低自学课本119--121页,完成以下问题:
(1)进入久未开启的菜窖或干涸的深井之前,为什么要做灯火实验?怎样检验?
(2)二氧化碳在生活和生产中具有哪些广泛用途?各利用了它的哪些性质?
(3)什么原因使空气中的二氧化碳含量越来越高? 二氧化碳过多会造成什么后果?根据二氧化碳的来源,可以采用什么办法来防止温室效应的进一步增强?3、二氧化碳对生活和环境的影响2、 CO2对生活和环境的影响CO2(1) CO2对生活和生产的影响性质决定用途灭火器光合作用汽水二氧化碳用途及相应性质:可做制冷剂,保存食品和人工降雨.(物理性质)可做灭火剂.(即有物理性质又有化学性质)可做气体肥料,促进光合作用.(化学性质)可做化工原料,制纯碱、汽水.(化学性质)(2) CO2对环境的影响(温室效应)a、两极冰川融化,海平面上升。
b 、气候反常,海洋风暴增多 。 c 、土地干旱,沙漠化面积增大。 ①大气中的二氧化碳气体能像温室的玻璃或塑料薄膜那样,使地面吸收的太阳光的能量不易散失,从而使全球变暖,这种现象叫“温室效应”。 ②温室效应增强的原因③危害1、化石燃料的大量使用,排入空气中的CO2增多;
2、森林面积不断减少 a、尽量减少使用化石燃料。
(例如:人们尽量节约用电, 少开私家车,多坐公交车。)
b、利用太阳能、风能等清洁燃料 。
c、大力植树造林,严禁乱砍滥伐。
(例如:减少使用一次性方便木筷,节约纸张,不践踏草坪等行动来保护绿色植物,使它们多吸收二氧化碳来帮助减缓温室效应。 ) 怎样减缓温室效应?课堂练习D1、下列关于二氧化碳的说中,正确的是( )
A、二氧化碳由一个碳原子和两个氧原子构成
B、二氧化碳溶于水是一个物理变化
C、二氧化碳可以使紫色石蕊试液变无色
D、二氧化碳是由碳元素和氧元素组成的2、CO2在下列变化中只发生物理变化的是( )
A、溶于水中 B、溶于石灰水中
C、进行光合作用 D、制成干冰DB3、向一试管中注入5 mL滴有石蕊试液的蒸馏水,通入二氧化碳气体,然后加热,其中颜色变化正确的是:( )
A、红—紫—无 B、紫—红—紫
C、紫—红—无 D、无—红—无 4、二氧化碳使紫色石蕊 试液变红的原因是( ) A、CO2能溶于水
B、CO2在加压降温下变成了干冰
C、CO2跟水反应生成了碳酸
D、CO2跟石蕊试液发生了化学反应 CD5、检验某无色气体是否是二氧化碳的方法是(? )
A、将气体通入紫色石蕊溶液中??
B、将气体从一个容器倒入另一容器中
C、将点燃的木条伸入集气瓶中??
D、将气体通入澄清的石灰水中
6、鉴别CO2、O2、空气三瓶气体时,最简便且可行的方法是( )
A、用燃着的木条分别伸入集气瓶中
B、分别加入石灰水并振荡
C、分别滴入紫色石蕊试液
D、分别加入水并振荡A8、盛石灰水的试剂瓶口常有一层白色的固体物质,该物质的化学式是_________,有关反应的化学方程式是
CO2+Ca(OH)2=CaCO3 +H2O
____________________________________。CaCO3 将二氧化碳通入蒸馏水中,然后滴入紫色的石蕊试液,可看到溶液变为__,这说明二氧化碳能___;而且能与水反应生成__。此反应的化学方程式为______。红色溶于水碳酸 取一玻璃杯,放入洗净的碎鸡蛋壳,然后加入
一些醋精(主要成分醋酸),立即用蘸有澄清石
灰水的玻璃片盖住。仔细观察什么现象发生。试
根据实验现象推测鸡蛋壳里可能含有什么物质。 现象: 1.杯子里面有气泡冒出 2.鸡蛋壳慢慢消失 3.玻璃片上变得模糊 推测鸡蛋壳里含有碳酸钙,与醋酸反应产生二氧化碳,使澄清石灰水变浑浊 3 二氧化碳和一氧化碳(第二课时)一、CO2的物理性质复习 二氧化碳的性质1、通常情况下是无色、无气味的气体。2、能溶于水(1:1)二、CO2的化学性质1、一般情况下,CO2不能燃烧,不能支持燃烧。2、CO2不能供呼吸。3、CO2跟水反应。CO2+H2O = H2CO3H2CO3 = CO2↑ +H2O 4、CO2与石灰水[Ca(OH)2]反应。CO2+ Ca(OH)2 = H2O +CaCO3 ↓三、用途一、CO的物理性质无色无色气态气态无味无味1.997克/升
( 比空气大)能溶于水(1体积水溶解约1体积CO2 )1.250克/升
( 比空气稍小)难溶于水(1体积水 溶解约0.02体积CO)CO与CO2的物理性质 比较表请选择收集CO的方法。CO的性质:⒈ CO难溶于水。⒉ CO密度比空气略小。收集CO的方法:收集 CO只能用排水法。1、一氧化碳有毒性
CO为什么会使人中毒呢?
中毒的生理过程如何?
想一想一氧化碳极易与血液中的血红蛋白结合,从而使血液中的
血红蛋白不能很好地与氧气结合,造成生物体内缺氧,所
以会出现中毒现象,严重时会危机生命。
二. CO的化学性质 写出CO在空气中燃烧的化学方程式CO + O2 == CO2点燃2、CO 有可燃性22燃烧现象CO在空气中燃烧,发出蓝色火焰,烧杯内壁上澄清的的石灰水变浑浊二. CO的化学性质你知道吗?煤炉里的煤在燃烧过程中, 发生了哪些化学反应? 液化气、天然气等含碳燃料在不充分燃烧时都会有CO生成。 CO是许多气体燃料如水煤气的主要成分。3、CO具有还原性 (通点熄停) CO还原性实验实验步骤:在玻璃管中放入氧化铜,通入一氧化碳赶走空气后,
加热。观察现象。
实验现象:
分析:是一氧化碳使CuO 失去氧变成Cu ,发生还原反应,所以说:一氧化碳具有还原性。
实验结论: . A:黑色粉末变成红色,B:澄清石灰水变浑浊,
C:点燃尾气,火焰呈蓝色一氧化碳与氧化铜反应生成铜和二氧化碳;
一氧化碳具有还原性 CuO + CO === Cu + CO2▲三、CO的用途1、CO有可燃性,可以用作燃料;
2、 CO有还原性,可以冶炼金属。1、机动车排放的尾气中,含有碳氢 化合物,CO,CO2,和氮的氧化物(如NO)等物质,因而是城市空气污染源之一。
(1)尾气中的_________能与人体中的血红蛋白结合而使人中毒。
(2)治理尾气的方法之一是在汽车的排气管上装一个“催化转化器”,它的作用是使CO和NO反应,生成两种气体,其中一种可参与植物光合作用,另一种是空气中含量最多的气体。请写出CO和NO反应的化学方程式
__________________________2CO + 2NO === N2 + 2CO2催化剂CO课堂练习2、CO和CO2相同的是 ( )
A、物理性质相同 B、化学性质相同
C、组成元素相同 D、相对分子质量相同
C3、你能说出几种鉴别CO和CO2气体的方法?
(1) 分别通入澄清的石灰水观察石灰水是否变 浑浊
(2)用燃着的木条分别伸入,观察火 焰是否熄灭 (3)分别通入灼热的氧化铜观察是否有红色的铜生成。 任何物质都必须合理运用。请仿照示例填写下表:广泛用于支持燃烧;
供动植物呼吸可用于民用或工业燃料植物的光合作用;
灭火;人工降雨造成食物的腐烂;
钢铁的锈蚀使用不当容易引起中毒事故大气中含量过多会引起“温室效应”
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
