人教版高中化学选修三课件2.3 分子的性质 课件(共15张PPT)
文档属性
| 名称 | 人教版高中化学选修三课件2.3 分子的性质 课件(共15张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 148.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 23:00:04 | ||
图片预览




文档简介
课件15张PPT。第三节 分子的性质(第一课时)
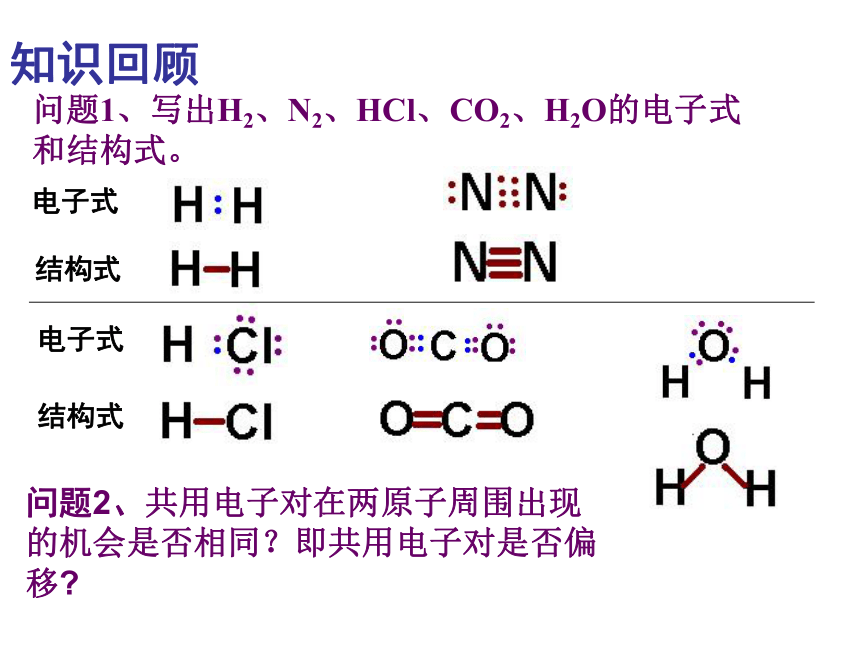
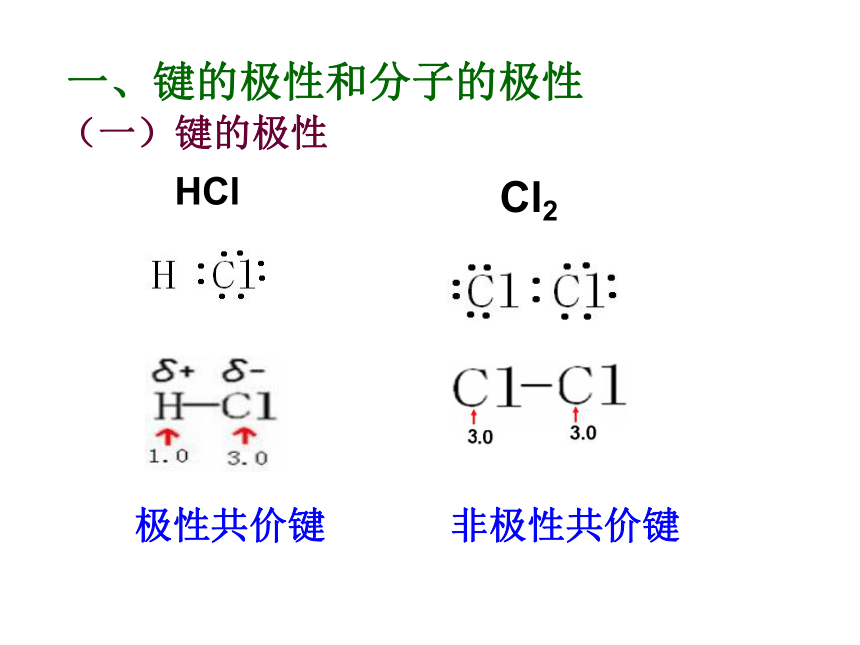
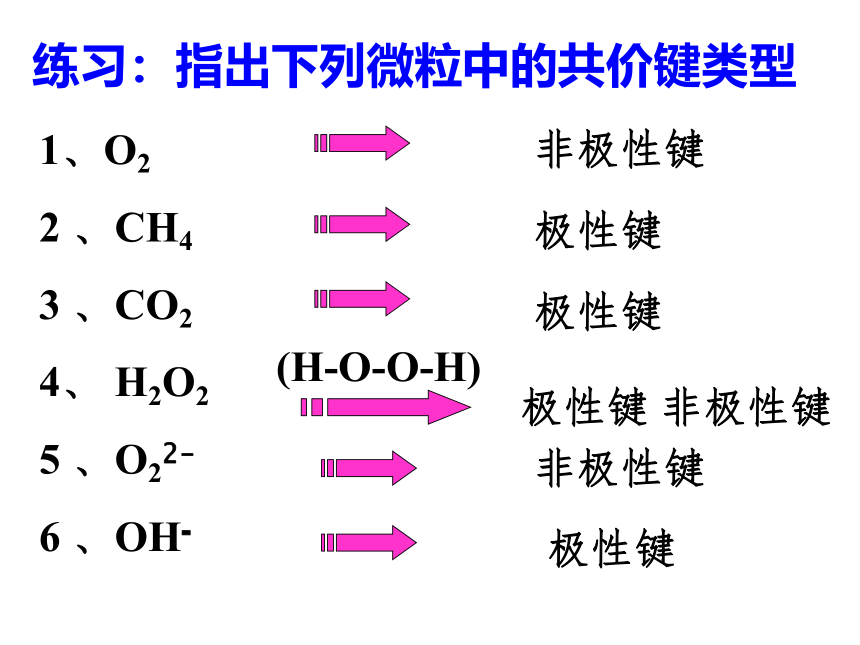
知识回顾问题1、写出H2、N2、HCl、CO2、H2O的电子式和结构式。问题2、共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?电子式结构式电子式结构式极性共价键 非极性共价键一、键的极性和分子的极性(一)键的极性HClCl22、共用电子对是否有偏向或偏离是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同造成的。即键合原子的电负性不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向或偏离思 考共用电子对有偏向(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)非极性键极性键3、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键。(2)不同种非金属元素的原子间形成的共价键是极性键。练习:指出下列微粒中的共价键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键极性键1.在培养皿中加入适量CCl4,用滴管滴入一滴水于培养皿的中央,用塑料笔在头发上摩擦后接近水滴并移动塑料笔,你观察到什么?为什么?
2.在培养皿中加少适量水,用滴管滴入一滴CCl4于培养皿的中央,用塑料笔在头发上摩擦后接近CCl4滴并移动塑料笔,你观察到什么?为什么?原因:
说明H2O分子与CCl4分子不同, H2O分子受静电作用, CCl4分子不受静电作用。动手做一做分子中键的极性对分子的性质有影响吗?极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合看正电中心和负电中心是否重合 (2)化学键的极性的向量和是否等于零(1)看键的极性,也看分子的空间构型 2、判断方法:1、概念(二)分子的极性第一类:全部由非极性键组成的分子是非极性分子。 如:P4、C60、S8 C70、B12 第二类:对于ABn型分子极性判别方法由极性键组成的双原子分子一定是极性分子。1.双原子分子双原子分子的极性取决于成键原子之间的共价键是否有极性,且分子的极性与键的极性一致。由非极性键组成的双原子分子一定是非极性分子。多原子分子呢?C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0CO2105oF1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子H2OBF3NH3120o107o三角锥型, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH42.多原子分子(ABn),当中心原子的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。 在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2非极性分子常见分子的构型及分子的极性无 无 直线型 非极性有 无 直线型 极性有 105o V型 极性有 180o 直线型 非极性有 107 三角锥型 极性有 120o 平面三角形 非极性有 109o28 ' 正四面体型 非极性分子的极性分子的空间结构键角键的极性
知识回顾问题1、写出H2、N2、HCl、CO2、H2O的电子式和结构式。问题2、共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?电子式结构式电子式结构式极性共价键 非极性共价键一、键的极性和分子的极性(一)键的极性HClCl22、共用电子对是否有偏向或偏离是由什么因素引起的呢? 这是由于原子对共用电子对的吸引力不同造成的。即键合原子的电负性不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向或偏离思 考共用电子对有偏向(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)非极性键极性键3、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键。(2)不同种非金属元素的原子间形成的共价键是极性键。练习:指出下列微粒中的共价键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键极性键1.在培养皿中加入适量CCl4,用滴管滴入一滴水于培养皿的中央,用塑料笔在头发上摩擦后接近水滴并移动塑料笔,你观察到什么?为什么?
2.在培养皿中加少适量水,用滴管滴入一滴CCl4于培养皿的中央,用塑料笔在头发上摩擦后接近CCl4滴并移动塑料笔,你观察到什么?为什么?原因:
说明H2O分子与CCl4分子不同, H2O分子受静电作用, CCl4分子不受静电作用。动手做一做分子中键的极性对分子的性质有影响吗?极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合看正电中心和负电中心是否重合 (2)化学键的极性的向量和是否等于零(1)看键的极性,也看分子的空间构型 2、判断方法:1、概念(二)分子的极性第一类:全部由非极性键组成的分子是非极性分子。 如:P4、C60、S8 C70、B12 第二类:对于ABn型分子极性判别方法由极性键组成的双原子分子一定是极性分子。1.双原子分子双原子分子的极性取决于成键原子之间的共价键是否有极性,且分子的极性与键的极性一致。由非极性键组成的双原子分子一定是非极性分子。多原子分子呢?C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子电荷分布均匀,没有极性,是非极性分子180oF1F2F合=0CO2105oF1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是V形构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子H2OBF3NH3120o107o三角锥型, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面正三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子CH42.多原子分子(ABn),当中心原子的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。 在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)[练习]判断下列分子是极性分子还是非极性分子:PCl3、CCl4、CS2、SO2非极性分子常见分子的构型及分子的极性无 无 直线型 非极性有 无 直线型 极性有 105o V型 极性有 180o 直线型 非极性有 107 三角锥型 极性有 120o 平面三角形 非极性有 109o28 ' 正四面体型 非极性分子的极性分子的空间结构键角键的极性
