人教版高中化学选修四课件 2.1 化学反应速率 课件(共18张PPT)
文档属性
| 名称 | 人教版高中化学选修四课件 2.1 化学反应速率 课件(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 178.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 23:01:53 | ||
图片预览


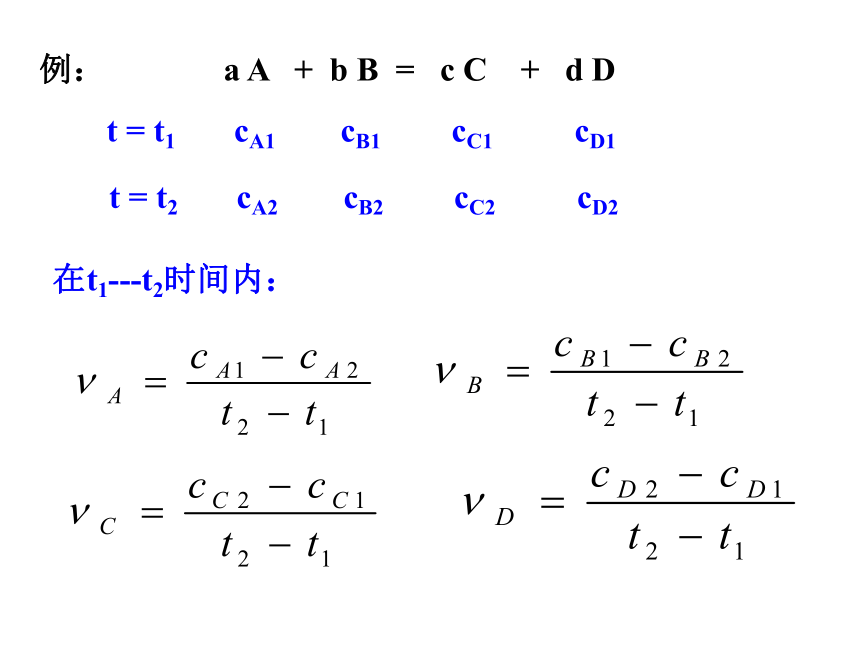



文档简介
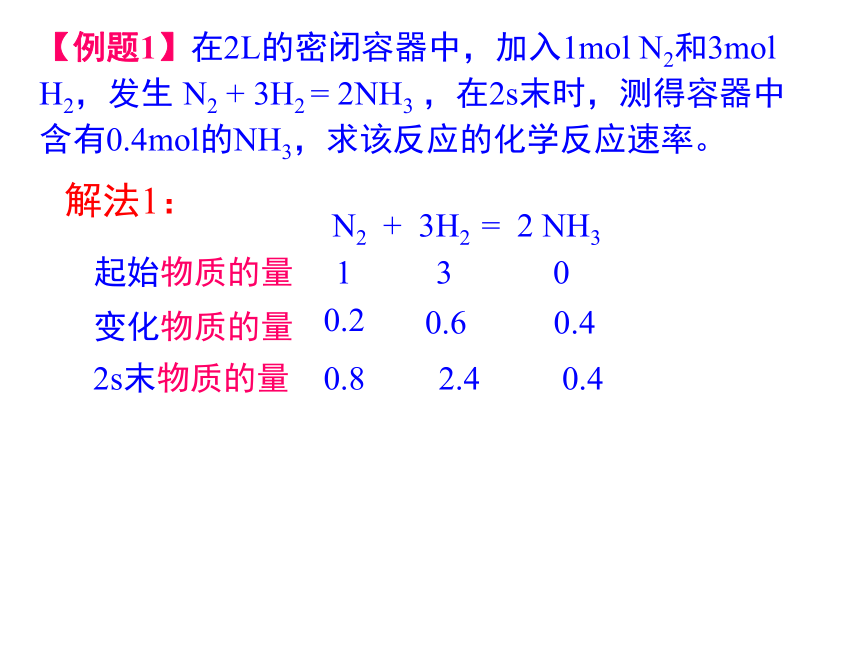
课件18张PPT。第一节 化学反应速率第二章 化学反应速率和化学平衡【例题1】在2L的密闭容器中,加入1mol N2和3mol H2,发生 N2 + 3H2 =?2NH3 ,在2s末时,测得容器中含有0.4mol的NH3,求该反应的化学反应速率。 N2 + 3H2 =? 2 NH3起始物质的量 1 3 02s末物质的量 0.42.40.8解法1:变化物质的量0.20.60.4一、化学反应速率(一)定义:用来衡量化学反应进行快慢程度的物理量。(二)定量表示:通常用单位时间内反应物浓度的减少或
生成物浓度的增加来表示。(三)定义式:例: a A + b B = c C + d D t = t1 cA1 cB1 cC1 cD1t = t2 cA2 cB2 cC2 cD2在t1---t2时间内:(四)单位注意:① 化学反应速率只取正值。603600 2、同一化学反应,用不同物质表示的速率值之比等于
化学方程式中各种物质化学计量数之比(也等于浓度
变化量之比)。对化学反应:mA(气)+nB(气)=pC(气)+qD(气) 1、同一化学反应,用不同物质表示反应速率时,数值
可能不同,但意义相同。故表示某化学反应的反应速率
时,必须指明具体的物质。注意:3、因固体物质和纯液体浓度为常数,反应中浓度变化
为 0 ,故不能用固体物质浓度变化来计算反应速率。
4、比较稀的水溶液中进行的化学反应,水的浓度约为
常数,一般也不用水的浓度变化来计算反应速率。 二、化学反应速率的测定 原理:化学反应进行时,反应体系中一种反应物的
变化,必然引起其他物质浓度发生相应的变化。
因此,反应体系中任何一种物质的浓度、质量等等
的变化均可测定用于计算化学反应速率。通常测量哪些值? 18页可用于化学反应速率测定的基本性质
①可直接观察的性质:如释放出的气体的体积和体系的压强
②依靠科学仪器才能测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力
③在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
【思考】
对于锌与不同浓度的稀硫酸的实验,你准备如何比较反应速率的快慢?定性
①观察产生气泡的
快、慢
②观察试管中剩余锌
粒的多、少
③用手触摸试管,感
受试管外壁温度的
高、低定量
①测量单位时间内所产生 的氢气的体积或质量
②测量单位时间内所消耗
的锌粒的质量
③测量单位时间内溶液所
上升的温度【思考】如何通过用注射器测量氢气的体积的方法判断锌和不同浓度的稀硫酸反应的速率快慢?
1)找出某种易于测量的物理量或性质的变化
——测量氢气的体积
2) 确定变量
——稀硫酸的浓度不同
3)控制不变的因素
——锌粒的表面积、温度
——时间或氢气的体积实验2-1该实验所用的仪器和药品锥形瓶分液漏斗玻璃导管橡皮管注射器(50ml)铁架台量筒(50ml)胶头滴管镊子 秒表锌粒、1mol/L硫酸、
4 mol/L硫酸化学反应的速率的实验测定5、常见题型例举【例题2】反应4NH3+5O2 =4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A、 v (O2)=0.01 mol/(L·s)
B、 v (NO)=0.008 mol/(L·s)
C、 v (H2O)=0.003 mol/(L·s)
D、 v (NH3)=0.002 mol/(L·s) C D【例题3】反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①VA = 0.15mol·L-1·s-1 ②VB = 0.6mol·L-1·s-1 ③Vc = 0.4mol·L-1·s-1 ④VD = 0.45mol·L-1·s-1 则该反应在不同条件下速率快慢顺序是 ④﹥②= ③﹥①注意:比较反应速率的大小不能单纯地看数值大小!将速率转化成用同一物质表示的速率,并且单位一致,再进行比较5、常见题型例举【例题4】某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为: c(X2)=0.4mol/L c(Y2)=0.8mol/L , c(Z)=0.4mol/L , 则该反应的反应方程式可表示为:3X2 + Y2 == 2Z3X2 + Y2 == 2X3Y5、常见题型例举【练习】1、反应物是 __________. 2、2min内A的平均速率是________3、写出化学方程式:A、B2.5mol/(L·s)5A + 4B = 4C 根据下图回答:长短小大反应物(指气体和液体,不含纯液体和固体)的浓度越大,反应时间越短,反应速率越快。【练习2】一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol氮气和3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内,用氢气的量的变化来表示的该反应的平均反应速率v(H2)是( )
A、0.2mol/(L·min) B、 0.6mol/(L·min) C、0.1mol/(L·min) D、 0.3mol/(L·min) C
生成物浓度的增加来表示。(三)定义式:例: a A + b B = c C + d D t = t1 cA1 cB1 cC1 cD1t = t2 cA2 cB2 cC2 cD2在t1---t2时间内:(四)单位注意:① 化学反应速率只取正值。603600 2、同一化学反应,用不同物质表示的速率值之比等于
化学方程式中各种物质化学计量数之比(也等于浓度
变化量之比)。对化学反应:mA(气)+nB(气)=pC(气)+qD(气) 1、同一化学反应,用不同物质表示反应速率时,数值
可能不同,但意义相同。故表示某化学反应的反应速率
时,必须指明具体的物质。注意:3、因固体物质和纯液体浓度为常数,反应中浓度变化
为 0 ,故不能用固体物质浓度变化来计算反应速率。
4、比较稀的水溶液中进行的化学反应,水的浓度约为
常数,一般也不用水的浓度变化来计算反应速率。 二、化学反应速率的测定 原理:化学反应进行时,反应体系中一种反应物的
变化,必然引起其他物质浓度发生相应的变化。
因此,反应体系中任何一种物质的浓度、质量等等
的变化均可测定用于计算化学反应速率。通常测量哪些值? 18页可用于化学反应速率测定的基本性质
①可直接观察的性质:如释放出的气体的体积和体系的压强
②依靠科学仪器才能测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力
③在溶液中,当反应物或生成本身有比较明显的颜色时,人们常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率.
【思考】
对于锌与不同浓度的稀硫酸的实验,你准备如何比较反应速率的快慢?定性
①观察产生气泡的
快、慢
②观察试管中剩余锌
粒的多、少
③用手触摸试管,感
受试管外壁温度的
高、低定量
①测量单位时间内所产生 的氢气的体积或质量
②测量单位时间内所消耗
的锌粒的质量
③测量单位时间内溶液所
上升的温度【思考】如何通过用注射器测量氢气的体积的方法判断锌和不同浓度的稀硫酸反应的速率快慢?
1)找出某种易于测量的物理量或性质的变化
——测量氢气的体积
2) 确定变量
——稀硫酸的浓度不同
3)控制不变的因素
——锌粒的表面积、温度
——时间或氢气的体积实验2-1该实验所用的仪器和药品锥形瓶分液漏斗玻璃导管橡皮管注射器(50ml)铁架台量筒(50ml)胶头滴管镊子 秒表锌粒、1mol/L硫酸、
4 mol/L硫酸化学反应的速率的实验测定5、常见题型例举【例题2】反应4NH3+5O2 =4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A、 v (O2)=0.01 mol/(L·s)
B、 v (NO)=0.008 mol/(L·s)
C、 v (H2O)=0.003 mol/(L·s)
D、 v (NH3)=0.002 mol/(L·s) C D【例题3】反应A + 3B == 2C + 2D在四种不同情况下的反应速率分别为
①VA = 0.15mol·L-1·s-1 ②VB = 0.6mol·L-1·s-1 ③Vc = 0.4mol·L-1·s-1 ④VD = 0.45mol·L-1·s-1 则该反应在不同条件下速率快慢顺序是 ④﹥②= ③﹥①注意:比较反应速率的大小不能单纯地看数值大小!将速率转化成用同一物质表示的速率,并且单位一致,再进行比较5、常见题型例举【例题4】某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为: c(X2)=0.4mol/L c(Y2)=0.8mol/L , c(Z)=0.4mol/L , 则该反应的反应方程式可表示为:3X2 + Y2 == 2Z3X2 + Y2 == 2X3Y5、常见题型例举【练习】1、反应物是 __________. 2、2min内A的平均速率是________3、写出化学方程式:A、B2.5mol/(L·s)5A + 4B = 4C 根据下图回答:长短小大反应物(指气体和液体,不含纯液体和固体)的浓度越大,反应时间越短,反应速率越快。【练习2】一定温度下,向一个容积为2L的事先装入催化剂的真空密闭容器中通入1mol氮气和3mol氢气,3min后测得容器内的压强是起始时压强的0.9倍,在此时间内,用氢气的量的变化来表示的该反应的平均反应速率v(H2)是( )
A、0.2mol/(L·min) B、 0.6mol/(L·min) C、0.1mol/(L·min) D、 0.3mol/(L·min) C
