人教版高中化学选修四课件 4.4 金属的电化学腐蚀与防护 课件(共51张PPT)
文档属性
| 名称 | 人教版高中化学选修四课件 4.4 金属的电化学腐蚀与防护 课件(共51张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 220.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-20 00:00:00 | ||
图片预览








文档简介
课件50张PPT。第四节 金属的电化学腐蚀与防护
自主学习一、金属的电化学腐蚀
1.金属腐蚀
(1)定义:金属与周围的____________物质发生____________反应而引起损耗的现象。
气体或液体氧化还原(2)本质:金属__________变成阳离子,发生了氧化反应,用反应方程式表示:M-ne-===Mn+。
(3)分类
①化学腐蚀:金属与接触到的_________ (如O2、Cl2、SO2等)或__________液体(如石油)等直接发生化学反应而引起的腐蚀。失去电子干燥气体非电解质②电化学腐蚀:______的金属与________溶液接触时,会发生__________反应,而使金属腐蚀。
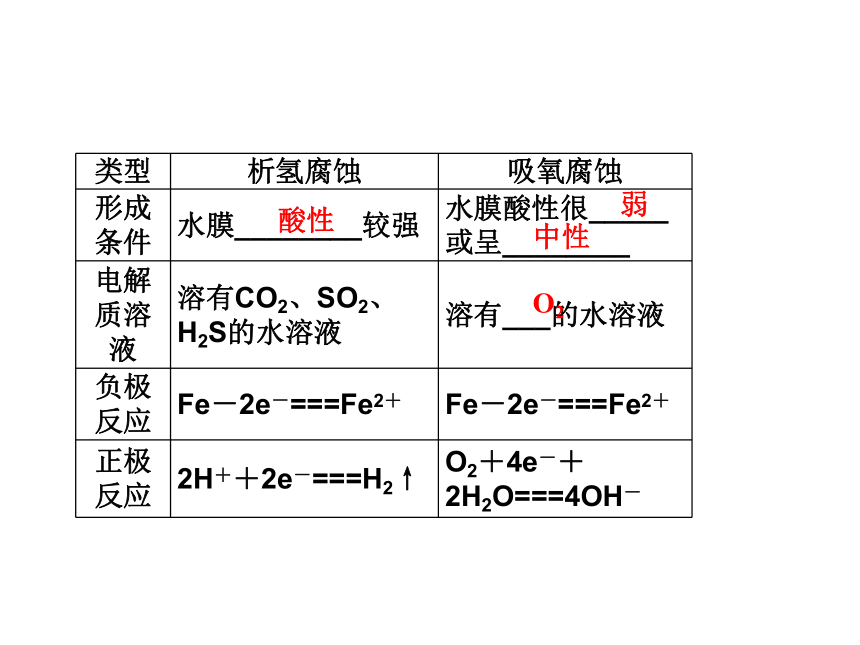
2.电化学腐蚀
钢铁析氢腐蚀和吸氧腐蚀的比较
不纯电解质原电池酸性弱中性O22Fe+O2+2H2O ===2Fe(OH)23.钢铁生锈原理的实验探究
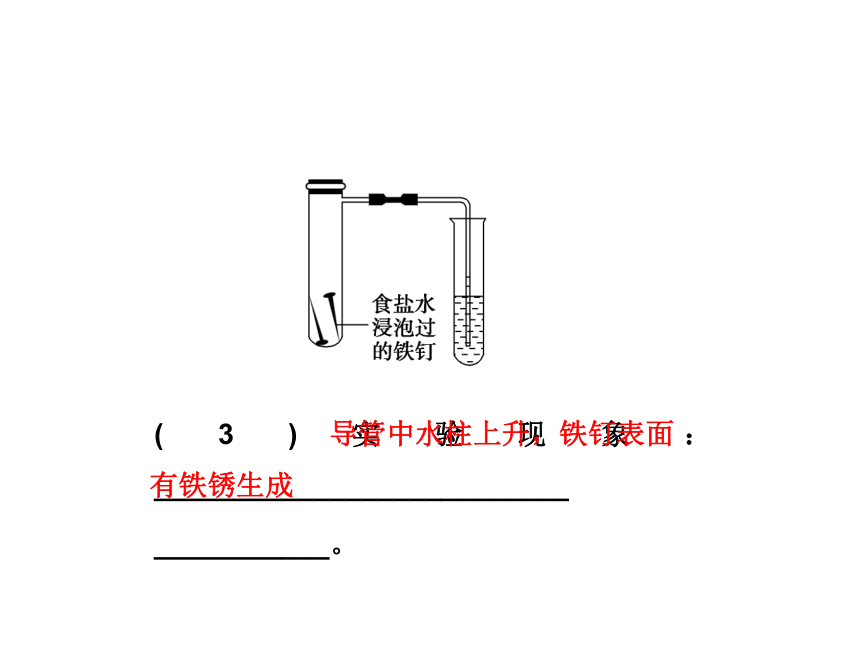
(1)实验目的:探究饱和食盐水浸泡过的铁钉发生吸氧腐蚀。
(2)实验步骤:将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入如图所示的具支试管中。几分钟后,观察导管中水柱的变化。
(3)实验现象:__________________________
___________。 导管中水柱上升,铁钉表面
有铁锈生成(4)实验分析:装置中Fe、C、饱和食盐水一起构成了原电池,Fe作负极,碳作正极,饱和食盐水作电解质溶液,由于NaCl溶液呈中
性,因此钢铁发生_________腐蚀。吸氧二、金属的电化学防护
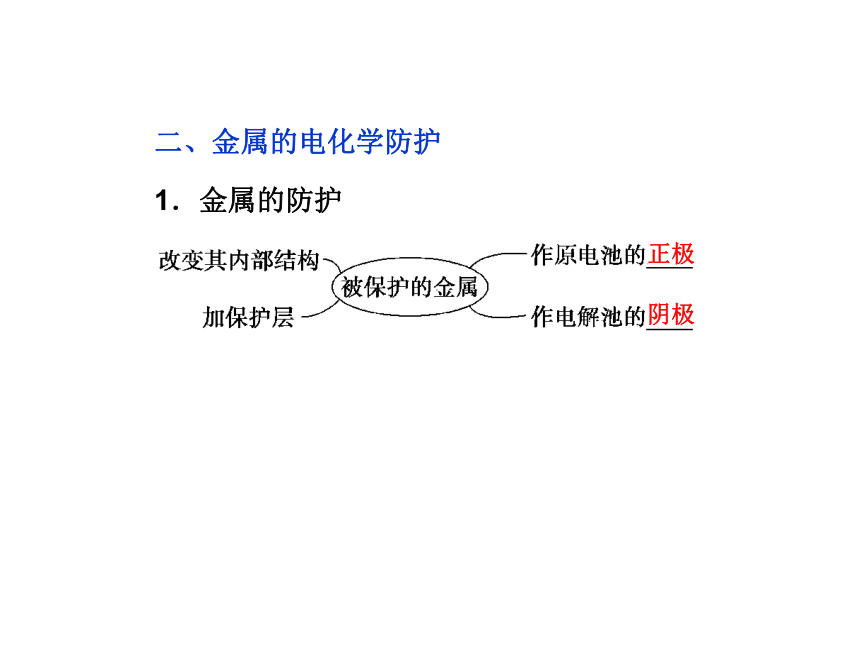
1.金属的防护
正极阴极2.金属的电化学防护
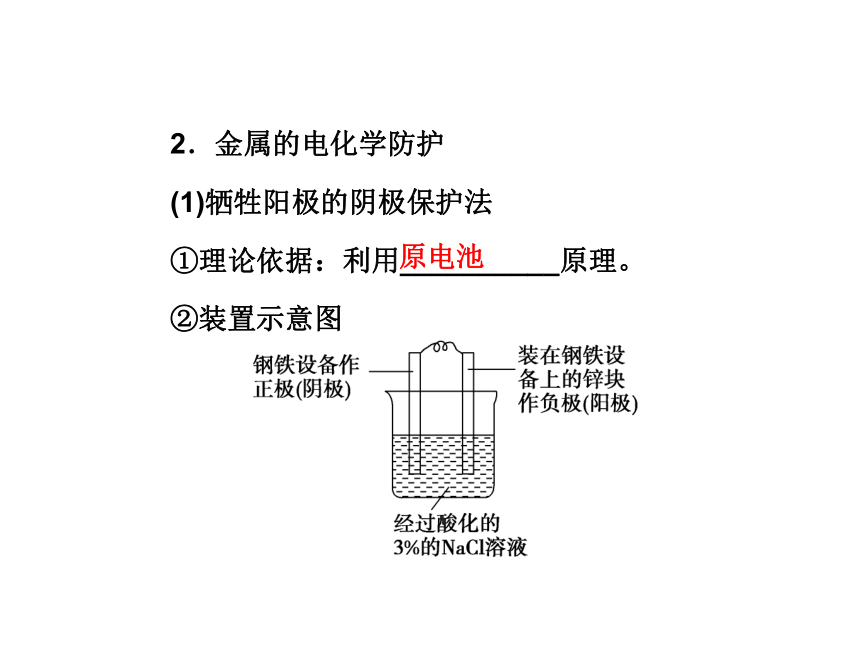
(1)牺牲阳极的阴极保护法
①理论依据:利用__________原理。
②装置示意图原电池③电极反应式
负极:______________________;
正极:___________________。
(2)外加电流的阴极保护法
①理论依据:利用__________原理。
电解Zn-2e-===Zn2+2H++2e-===H2↑②装置示意图
阴极阳极自主体验
判断正误
1.金属的腐蚀都是金属失去电子被氧化的过程,所以都是化学腐蚀。( )
2.钢铁的析氢腐蚀和吸氧腐蚀的区别在于前者有H2生成,后者有O2参加。( )
3.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀。( )4.钢铁发生电化学腐蚀的负极反应式为Fe-3e-===Fe3+。( )
5.白铁(镀锌铁)镀层破损后铁皮的腐蚀速率减慢。( )
6.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀。( )
答案:1.× 2.? √ 3.× 4.× 5.× 6.×探究导引1将纯铁片放入稀硫酸中发生的是析氢腐蚀吗?
提示:不是,因为没有形成原电池,属于化学腐蚀。要点归纳
特别提醒
判断金属的腐蚀类型要从本质入手,化学腐蚀和电化学腐蚀的本质区别在于是否发生原电池反应。在电化学腐蚀中,只有在金属活动性顺序中位于氢前面的金属才可能发生析
氢腐蚀,而位于氢之后的金属只能发生吸氧
腐蚀,吸氧腐蚀比析氢腐蚀更为普遍。
即时应用
1.(2012·太原高二检测)某课外活动小组,为研究金属的腐蚀原理,做了如下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图的装置进行实验,过一段时间后观察。下列现象不可能出现的是( )A.B中导气管中产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀
解析:选A。由题意知,锌铁合金放入NaCl溶液中,形成了原电池,由于金属活动性:Zn>Fe,且电解质溶液为NaCl溶液,呈中
性,故发生了Zn的吸氧腐蚀,导致A中压强
减小,B中应形成一段水柱,由于O2得电子后结合H2O形成OH-,显碱性,使酚酞变红,故A错误,B、C、D正确。
探究导引2 结合金属腐蚀的本质,分析金属防护的本质是什么?在电化学防护中是如何做的?提示:金属腐蚀的本质是金属被氧化剂氧化变成金属阳离子,因此金属防护的本质是避免金属接触氧化剂,或采取措施使金属不被
氧化。在电化学防护中使被保护的金属作原
电池的正极或电解池的阴极,不参与电极反
应,从而不被氧化。
要点归纳
1.金属腐蚀快慢的判断方法
(1)在同一电解质溶液中:电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)同一种金属在相同浓度不同介质中腐蚀由快到慢的顺序为:强电解质溶液>弱电解质溶液>非电解质溶液。(3)有无保护措施的腐蚀快慢顺序:无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护法引起的金属腐蚀>有外加电流的阴极保护法引起的金属腐蚀。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀速率越快。
特别提醒
对于活动性不同的两种金属,活动性差别越
大,氧化还原反应的速率越快,活泼金属腐
蚀速率越快;纯度越高的金属,腐蚀速率越
慢。
2.金属的防护方法
(1)改变金属的内部组织结构
例如:把铬、镍等加入普通钢里制成的不锈
钢,就大大地增加了钢铁对各种侵蚀的抵抗
力。(2)在金属表面覆盖保护层
在金属表面覆盖致密的保护层,从而使金属制品跟周围物质隔离开来,这是一种普遍采用的防护方法。
(3)电化学保护法
①牺牲阳极的阴极保护法
将还原性较强的金属作为保护极与被保护金属相连构成原电池,还原性较强的金属将作为负极发生氧化反应而被损耗,被保护金属作为正极就可以避免被腐蚀。这种保护法牺牲了阳极保护了阴极。
②外加电流的阴极保护法
将被保护金属与外加直流电源的负极相连让其成为阴极,而将外加直流电源的正极接到惰性电极上,让其成为阳极。
即时应用
2.下列各情况下,其中铁块腐蚀由快到慢的顺序是________。解析:⑤中Fe作电解池的阳极,腐蚀速率最
快,②中Fe作原电池的负极,腐蚀速率较快,③中Fe作原电池的正极,④中Fe作电解池的
阴极,受到保护。因此铁片腐蚀由快到慢的顺序是:⑤②①③④。
答案:⑤②①③④
(2012·黑河高二检测)下列试管中的铁钉腐蚀最快的是( )【思路点拨】 (1)原电池负极被腐蚀,电解池阳极被腐蚀。
(2)一般规律:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
【解析】 A、B、C装置主要发生了化学腐
蚀,而D装置中首先Fe把Cu置换出来,Fe-Cu与H+形成了原电池,加快了腐蚀速度。【答案】 D
【误区警示】 D装置中易忽略Fe置换出的少量Cu与Fe组成原电池,发生原电池反应会引起腐蚀加快。
(2010·高考北京卷)下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+【解析】 本题考查金属的腐蚀和防护,意在考查学生对金属腐蚀原理的理解和防护措施的应用。钢管与电源正极相连,则钢管作阳极,发生氧化反应而被腐蚀,A项错误;铁遇冷浓硝酸表面钝化,在表面生成一层致密的氧化膜保护内部不被腐蚀,B项正确;钢管与铜管露天堆放在一起,形成原电池时钢管作负极,发生氧化反应而被腐蚀,C项错误;钢铁发生析氢腐蚀时,负极反应为:Fe-2e-===Fe2+,D项错误。
【答案】 B钢铁生锈的实验探究
钢铁在潮湿环境下形成原电池,发生电化学腐蚀。潮湿是铁生锈的必需前提,根据铁(Fe)→铁锈(Fe2O3·H2O)生锈条件:O2浓度是影响生锈快慢的一个重要因素。[经典案例] 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在四个小烧瓶中分别放入下列物质:A瓶干燥的细铁丝、B瓶浸过食盐水的细铁丝、C瓶浸过清水的细铁丝、D瓶食盐水及细铁丝,并使细铁丝完全浸没在食盐水中。然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示。
不同时间水面上升的高度
课题组在解题时,学校评审组组织了成果展示与答辩,假如你是课题组组长,请回答以下的问题:
(1)导管中水面为什么会上升?________________________________________________________________________
________________________________________________________________________。
(2)上述实验中,细铁丝生锈的速率由大到小的排列顺序为(填小烧瓶号) ________________________________________________________________________。
(3)影响钢铁生锈的因素主要有__________________________________
________________________________________________________________________。(4)为防止铁的锈蚀,工业上普遍采用的方法是________________________________________________________________________
________________________________________________________________________(答两种方法)【解析】 浸过清水或食盐水的铁丝发生吸氧腐蚀,故导管中液面要上升。但要发生吸氧腐蚀的原电池反应,必须符合构成原电池的基本条件: ①活泼性不同的电极互相接
触;②电解质溶液;③有空气(或O2)且尽量与细铁丝和电解质接触。为了防止铁的锈蚀,工业上普遍采用电化学保护法,可以作原电池的正极或电解池的阴
极,也可以用覆盖保护层的方法。【答案】(1)铁生锈时跟空气中的氧气反应, 消耗了氧气而使小烧瓶中气体压强降低
(2)B>C>A=D
(3)①跟氧气接触,②有水分存在,③有电解质存在,三者同时具备时铁生锈速率最快(或从构成原电池的条件分析)
(4)电镀等表面覆盖保护层法、牺牲阳极的阴极保护法等
自主学习一、金属的电化学腐蚀
1.金属腐蚀
(1)定义:金属与周围的____________物质发生____________反应而引起损耗的现象。
气体或液体氧化还原(2)本质:金属__________变成阳离子,发生了氧化反应,用反应方程式表示:M-ne-===Mn+。
(3)分类
①化学腐蚀:金属与接触到的_________ (如O2、Cl2、SO2等)或__________液体(如石油)等直接发生化学反应而引起的腐蚀。失去电子干燥气体非电解质②电化学腐蚀:______的金属与________溶液接触时,会发生__________反应,而使金属腐蚀。
2.电化学腐蚀
钢铁析氢腐蚀和吸氧腐蚀的比较
不纯电解质原电池酸性弱中性O22Fe+O2+2H2O ===2Fe(OH)23.钢铁生锈原理的实验探究
(1)实验目的:探究饱和食盐水浸泡过的铁钉发生吸氧腐蚀。
(2)实验步骤:将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入如图所示的具支试管中。几分钟后,观察导管中水柱的变化。
(3)实验现象:__________________________
___________。 导管中水柱上升,铁钉表面
有铁锈生成(4)实验分析:装置中Fe、C、饱和食盐水一起构成了原电池,Fe作负极,碳作正极,饱和食盐水作电解质溶液,由于NaCl溶液呈中
性,因此钢铁发生_________腐蚀。吸氧二、金属的电化学防护
1.金属的防护
正极阴极2.金属的电化学防护
(1)牺牲阳极的阴极保护法
①理论依据:利用__________原理。
②装置示意图原电池③电极反应式
负极:______________________;
正极:___________________。
(2)外加电流的阴极保护法
①理论依据:利用__________原理。
电解Zn-2e-===Zn2+2H++2e-===H2↑②装置示意图
阴极阳极自主体验
判断正误
1.金属的腐蚀都是金属失去电子被氧化的过程,所以都是化学腐蚀。( )
2.钢铁的析氢腐蚀和吸氧腐蚀的区别在于前者有H2生成,后者有O2参加。( )
3.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀。( )4.钢铁发生电化学腐蚀的负极反应式为Fe-3e-===Fe3+。( )
5.白铁(镀锌铁)镀层破损后铁皮的腐蚀速率减慢。( )
6.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀。( )
答案:1.× 2.? √ 3.× 4.× 5.× 6.×探究导引1将纯铁片放入稀硫酸中发生的是析氢腐蚀吗?
提示:不是,因为没有形成原电池,属于化学腐蚀。要点归纳
特别提醒
判断金属的腐蚀类型要从本质入手,化学腐蚀和电化学腐蚀的本质区别在于是否发生原电池反应。在电化学腐蚀中,只有在金属活动性顺序中位于氢前面的金属才可能发生析
氢腐蚀,而位于氢之后的金属只能发生吸氧
腐蚀,吸氧腐蚀比析氢腐蚀更为普遍。
即时应用
1.(2012·太原高二检测)某课外活动小组,为研究金属的腐蚀原理,做了如下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图的装置进行实验,过一段时间后观察。下列现象不可能出现的是( )A.B中导气管中产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀
解析:选A。由题意知,锌铁合金放入NaCl溶液中,形成了原电池,由于金属活动性:Zn>Fe,且电解质溶液为NaCl溶液,呈中
性,故发生了Zn的吸氧腐蚀,导致A中压强
减小,B中应形成一段水柱,由于O2得电子后结合H2O形成OH-,显碱性,使酚酞变红,故A错误,B、C、D正确。
探究导引2 结合金属腐蚀的本质,分析金属防护的本质是什么?在电化学防护中是如何做的?提示:金属腐蚀的本质是金属被氧化剂氧化变成金属阳离子,因此金属防护的本质是避免金属接触氧化剂,或采取措施使金属不被
氧化。在电化学防护中使被保护的金属作原
电池的正极或电解池的阴极,不参与电极反
应,从而不被氧化。
要点归纳
1.金属腐蚀快慢的判断方法
(1)在同一电解质溶液中:电解池原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(2)同一种金属在相同浓度不同介质中腐蚀由快到慢的顺序为:强电解质溶液>弱电解质溶液>非电解质溶液。(3)有无保护措施的腐蚀快慢顺序:无保护措施的金属腐蚀>有一定保护措施的金属腐蚀>牺牲阳极的阴极保护法引起的金属腐蚀>有外加电流的阴极保护法引起的金属腐蚀。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀速率越快。
特别提醒
对于活动性不同的两种金属,活动性差别越
大,氧化还原反应的速率越快,活泼金属腐
蚀速率越快;纯度越高的金属,腐蚀速率越
慢。
2.金属的防护方法
(1)改变金属的内部组织结构
例如:把铬、镍等加入普通钢里制成的不锈
钢,就大大地增加了钢铁对各种侵蚀的抵抗
力。(2)在金属表面覆盖保护层
在金属表面覆盖致密的保护层,从而使金属制品跟周围物质隔离开来,这是一种普遍采用的防护方法。
(3)电化学保护法
①牺牲阳极的阴极保护法
将还原性较强的金属作为保护极与被保护金属相连构成原电池,还原性较强的金属将作为负极发生氧化反应而被损耗,被保护金属作为正极就可以避免被腐蚀。这种保护法牺牲了阳极保护了阴极。
②外加电流的阴极保护法
将被保护金属与外加直流电源的负极相连让其成为阴极,而将外加直流电源的正极接到惰性电极上,让其成为阳极。
即时应用
2.下列各情况下,其中铁块腐蚀由快到慢的顺序是________。解析:⑤中Fe作电解池的阳极,腐蚀速率最
快,②中Fe作原电池的负极,腐蚀速率较快,③中Fe作原电池的正极,④中Fe作电解池的
阴极,受到保护。因此铁片腐蚀由快到慢的顺序是:⑤②①③④。
答案:⑤②①③④
(2012·黑河高二检测)下列试管中的铁钉腐蚀最快的是( )【思路点拨】 (1)原电池负极被腐蚀,电解池阳极被腐蚀。
(2)一般规律:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
【解析】 A、B、C装置主要发生了化学腐
蚀,而D装置中首先Fe把Cu置换出来,Fe-Cu与H+形成了原电池,加快了腐蚀速度。【答案】 D
【误区警示】 D装置中易忽略Fe置换出的少量Cu与Fe组成原电池,发生原电池反应会引起腐蚀加快。
(2010·高考北京卷)下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+【解析】 本题考查金属的腐蚀和防护,意在考查学生对金属腐蚀原理的理解和防护措施的应用。钢管与电源正极相连,则钢管作阳极,发生氧化反应而被腐蚀,A项错误;铁遇冷浓硝酸表面钝化,在表面生成一层致密的氧化膜保护内部不被腐蚀,B项正确;钢管与铜管露天堆放在一起,形成原电池时钢管作负极,发生氧化反应而被腐蚀,C项错误;钢铁发生析氢腐蚀时,负极反应为:Fe-2e-===Fe2+,D项错误。
【答案】 B钢铁生锈的实验探究
钢铁在潮湿环境下形成原电池,发生电化学腐蚀。潮湿是铁生锈的必需前提,根据铁(Fe)→铁锈(Fe2O3·H2O)生锈条件:O2浓度是影响生锈快慢的一个重要因素。[经典案例] 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在四个小烧瓶中分别放入下列物质:A瓶干燥的细铁丝、B瓶浸过食盐水的细铁丝、C瓶浸过清水的细铁丝、D瓶食盐水及细铁丝,并使细铁丝完全浸没在食盐水中。然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示。
不同时间水面上升的高度
课题组在解题时,学校评审组组织了成果展示与答辩,假如你是课题组组长,请回答以下的问题:
(1)导管中水面为什么会上升?________________________________________________________________________
________________________________________________________________________。
(2)上述实验中,细铁丝生锈的速率由大到小的排列顺序为(填小烧瓶号) ________________________________________________________________________。
(3)影响钢铁生锈的因素主要有__________________________________
________________________________________________________________________。(4)为防止铁的锈蚀,工业上普遍采用的方法是________________________________________________________________________
________________________________________________________________________(答两种方法)【解析】 浸过清水或食盐水的铁丝发生吸氧腐蚀,故导管中液面要上升。但要发生吸氧腐蚀的原电池反应,必须符合构成原电池的基本条件: ①活泼性不同的电极互相接
触;②电解质溶液;③有空气(或O2)且尽量与细铁丝和电解质接触。为了防止铁的锈蚀,工业上普遍采用电化学保护法,可以作原电池的正极或电解池的阴
极,也可以用覆盖保护层的方法。【答案】(1)铁生锈时跟空气中的氧气反应, 消耗了氧气而使小烧瓶中气体压强降低
(2)B>C>A=D
(3)①跟氧气接触,②有水分存在,③有电解质存在,三者同时具备时铁生锈速率最快(或从构成原电池的条件分析)
(4)电镀等表面覆盖保护层法、牺牲阳极的阴极保护法等
