宁夏石嘴山市平罗中学2023-2024学年高二下学期期末考试(尖子班)化学试卷
文档属性
| 名称 | 宁夏石嘴山市平罗中学2023-2024学年高二下学期期末考试(尖子班)化学试卷 |  | |
| 格式 | docx | ||
| 文件大小 | 607.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 10:33:11 | ||
图片预览



文档简介
宁夏石嘴山市平罗县平罗中学2023-2024学年高二下学期期末考试化学试卷(重点班)
一、单选题
1.下列设备工作时,将化学能转化为热能的是
A.硅太阳能电池 B.锂离子电池
C.太阳能集热器 D.燃气灶
2.已知: kJ·mol-1
kJ·mol-1
则反应的为
A.+519.4kJ mol-1 B.-259.7kJ mol-1 C.+259.7kJ mol-1 D.-519.4kJ mol-1
3.关于强弱电解质及非电解质的组合完全正确的是
A B C D
强电解质 NaCl H2SO4 NaOH HNO3
弱电解质 HF BaSO4 CaCO3 CH3COOH
非电解质 Cl2 CO2 C2H5OH SO2
A.A B.B C.C D.D
4.已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确关系是
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
5.下列说法正确的是
A.醋酸溶液的浓度增大,醋酸的电离度随之增大
B.0.1 mol·L-1的CH3COOH溶液,升高温度,CH3COOH的电离度增大
C.在0.1 mol·L-1的醋酸溶液中,水电离出的H+浓度为10-13mol·L-1
D.盐酸溶液中的c(H+)比醋酸溶液中的c(H+)大
6.古代造纸工艺中使用的某种物质存在副作用,它易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物质是
A.明矾:KAl(SO4)2·12H2O B.纯碱 Na2CO3·10H2O
C.草木灰 K2CO3 D.漂白粉Ca(ClO)2·CaCl2
7.下列有关AgCl的沉淀-溶解平衡的说法中,正确的是
A.AgCl沉淀生成和沉淀溶解不断进行,且c(Cl-)一定等于c(Ag+)
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
8.为了防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在地下输油的铸铁管上接直流电源的正极
C.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
D.在海轮舷上用铁丝系住锌板浸在海水里
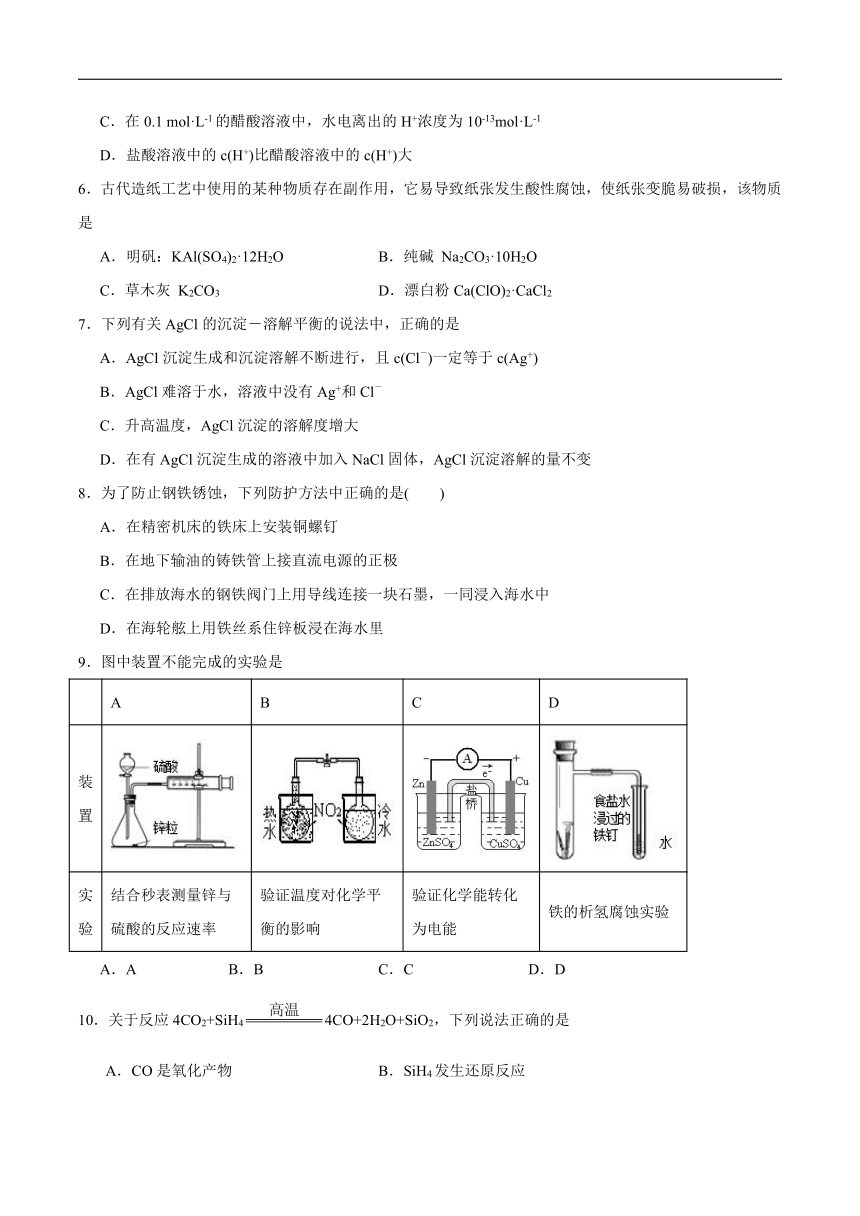
9.图中装置不能完成的实验是
A B C D
装置
实验 结合秒表测量锌与硫酸的反应速率 验证温度对化学平衡的影响 验证化学能转化为电能 铁的析氢腐蚀实验
A.A B.B C.C D.D
10.关于反应4CO2+SiH44CO+2H2O+SiO2,下列说法正确的是
A.CO是氧化产物 B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4 D.生成1molSiO2时,转移8mol电子
11.常温时,向20 mL0.1mol/L的溶液中逐滴滴加0.1mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
A.a点的pH=1 B.b点时,
C.c点时, D.反应过程中的值不断增大
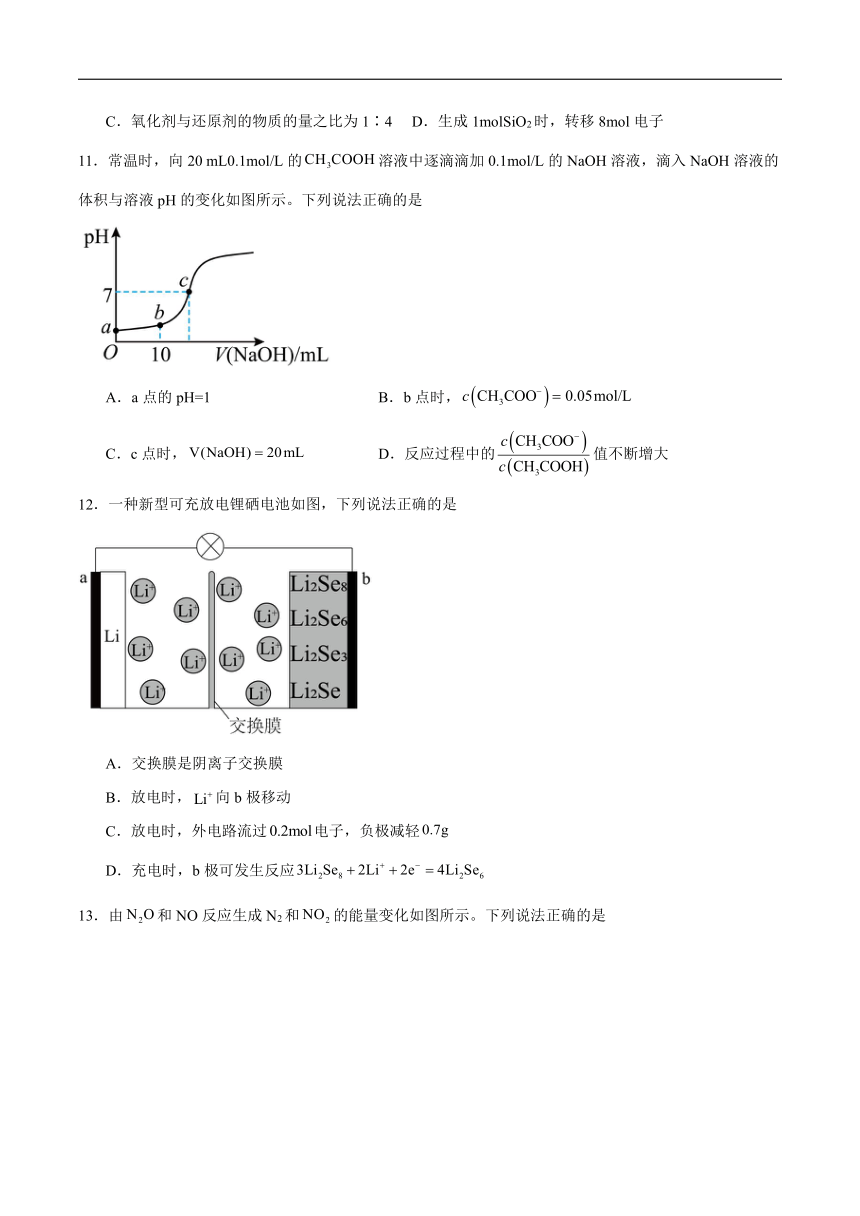
12.一种新型可充放电锂硒电池如图,下列说法正确的是
A.交换膜是阴离子交换膜
B.放电时,向b极移动
C.放电时,外电路流过电子,负极减轻
D.充电时,b极可发生反应
13.由和NO反应生成N2和的能量变化如图所示。下列说法正确的是
A.反应物的总键能大于生成物的总键能
B.该反应的焓变
C.加入催化剂,可以使正反应活化能和逆反应活化能均降低,但两者的差值不变
D.相同条件下,反应物、生成物和过渡态中的物质,过渡态最稳定
14.几种物质的转化关系如图所示。下列说法正确的是
A.反应1中Fe3+是还原产物
B.反应2中H2S得电子
C.反应2的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+
D.该转化过程中Fe3+和Fe2+均作催化剂
15.氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为:
C.应选用阳离子交换膜,在右室获得浓度较高的溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
二、填空题
16.按要求完成下列方程式(在答题卡作答)
(1)45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2,写出并配平该反应的化学方程式 。
(2)KMnO4与热的稀硫酸酸化的Na2C2O4反应生成Mn2+和CO2,写出并配平该反应的离子方程式 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,写出并配平该反应的离子方程式 。
(4)饱和碳酸钠溶液能将锅炉水垢中的硫酸钙难溶物转化为碳酸钙,写出转化反应的离子方程式 。
(5)写出用惰性电极电解硫酸铜溶液的阳极反应式 。
(6)写出甲醇-空气碱性燃料电池的负极反应式 。
17.Ⅰ.已知:25 ℃时,0.1 mol/L某一元酸HCN溶液中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= 。
(2)由HCN电离出的c(H+)约为水电离出的c(H+)的 倍。
(3)计算HCN的电离平衡常数Ka = 。
(4)CN-的水解常数Kh为 。
Ⅱ.将0.2 mol·L-1 HCN溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),则(用“>”、“<”或“=”填写下列空白):
(5)混合溶液中c(HCN) c(CN-)。
(6)混合溶液中c(HCN)+c(CN-) 0.1 mol·L-1。
(7)25℃时,如果取0.2 mol·L-1 HCN溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH>7,则HCN的电离程度 NaCN的水解程度。
三、解答题
18.某学习小组将Cu与的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)稀硫酸的配制
①配制的溶液,需溶液的体积为 mL。
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是 (填仪器名称)。
(2)Cu与在酸性条件下反应的离子方程式为 。
II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(3)利用下表所示装置进行实验1~4,记录数据。
装置 实验 序号 烧杯中所加试剂 电压表 读数
30%
1 30.0 / 10.0
2 30.0 1.0 9.0
3 30.0 2.0 8.0
4 35.0 1.0
已知:本实验条件下,对电压的影响可忽略。
①根据表中信息,补充数据: 。
②由实验2和4可知, (填“大于”或“小于”或“等于”),说明其他条件相同时,溶液的浓度越大,其氧化性越强。
(4)由(3)中实验结果,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下,的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
装置 实验 序号 操作 电压表 读数
5 /
6 ①向 (填“左”或“右”)侧烧杯中滴加溶液。
7 向另一侧烧杯中滴加溶液
②实验结果为:、 ,说明猜想2不成立,猜想1成立。
(5)已知Cu与反应时,加入氨水可形成深蓝色的。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因: 。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
19.我国明确提出2060年“碳中和”目标,意味着需要通过工艺改造、节能等措施减少在能源的产生、转换、消费过程中二氧化碳的排放。回答下列问题:
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行。
反应①:CH4(g) C(s)+2H2(g)
反应②:C(s)+CO2(g)2CO(g)
上述反应中C(s)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图所示。
(1)总反应CH4(g)+CO2(g) 2H2(g)+2CO(g)能自发进行的条件为 ;研究表明,总反应速率由反应①决定,请结合图1与碰撞理论说明原因: 。
Ⅱ.将CO2催化还原,是目前处理CO2的重要方法。
ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1<0
ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
(2)已知CO和H2的燃烧热分别为-283 kJ/mol和-285.8 kJ/mol, H2O(l)=H2O(g) ΔH3=+44 kJ/mol,则ΔH2= kJ/mol。
(3)恒温恒容的密闭容器中,投入物质的量之比为1∶3的CO2和H2,发生反应ⅰ达到平衡。下列有关叙述正确的是___________(填字母)。
A.升高温度,逆反应速率增加,平衡常数减小
B.按相同比例再加入一定量的CO2和H2,CO2和H2的转化率同时增大
C.加入合适的催化剂可提高CO2的平衡转化率
D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量
(4)在一定条件下,向1 L恒容密闭容器中充入2 mol CO2和6 mol H2,发生反应ⅰ,测得在相同时间内,不同温度下H2的转化率如图所示,计算T2时反应ⅰ的平衡K= (结果保留一位小数)。
参考答案
1.D
2.D
3.D
4.D
5.B
6.A
7.C
8.D
9.D
10.D
11.D
12.B
13.C
14.C
15.B
16.(1)4CuCl+O2+2H2O2Cu2(OH)2Cl2
(2)2+5+16H+=2Mn2++10CO2↑+8H2O
(3)PbO+ClO-=PbO2+Cl-
(4)CaSO4(s)+(aq)CaCO3(s)+(aq)
(5)2H2O-4e-=O2↑+4H+
(6)CH3OH-6e-+8OH-=+6H2O
17.(1)
(2)
(3)
(4)
(5)<
(6)=
(7)<
18.(1) 5.0 100mL容量瓶
(2)
(3) 4.0 小于
(4) 左
(5)加入氨水后形成,使减小,促进铜失电子,使电压表读数增大
19.(1) 高温 反应①活化能大,单位体积内的活化分子数少,有效碰撞次数少,反应速率小
(2)+41.2
(3)ABD
(4)3.7
一、单选题
1.下列设备工作时,将化学能转化为热能的是
A.硅太阳能电池 B.锂离子电池
C.太阳能集热器 D.燃气灶
2.已知: kJ·mol-1
kJ·mol-1
则反应的为
A.+519.4kJ mol-1 B.-259.7kJ mol-1 C.+259.7kJ mol-1 D.-519.4kJ mol-1
3.关于强弱电解质及非电解质的组合完全正确的是
A B C D
强电解质 NaCl H2SO4 NaOH HNO3
弱电解质 HF BaSO4 CaCO3 CH3COOH
非电解质 Cl2 CO2 C2H5OH SO2
A.A B.B C.C D.D
4.已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确关系是
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
5.下列说法正确的是
A.醋酸溶液的浓度增大,醋酸的电离度随之增大
B.0.1 mol·L-1的CH3COOH溶液,升高温度,CH3COOH的电离度增大
C.在0.1 mol·L-1的醋酸溶液中,水电离出的H+浓度为10-13mol·L-1
D.盐酸溶液中的c(H+)比醋酸溶液中的c(H+)大
6.古代造纸工艺中使用的某种物质存在副作用,它易导致纸张发生酸性腐蚀,使纸张变脆易破损,该物质是
A.明矾:KAl(SO4)2·12H2O B.纯碱 Na2CO3·10H2O
C.草木灰 K2CO3 D.漂白粉Ca(ClO)2·CaCl2
7.下列有关AgCl的沉淀-溶解平衡的说法中,正确的是
A.AgCl沉淀生成和沉淀溶解不断进行,且c(Cl-)一定等于c(Ag+)
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
8.为了防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在地下输油的铸铁管上接直流电源的正极
C.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
D.在海轮舷上用铁丝系住锌板浸在海水里
9.图中装置不能完成的实验是
A B C D
装置
实验 结合秒表测量锌与硫酸的反应速率 验证温度对化学平衡的影响 验证化学能转化为电能 铁的析氢腐蚀实验
A.A B.B C.C D.D
10.关于反应4CO2+SiH44CO+2H2O+SiO2,下列说法正确的是
A.CO是氧化产物 B.SiH4发生还原反应
C.氧化剂与还原剂的物质的量之比为1∶4 D.生成1molSiO2时,转移8mol电子
11.常温时,向20 mL0.1mol/L的溶液中逐滴滴加0.1mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
A.a点的pH=1 B.b点时,
C.c点时, D.反应过程中的值不断增大
12.一种新型可充放电锂硒电池如图,下列说法正确的是
A.交换膜是阴离子交换膜
B.放电时,向b极移动
C.放电时,外电路流过电子,负极减轻
D.充电时,b极可发生反应
13.由和NO反应生成N2和的能量变化如图所示。下列说法正确的是
A.反应物的总键能大于生成物的总键能
B.该反应的焓变
C.加入催化剂,可以使正反应活化能和逆反应活化能均降低,但两者的差值不变
D.相同条件下,反应物、生成物和过渡态中的物质,过渡态最稳定
14.几种物质的转化关系如图所示。下列说法正确的是
A.反应1中Fe3+是还原产物
B.反应2中H2S得电子
C.反应2的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+
D.该转化过程中Fe3+和Fe2+均作催化剂
15.氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应式为:
C.应选用阳离子交换膜,在右室获得浓度较高的溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
二、填空题
16.按要求完成下列方程式(在答题卡作答)
(1)45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2,写出并配平该反应的化学方程式 。
(2)KMnO4与热的稀硫酸酸化的Na2C2O4反应生成Mn2+和CO2,写出并配平该反应的离子方程式 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,写出并配平该反应的离子方程式 。
(4)饱和碳酸钠溶液能将锅炉水垢中的硫酸钙难溶物转化为碳酸钙,写出转化反应的离子方程式 。
(5)写出用惰性电极电解硫酸铜溶液的阳极反应式 。
(6)写出甲醇-空气碱性燃料电池的负极反应式 。
17.Ⅰ.已知:25 ℃时,0.1 mol/L某一元酸HCN溶液中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= 。
(2)由HCN电离出的c(H+)约为水电离出的c(H+)的 倍。
(3)计算HCN的电离平衡常数Ka = 。
(4)CN-的水解常数Kh为 。
Ⅱ.将0.2 mol·L-1 HCN溶液与0.2 mol·L-1 NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),则(用“>”、“<”或“=”填写下列空白):
(5)混合溶液中c(HCN) c(CN-)。
(6)混合溶液中c(HCN)+c(CN-) 0.1 mol·L-1。
(7)25℃时,如果取0.2 mol·L-1 HCN溶液与0.1 mol·L-1 NaOH溶液等体积混合,测得混合溶液的pH>7,则HCN的电离程度 NaCN的水解程度。
三、解答题
18.某学习小组将Cu与的反应设计为原电池,并进行相关实验探究。回答下列问题:
I.实验准备
(1)稀硫酸的配制
①配制的溶液,需溶液的体积为 mL。
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是 (填仪器名称)。
(2)Cu与在酸性条件下反应的离子方程式为 。
II.实验探究
【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
(3)利用下表所示装置进行实验1~4,记录数据。
装置 实验 序号 烧杯中所加试剂 电压表 读数
30%
1 30.0 / 10.0
2 30.0 1.0 9.0
3 30.0 2.0 8.0
4 35.0 1.0
已知:本实验条件下,对电压的影响可忽略。
①根据表中信息,补充数据: 。
②由实验2和4可知, (填“大于”或“小于”或“等于”),说明其他条件相同时,溶液的浓度越大,其氧化性越强。
(4)由(3)中实验结果,小组同学对“电压随pH减小而增大”可能的原因,提出了以下两种猜想:
猜想1:酸性条件下,的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
装置 实验 序号 操作 电压表 读数
5 /
6 ①向 (填“左”或“右”)侧烧杯中滴加溶液。
7 向另一侧烧杯中滴加溶液
②实验结果为:、 ,说明猜想2不成立,猜想1成立。
(5)已知Cu与反应时,加入氨水可形成深蓝色的。小组同学利用(4)中实验5的装置继续探究,向左侧烧杯中滴加5.0mL一定浓度的氨水,相比实验5,电压表读数增大,分析该电压表读数增大的原因: 。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
19.我国明确提出2060年“碳中和”目标,意味着需要通过工艺改造、节能等措施减少在能源的产生、转换、消费过程中二氧化碳的排放。回答下列问题:
Ⅰ.利用CO2和CH4制备合成气(CO、H2),该反应分两步进行。
反应①:CH4(g) C(s)+2H2(g)
反应②:C(s)+CO2(g)2CO(g)
上述反应中C(s)为吸附性活性炭,有关物质的相对能量与反应历程的变化如图所示。
(1)总反应CH4(g)+CO2(g) 2H2(g)+2CO(g)能自发进行的条件为 ;研究表明,总反应速率由反应①决定,请结合图1与碰撞理论说明原因: 。
Ⅱ.将CO2催化还原,是目前处理CO2的重要方法。
ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1<0
ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
(2)已知CO和H2的燃烧热分别为-283 kJ/mol和-285.8 kJ/mol, H2O(l)=H2O(g) ΔH3=+44 kJ/mol,则ΔH2= kJ/mol。
(3)恒温恒容的密闭容器中,投入物质的量之比为1∶3的CO2和H2,发生反应ⅰ达到平衡。下列有关叙述正确的是___________(填字母)。
A.升高温度,逆反应速率增加,平衡常数减小
B.按相同比例再加入一定量的CO2和H2,CO2和H2的转化率同时增大
C.加入合适的催化剂可提高CO2的平衡转化率
D.其他条件不变,改为恒温恒压,可以提高平衡时CH3OH的百分含量
(4)在一定条件下,向1 L恒容密闭容器中充入2 mol CO2和6 mol H2,发生反应ⅰ,测得在相同时间内,不同温度下H2的转化率如图所示,计算T2时反应ⅰ的平衡K= (结果保留一位小数)。
参考答案
1.D
2.D
3.D
4.D
5.B
6.A
7.C
8.D
9.D
10.D
11.D
12.B
13.C
14.C
15.B
16.(1)4CuCl+O2+2H2O2Cu2(OH)2Cl2
(2)2+5+16H+=2Mn2++10CO2↑+8H2O
(3)PbO+ClO-=PbO2+Cl-
(4)CaSO4(s)+(aq)CaCO3(s)+(aq)
(5)2H2O-4e-=O2↑+4H+
(6)CH3OH-6e-+8OH-=+6H2O
17.(1)
(2)
(3)
(4)
(5)<
(6)=
(7)<
18.(1) 5.0 100mL容量瓶
(2)
(3) 4.0 小于
(4) 左
(5)加入氨水后形成,使减小,促进铜失电子,使电压表读数增大
19.(1) 高温 反应①活化能大,单位体积内的活化分子数少,有效碰撞次数少,反应速率小
(2)+41.2
(3)ABD
(4)3.7
同课章节目录
