辽宁省沈阳市东北育才学校2024-2025学年高二下学期第二次月考化学试题(PDF版、含答案)
文档属性
| 名称 | 辽宁省沈阳市东北育才学校2024-2025学年高二下学期第二次月考化学试题(PDF版、含答案) |  | |
| 格式 | |||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 14:17:26 | ||
图片预览



文档简介
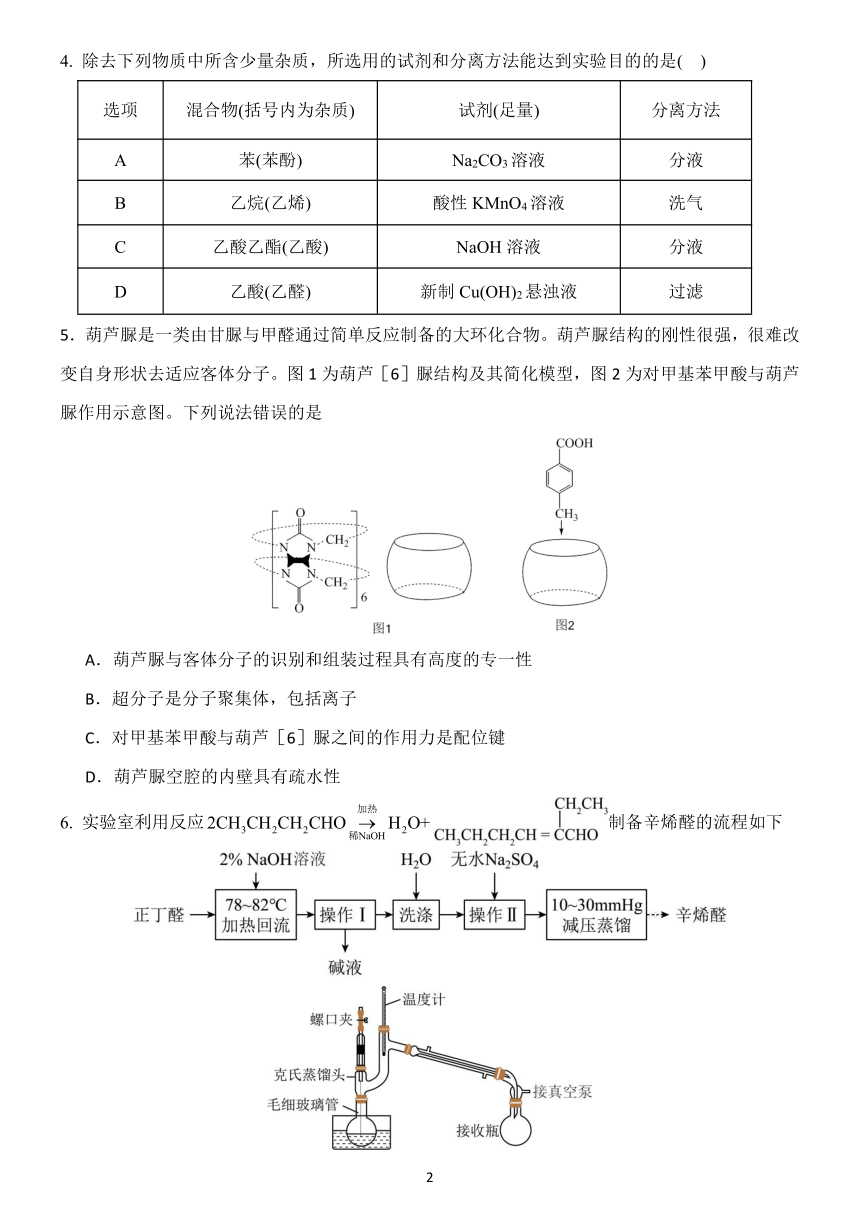
东北育才学校高中 2024-2025 下学期高二年级月考
化学学科试卷
总分:100分 时间:75分钟
可能用到的相对原子质量:H1,B11,C12,N14,O16,Ca40,Fe56,Sb122
第Ⅰ卷 选择题 (共 45分)
一、选择题(本题共 15小题,每小题 3分,共 45分)
1. 科技创新是发展新质生产力的核心要素,下列说法错误的是
A.我国空间站使用了氮化硼陶瓷基复合材料,氮化硼为共价晶体
B.可降解塑料聚羟基丁酸酯,可由 3-羟基丁酸加聚反应合成
C.婴儿纸尿裤使用了高吸水性树脂,高吸水性树脂属于功能高分子材料
D.航天员返回所用降落伞使用了聚酯纤维材料,聚酯纤维属于合成纤维
2.下列表示正确的是
A.OF2的空间结构:直线形
B.基态溴离子价电子排布式:[Ar]3d104s24p6
C.Cl2分子中σ键的形成:
D.腺苷三磷酸(ATP)水解时磷酸酐键断裂过程的能量变化表示为:
3 下列化学方程式书写不正确的是
A. 苯胺与盐酸的反应: +HCl→
B. 苯酚钠溶液与少量二氧化碳反应:2 +CO2+H2O→2 +Na2CO3
C. 溴乙烷消去反应:CH3CH2Br+NaOH 醇 CH2=CH2↑+NaBr+HΔ 2O
D. 工业上由乙醛生产乙酸:2CH CHO+O 催 化剂3 2 2CHΔ 3COOH
1
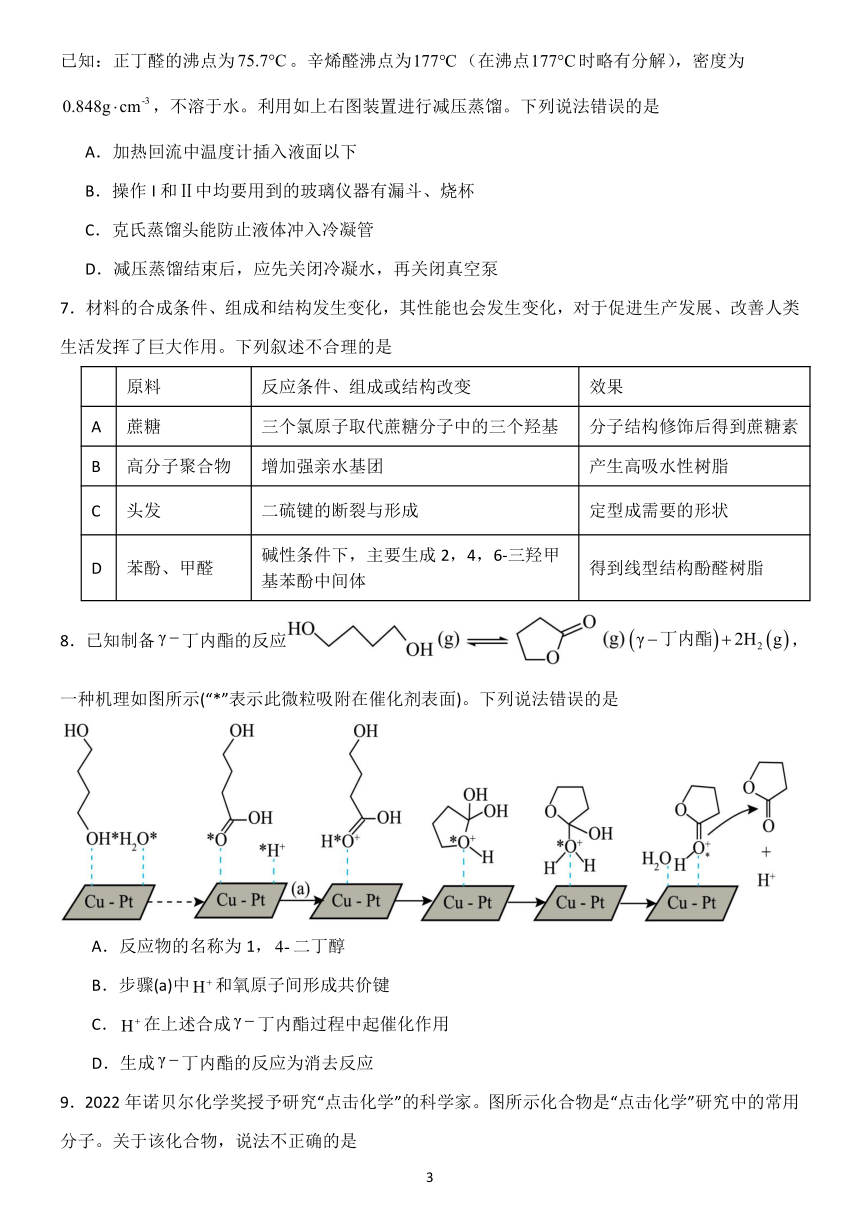
4. 除去下列物质中所含少量杂质,所选用的试剂和分离方法能达到实验目的的是( )
选项 混合物(括号内为杂质) 试剂(足量) 分离方法
A 苯(苯酚) Na2CO3溶液 分液
B 乙烷(乙烯) 酸性 KMnO4溶液 洗气
C 乙酸乙酯(乙酸) NaOH溶液 分液
D 乙酸(乙醛) 新制 Cu(OH)2悬浊液 过滤
5.葫芦脲是一类由甘脲与甲醛通过简单反应制备的大环化合物。葫芦脲结构的刚性很强,很难改
变自身形状去适应客体分子。图 1 为葫芦[6]脲结构及其简化模型,图 2 为对甲基苯甲酸与葫芦
脲作用示意图。下列说法错误的是
A.葫芦脲与客体分子的识别和组装过程具有高度的专一性
B.超分子是分子聚集体,包括离子
C.对甲基苯甲酸与葫芦[6]脲之间的作用力是配位键
D.葫芦脲空腔的内壁具有疏水性
加热
6. 实验室利用反应 2CH3CH2CH2CHO H2O+ 制备辛烯醛的流程如下
稀NaOH
2
已知:正丁醛的沸点为75.7 C。辛烯醛沸点为177 C(在沸点177 C时略有分解),密度为
0.848g cm-3,不溶于水。利用如上右图装置进行减压蒸馏。下列说法错误的是
A.加热回流中温度计插入液面以下
B.操作 I和Ⅱ中均要用到的玻璃仪器有漏斗、烧杯
C.克氏蒸馏头能防止液体冲入冷凝管
D.减压蒸馏结束后,应先关闭冷凝水,再关闭真空泵
7.材料的合成条件、组成和结构发生变化,其性能也会发生变化,对于促进生产发展、改善人类
生活发挥了巨大作用。下列叙述不合理的是
原料 反应条件、组成或结构改变 效果
A 蔗糖 三个氯原子取代蔗糖分子中的三个羟基 分子结构修饰后得到蔗糖素
B 高分子聚合物 增加强亲水基团 产生高吸水性树脂
C 头发 二硫键的断裂与形成 定型成需要的形状
碱性条件下,主要生成 2,4,6-三羟甲
D 苯酚、甲醛 得到线型结构酚醛树脂
基苯酚中间体
8.已知制备 γ 丁内酯的反应 γ 丁内酯 2H2 g ,
一种机理如图所示(“*”表示此微粒吸附在催化剂表面)。下列说法错误的是
A.反应物的名称为 1, 4-二丁醇
B.步骤(a)中H 和氧原子间形成共价键
C.H 在上述合成 γ 丁内酯过程中起催化作用
D.生成 γ 丁内酯的反应为消去反应
9.2022 年诺贝尔化学奖授予研究“点击化学”的科学家。图所示化合物是“点击化学”研究中的常用
分子。关于该化合物,说法不正确的是
3
A.能发生加成反应 B.最多能与等物质的量的NaOH反应
C.能使溴水和酸性KMnO 4溶液褪色 D.能与氨基酸和蛋白质中的氨基反应
10.下列关于 的说法中,正确的是
A.该物质可由 n个单体分子通过缩聚反应生成
B.0.1mol 该物质完全燃烧,生成 33.6L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1mol 该物质与足量 NaOH 溶液反应,最多可消耗 3nmolNaOH
11.氟他胺是一种抗肿瘤药,可由中间体M通过如下转化制得(部分试剂和条件已略去)。
已知:氨基具有还原性,吡啶具有碱性。
下列说法不.正.确.的是
A.氟他胺中含有三种官能团 B.X 不具有手性异构体(对映异构体)
C.吡啶可提高①的原料利用率 D.交换①、②的顺序,对氟他胺的制备没有影响
12.以下 12 种实验操作方法以及结论错误的有
①比较水和乙醇羟基的活泼性强弱,用金属钠分别与水和乙醇反应。
②欲证明 CH2=CHCHO 中含有碳碳双键,滴入酸性 KMnO4溶液,看紫红色是否褪去。
③将 0.1mol/L 的 NaOH 溶液与 0.5mol/L 的 CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验
麦芽糖是否为还原性糖。
④检验溴乙烷中的溴元素,将少量溴乙烷与 NaOH 溶液混合共热,充分反应并冷却后,向溶液中
4
加稀 HNO3酸化,再滴加 AgNO3溶液。
⑤用燃烧的方法鉴别乙醇、四氯化碳、苯。
⑥用足量的 NaOH 溶液与矿物油和地沟油加热,可鉴别出地沟油。
⑦油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离。
⑧将铜丝在酒精灯外焰上加热变黑后移至内焰,铜丝恢复原来的红色。
⑨检验淀粉是否水解完全的方法是:在水解液中先加入过量的氢氧化钠溶液,然后滴加碘水,未
变蓝,说明已水解完全。
⑩在紫外线、饱和 Na2SO4、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性。
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红,则生成的氯甲烷具有酸性。
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明,则生成的 1,2-二溴乙烷无色、可溶于
四氯化碳。
A.3 个 B.4 个 C.5 个 D.6 个
13.叔丁醇与羧酸发生酯化反应的机理具有其特殊性,可用下图表示,已知:连在同一碳原子上
的甲基之间存在排斥力。
下列说法错误的是
A.相同条件下,中间体 3 比R COOH酸性强
B.中间体 2 中C-C-C键角大于叔丁醇中C-C-C键角
C.用NaOH溶液中和步骤④产生的H+,有利于提高羧酸叔丁酯的产率
D.用 18O标记醇羟基,可区别叔丁醇、乙醇与羧酸在酯化反应时的机理差异
14.原子序数依次增大短周期元素 X、Y、Z、M,在一定条件下形成结构如图所示的一种团簇分子。
X 是宇宙中含量最多的元素,Y 元素基态原子的价层电子排布是 nsnnp2n,Z 元素基态原子最外层电
子数与最内层电子数相等,M 元素基态原子最外层电子数等于其电子层数。下列说法正确的是
5
A.该团簇分子的分子式为XZMY3 B.基态原子第一电离能:Y>Z>M
C.工业上主要采用电解水溶液法制备 M 的单质 D.常温下 Z 的单质能溶于水
15.一种半导体材料FeSb2 的晶胞结构如图。已知晶胞α=β=γ=90o ,a b c,设 NA为阿伏加德罗
常数的值。下列有关说法错误的是
A.Sb位于晶胞的体内和面上
6 1032
B.该晶体的密度为 g cm-3NA abc
C.Sb的配位数为 4
2 2 2
D.1 号原子与 2 a +b +c号原子核间距为 pm
2
6
第Ⅱ卷 非选择题(共 55分)
二、填空题(非选择题,本题包括 4小题,共 55分)
16.(13分)回答下列问题:
(1)基态某原子的价层电子排布式是 5 25 4,推断该元素位于元素周期表中的位置______;
(2)下列状态的镁原子中,电离最外层一个电子所需能量最低的是___________(填选项);
A. . . .
(3)氰酸( )是一元弱酸,与氰酸根互为等电子体且为非极性分子的是_________(填化学式);
(4)分子中大 键可以用 ( 表示参与形成大 键的轨道数, 表示形成大 键的 电子数目)表示,
2分子中存在 53,分子呈 形,其杂化方式是_________。
(5)邻二氮菲(结构如图所示)与 2+生成稳定的橙红色邻二氮菲亚铁离子{[ ( ) ]2+3 },可用于补
铁剂中 2+的测定。
①用邻二氮菲测定 2+浓度时应控制 为 5~6,原因是_____________________。
②邻二氮菲结构中包含吡啶环( ),含有类似结构的物质通常具有一定的碱性,试判断
、 的碱性强弱:________________________________________。
(6)常温下, 2加入浓的 溶液中可制备 3 , 3 的中心原子 的杂化类型可能为________(填字母)杂
化;在一定条件下, 2加入浓的 溶液中也可制备 +3, +3中心原子的价层电子对数为________。
A. 2 . 3 . 3 . 3 2
17.(14 分)我国的航空航天事业取得了举世瞩目的成就,近年来硼氢类离子液体作为火箭推进剂
燃料得到了广泛使用,该火箭推进剂具有点火延迟时间、宽液程和极低的蒸汽压等优点。硼氢类
离子液体的合成如图所示:
回答下列问题:
(1)基态 原子的价层电子排布式为__________,其 层具有的电子数是__________。
7
(2) 、 、 的第一电离能由大到小的顺序为________________(用元素符号表示)。
(3) 中碳原子的杂化方式为_________; 2 4 的空间构型为_________形。
(4) 中不存在的作用力有_________(填字母)。
.离子键 .配位键 . 键 . 键 .金属键
(5)多原子分子中,若原子都在同一平面上且这些原子有相互平行的 轨道,则 电子可在多个原子
间运动,形成大 键。大 键可用 表示,其中 、 分别代表参与形成大 键的原子个数和电子数,
则 的大 键可表示为______________。
(6)硼化钙晶胞结构如图所示, 原子构成 6八面体,各个顶点通过 键互相连接成三维骨架,
八个 多面体围成立方体,中心为 2+,晶胞密度为 · 36 。
①硼化钙的化学式为__________________。
②晶胞边长为_______________ (已知 为阿伏加德罗常数)。
18.(14 分)阿司匹林(即乙酰水杨酸,结构简式是 )是世界上应用最广泛的解热、
镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为 128~135℃。某学习小组在实验室以水杨酸
(邻羟基苯甲酸)与醋酸酐[( 3 )2 ]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程为:
8
主要试剂和产品的物理常数如下表所示:
名称 相对分子质量 熔点或者沸点(℃) 水溶性
水杨酸 138 158(熔点) 微溶
醋酸酐 102 139(沸点) 易水解
乙酰水杨酸 180 135(熔点) 微溶
回答下列问题:
(1)阿司匹林中所含官能团的名称是____________;上述合成阿司匹林的反应类型是____________。
(2)制备阿司匹林时,要保证的条件有________________、________________(填两个即可)。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是_______________________________。
(4)提纯粗产品流程如下:
加热回流装置如图所示。
①“步骤 ”的名称是________(已知较高温度下水杨酸在乙酸乙酯中的溶解度较小)。
②仪器 的名称为________。冷凝水的进水口是________(填“ ”或“ ”)。
③下列说法不正确的是________(填字母)。
A.此种提纯粗产品的方法叫重结晶
B.此种提纯方法中乙酸乙酯的作用是作溶剂
C.可以用紫色石蕊试液判断产品中是否含有未反应完的水杨酸
D.根据以上提纯过程可以得出低温时阿司匹林在乙酸乙酯中的溶解度大
(5)在实验中原料用量:2.0 水杨酸、5.0 醋酸酐( = 1.08 · 3),最终称得产品质量为 2.4 ,
则本次实验乙酰水杨酸(Mr=180g/mol)的产率为________。
9
19.(14 分)常用作风信子等香精的定香剂 以及可用作安全玻璃夹层的高分子化合物 的合成
路线如图。
稀
已知:Ⅰ. + ′ 2 → + 2 ( 、 ′表示烃基或氢原子)
Ⅱ.醛与二元醇(如乙二醇)可生成环状缩醛: +
(1)A的名称是乙醛,其核磁共振氢谱有________种峰。
(2)已知 C为反式结构,由 B还原得到 C的结构简式为______________(要求画出 C的反式结构)。
(3)C与 M反应生成 D的化学方程式为_______________________________________________。
(4)E能使 Br2的 CCl4溶液褪色。N由 A经反应①~③合成。
a.反应①所需的反应条件是_______________________________________。
b.反应②的反应类型是___________________________________________。
c. F的名称为___________________________________________________。
d.反应③的化学方程式为_________________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是________________________。
(6)碱性条件下,PVAc完全水解的化学方程式为_____________________________________。
10
东北育才学校高中 2024-2025 下学期高二年级月考
化学学科参考答案
一、选择题(本题共 15 小题,每小题 3 分,共 45 分)
1—5. B C B A C
6—10. D D A B C
11—15. D D C B C
二、填空题(共 55 分)
16(13分)
(1)第五周期第ⅥA 族(1分)
(2)C(2分) (3)CO2(1分) (4) sp2(1分)
(5)①当H+浓度较高时,邻二氮菲中的 N 体现碱性,会优先与酸反应生成盐,导致与 Fe2+配位能力减弱,
而当 OH 浓度较高时,OH 与 Fe2+反应生成沉淀,也影响 Fe2+与邻二氮菲配位(2分)
② > > (2分)
(6)C(2 分); 4(2 分)
17.(14分)
(1)6s2(1分) ;18(1分)
(2)N > O > C(2分)
(3)sp2(1分) ;正四面体(1分)
(4)e(2分)
(5)Π65(2分)
(6)①CaB6(2分); ②
3 106 × 107ρ·N (2分)A
18.(14分)
(1)羧基、酯基(2分,各 1分) ;取代反应(1分)
(2)使用干燥的仪器;85 90℃水浴加热(2分,各 1分)
(3)除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗(2分)
(4) ①趁热过滤(1分) ②三颈烧瓶(1分);b(1分) ③CD(2分)
(5) 92% (2分)
第 1页,共 2页
19.(14分)
(1)2(1分)(2)
(2分)
(3) + 3 + 2 (2分)
(4) .稀 溶液、加热(1分) .加成反应(1分) . 1 丁醇(1分)
. 2 3( 2)3 + 2 2 3( 2)2 + 2 2 (2分)
(5) 3 2(2分)
(6) + + 3 (2分)
第 2页,共 2页
高二月考化学
姓名: 班级:
考场/座位号:
贴条形码区
注意事项
1.答题前,考生先将自己的姓名、班级、考场填写清楚,并认真核对
条形码上的姓名和准考证号。
2.选择题部分请按题号用2B铅笔填涂方框,修改时用橡皮擦干净,不 (正面朝上,切勿贴出虚线方框)
留痕迹。
3.非选择题部分请按题号用0.5毫米黑色墨水签字笔书写,否则作答
无效。要求字体工整、笔迹清晰。作图时,必须用2B铅笔,并描浓。 正确填涂 缺考标记
4.在草稿纸、试题卷上答题无效。
5.请勿折叠答题卡,保持字体工整、笔迹清晰、卡面清洁。
单选题
1 [A] [B] [C] [D] 6 [A] [B] [C] [D] 11 [A] [B] [C] [D]
2 [A] [B] [C] [D] 7 [A] [B] [C] [D] 12 [A] [B] [C] [D]
3 [A] [B] [C] [D] 8 [A] [B] [C] [D] 13 [A] [B] [C] [D]
4 [A] [B] [C] [D] 9 [A] [B] [C] [D] 14 [A] [B] [C] [D]
5 [A] [B] [C] [D] 10 [A] [B] [C] [D] 15 [A] [B] [C] [D]
填空题
16. (1) ;(2) ;
(3) ;(4) ;
(5)①
②
(6) ; ;
填空题
17. (1) ; ;(2) ;
(3) ; ;(4) ;(5)
(6) ; ;
填空题
18.
(1) ;
(2) ;
(3) ;
(4)① ;② ;③ ;
(5)
填空题
19.
(1) ;(2) ;
(3) ;
(4)a b c
d ;
(5)
(6) ;
化学学科试卷
总分:100分 时间:75分钟
可能用到的相对原子质量:H1,B11,C12,N14,O16,Ca40,Fe56,Sb122
第Ⅰ卷 选择题 (共 45分)
一、选择题(本题共 15小题,每小题 3分,共 45分)
1. 科技创新是发展新质生产力的核心要素,下列说法错误的是
A.我国空间站使用了氮化硼陶瓷基复合材料,氮化硼为共价晶体
B.可降解塑料聚羟基丁酸酯,可由 3-羟基丁酸加聚反应合成
C.婴儿纸尿裤使用了高吸水性树脂,高吸水性树脂属于功能高分子材料
D.航天员返回所用降落伞使用了聚酯纤维材料,聚酯纤维属于合成纤维
2.下列表示正确的是
A.OF2的空间结构:直线形
B.基态溴离子价电子排布式:[Ar]3d104s24p6
C.Cl2分子中σ键的形成:
D.腺苷三磷酸(ATP)水解时磷酸酐键断裂过程的能量变化表示为:
3 下列化学方程式书写不正确的是
A. 苯胺与盐酸的反应: +HCl→
B. 苯酚钠溶液与少量二氧化碳反应:2 +CO2+H2O→2 +Na2CO3
C. 溴乙烷消去反应:CH3CH2Br+NaOH 醇 CH2=CH2↑+NaBr+HΔ 2O
D. 工业上由乙醛生产乙酸:2CH CHO+O 催 化剂3 2 2CHΔ 3COOH
1
4. 除去下列物质中所含少量杂质,所选用的试剂和分离方法能达到实验目的的是( )
选项 混合物(括号内为杂质) 试剂(足量) 分离方法
A 苯(苯酚) Na2CO3溶液 分液
B 乙烷(乙烯) 酸性 KMnO4溶液 洗气
C 乙酸乙酯(乙酸) NaOH溶液 分液
D 乙酸(乙醛) 新制 Cu(OH)2悬浊液 过滤
5.葫芦脲是一类由甘脲与甲醛通过简单反应制备的大环化合物。葫芦脲结构的刚性很强,很难改
变自身形状去适应客体分子。图 1 为葫芦[6]脲结构及其简化模型,图 2 为对甲基苯甲酸与葫芦
脲作用示意图。下列说法错误的是
A.葫芦脲与客体分子的识别和组装过程具有高度的专一性
B.超分子是分子聚集体,包括离子
C.对甲基苯甲酸与葫芦[6]脲之间的作用力是配位键
D.葫芦脲空腔的内壁具有疏水性
加热
6. 实验室利用反应 2CH3CH2CH2CHO H2O+ 制备辛烯醛的流程如下
稀NaOH
2
已知:正丁醛的沸点为75.7 C。辛烯醛沸点为177 C(在沸点177 C时略有分解),密度为
0.848g cm-3,不溶于水。利用如上右图装置进行减压蒸馏。下列说法错误的是
A.加热回流中温度计插入液面以下
B.操作 I和Ⅱ中均要用到的玻璃仪器有漏斗、烧杯
C.克氏蒸馏头能防止液体冲入冷凝管
D.减压蒸馏结束后,应先关闭冷凝水,再关闭真空泵
7.材料的合成条件、组成和结构发生变化,其性能也会发生变化,对于促进生产发展、改善人类
生活发挥了巨大作用。下列叙述不合理的是
原料 反应条件、组成或结构改变 效果
A 蔗糖 三个氯原子取代蔗糖分子中的三个羟基 分子结构修饰后得到蔗糖素
B 高分子聚合物 增加强亲水基团 产生高吸水性树脂
C 头发 二硫键的断裂与形成 定型成需要的形状
碱性条件下,主要生成 2,4,6-三羟甲
D 苯酚、甲醛 得到线型结构酚醛树脂
基苯酚中间体
8.已知制备 γ 丁内酯的反应 γ 丁内酯 2H2 g ,
一种机理如图所示(“*”表示此微粒吸附在催化剂表面)。下列说法错误的是
A.反应物的名称为 1, 4-二丁醇
B.步骤(a)中H 和氧原子间形成共价键
C.H 在上述合成 γ 丁内酯过程中起催化作用
D.生成 γ 丁内酯的反应为消去反应
9.2022 年诺贝尔化学奖授予研究“点击化学”的科学家。图所示化合物是“点击化学”研究中的常用
分子。关于该化合物,说法不正确的是
3
A.能发生加成反应 B.最多能与等物质的量的NaOH反应
C.能使溴水和酸性KMnO 4溶液褪色 D.能与氨基酸和蛋白质中的氨基反应
10.下列关于 的说法中,正确的是
A.该物质可由 n个单体分子通过缩聚反应生成
B.0.1mol 该物质完全燃烧,生成 33.6L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1mol 该物质与足量 NaOH 溶液反应,最多可消耗 3nmolNaOH
11.氟他胺是一种抗肿瘤药,可由中间体M通过如下转化制得(部分试剂和条件已略去)。
已知:氨基具有还原性,吡啶具有碱性。
下列说法不.正.确.的是
A.氟他胺中含有三种官能团 B.X 不具有手性异构体(对映异构体)
C.吡啶可提高①的原料利用率 D.交换①、②的顺序,对氟他胺的制备没有影响
12.以下 12 种实验操作方法以及结论错误的有
①比较水和乙醇羟基的活泼性强弱,用金属钠分别与水和乙醇反应。
②欲证明 CH2=CHCHO 中含有碳碳双键,滴入酸性 KMnO4溶液,看紫红色是否褪去。
③将 0.1mol/L 的 NaOH 溶液与 0.5mol/L 的 CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验
麦芽糖是否为还原性糖。
④检验溴乙烷中的溴元素,将少量溴乙烷与 NaOH 溶液混合共热,充分反应并冷却后,向溶液中
4
加稀 HNO3酸化,再滴加 AgNO3溶液。
⑤用燃烧的方法鉴别乙醇、四氯化碳、苯。
⑥用足量的 NaOH 溶液与矿物油和地沟油加热,可鉴别出地沟油。
⑦油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离。
⑧将铜丝在酒精灯外焰上加热变黑后移至内焰,铜丝恢复原来的红色。
⑨检验淀粉是否水解完全的方法是:在水解液中先加入过量的氢氧化钠溶液,然后滴加碘水,未
变蓝,说明已水解完全。
⑩在紫外线、饱和 Na2SO4、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性。
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红,则生成的氯甲烷具有酸性。
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明,则生成的 1,2-二溴乙烷无色、可溶于
四氯化碳。
A.3 个 B.4 个 C.5 个 D.6 个
13.叔丁醇与羧酸发生酯化反应的机理具有其特殊性,可用下图表示,已知:连在同一碳原子上
的甲基之间存在排斥力。
下列说法错误的是
A.相同条件下,中间体 3 比R COOH酸性强
B.中间体 2 中C-C-C键角大于叔丁醇中C-C-C键角
C.用NaOH溶液中和步骤④产生的H+,有利于提高羧酸叔丁酯的产率
D.用 18O标记醇羟基,可区别叔丁醇、乙醇与羧酸在酯化反应时的机理差异
14.原子序数依次增大短周期元素 X、Y、Z、M,在一定条件下形成结构如图所示的一种团簇分子。
X 是宇宙中含量最多的元素,Y 元素基态原子的价层电子排布是 nsnnp2n,Z 元素基态原子最外层电
子数与最内层电子数相等,M 元素基态原子最外层电子数等于其电子层数。下列说法正确的是
5
A.该团簇分子的分子式为XZMY3 B.基态原子第一电离能:Y>Z>M
C.工业上主要采用电解水溶液法制备 M 的单质 D.常温下 Z 的单质能溶于水
15.一种半导体材料FeSb2 的晶胞结构如图。已知晶胞α=β=γ=90o ,a b c,设 NA为阿伏加德罗
常数的值。下列有关说法错误的是
A.Sb位于晶胞的体内和面上
6 1032
B.该晶体的密度为 g cm-3NA abc
C.Sb的配位数为 4
2 2 2
D.1 号原子与 2 a +b +c号原子核间距为 pm
2
6
第Ⅱ卷 非选择题(共 55分)
二、填空题(非选择题,本题包括 4小题,共 55分)
16.(13分)回答下列问题:
(1)基态某原子的价层电子排布式是 5 25 4,推断该元素位于元素周期表中的位置______;
(2)下列状态的镁原子中,电离最外层一个电子所需能量最低的是___________(填选项);
A. . . .
(3)氰酸( )是一元弱酸,与氰酸根互为等电子体且为非极性分子的是_________(填化学式);
(4)分子中大 键可以用 ( 表示参与形成大 键的轨道数, 表示形成大 键的 电子数目)表示,
2分子中存在 53,分子呈 形,其杂化方式是_________。
(5)邻二氮菲(结构如图所示)与 2+生成稳定的橙红色邻二氮菲亚铁离子{[ ( ) ]2+3 },可用于补
铁剂中 2+的测定。
①用邻二氮菲测定 2+浓度时应控制 为 5~6,原因是_____________________。
②邻二氮菲结构中包含吡啶环( ),含有类似结构的物质通常具有一定的碱性,试判断
、 的碱性强弱:________________________________________。
(6)常温下, 2加入浓的 溶液中可制备 3 , 3 的中心原子 的杂化类型可能为________(填字母)杂
化;在一定条件下, 2加入浓的 溶液中也可制备 +3, +3中心原子的价层电子对数为________。
A. 2 . 3 . 3 . 3 2
17.(14 分)我国的航空航天事业取得了举世瞩目的成就,近年来硼氢类离子液体作为火箭推进剂
燃料得到了广泛使用,该火箭推进剂具有点火延迟时间、宽液程和极低的蒸汽压等优点。硼氢类
离子液体的合成如图所示:
回答下列问题:
(1)基态 原子的价层电子排布式为__________,其 层具有的电子数是__________。
7
(2) 、 、 的第一电离能由大到小的顺序为________________(用元素符号表示)。
(3) 中碳原子的杂化方式为_________; 2 4 的空间构型为_________形。
(4) 中不存在的作用力有_________(填字母)。
.离子键 .配位键 . 键 . 键 .金属键
(5)多原子分子中,若原子都在同一平面上且这些原子有相互平行的 轨道,则 电子可在多个原子
间运动,形成大 键。大 键可用 表示,其中 、 分别代表参与形成大 键的原子个数和电子数,
则 的大 键可表示为______________。
(6)硼化钙晶胞结构如图所示, 原子构成 6八面体,各个顶点通过 键互相连接成三维骨架,
八个 多面体围成立方体,中心为 2+,晶胞密度为 · 36 。
①硼化钙的化学式为__________________。
②晶胞边长为_______________ (已知 为阿伏加德罗常数)。
18.(14 分)阿司匹林(即乙酰水杨酸,结构简式是 )是世界上应用最广泛的解热、
镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为 128~135℃。某学习小组在实验室以水杨酸
(邻羟基苯甲酸)与醋酸酐[( 3 )2 ]为主要原料合成阿司匹林,反应原理如下:
制备基本操作流程为:
8
主要试剂和产品的物理常数如下表所示:
名称 相对分子质量 熔点或者沸点(℃) 水溶性
水杨酸 138 158(熔点) 微溶
醋酸酐 102 139(沸点) 易水解
乙酰水杨酸 180 135(熔点) 微溶
回答下列问题:
(1)阿司匹林中所含官能团的名称是____________;上述合成阿司匹林的反应类型是____________。
(2)制备阿司匹林时,要保证的条件有________________、________________(填两个即可)。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是_______________________________。
(4)提纯粗产品流程如下:
加热回流装置如图所示。
①“步骤 ”的名称是________(已知较高温度下水杨酸在乙酸乙酯中的溶解度较小)。
②仪器 的名称为________。冷凝水的进水口是________(填“ ”或“ ”)。
③下列说法不正确的是________(填字母)。
A.此种提纯粗产品的方法叫重结晶
B.此种提纯方法中乙酸乙酯的作用是作溶剂
C.可以用紫色石蕊试液判断产品中是否含有未反应完的水杨酸
D.根据以上提纯过程可以得出低温时阿司匹林在乙酸乙酯中的溶解度大
(5)在实验中原料用量:2.0 水杨酸、5.0 醋酸酐( = 1.08 · 3),最终称得产品质量为 2.4 ,
则本次实验乙酰水杨酸(Mr=180g/mol)的产率为________。
9
19.(14 分)常用作风信子等香精的定香剂 以及可用作安全玻璃夹层的高分子化合物 的合成
路线如图。
稀
已知:Ⅰ. + ′ 2 → + 2 ( 、 ′表示烃基或氢原子)
Ⅱ.醛与二元醇(如乙二醇)可生成环状缩醛: +
(1)A的名称是乙醛,其核磁共振氢谱有________种峰。
(2)已知 C为反式结构,由 B还原得到 C的结构简式为______________(要求画出 C的反式结构)。
(3)C与 M反应生成 D的化学方程式为_______________________________________________。
(4)E能使 Br2的 CCl4溶液褪色。N由 A经反应①~③合成。
a.反应①所需的反应条件是_______________________________________。
b.反应②的反应类型是___________________________________________。
c. F的名称为___________________________________________________。
d.反应③的化学方程式为_________________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是________________________。
(6)碱性条件下,PVAc完全水解的化学方程式为_____________________________________。
10
东北育才学校高中 2024-2025 下学期高二年级月考
化学学科参考答案
一、选择题(本题共 15 小题,每小题 3 分,共 45 分)
1—5. B C B A C
6—10. D D A B C
11—15. D D C B C
二、填空题(共 55 分)
16(13分)
(1)第五周期第ⅥA 族(1分)
(2)C(2分) (3)CO2(1分) (4) sp2(1分)
(5)①当H+浓度较高时,邻二氮菲中的 N 体现碱性,会优先与酸反应生成盐,导致与 Fe2+配位能力减弱,
而当 OH 浓度较高时,OH 与 Fe2+反应生成沉淀,也影响 Fe2+与邻二氮菲配位(2分)
② > > (2分)
(6)C(2 分); 4(2 分)
17.(14分)
(1)6s2(1分) ;18(1分)
(2)N > O > C(2分)
(3)sp2(1分) ;正四面体(1分)
(4)e(2分)
(5)Π65(2分)
(6)①CaB6(2分); ②
3 106 × 107ρ·N (2分)A
18.(14分)
(1)羧基、酯基(2分,各 1分) ;取代反应(1分)
(2)使用干燥的仪器;85 90℃水浴加热(2分,各 1分)
(3)除去醋酸酐、醋酸、硫酸,并降低乙酰水杨酸的损耗(2分)
(4) ①趁热过滤(1分) ②三颈烧瓶(1分);b(1分) ③CD(2分)
(5) 92% (2分)
第 1页,共 2页
19.(14分)
(1)2(1分)(2)
(2分)
(3) + 3 + 2 (2分)
(4) .稀 溶液、加热(1分) .加成反应(1分) . 1 丁醇(1分)
. 2 3( 2)3 + 2 2 3( 2)2 + 2 2 (2分)
(5) 3 2(2分)
(6) + + 3 (2分)
第 2页,共 2页
高二月考化学
姓名: 班级:
考场/座位号:
贴条形码区
注意事项
1.答题前,考生先将自己的姓名、班级、考场填写清楚,并认真核对
条形码上的姓名和准考证号。
2.选择题部分请按题号用2B铅笔填涂方框,修改时用橡皮擦干净,不 (正面朝上,切勿贴出虚线方框)
留痕迹。
3.非选择题部分请按题号用0.5毫米黑色墨水签字笔书写,否则作答
无效。要求字体工整、笔迹清晰。作图时,必须用2B铅笔,并描浓。 正确填涂 缺考标记
4.在草稿纸、试题卷上答题无效。
5.请勿折叠答题卡,保持字体工整、笔迹清晰、卡面清洁。
单选题
1 [A] [B] [C] [D] 6 [A] [B] [C] [D] 11 [A] [B] [C] [D]
2 [A] [B] [C] [D] 7 [A] [B] [C] [D] 12 [A] [B] [C] [D]
3 [A] [B] [C] [D] 8 [A] [B] [C] [D] 13 [A] [B] [C] [D]
4 [A] [B] [C] [D] 9 [A] [B] [C] [D] 14 [A] [B] [C] [D]
5 [A] [B] [C] [D] 10 [A] [B] [C] [D] 15 [A] [B] [C] [D]
填空题
16. (1) ;(2) ;
(3) ;(4) ;
(5)①
②
(6) ; ;
填空题
17. (1) ; ;(2) ;
(3) ; ;(4) ;(5)
(6) ; ;
填空题
18.
(1) ;
(2) ;
(3) ;
(4)① ;② ;③ ;
(5)
填空题
19.
(1) ;(2) ;
(3) ;
(4)a b c
d ;
(5)
(6) ;
同课章节目录
