人教版高中化学选修四课件 1.3 化学反应热的计算 (共71张PPT)
文档属性
| 名称 | 人教版高中化学选修四课件 1.3 化学反应热的计算 (共71张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 617.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-06-21 17:17:01 | ||
图片预览









文档简介
课件71张PPT。第三节 化学反应热的计算学习目标
1.知道盖斯定律的内容,了解其在科学研究中的意义。
2.能用盖斯定律进行有关反应热的简单计算。
3.通过有关反应热计算的学习过程,掌握有关反应热计算的方法和技巧,以进一步提高计算能力。 课堂互动讲练知能优化训练第三节
化学反应热的计算课前自主学案探究整合应用课前自主学案一、盖斯定律
1.内容
不管化学反应是一步完成或分几步完成,其反应热是_____的。或者说,化学反应的反应热只与反应体系的___________有关,而与反应的_____无关。相同始态和终态途径2.理解
能量的释放或吸收是以发生变化的物质为基础的,没有_____的变化,就不能引发_____的变化。
3.盖斯定律的重要意义
有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。如果应用_____
____,可以间接地把它们的_______计算出来。物质能量反应热思考感悟
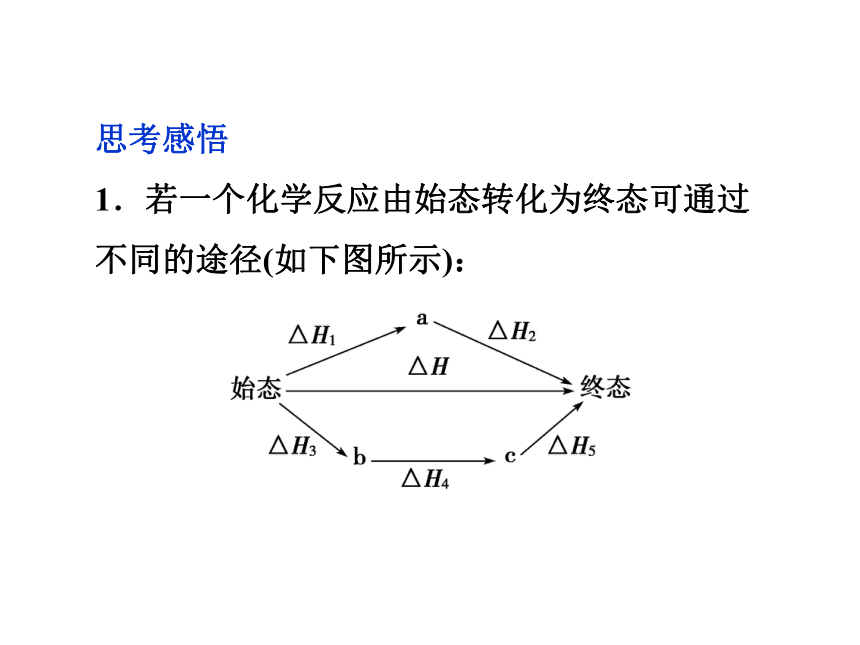
1.若一个化学反应由始态转化为终态可通过不同的途径(如下图所示):则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5之间有何关系?
【提示】ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5二、反应热的计算
1.计算依据
(1) _____________ 。
(2) _________ 。
(3) _______的数据。
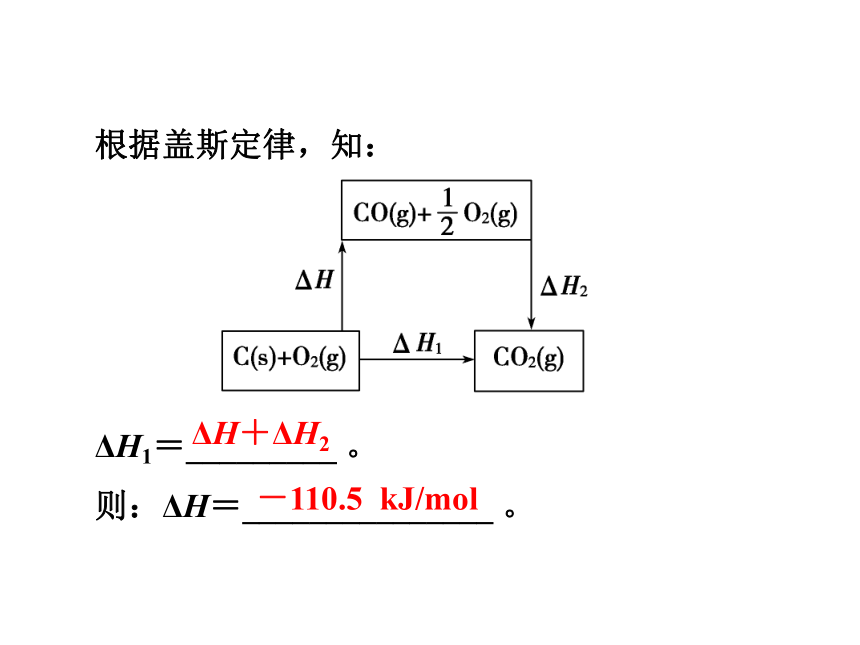
2.计算方法热化学方程式盖斯定律燃烧热ΔH+ΔH2-110.5 kJ/mol根据盖斯定律,知:
ΔH1=_________ 。
则:ΔH=_______________ 。思考感悟
2.如何利用已知反应热求未知反应热?
【提示】 (1)确定待求的反应方程式;(2)找出待求方程式中各物质出现在已知方程式的什么位置;(3)根据未知方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;(4)实行叠加并检验分析的正确与否。2.(2011年河北衡水调研)人体内葡萄糖的消耗可用下列热化学方程式表示:
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)
ΔH=-2800.6 kJ/mol
如果某人每天消耗12540 kJ的热量,则每天至少要摄入葡萄糖的质量为( )A.806 g B.1000 g
C.1250 g D.1500 g3.氢气和氧气生成液态水的反应,可以通过两种途径来完成,如图所示:解析:根据盖斯定律:ΔH=ΔH1+ΔH2,所以ΔH1=ΔH-ΔH2=-285.8 kJ/mol-(-44.0 kJ/mol)=-241.8 kJ/mol。
答案:ΔH1=-241.8 kJ/mol课堂互动讲练盖斯定律1.对盖斯定律的理解
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。应用盖斯定律进行简单计算,关键在于设计反应过程,同时要注意:
①当热化学方程式乘以或除以某数时,ΔH也相应乘以或除以某数。
②当热化学方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。③通过盖斯定律计算比较反应热的大小时,同样要把ΔH看作一个整体。
④在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,物质的状态由固→液→气变化时,会吸热;反之会放热。
⑤当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。A.Q1>Q2 B.Q1=Q2
C.Q1【规律方法】 (1)该类题目属于信息给予题。在解答该题时除了明确盖斯定律的应用规律之外,还应提炼题中所给信息,如“胆矾溶于水温度降低”说明该过程是吸热过程,故ΔH>0;
“无水硫酸铜溶解为溶液时放热Q2 kJ”说明固体溶解为放热过程。(2)熟悉物质的气、液、固三态与反应热的关系。变式训练1 实验中不能直接测出由石墨和氢气反应生成甲烷的ΔH,但可测出下面几个反应的热效应:
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH1=-890.3 kJ·mol-1 ①
C(石墨)+O2(g)===CO2(g)
ΔH2=-393.5 kJ·mol-1 ②H2(g)+1/2O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1 ③
根据盖斯定律求得反应C(石墨)+2H2(g)===
CH4(g) ④的ΔH4=__________。
解析:法一:因为反应式①②③和④之间有以下关系:②+③×2-①=④
所以ΔH4=ΔH2+2ΔH3-ΔH1
=-393.5+2×(-285.8)-(-890.3)
=-74.8(kJ·mol-1)法二:也可以设计一个途径,使反应物经过一些中间步骤最后回到产物:
可见,ΔH4=ΔH2+2ΔH3-ΔH1=-74.8 kJ·mol-1。答案:ΔH4=-74.8 kJ·mol-1反应热的计算1.反应热的计算方法和类型
(1)根据热化学方程式计算:反应热与反应物各物质的物质的量成正比。
(2)根据反应物和生成物的能量和计算:ΔH=生成物的能量和-反应物的能量和。
(3)根据反应物和生成物的键能和计算:ΔH=反应物的键能和-生成物的键能和。(4)根据盖斯定律计算:将热化学方程式进行适当的“加”“减”等变形后,由过程的热效应进行计算、比较。
(5)根据物质燃烧放热数值计算:Q(放)=n(可燃物)×ΔH。
(6)根据比热公式进行计算:Q=cmΔt。2.反应热的计算常用的解题方法
(1)列方程法:思路是先写出热化学方程式,再根据热化学方程式所体现的物质与反应热间的关系直接求算反应热。
(2)估算法:根据热化学方程式所表示反应的热效应与混合物燃烧放出热量,大致估算各成分的比例。此法主要应用于解答选择题,根据题给信息找出大致范围,便可以此为依据找出答案,此法解题快速、简便。(3)十字交叉法:混合物燃烧放热求比例问题,既可以采用常规的列方程组法,又可以采用十字交叉法。
(4)将热化学方程式看作数学中的代数方程,扩大或缩小一定倍数后,直接加减或移项变形,得到需要的热化学反应,再以此为依据计算求解或比较反应热大小等。3.反应热的计算应注意的问题
(1)运用热化学方程式进行反应热的计算,可以从反应式中各物质的物质的量、质量、标准状况下气体体积、反应热等对应关系,列式进行简单计算。
(2)注意热化学方程式中化学计量数只表示物质的物质的量,必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。尤其是利用盖斯定律计算反应热时,热化学方程式可以直接相加减,化学计量数必须与ΔH相对应。
(3)热化学方程式中的反应热是指按所给形式反应完全时的反应热。
(4)正、逆反应的反应热数值相等,符号相反。 (2011年北京海淀区模拟)化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能数据:H—S:364 kJ/mol,S—S:266 kJ/mol,S===O:522 kJ/mol,H—O:464 kJ/mol。(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热_______kJ,当a<2b时,反应放热________kJ。【思路点拨】 (2)当a>2b时,硫化氢过量,依据SO2计算;当a<2b时,SO2过量,依据H2S计算。变式训练2 煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。
这两个过程的热化学方程式为:试回答下列问题:
(1)与途径a相比,途径b有较多的优点,即___
______________________________________________________________________________。
(2)上述四个热化学方程式中ΔH>0的反应有_________________________。(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是_____。
A.a比b多 B.a比b少
C.a与b在理论上相同 D.两者无法比较
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为__________________。解析:(1)与途径a相比,途径b的优点主要有:煤的利用率高;变成气体燃料后,运输方便;使燃料充分燃烧。
(2)上述四个反应中①③④为放热反应,ΔH<0;②为吸热反应,ΔH>0。
(3)根据盖斯定律,等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同。
(4)根据盖斯定律可知:E1=E2+E3+E4。答案:(1)煤的利用率高;变成气体燃料后,运输方便;使燃料充分燃烧 (2)② (3)C
(4)E1=E2+E3+E4反应热大小的比较比较反应热的大小,一般从以下几个方面考虑:
1.比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较“燃烧热”“中和热”时,只需比较数值大小即可。
2.参加反应的物质的量不同,则反应热的数值也会发生相应的变化,如1 mol H2完全燃烧生成液态水时放出285.8 kJ的热量,2 mol H2完全燃烧生成液态水时则放出571.6 kJ的热量。4.同一反应中物质的聚集状态不同,反应热数值大小也不同。例如,S(g)+O2(g)===SO2(g) ΔH1=-Q1;S(s)+O2(g)===SO2(g) ΔH2=-Q2,可以理解成固态硫变成气态硫后再发生变化,而由固态到气态是需要吸收能量的,所以Q1>Q2、ΔH1<ΔH2,故当同一反应中只由于聚集状态不同比较反应热的大小时,反应物为固态时放出的热量少,当生成物为固态时放出的热量多。
5.中和热为稀溶液中强酸和强碱生成1 mol H2O时的反应热。但当酸为浓硫酸时,由于浓硫酸溶解放热,此时生成1 mol H2O放出热量大于57.3 kJ。 (2011年江苏盐城调研)下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4A.① B.④
C.②③④ D.①②③
【思路点拨】 解答本题要注意以下两点:
(1)依据盖斯定律,设计合理的途径。
(2)注意ΔH的正负号问题,作出正确判断。【解析】因此,ΔH前者大于后者的有②③④。
【答案】 C③2H2(g)+O2(g)===2H2O(g) ΔH=-Q1 kJ/ mol
2H2(g)+O2(g)===2H2O(l) ΔH=-Q2 kJ/mol
A.① B.②③
C.①③ D.②解析:选D。分步进行的放热反应,反应进行程度越深,放出的热量越多,即炭燃烧生成CO2时放热多,Q1Q2;水蒸气变成液态水要放出热量,故H2燃烧生成液态水时放热多,Q1有专家预测,可燃冰至少能为人类提供1000年的能源,将来它有望替代煤、石油和天然气,成为“21世纪的新能源”。
可燃冰是1983年被发现的,这种可用火柴点燃,能像蜡烛一样燃烧的天然气水合物是在海底低温、高压下形成的外形与冰相似的结晶体。由于含有大量的甲烷可燃性气体,可燃冰极易燃烧,而且燃烧造成的污染较少。世界上可燃冰的总储量非常大,据估算,其有机碳含量大约相当于全世界已知煤炭、石油和天然气总量的2倍。这些可燃冰资源可满足人类未来1000年的需要。世界上已发现的可燃冰分布区多达116处,其矿层之厚、规模之大,是常规的天然气田无法比拟的。天然可燃冰呈固态,不会像石油开采那样自喷流出。为了获取这种清洁能源,世界上许多国家都在研究天然可燃冰的开采方法。科学家们认为,一旦开采技术获得突破性进展,那么可燃冰立刻就会成为主要能源。相反,如果开采不当,后果将是灾难性的。在导致全球气候变暖方面,甲烷所起的作用比二氧化碳要大10~20倍;而可燃冰矿藏哪怕受到最小的破坏,都足以导致甲烷气体的大量泄漏,从而引起强烈的温室效应。另外,陆缘海边的可燃冰开采起来十分困难,一旦发生井喷事故,就会造成海啸、海底滑坡、海水毒化等灾害。所以,可燃冰的开发利用就像一柄“双刃剑”,需要慎重对待。 可燃冰中蕴藏着大量的甲烷,有望成为未来新能源。已知1 mol CH4气体完全燃烧生成CO2气体和液态H2O时放出的热量为890.3 kJ,当它不完全燃烧生成CO气体和液态H2O时,放出的热量为519 kJ。如果1 mol CH4在n g O2中燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。(1)写出表示甲烷燃烧热的热化学方程式。
(2)写出甲烷气体不完全燃烧的热化学方程式。
(3)计算n的值。
【解析】 (1)1 mol CH4完全燃烧生成CO2气体和液态水放出的热量就是CH4的燃烧热,所以表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol。【答案】 见解析
1.知道盖斯定律的内容,了解其在科学研究中的意义。
2.能用盖斯定律进行有关反应热的简单计算。
3.通过有关反应热计算的学习过程,掌握有关反应热计算的方法和技巧,以进一步提高计算能力。 课堂互动讲练知能优化训练第三节
化学反应热的计算课前自主学案探究整合应用课前自主学案一、盖斯定律
1.内容
不管化学反应是一步完成或分几步完成,其反应热是_____的。或者说,化学反应的反应热只与反应体系的___________有关,而与反应的_____无关。相同始态和终态途径2.理解
能量的释放或吸收是以发生变化的物质为基础的,没有_____的变化,就不能引发_____的变化。
3.盖斯定律的重要意义
有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。如果应用_____
____,可以间接地把它们的_______计算出来。物质能量反应热思考感悟
1.若一个化学反应由始态转化为终态可通过不同的途径(如下图所示):则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5之间有何关系?
【提示】ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5二、反应热的计算
1.计算依据
(1) _____________ 。
(2) _________ 。
(3) _______的数据。
2.计算方法热化学方程式盖斯定律燃烧热ΔH+ΔH2-110.5 kJ/mol根据盖斯定律,知:
ΔH1=_________ 。
则:ΔH=_______________ 。思考感悟
2.如何利用已知反应热求未知反应热?
【提示】 (1)确定待求的反应方程式;(2)找出待求方程式中各物质出现在已知方程式的什么位置;(3)根据未知方程式中各物质计量数和位置的需要对已知方程式进行处理,或调整计量数,或调整反应方向;(4)实行叠加并检验分析的正确与否。2.(2011年河北衡水调研)人体内葡萄糖的消耗可用下列热化学方程式表示:
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)
ΔH=-2800.6 kJ/mol
如果某人每天消耗12540 kJ的热量,则每天至少要摄入葡萄糖的质量为( )A.806 g B.1000 g
C.1250 g D.1500 g3.氢气和氧气生成液态水的反应,可以通过两种途径来完成,如图所示:解析:根据盖斯定律:ΔH=ΔH1+ΔH2,所以ΔH1=ΔH-ΔH2=-285.8 kJ/mol-(-44.0 kJ/mol)=-241.8 kJ/mol。
答案:ΔH1=-241.8 kJ/mol课堂互动讲练盖斯定律1.对盖斯定律的理解
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。应用盖斯定律进行简单计算,关键在于设计反应过程,同时要注意:
①当热化学方程式乘以或除以某数时,ΔH也相应乘以或除以某数。
②当热化学方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。③通过盖斯定律计算比较反应热的大小时,同样要把ΔH看作一个整体。
④在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,物质的状态由固→液→气变化时,会吸热;反之会放热。
⑤当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。A.Q1>Q2 B.Q1=Q2
C.Q1
“无水硫酸铜溶解为溶液时放热Q2 kJ”说明固体溶解为放热过程。(2)熟悉物质的气、液、固三态与反应热的关系。变式训练1 实验中不能直接测出由石墨和氢气反应生成甲烷的ΔH,但可测出下面几个反应的热效应:
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH1=-890.3 kJ·mol-1 ①
C(石墨)+O2(g)===CO2(g)
ΔH2=-393.5 kJ·mol-1 ②H2(g)+1/2O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1 ③
根据盖斯定律求得反应C(石墨)+2H2(g)===
CH4(g) ④的ΔH4=__________。
解析:法一:因为反应式①②③和④之间有以下关系:②+③×2-①=④
所以ΔH4=ΔH2+2ΔH3-ΔH1
=-393.5+2×(-285.8)-(-890.3)
=-74.8(kJ·mol-1)法二:也可以设计一个途径,使反应物经过一些中间步骤最后回到产物:
可见,ΔH4=ΔH2+2ΔH3-ΔH1=-74.8 kJ·mol-1。答案:ΔH4=-74.8 kJ·mol-1反应热的计算1.反应热的计算方法和类型
(1)根据热化学方程式计算:反应热与反应物各物质的物质的量成正比。
(2)根据反应物和生成物的能量和计算:ΔH=生成物的能量和-反应物的能量和。
(3)根据反应物和生成物的键能和计算:ΔH=反应物的键能和-生成物的键能和。(4)根据盖斯定律计算:将热化学方程式进行适当的“加”“减”等变形后,由过程的热效应进行计算、比较。
(5)根据物质燃烧放热数值计算:Q(放)=n(可燃物)×ΔH。
(6)根据比热公式进行计算:Q=cmΔt。2.反应热的计算常用的解题方法
(1)列方程法:思路是先写出热化学方程式,再根据热化学方程式所体现的物质与反应热间的关系直接求算反应热。
(2)估算法:根据热化学方程式所表示反应的热效应与混合物燃烧放出热量,大致估算各成分的比例。此法主要应用于解答选择题,根据题给信息找出大致范围,便可以此为依据找出答案,此法解题快速、简便。(3)十字交叉法:混合物燃烧放热求比例问题,既可以采用常规的列方程组法,又可以采用十字交叉法。
(4)将热化学方程式看作数学中的代数方程,扩大或缩小一定倍数后,直接加减或移项变形,得到需要的热化学反应,再以此为依据计算求解或比较反应热大小等。3.反应热的计算应注意的问题
(1)运用热化学方程式进行反应热的计算,可以从反应式中各物质的物质的量、质量、标准状况下气体体积、反应热等对应关系,列式进行简单计算。
(2)注意热化学方程式中化学计量数只表示物质的物质的量,必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。尤其是利用盖斯定律计算反应热时,热化学方程式可以直接相加减,化学计量数必须与ΔH相对应。
(3)热化学方程式中的反应热是指按所给形式反应完全时的反应热。
(4)正、逆反应的反应热数值相等,符号相反。 (2011年北京海淀区模拟)化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能数据:H—S:364 kJ/mol,S—S:266 kJ/mol,S===O:522 kJ/mol,H—O:464 kJ/mol。(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热_______kJ,当a<2b时,反应放热________kJ。【思路点拨】 (2)当a>2b时,硫化氢过量,依据SO2计算;当a<2b时,SO2过量,依据H2S计算。变式训练2 煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。
这两个过程的热化学方程式为:试回答下列问题:
(1)与途径a相比,途径b有较多的优点,即___
______________________________________________________________________________。
(2)上述四个热化学方程式中ΔH>0的反应有_________________________。(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是_____。
A.a比b多 B.a比b少
C.a与b在理论上相同 D.两者无法比较
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为__________________。解析:(1)与途径a相比,途径b的优点主要有:煤的利用率高;变成气体燃料后,运输方便;使燃料充分燃烧。
(2)上述四个反应中①③④为放热反应,ΔH<0;②为吸热反应,ΔH>0。
(3)根据盖斯定律,等质量的煤分别通过以上两条不同的途径产生的可利用的总能量相同。
(4)根据盖斯定律可知:E1=E2+E3+E4。答案:(1)煤的利用率高;变成气体燃料后,运输方便;使燃料充分燃烧 (2)② (3)C
(4)E1=E2+E3+E4反应热大小的比较比较反应热的大小,一般从以下几个方面考虑:
1.比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较“燃烧热”“中和热”时,只需比较数值大小即可。
2.参加反应的物质的量不同,则反应热的数值也会发生相应的变化,如1 mol H2完全燃烧生成液态水时放出285.8 kJ的热量,2 mol H2完全燃烧生成液态水时则放出571.6 kJ的热量。4.同一反应中物质的聚集状态不同,反应热数值大小也不同。例如,S(g)+O2(g)===SO2(g) ΔH1=-Q1;S(s)+O2(g)===SO2(g) ΔH2=-Q2,可以理解成固态硫变成气态硫后再发生变化,而由固态到气态是需要吸收能量的,所以Q1>Q2、ΔH1<ΔH2,故当同一反应中只由于聚集状态不同比较反应热的大小时,反应物为固态时放出的热量少,当生成物为固态时放出的热量多。
5.中和热为稀溶液中强酸和强碱生成1 mol H2O时的反应热。但当酸为浓硫酸时,由于浓硫酸溶解放热,此时生成1 mol H2O放出热量大于57.3 kJ。 (2011年江苏盐城调研)下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4A.① B.④
C.②③④ D.①②③
【思路点拨】 解答本题要注意以下两点:
(1)依据盖斯定律,设计合理的途径。
(2)注意ΔH的正负号问题,作出正确判断。【解析】因此,ΔH前者大于后者的有②③④。
【答案】 C③2H2(g)+O2(g)===2H2O(g) ΔH=-Q1 kJ/ mol
2H2(g)+O2(g)===2H2O(l) ΔH=-Q2 kJ/mol
A.① B.②③
C.①③ D.②解析:选D。分步进行的放热反应,反应进行程度越深,放出的热量越多,即炭燃烧生成CO2时放热多,Q1
可燃冰是1983年被发现的,这种可用火柴点燃,能像蜡烛一样燃烧的天然气水合物是在海底低温、高压下形成的外形与冰相似的结晶体。由于含有大量的甲烷可燃性气体,可燃冰极易燃烧,而且燃烧造成的污染较少。世界上可燃冰的总储量非常大,据估算,其有机碳含量大约相当于全世界已知煤炭、石油和天然气总量的2倍。这些可燃冰资源可满足人类未来1000年的需要。世界上已发现的可燃冰分布区多达116处,其矿层之厚、规模之大,是常规的天然气田无法比拟的。天然可燃冰呈固态,不会像石油开采那样自喷流出。为了获取这种清洁能源,世界上许多国家都在研究天然可燃冰的开采方法。科学家们认为,一旦开采技术获得突破性进展,那么可燃冰立刻就会成为主要能源。相反,如果开采不当,后果将是灾难性的。在导致全球气候变暖方面,甲烷所起的作用比二氧化碳要大10~20倍;而可燃冰矿藏哪怕受到最小的破坏,都足以导致甲烷气体的大量泄漏,从而引起强烈的温室效应。另外,陆缘海边的可燃冰开采起来十分困难,一旦发生井喷事故,就会造成海啸、海底滑坡、海水毒化等灾害。所以,可燃冰的开发利用就像一柄“双刃剑”,需要慎重对待。 可燃冰中蕴藏着大量的甲烷,有望成为未来新能源。已知1 mol CH4气体完全燃烧生成CO2气体和液态H2O时放出的热量为890.3 kJ,当它不完全燃烧生成CO气体和液态H2O时,放出的热量为519 kJ。如果1 mol CH4在n g O2中燃烧生成CO、CO2气体和液态H2O,放出731.25 kJ热量。(1)写出表示甲烷燃烧热的热化学方程式。
(2)写出甲烷气体不完全燃烧的热化学方程式。
(3)计算n的值。
【解析】 (1)1 mol CH4完全燃烧生成CO2气体和液态水放出的热量就是CH4的燃烧热,所以表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol。【答案】 见解析
