(2)化学反应中的热——高一化学苏教版(2019)暑假作业(含答案)
文档属性
| 名称 | (2)化学反应中的热——高一化学苏教版(2019)暑假作业(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 328.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 19:18:25 | ||
图片预览



文档简介
(2)化学反应中的热——高一化学苏教版(2019)暑假作业
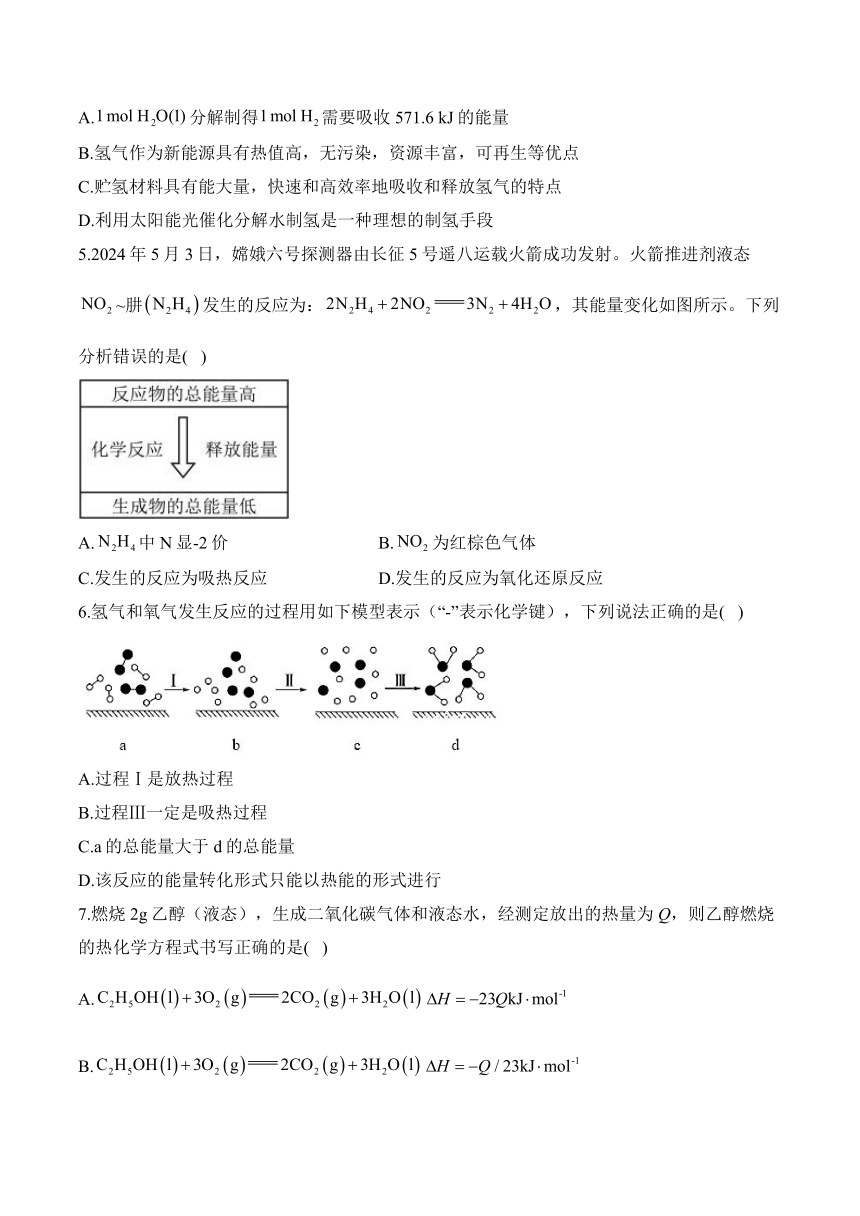
1.下列实验现象能充分说明对应的化学反应是放热反应的是( )
A.试管内有气泡产生,烧杯内有固体析出
B.反应开始后,针筒活塞向右移动
C.温度计的水银柱不断下降
D.U形管的液面左高右低
2.下列关于能量转化的认识错误的是( )
A.电解饱和食盐水时,电能转化为化学能
B.树木进行光合作用时,太阳能转化为化学能
C.汽油燃烧时,化学能转化为热能
D.电灯工作时,电能全部转化为光能
3.下列说法正确的是( )
A.凡需加热的反应一定是吸热反应
B.水汽化需要吸收能量,所以水汽化属于吸热反应
C.任何化学反应都伴随有能量变化
D.已知在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热能,据此判断:金刚石比石墨稳定
4.氢能是最具前景的清洁能源之一,目前水分解制氢技术及贮氢材料的开发应用都取得了很大进展。已知:。下列说法中错误的是( )
A.分解制得需要吸收571.6 kJ的能量
B.氢气作为新能源具有热值高,无污染,资源丰富,可再生等优点
C.贮氢材料具有能大量,快速和高效率地吸收和释放氢气的特点
D.利用太阳能光催化分解水制氢是一种理想的制氢手段
5.2024年5月3日,嫦娥六号探测器由长征5号遥八运载火箭成功发射。火箭推进剂液态~肼发生的反应为:,其能量变化如图所示。下列分析错误的是( )
A.中N显-2价 B.为红棕色气体
C.发生的反应为吸热反应 D.发生的反应为氧化还原反应
6.氢气和氧气发生反应的过程用如下模型表示(“-”表示化学键),下列说法正确的是( )
A.过程Ⅰ是放热过程
B.过程Ⅲ一定是吸热过程
C.a的总能量大于d的总能量
D.该反应的能量转化形式只能以热能的形式进行
7.燃烧2g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则乙醇燃烧的热化学方程式书写正确的是( )
A.
B.
C.
D.
8.反应的能量变化如图所示,下列说法正确的是( )
A.该反应为放热反应
B.改变反应条件,反应物的转化率一定不变
C.充分反应后,原料的转化率可达100%
D.该反应中,断裂反应物化学键吸收的能量大于形成生成物化学键放出的能量
9.下列所述变化中,前者是吸热反应,后者是放热反应的是( )
A.与的反应;氢氧化钠溶于水
B. 点燃的镁条在二氧化碳中继续燃烧;碳酸氢钠分解
C. 灼热的碳与二氧化碳的反应;氢气在氯气中燃烧
D. 酸碱中和;焦炭与高温水蒸气反应
10.“煤制油”的关键技术是煤的气化,目前煤的气化主要反应是:①,此外还存在间歇性的煤燃烧:②,下列关于该过程的说法错误的是( )
A.和的总能量高于和的总能量
B.反应②发生的目的是为反应①提供能量
C.“煤制油”技术的使用符合蓝天工程的要求
D.①中产生的氢气可用于油的制备
11.已知某反应的能量变化如图所示,下列说法正确的是( )
A. 该反应只有在加热条件下才能进行
B. 该反应不可能是氧化还原反应
C. 该图可以表示盐酸与碳酸氢钠反应过程的能量变化
D. 反应中断开化学键吸收的总能量低于形成化学键放出的总能量
12.下列热化学方程式书写正确的是( )
A.
B.
C.
D.
13.一种碘硫热化学分解、水循环制氢的化学工艺流程如图所示,下列说法错误的是( )
A.该工艺需要消耗大量的热能
B.该工艺总反应为
C.吸热反应需要加热才能进行,放热反应都不需要加热
D.该工艺流程图中只有化学能与热能之间的相互转化
14.某反应由两步反应构成,反应过程中能量变化曲线如图,下列叙述正确的是( )
A.升高温度,使得的反应速率都加快
B.A与C的能量差为
C.两步反应均为吸热反应
D.A、B、C三种化合物中B能量最高,所以最稳定
15.已知碘化氢分解吸热,分以下两步完成:;,下列图像最符合上述反应历程的是( )
A. B.
C. D.
答案以及解析
1.答案:A
解析:A(√)Mg与稀盐酸发生置换反应产生,所以试管内有气泡生成,反应放出热量,使烧杯内饱和石灰水温度升高,溶解度降低而结晶析出,可证明反应是放热反应。
B(×)锌粒与稀硫酸反应产生氢气,不管反应是否放热,反应开始后,锥形瓶内气体压强都会增大,导致针筒活塞向右移动,不能证明反应放出热量。
C(×)向中加入稀盐酸,二者发生反应后使温度计水银柱不断下降,说明反应过程吸收热量,该反应为吸热反应。
D(×)硝酸铵固体溶于水是物理变化,无需判断。
2.答案:D
解析:A(√)电解饱和食盐水时需要消耗电能,电能转化为化学能。
B(√)树木进行光合作用时,可把太阳能转化为化学能。
C(√)汽油燃烧时释放出热量,故其化学能转化为热能。
D(×)电灯工作时,电能除转化为光能外,还有部分电能转化为热能等。
3.答案:C
解析:A.铝热反应为放热反应,但需要在高温条件下进行,A错误;
B.水汽化时并未发生化学变化,不属于吸热反应,B错误;
C.化学反应的实质是旧化学键的断裂和新化学键的形成,任何化学反应都伴随有能量变化,C正确;
D.物质具有的能量越低越稳定,根据题意,石墨具有的能量低,故石墨更稳定,D错误;
故选C。
4.答案:A
解析:完全分解需吸收的能量,A项错误。
5.答案:C
解析:A.中H元素化合价为+1价,N元素为-2价,A正确;
B.为一种红棕色易溶于水的有毒气体,B正确;
C.该反应物总能量大于生成物总能量,为放热反应,C错误;
D.该反应中氮元素化合价发生了变化,为氧化还原反应,D正确;
故答案为C。
6.答案:C
解析:A.过程Ⅰ分子化学键断裂形成原子,属于吸热过程,A错误;
B.过程Ⅲ为新化学键形成的过程,是放热过程,B错误;
C.氢气燃烧放热,则a的总能量大于d的总能量,C正确;
D.该反应可通过燃料电池,实现化学能到电能的转化,不一定只能以热能的形式进行,D错误;
故答案为:C。
7.答案:A
解析:燃烧2g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则燃烧1mol液态乙醇生成二氧化碳气体和液态水的反应热为:,故乙醇燃烧的热化学方程式为:,故选A
8.答案:A
解析:A.图中分析可知,反应物总能量大于生成物总能量,反应为放热反应,故A正确;
B.改变反应条件,反应物的转化率不一定变化,若改变压强,反应前后气体体积不变,反应物转化率不变,若升高温度,平衡逆向进行,反应物转化率减小,故B错误;
C.反应为可逆反应,充分反应后达到平衡状态,原料的转化率不能达到100%,故C错误;
D.反应物总能量大于生成物总能量,为放热反应,且恰变等于断裂化学键吸收的能量减去成键释放的能量,则和断键吸收的能量小于形成和放出的能量,故D错误;
故选A。
9.答案:C
解析:A. 与的反应属于吸热反应;氢氧化钠溶于水为放热过程但不是放热反应,选项A不符合;
B. 点燃的镁条在二氧化碳中继续燃烧属于放热反应;碳酸氢钠分解属于吸热反应,选项B不符合;
C. 灼热的碳与二氧化碳的反应属于吸热反应;氢气在氯气中燃烧属于放热反应,选项C符合;
D. 酸碱中和反应属于放热反应;焦炭与高温水蒸气反应属于吸热反应,选项D不符合。
答案选C。
10.答案:A
解析:反应①是吸热反应,生成物的总能量较高,A项错误;
②是放热反应,反应①需要吸收热量,B项正确;
煤制油后,可减少灰尘等有害物质的排放,C项正确;
“油”的主要成分是烃,将转化为油需要添加氢元素,D项正确。
11.答案:C
解析: A.反应条件与反应热之间没有必然关系,有些吸热反应在常温下就可以发生,如氢氧化钡晶体与氯化铵的反应,A错误;
B.氧化还原反应也可以是吸热反应,如C和的反应,B错误;
C.盐酸与碳酸氢钠反应吸收热量,该图可以表示盐酸与碳酸氢钠反应过程的能量变化,C正确;
D.吸热反应断开化学键吸收的总能量高于形成化学键放出的总能量,D错误;
故选C。
12.答案:D
解析:A.物质的聚集状态对反应的反应热有影响,故书写热化学方程式时,要标出物质的聚集状态,故A错误;
B.碳的燃烧为放热反应,应为负值,故B错误;
C.酸碱中和为放热反应,应为负值,且的单位为,故C错误;
D.氢气在氯气中燃烧为放热反应,故为负值,故D正确。
故选D。
13.答案:C
解析:根据题图,碘硫热化学分解、水循环制氢的化学工艺流程涉及的反应为,总反应为,和是反应的催化剂。
A(√)根据题图,HI、的分解反应都需要在较高温度下进行,因此该工艺需要消耗大量的热能。
B(√)根据上述分析,总反应为。
C(×)吸热反应和放热反应的进行与需不需要加热无关。
D(√)该工艺流程图中只有化学能与热能之间的相互转化,无其他能量变化。
14.答案:A
解析:A.升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中活化分子的百分数,使得单位时间内有效碰撞的次数增加,使得的反应速率都加快,A正确;
B.由图可知,A与C的能量差为,B错误;
C.由图可知,第一步反应为吸热反应,第二步反应为放热反应,C错误;
D.能量越低,物质越稳定,C能量最低,则C最稳定,D错误;
故选A。
15.答案:A
解析:根据题干描述,碘化氢分解的总反应是吸热的,而第二步是成键过程,一定是放热,故第一步必然吸热;
A.结合图像,第一步吸热,第二步放热,总反应吸热,符合上述分析,故A符合题意;
B.根据图像,总反应是放热反应,不符合上述分析,故B不符合题意;
C.根据图像,第二步吸热,不符合上述分析,故C不符合题意;
D.根据图像,第一步放热,第二步吸热,不符合上述分析,故D不符合题意。
答案选A。
1.下列实验现象能充分说明对应的化学反应是放热反应的是( )
A.试管内有气泡产生,烧杯内有固体析出
B.反应开始后,针筒活塞向右移动
C.温度计的水银柱不断下降
D.U形管的液面左高右低
2.下列关于能量转化的认识错误的是( )
A.电解饱和食盐水时,电能转化为化学能
B.树木进行光合作用时,太阳能转化为化学能
C.汽油燃烧时,化学能转化为热能
D.电灯工作时,电能全部转化为光能
3.下列说法正确的是( )
A.凡需加热的反应一定是吸热反应
B.水汽化需要吸收能量,所以水汽化属于吸热反应
C.任何化学反应都伴随有能量变化
D.已知在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热能,据此判断:金刚石比石墨稳定
4.氢能是最具前景的清洁能源之一,目前水分解制氢技术及贮氢材料的开发应用都取得了很大进展。已知:。下列说法中错误的是( )
A.分解制得需要吸收571.6 kJ的能量
B.氢气作为新能源具有热值高,无污染,资源丰富,可再生等优点
C.贮氢材料具有能大量,快速和高效率地吸收和释放氢气的特点
D.利用太阳能光催化分解水制氢是一种理想的制氢手段
5.2024年5月3日,嫦娥六号探测器由长征5号遥八运载火箭成功发射。火箭推进剂液态~肼发生的反应为:,其能量变化如图所示。下列分析错误的是( )
A.中N显-2价 B.为红棕色气体
C.发生的反应为吸热反应 D.发生的反应为氧化还原反应
6.氢气和氧气发生反应的过程用如下模型表示(“-”表示化学键),下列说法正确的是( )
A.过程Ⅰ是放热过程
B.过程Ⅲ一定是吸热过程
C.a的总能量大于d的总能量
D.该反应的能量转化形式只能以热能的形式进行
7.燃烧2g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则乙醇燃烧的热化学方程式书写正确的是( )
A.
B.
C.
D.
8.反应的能量变化如图所示,下列说法正确的是( )
A.该反应为放热反应
B.改变反应条件,反应物的转化率一定不变
C.充分反应后,原料的转化率可达100%
D.该反应中,断裂反应物化学键吸收的能量大于形成生成物化学键放出的能量
9.下列所述变化中,前者是吸热反应,后者是放热反应的是( )
A.与的反应;氢氧化钠溶于水
B. 点燃的镁条在二氧化碳中继续燃烧;碳酸氢钠分解
C. 灼热的碳与二氧化碳的反应;氢气在氯气中燃烧
D. 酸碱中和;焦炭与高温水蒸气反应
10.“煤制油”的关键技术是煤的气化,目前煤的气化主要反应是:①,此外还存在间歇性的煤燃烧:②,下列关于该过程的说法错误的是( )
A.和的总能量高于和的总能量
B.反应②发生的目的是为反应①提供能量
C.“煤制油”技术的使用符合蓝天工程的要求
D.①中产生的氢气可用于油的制备
11.已知某反应的能量变化如图所示,下列说法正确的是( )
A. 该反应只有在加热条件下才能进行
B. 该反应不可能是氧化还原反应
C. 该图可以表示盐酸与碳酸氢钠反应过程的能量变化
D. 反应中断开化学键吸收的总能量低于形成化学键放出的总能量
12.下列热化学方程式书写正确的是( )
A.
B.
C.
D.
13.一种碘硫热化学分解、水循环制氢的化学工艺流程如图所示,下列说法错误的是( )
A.该工艺需要消耗大量的热能
B.该工艺总反应为
C.吸热反应需要加热才能进行,放热反应都不需要加热
D.该工艺流程图中只有化学能与热能之间的相互转化
14.某反应由两步反应构成,反应过程中能量变化曲线如图,下列叙述正确的是( )
A.升高温度,使得的反应速率都加快
B.A与C的能量差为
C.两步反应均为吸热反应
D.A、B、C三种化合物中B能量最高,所以最稳定
15.已知碘化氢分解吸热,分以下两步完成:;,下列图像最符合上述反应历程的是( )
A. B.
C. D.
答案以及解析
1.答案:A
解析:A(√)Mg与稀盐酸发生置换反应产生,所以试管内有气泡生成,反应放出热量,使烧杯内饱和石灰水温度升高,溶解度降低而结晶析出,可证明反应是放热反应。
B(×)锌粒与稀硫酸反应产生氢气,不管反应是否放热,反应开始后,锥形瓶内气体压强都会增大,导致针筒活塞向右移动,不能证明反应放出热量。
C(×)向中加入稀盐酸,二者发生反应后使温度计水银柱不断下降,说明反应过程吸收热量,该反应为吸热反应。
D(×)硝酸铵固体溶于水是物理变化,无需判断。
2.答案:D
解析:A(√)电解饱和食盐水时需要消耗电能,电能转化为化学能。
B(√)树木进行光合作用时,可把太阳能转化为化学能。
C(√)汽油燃烧时释放出热量,故其化学能转化为热能。
D(×)电灯工作时,电能除转化为光能外,还有部分电能转化为热能等。
3.答案:C
解析:A.铝热反应为放热反应,但需要在高温条件下进行,A错误;
B.水汽化时并未发生化学变化,不属于吸热反应,B错误;
C.化学反应的实质是旧化学键的断裂和新化学键的形成,任何化学反应都伴随有能量变化,C正确;
D.物质具有的能量越低越稳定,根据题意,石墨具有的能量低,故石墨更稳定,D错误;
故选C。
4.答案:A
解析:完全分解需吸收的能量,A项错误。
5.答案:C
解析:A.中H元素化合价为+1价,N元素为-2价,A正确;
B.为一种红棕色易溶于水的有毒气体,B正确;
C.该反应物总能量大于生成物总能量,为放热反应,C错误;
D.该反应中氮元素化合价发生了变化,为氧化还原反应,D正确;
故答案为C。
6.答案:C
解析:A.过程Ⅰ分子化学键断裂形成原子,属于吸热过程,A错误;
B.过程Ⅲ为新化学键形成的过程,是放热过程,B错误;
C.氢气燃烧放热,则a的总能量大于d的总能量,C正确;
D.该反应可通过燃料电池,实现化学能到电能的转化,不一定只能以热能的形式进行,D错误;
故答案为:C。
7.答案:A
解析:燃烧2g乙醇(液态),生成二氧化碳气体和液态水,经测定放出的热量为Q,则燃烧1mol液态乙醇生成二氧化碳气体和液态水的反应热为:,故乙醇燃烧的热化学方程式为:,故选A
8.答案:A
解析:A.图中分析可知,反应物总能量大于生成物总能量,反应为放热反应,故A正确;
B.改变反应条件,反应物的转化率不一定变化,若改变压强,反应前后气体体积不变,反应物转化率不变,若升高温度,平衡逆向进行,反应物转化率减小,故B错误;
C.反应为可逆反应,充分反应后达到平衡状态,原料的转化率不能达到100%,故C错误;
D.反应物总能量大于生成物总能量,为放热反应,且恰变等于断裂化学键吸收的能量减去成键释放的能量,则和断键吸收的能量小于形成和放出的能量,故D错误;
故选A。
9.答案:C
解析:A. 与的反应属于吸热反应;氢氧化钠溶于水为放热过程但不是放热反应,选项A不符合;
B. 点燃的镁条在二氧化碳中继续燃烧属于放热反应;碳酸氢钠分解属于吸热反应,选项B不符合;
C. 灼热的碳与二氧化碳的反应属于吸热反应;氢气在氯气中燃烧属于放热反应,选项C符合;
D. 酸碱中和反应属于放热反应;焦炭与高温水蒸气反应属于吸热反应,选项D不符合。
答案选C。
10.答案:A
解析:反应①是吸热反应,生成物的总能量较高,A项错误;
②是放热反应,反应①需要吸收热量,B项正确;
煤制油后,可减少灰尘等有害物质的排放,C项正确;
“油”的主要成分是烃,将转化为油需要添加氢元素,D项正确。
11.答案:C
解析: A.反应条件与反应热之间没有必然关系,有些吸热反应在常温下就可以发生,如氢氧化钡晶体与氯化铵的反应,A错误;
B.氧化还原反应也可以是吸热反应,如C和的反应,B错误;
C.盐酸与碳酸氢钠反应吸收热量,该图可以表示盐酸与碳酸氢钠反应过程的能量变化,C正确;
D.吸热反应断开化学键吸收的总能量高于形成化学键放出的总能量,D错误;
故选C。
12.答案:D
解析:A.物质的聚集状态对反应的反应热有影响,故书写热化学方程式时,要标出物质的聚集状态,故A错误;
B.碳的燃烧为放热反应,应为负值,故B错误;
C.酸碱中和为放热反应,应为负值,且的单位为,故C错误;
D.氢气在氯气中燃烧为放热反应,故为负值,故D正确。
故选D。
13.答案:C
解析:根据题图,碘硫热化学分解、水循环制氢的化学工艺流程涉及的反应为,总反应为,和是反应的催化剂。
A(√)根据题图,HI、的分解反应都需要在较高温度下进行,因此该工艺需要消耗大量的热能。
B(√)根据上述分析,总反应为。
C(×)吸热反应和放热反应的进行与需不需要加热无关。
D(√)该工艺流程图中只有化学能与热能之间的相互转化,无其他能量变化。
14.答案:A
解析:A.升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子,从而增加了反应物分子中活化分子的百分数,使得单位时间内有效碰撞的次数增加,使得的反应速率都加快,A正确;
B.由图可知,A与C的能量差为,B错误;
C.由图可知,第一步反应为吸热反应,第二步反应为放热反应,C错误;
D.能量越低,物质越稳定,C能量最低,则C最稳定,D错误;
故选A。
15.答案:A
解析:根据题干描述,碘化氢分解的总反应是吸热的,而第二步是成键过程,一定是放热,故第一步必然吸热;
A.结合图像,第一步吸热,第二步放热,总反应吸热,符合上述分析,故A符合题意;
B.根据图像,总反应是放热反应,不符合上述分析,故B不符合题意;
C.根据图像,第二步吸热,不符合上述分析,故C不符合题意;
D.根据图像,第一步放热,第二步吸热,不符合上述分析,故D不符合题意。
答案选A。
同课章节目录
