(2)氮及其化合物——高一化学人教版(2019)暑假作业(含答案)
文档属性
| 名称 | (2)氮及其化合物——高一化学人教版(2019)暑假作业(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 564.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 19:20:59 | ||
图片预览



文档简介
(2)氮及其化合物——高一化学人教版(2019)暑假作业
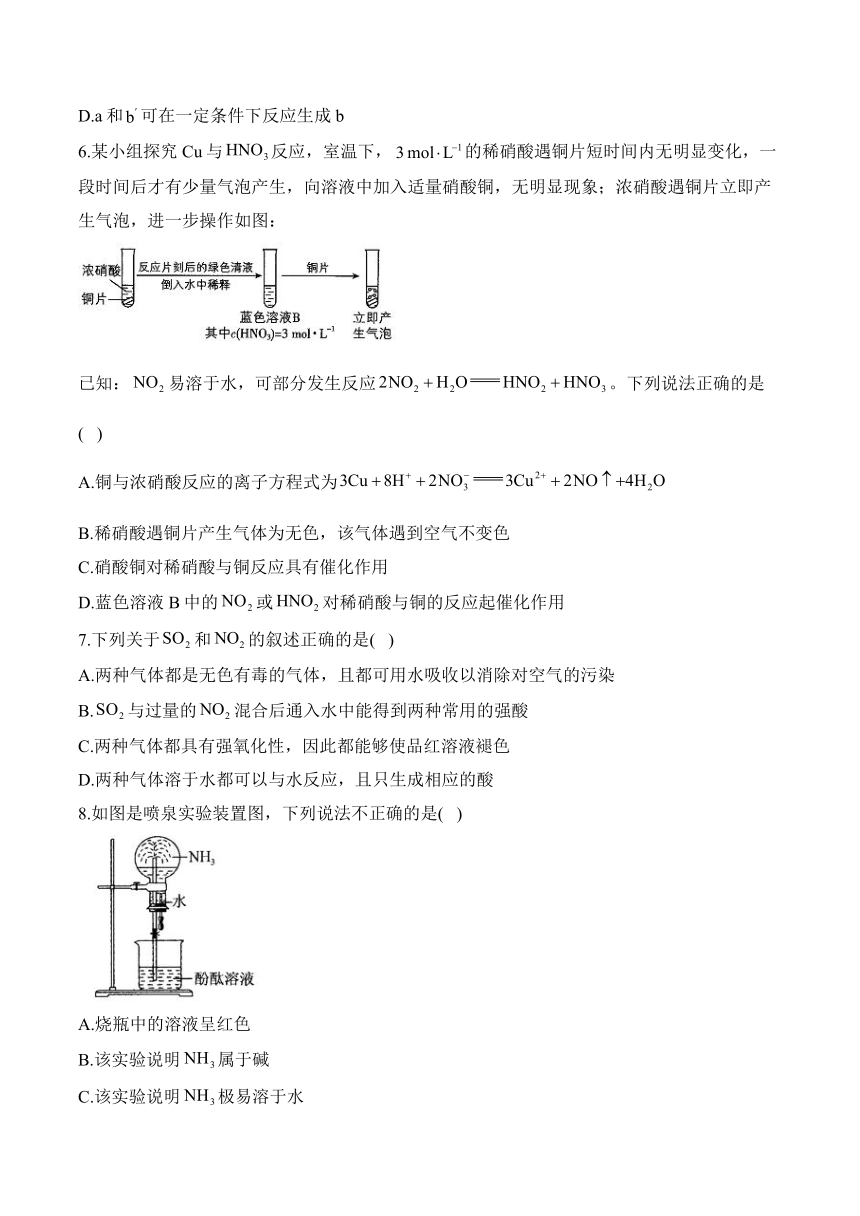
1.要用棕色试剂瓶保存的试剂是( )
A.浓硝酸 B.浓硫酸 C.碳酸钠溶液 D.硫酸钾溶液
2.用下图所示装置进行实验,下列说法正确的是( )
A.挤压滴管并打开止水夹后,观察到烧杯中的水倒吸,产生红色“喷泉”
B.“喷泉”的产生能证明与发生了反应
C.若将换成,也能产生明显的“喷泉”
D.实验后,取出烧瓶中的溶液,测得其,原因是:,
3.植物对氮元素的吸收过程如下,下列说法正确的是( )
A.高温有利于加快过程① B.浇水和松土有利于过程②
C.过程③中被还原 D.过程④叫做氮的固定
4.下列过程属于大气固氮的是( )
A.分离液态空气制氮气 B.工业合成氨
C.闪电时转化为NO D.豆科作物根瘤菌将转化为
5.部分含氮及氯物质的价类二维图如下,下列推断不合理的是( )
A.a和c可在一定条件下反应生成b
B.工业上通过a→b→d→e来制备
C.浓的溶液和浓的溶液反应可以得到
D.a和可在一定条件下反应生成b
6.某小组探究Cu与反应,室温下,的稀硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,向溶液中加入适量硝酸铜,无明显现象;浓硝酸遇铜片立即产生气泡,进一步操作如图:
已知:易溶于水,可部分发生反应。下列说法正确的是( )
A.铜与浓硝酸反应的离子方程式为
B.稀硝酸遇铜片产生气体为无色,该气体遇到空气不变色
C.硝酸铜对稀硝酸与铜反应具有催化作用
D.蓝色溶液B中的或对稀硝酸与铜的反应起催化作用
7.下列关于和的叙述正确的是( )
A.两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染
B.与过量的混合后通入水中能得到两种常用的强酸
C.两种气体都具有强氧化性,因此都能够使品红溶液褪色
D.两种气体溶于水都可以与水反应,且只生成相应的酸
8.如图是喷泉实验装置图,下列说法不正确的是( )
A.烧瓶中的溶液呈红色
B.该实验说明属于碱
C.该实验说明极易溶于水
D.形成喷泉的原因是烧瓶内压强小于外界大气压
9.下列有关硝酸化学性质的叙述正确的是( )
A.稀硝酸能与等盐反应,产生和
B.稀硝酸与FeO反应生成和,与Fe反应生成和
C.浓硝酸、稀硝酸都只能使蓝色石蕊试纸变红
D.浓硝酸因分解放出的又溶解于浓硝酸而呈黄色
10.用以下三种途径来制取相同质量的硝酸铜:①铜跟浓硝酸反应;②铜跟稀硝酸反应;③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量:途径③>途径①>途径②
D.所消耗硝酸的物质的量:途径①>途径②>途径③
11.部分含氮、硫元素的化合物的价-类二维图如图所示。下列关于各物质的说法错误的是( )
A.i在一定条件下均可以与a、b、c发生反应
B.e的浓溶液可用于干燥c、f、g
C.g与CO在汽车催化转化器中会转化成两种无毒气体
D.实验室中产生的h可用NaOH溶液吸收
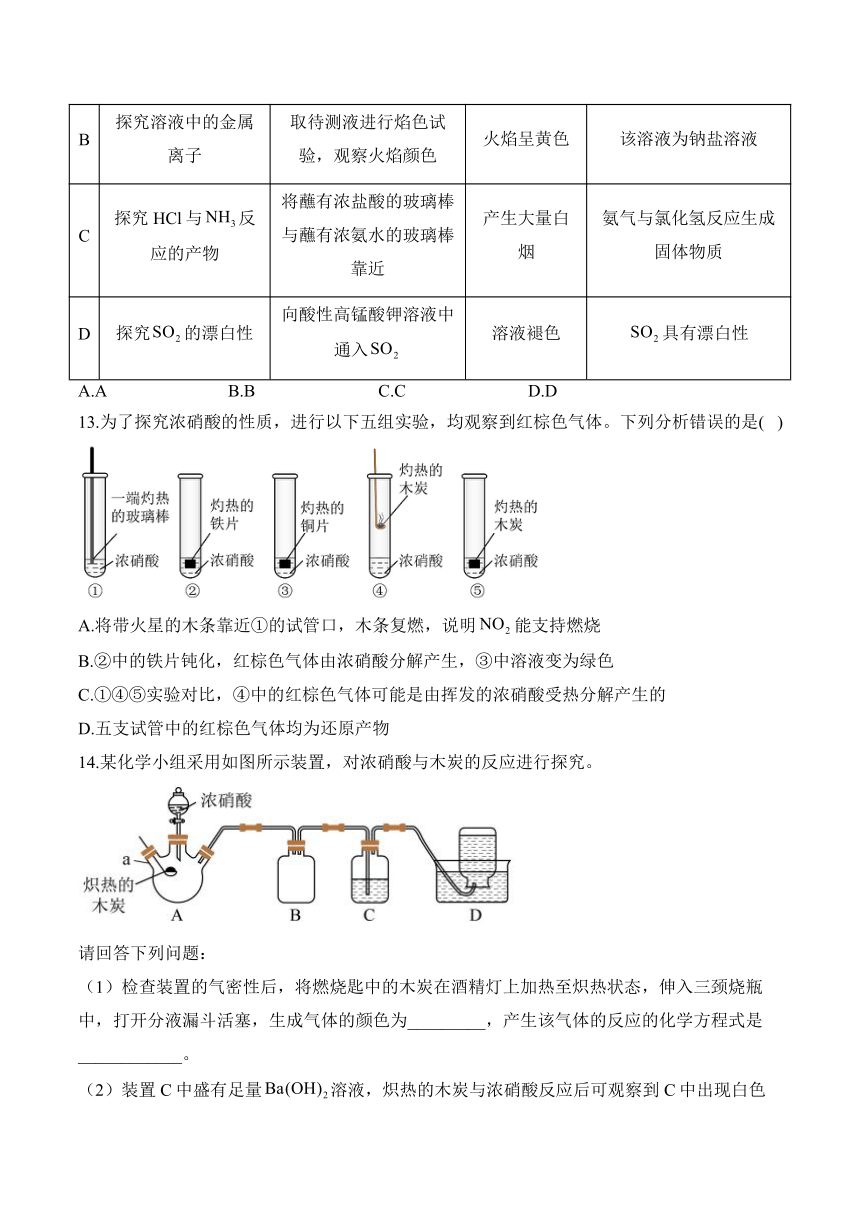
12.根据下列实验目的,实验操作、现象和结论均正确的是( )
实验目的 实验操作 现象 结论
A 探究与碱性强弱 向溶液中逐滴加入稀氨水至过量 产生白色沉淀,后慢慢溶解 碱性:
B 探究溶液中的金属离子 取待测液进行焰色试验,观察火焰颜色 火焰呈黄色 该溶液为钠盐溶液
C 探究HCl与反应的产物 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨气与氯化氢反应生成固体物质
D 探究的漂白性 向酸性高锰酸钾溶液中通入 溶液褪色 具有漂白性
A.A B.B C.C D.D
13.为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是( )
A.将带火星的木条靠近①的试管口,木条复燃,说明能支持燃烧
B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
D.五支试管中的红棕色气体均为还原产物
14.某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究。
请回答下列问题:
(1)检查装置的气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,打开分液漏斗活塞,生成气体的颜色为_________,产生该气体的反应的化学方程式是____________。
(2)装置C中盛有足量溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为_________(填化学式)。
(3)装置B的作用是__________________。
(4)装置D中收集到无色气体,有同学认为是NO,还有同学认为是。
①下列对该气体的检验方法合适的是__________(填字母)。
A.向装置D中集气瓶内通入,观察气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果装置D中集气瓶内收集到的无色气体是,则的来源是__________________。
15.五水硫酸铜在化工,农业,医药,食品等方面均有广泛的用途,实验室制备方法如下:
(1)制备硫酸铜溶液
称取3.0g铜粉放入双颈烧瓶中,加入11.0mL溶液,再分批缓慢加入浓,待反应缓和后水浴加热。在加热过程中补加溶液和1.0 mL浓硝酸。
①仪器甲的名称是_________,硝酸的主要作用是_________。
②分批加入硝酸的主要原因是_________。
③实验过程中,观察到有_________气体生成,NaOH溶液的作用是吸收_________和_________。
(2)制得五水硫酸铜粗品待Cu接近于全部溶解后,趁热用倾析法将溶液转至小烧杯中,然后通过“相关操作”得到粗五水硫酸铜晶体。
①趁热用倾析法转移溶液的目的是_________、_________。
②通过“相关操作”得到粗五水硫酸铜晶体,其中“相关操作”是指将溶液转至蒸发皿中,水浴加热,________________。
③如果水浴加热时温度过高,得到的晶体颜色会偏白,原因是________(用化学方程式表示)。
答案以及解析
1.答案:A
解析:棕色试剂瓶一般保存的是见光易分解的物质,A.浓硝酸见光易分解,需要保存在棕色试剂瓶中,故A正确;B.浓硫酸见光不易分解,不需要保存在棕色试剂瓶中,故B错误;C.碳酸钠溶液见光不易分解,不需要保存在棕色试剂瓶中,故C错误;D.硫酸钾溶液见光不易分解,不需要保存在棕色试剂瓶中,故D错误;故选A。
2.答案:D
解析:A.该实验中水中未加入酚酞,故不会产生红色“喷泉”,A错误;
B.氨气极易溶于水,溶于水后会形成压强差,“喷泉”的产生不能证明与水发生了反应,B错误;
C.在水中的溶解度远小于氨气,溶解的量小,压强差也较小,不能产生明显的“喷泉”,C错误;
D.氨气溶于水形成一水合氨,一水合氨为弱电解质,在水中电离出氢氧根使得溶液显碱性,D正确;
故选D。
3.答案:B
解析:过程①有根瘤菌参与催化,不能高温下进行,A错误;过程②是和反应生成,浇水和松土有利于过程②的反应,B正确;过程③中转化为,N的化合价由+3价升高到+5价,作还原剂被氧化,C错误;氮的固定是将空气中游离态的氮转化为含氮化合物的过程,过程④不是氮的固定,D错误。
4.答案:C
解析:A. 分离液态空气制氮气,氮气的状态发生改变,不属于氮的固定,A项不选;
B. 工业合成氨是与在一定条件下反应生成,属于人工固氮,B项不选;
C. 闪电时转化为NO,属于大气固氮,C项选;
D. 豆科作物根瘤菌将转化为属于生物固氮,D项不选;
答案选C。
5.答案:B
解析:A.和NO可在一定条件下可以发生归中反应生成,A正确;
B.工业上通过,,,即来制备,B错误;
C.可通过反应得到氯气,C正确;
D.氨气中的氮-3价,有还原性,氯气有氧化性,两者可在一定条件下反应生成,D正确;
故选B。
6.答案:D
解析:本题考查铜与浓硝酸的反应等。铜与浓硝酸反应生成,离子方程式为,A错误;稀硝酸遇铜片产生气体为无色的NO,该气体遇到空气变为红棕色的,B错误;通过对比实验,向溶液中加入适量硝酸铜,无明显现象,说明硝酸铜对该反应没有催化作用,C错误;通过控制变量,蓝色溶液B中加水稀释后硝酸浓度为的稀硝酸,与初始稀硝酸反应进行对比,反应速率快,只能考虑为溶解的或新生成的起催化作用,D正确。
7.答案:B
解析:与的反应是可逆反应,是红棕色气体,且与反应生成和NO,NO有毒,仅用水吸收和不能消除对空气的污染,A错误;溶于水生成与反应生成可以将氧化成,B正确;使品红溶液褪色是由于的漂白性,C错误;与反应生成和NO,D错误。
8.答案:B
解析:溶于水得到氨水,溶液显碱性,酚酞遇碱性溶液变红,烧瓶中的溶液呈红色,A正确;属于氢化物,不属于碱,B错误;极易溶于水,导致圆底烧瓶内压强小于外界大气压,从而形成喷泉,C、D正确。
9.答案:D
解析:稀硝酸与反应的化学方程式为具有还原性,而稀硝酸具有强氧化性,发生的反应依次为、,A错误;稀硝酸具有强氧化性,与FeO反应生成,与Fe反应不生成,B错误;稀硝酸可以使蓝色石蕊试纸变红,最终不会褪色,而浓硝酸可以使蓝色石蕊试纸先变红后褪色,C错误;浓硝酸不稳定,易分解生成红棕色的气体,气体溶于硝酸而使其溶液呈黄色,D正确。
10.答案:D
解析:A.根据原子守恒,铜单质最终转化为硝酸铜,则三种途径制取相同质量的硝酸铜,所消耗的铜的物质的量相等,故A错误;
B.由分析可知,三种途径消耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗最多,途径②次之,途径③消耗最少,故B错误;
C.根据A项分析可知,三种途径消耗铜的质量相等,则所消耗铜的物质的量也相等:途径①=途径②=途径③,故C错误;
D.根据分析可知,消耗硝酸的质量(或物质的量)不相同,途径①消耗最多,途径②次之,途径③消耗最少,则所消耗硝酸的物质的量:途径①>途径②>途径③,故D正确;
答案选D。
11.答案:B
解析:A.由图可知,i、a、b、c分别为;具有强氧化性,均具有一定的还原性,故在一定条件下均可以发生反应,A正确;
B.e的浓溶液为浓硫酸具有酸性、强氧化性、吸水性;c、f、g分别为浓硫酸能和氨气反应,故不可干燥氨气,B错误;
C.NO与CO在汽车催化转化器中会转化成两种无毒气体氮气和二氧化碳,C正确;
D.h为二氧化氮,能和氢氧化钠反应,实验室中产生的二氧化氮可用NaOH溶液吸收,D正确;
12.答案:C
解析:A.与氨水不反应,故溶液中加入稀氨水至过量,产生白色沉淀并逐渐增多,沉淀不会溶解;故A错误
B.取某待测液进行焰色试验,若火焰呈黄色,说明其中含有Na元素,但不一定是钠盐溶液,也可能是NaOH溶液;故B错误
C.氨气与氯化氢反应生成氯化铵固体小颗粒,产生白烟;故C正确;
D.高锰酸钾和二氧化硫反应,生成无色的,是二氧化硫发生氧化还原反应,不体现二氧化硫的漂白性,故D错误。
答案选C。
13.答案:B
解析:A.灼热的玻璃棒插入浓硝酸中,分解生成、和,分解产生的二氧化氮与氧气为4:1与空气中氮气与氧气比例相当,空气不能复燃,混合气复燃,说明二氧化氮支持燃烧,A正确;
B.灼热的铁片在浓硝酸中发生反应,且生成红棕色的,不能钝化,B错误;
C.浓硝酸具有强挥发性,挥发出的(g)受灼热木炭作用,发生分解反应生成红棕色,C正确;
D.红棕色气体均为,都是被还原生成,均为还原产物,D正确;
故答案为:B。
14.答案:(1)红棕色;
(2)
(3)防倒吸
(4)①AC
②浓硝酸的分解
解析:(1)C与浓硝酸在加热的条件下反应生成、红棕色的和,所以可观察到三颈烧瓶中气体的颜色为红棕色。
(2)装置C中盛有足量溶液,通入其中,发生反应,产生白色沉淀。
(3)根据题图可知,装置B用作安全瓶,防止溶液倒吸。
(4)①A项,NO和反应生成,为红棕色,如果集气瓶内气体是NO,向集气瓶中通入,可以看到集气瓶内气体由无色变为红棕色,对NO气体的检验方法合适;B项,NO不溶于水,与水不反应,湿润的蓝色石蕊试纸不能区别NO和,检验方法不合适;C项,将带火星的木条伸入集气瓶中,观察木条是否复燃,可以判断集气瓶中是否为,对的检验方法合适。
②硝酸在加热的条件下分解产生和,所以的来源是浓硝酸的分解。
15.答案:(1)①分液漏斗;氧化铜粉
②防止反应产生的热效应增加硝酸的挥发量
③红棕色;二氧化氮;一氧化氮
(2)①除去残余固体;防止硫酸铜晶体析出
②浓缩至表面有晶膜出现,取下蒸发皿(或拆去热源),自然冷却,析出粗五水硫酸铜晶体
③
解析:(1)①仪器甲的名称为分液漏斗。铜与稀硫酸不反应,故硝酸的主要作用是氧化铜粉。
②浓硝酸易挥发,分批加入浓硝酸,可以防止反应产生的热效应增加硝酸的挥发量。
③铜和浓硝酸反应产生红棕色气体,随着反应的进行,浓硝酸变稀,产生NO气体,氮氧化物有毒,因此NaOH溶液的作用是吸收和。
(2)①倾析可除去残余固体,而趁热可防止硫酸铜晶体析出。
②由硫酸铜溶液得到粗五水硫酸铜晶体,应使用蒸发浓缩,降温结晶法,故"相关操作"是指将溶液转移至蒸发皿中,水浴加热,浓缩至表面有晶膜出现,取下蒸发皿,自然冷却,析出粗五水硫酸铜晶体。
③如果温度过高,则五水硫酸铜会失去结晶水,得到五水硫酸铜,晶体颜色会偏白,反应的化学方程式为。
1.要用棕色试剂瓶保存的试剂是( )
A.浓硝酸 B.浓硫酸 C.碳酸钠溶液 D.硫酸钾溶液
2.用下图所示装置进行实验,下列说法正确的是( )
A.挤压滴管并打开止水夹后,观察到烧杯中的水倒吸,产生红色“喷泉”
B.“喷泉”的产生能证明与发生了反应
C.若将换成,也能产生明显的“喷泉”
D.实验后,取出烧瓶中的溶液,测得其,原因是:,
3.植物对氮元素的吸收过程如下,下列说法正确的是( )
A.高温有利于加快过程① B.浇水和松土有利于过程②
C.过程③中被还原 D.过程④叫做氮的固定
4.下列过程属于大气固氮的是( )
A.分离液态空气制氮气 B.工业合成氨
C.闪电时转化为NO D.豆科作物根瘤菌将转化为
5.部分含氮及氯物质的价类二维图如下,下列推断不合理的是( )
A.a和c可在一定条件下反应生成b
B.工业上通过a→b→d→e来制备
C.浓的溶液和浓的溶液反应可以得到
D.a和可在一定条件下反应生成b
6.某小组探究Cu与反应,室温下,的稀硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生,向溶液中加入适量硝酸铜,无明显现象;浓硝酸遇铜片立即产生气泡,进一步操作如图:
已知:易溶于水,可部分发生反应。下列说法正确的是( )
A.铜与浓硝酸反应的离子方程式为
B.稀硝酸遇铜片产生气体为无色,该气体遇到空气不变色
C.硝酸铜对稀硝酸与铜反应具有催化作用
D.蓝色溶液B中的或对稀硝酸与铜的反应起催化作用
7.下列关于和的叙述正确的是( )
A.两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染
B.与过量的混合后通入水中能得到两种常用的强酸
C.两种气体都具有强氧化性,因此都能够使品红溶液褪色
D.两种气体溶于水都可以与水反应,且只生成相应的酸
8.如图是喷泉实验装置图,下列说法不正确的是( )
A.烧瓶中的溶液呈红色
B.该实验说明属于碱
C.该实验说明极易溶于水
D.形成喷泉的原因是烧瓶内压强小于外界大气压
9.下列有关硝酸化学性质的叙述正确的是( )
A.稀硝酸能与等盐反应,产生和
B.稀硝酸与FeO反应生成和,与Fe反应生成和
C.浓硝酸、稀硝酸都只能使蓝色石蕊试纸变红
D.浓硝酸因分解放出的又溶解于浓硝酸而呈黄色
10.用以下三种途径来制取相同质量的硝酸铜:①铜跟浓硝酸反应;②铜跟稀硝酸反应;③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量:途径③>途径①>途径②
D.所消耗硝酸的物质的量:途径①>途径②>途径③
11.部分含氮、硫元素的化合物的价-类二维图如图所示。下列关于各物质的说法错误的是( )
A.i在一定条件下均可以与a、b、c发生反应
B.e的浓溶液可用于干燥c、f、g
C.g与CO在汽车催化转化器中会转化成两种无毒气体
D.实验室中产生的h可用NaOH溶液吸收
12.根据下列实验目的,实验操作、现象和结论均正确的是( )
实验目的 实验操作 现象 结论
A 探究与碱性强弱 向溶液中逐滴加入稀氨水至过量 产生白色沉淀,后慢慢溶解 碱性:
B 探究溶液中的金属离子 取待测液进行焰色试验,观察火焰颜色 火焰呈黄色 该溶液为钠盐溶液
C 探究HCl与反应的产物 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨气与氯化氢反应生成固体物质
D 探究的漂白性 向酸性高锰酸钾溶液中通入 溶液褪色 具有漂白性
A.A B.B C.C D.D
13.为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是( )
A.将带火星的木条靠近①的试管口,木条复燃,说明能支持燃烧
B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
D.五支试管中的红棕色气体均为还原产物
14.某化学小组采用如图所示装置,对浓硝酸与木炭的反应进行探究。
请回答下列问题:
(1)检查装置的气密性后,将燃烧匙中的木炭在酒精灯上加热至炽热状态,伸入三颈烧瓶中,打开分液漏斗活塞,生成气体的颜色为_________,产生该气体的反应的化学方程式是____________。
(2)装置C中盛有足量溶液,炽热的木炭与浓硝酸反应后可观察到C中出现白色沉淀,该白色沉淀为_________(填化学式)。
(3)装置B的作用是__________________。
(4)装置D中收集到无色气体,有同学认为是NO,还有同学认为是。
①下列对该气体的检验方法合适的是__________(填字母)。
A.向装置D中集气瓶内通入,观察气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果装置D中集气瓶内收集到的无色气体是,则的来源是__________________。
15.五水硫酸铜在化工,农业,医药,食品等方面均有广泛的用途,实验室制备方法如下:
(1)制备硫酸铜溶液
称取3.0g铜粉放入双颈烧瓶中,加入11.0mL溶液,再分批缓慢加入浓,待反应缓和后水浴加热。在加热过程中补加溶液和1.0 mL浓硝酸。
①仪器甲的名称是_________,硝酸的主要作用是_________。
②分批加入硝酸的主要原因是_________。
③实验过程中,观察到有_________气体生成,NaOH溶液的作用是吸收_________和_________。
(2)制得五水硫酸铜粗品待Cu接近于全部溶解后,趁热用倾析法将溶液转至小烧杯中,然后通过“相关操作”得到粗五水硫酸铜晶体。
①趁热用倾析法转移溶液的目的是_________、_________。
②通过“相关操作”得到粗五水硫酸铜晶体,其中“相关操作”是指将溶液转至蒸发皿中,水浴加热,________________。
③如果水浴加热时温度过高,得到的晶体颜色会偏白,原因是________(用化学方程式表示)。
答案以及解析
1.答案:A
解析:棕色试剂瓶一般保存的是见光易分解的物质,A.浓硝酸见光易分解,需要保存在棕色试剂瓶中,故A正确;B.浓硫酸见光不易分解,不需要保存在棕色试剂瓶中,故B错误;C.碳酸钠溶液见光不易分解,不需要保存在棕色试剂瓶中,故C错误;D.硫酸钾溶液见光不易分解,不需要保存在棕色试剂瓶中,故D错误;故选A。
2.答案:D
解析:A.该实验中水中未加入酚酞,故不会产生红色“喷泉”,A错误;
B.氨气极易溶于水,溶于水后会形成压强差,“喷泉”的产生不能证明与水发生了反应,B错误;
C.在水中的溶解度远小于氨气,溶解的量小,压强差也较小,不能产生明显的“喷泉”,C错误;
D.氨气溶于水形成一水合氨,一水合氨为弱电解质,在水中电离出氢氧根使得溶液显碱性,D正确;
故选D。
3.答案:B
解析:过程①有根瘤菌参与催化,不能高温下进行,A错误;过程②是和反应生成,浇水和松土有利于过程②的反应,B正确;过程③中转化为,N的化合价由+3价升高到+5价,作还原剂被氧化,C错误;氮的固定是将空气中游离态的氮转化为含氮化合物的过程,过程④不是氮的固定,D错误。
4.答案:C
解析:A. 分离液态空气制氮气,氮气的状态发生改变,不属于氮的固定,A项不选;
B. 工业合成氨是与在一定条件下反应生成,属于人工固氮,B项不选;
C. 闪电时转化为NO,属于大气固氮,C项选;
D. 豆科作物根瘤菌将转化为属于生物固氮,D项不选;
答案选C。
5.答案:B
解析:A.和NO可在一定条件下可以发生归中反应生成,A正确;
B.工业上通过,,,即来制备,B错误;
C.可通过反应得到氯气,C正确;
D.氨气中的氮-3价,有还原性,氯气有氧化性,两者可在一定条件下反应生成,D正确;
故选B。
6.答案:D
解析:本题考查铜与浓硝酸的反应等。铜与浓硝酸反应生成,离子方程式为,A错误;稀硝酸遇铜片产生气体为无色的NO,该气体遇到空气变为红棕色的,B错误;通过对比实验,向溶液中加入适量硝酸铜,无明显现象,说明硝酸铜对该反应没有催化作用,C错误;通过控制变量,蓝色溶液B中加水稀释后硝酸浓度为的稀硝酸,与初始稀硝酸反应进行对比,反应速率快,只能考虑为溶解的或新生成的起催化作用,D正确。
7.答案:B
解析:与的反应是可逆反应,是红棕色气体,且与反应生成和NO,NO有毒,仅用水吸收和不能消除对空气的污染,A错误;溶于水生成与反应生成可以将氧化成,B正确;使品红溶液褪色是由于的漂白性,C错误;与反应生成和NO,D错误。
8.答案:B
解析:溶于水得到氨水,溶液显碱性,酚酞遇碱性溶液变红,烧瓶中的溶液呈红色,A正确;属于氢化物,不属于碱,B错误;极易溶于水,导致圆底烧瓶内压强小于外界大气压,从而形成喷泉,C、D正确。
9.答案:D
解析:稀硝酸与反应的化学方程式为具有还原性,而稀硝酸具有强氧化性,发生的反应依次为、,A错误;稀硝酸具有强氧化性,与FeO反应生成,与Fe反应不生成,B错误;稀硝酸可以使蓝色石蕊试纸变红,最终不会褪色,而浓硝酸可以使蓝色石蕊试纸先变红后褪色,C错误;浓硝酸不稳定,易分解生成红棕色的气体,气体溶于硝酸而使其溶液呈黄色,D正确。
10.答案:D
解析:A.根据原子守恒,铜单质最终转化为硝酸铜,则三种途径制取相同质量的硝酸铜,所消耗的铜的物质的量相等,故A错误;
B.由分析可知,三种途径消耗相同质量的铜,但消耗硝酸的质量(或物质的量)不相同,途径①消耗最多,途径②次之,途径③消耗最少,故B错误;
C.根据A项分析可知,三种途径消耗铜的质量相等,则所消耗铜的物质的量也相等:途径①=途径②=途径③,故C错误;
D.根据分析可知,消耗硝酸的质量(或物质的量)不相同,途径①消耗最多,途径②次之,途径③消耗最少,则所消耗硝酸的物质的量:途径①>途径②>途径③,故D正确;
答案选D。
11.答案:B
解析:A.由图可知,i、a、b、c分别为;具有强氧化性,均具有一定的还原性,故在一定条件下均可以发生反应,A正确;
B.e的浓溶液为浓硫酸具有酸性、强氧化性、吸水性;c、f、g分别为浓硫酸能和氨气反应,故不可干燥氨气,B错误;
C.NO与CO在汽车催化转化器中会转化成两种无毒气体氮气和二氧化碳,C正确;
D.h为二氧化氮,能和氢氧化钠反应,实验室中产生的二氧化氮可用NaOH溶液吸收,D正确;
12.答案:C
解析:A.与氨水不反应,故溶液中加入稀氨水至过量,产生白色沉淀并逐渐增多,沉淀不会溶解;故A错误
B.取某待测液进行焰色试验,若火焰呈黄色,说明其中含有Na元素,但不一定是钠盐溶液,也可能是NaOH溶液;故B错误
C.氨气与氯化氢反应生成氯化铵固体小颗粒,产生白烟;故C正确;
D.高锰酸钾和二氧化硫反应,生成无色的,是二氧化硫发生氧化还原反应,不体现二氧化硫的漂白性,故D错误。
答案选C。
13.答案:B
解析:A.灼热的玻璃棒插入浓硝酸中,分解生成、和,分解产生的二氧化氮与氧气为4:1与空气中氮气与氧气比例相当,空气不能复燃,混合气复燃,说明二氧化氮支持燃烧,A正确;
B.灼热的铁片在浓硝酸中发生反应,且生成红棕色的,不能钝化,B错误;
C.浓硝酸具有强挥发性,挥发出的(g)受灼热木炭作用,发生分解反应生成红棕色,C正确;
D.红棕色气体均为,都是被还原生成,均为还原产物,D正确;
故答案为:B。
14.答案:(1)红棕色;
(2)
(3)防倒吸
(4)①AC
②浓硝酸的分解
解析:(1)C与浓硝酸在加热的条件下反应生成、红棕色的和,所以可观察到三颈烧瓶中气体的颜色为红棕色。
(2)装置C中盛有足量溶液,通入其中,发生反应,产生白色沉淀。
(3)根据题图可知,装置B用作安全瓶,防止溶液倒吸。
(4)①A项,NO和反应生成,为红棕色,如果集气瓶内气体是NO,向集气瓶中通入,可以看到集气瓶内气体由无色变为红棕色,对NO气体的检验方法合适;B项,NO不溶于水,与水不反应,湿润的蓝色石蕊试纸不能区别NO和,检验方法不合适;C项,将带火星的木条伸入集气瓶中,观察木条是否复燃,可以判断集气瓶中是否为,对的检验方法合适。
②硝酸在加热的条件下分解产生和,所以的来源是浓硝酸的分解。
15.答案:(1)①分液漏斗;氧化铜粉
②防止反应产生的热效应增加硝酸的挥发量
③红棕色;二氧化氮;一氧化氮
(2)①除去残余固体;防止硫酸铜晶体析出
②浓缩至表面有晶膜出现,取下蒸发皿(或拆去热源),自然冷却,析出粗五水硫酸铜晶体
③
解析:(1)①仪器甲的名称为分液漏斗。铜与稀硫酸不反应,故硝酸的主要作用是氧化铜粉。
②浓硝酸易挥发,分批加入浓硝酸,可以防止反应产生的热效应增加硝酸的挥发量。
③铜和浓硝酸反应产生红棕色气体,随着反应的进行,浓硝酸变稀,产生NO气体,氮氧化物有毒,因此NaOH溶液的作用是吸收和。
(2)①倾析可除去残余固体,而趁热可防止硫酸铜晶体析出。
②由硫酸铜溶液得到粗五水硫酸铜晶体,应使用蒸发浓缩,降温结晶法,故"相关操作"是指将溶液转移至蒸发皿中,水浴加热,浓缩至表面有晶膜出现,取下蒸发皿,自然冷却,析出粗五水硫酸铜晶体。
③如果温度过高,则五水硫酸铜会失去结晶水,得到五水硫酸铜,晶体颜色会偏白,反应的化学方程式为。
同课章节目录
