(1)硫及其化合物——高一化学人教版(2019)暑假作业(含答案)
文档属性
| 名称 | (1)硫及其化合物——高一化学人教版(2019)暑假作业(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 734.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 19:21:22 | ||
图片预览



文档简介
(1)硫及其化合物——高一化学人教版(2019)暑假作业
1.某溶液中可能含有的阴离子有、、等,为了检验其中是否含有,除了溶液外,还需要的试剂是( )
A.氢氧化钠溶液 B.盐酸 C.稀硫酸 D.硝酸银溶液
2.下列物质久置在干燥的空气中,会因化学变化而质量减轻的是( )
A.石碱 B.烧碱 C.浓硫酸 D.粗盐
3.下列一种物质与其他三种物质的颜色不相似也不接近的是( )
A.硫磺 B.过氧化钠 C.氧化亚铁 D.溴化银固体
4.下列有关工业制硫酸的说法正确的是( )
A.一般以硫磺或黄铁矿(主要成分:)为原料
B.鼓入足量的空气,原料可直接转化为
C.用水吸收,可提高吸收效率
D.含的废气经回收可用于制备硫酸
5.在检验的过程中,下列操作正确的是( )
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡溶液,产生白色沉淀,证明有存在
B.先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有存在
D.先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有存在
6.铁基脱硫剂常用于水泥、石化领域中硫化物的脱除,其转化关系如下图所示。
下列说法中,不正确的是( )
A.过程I中,铁元素的化合价降低 B.过程II中,只有硫元素被氧化
C.通过过程I和II,硫元素被脱除 D.可以循环利用
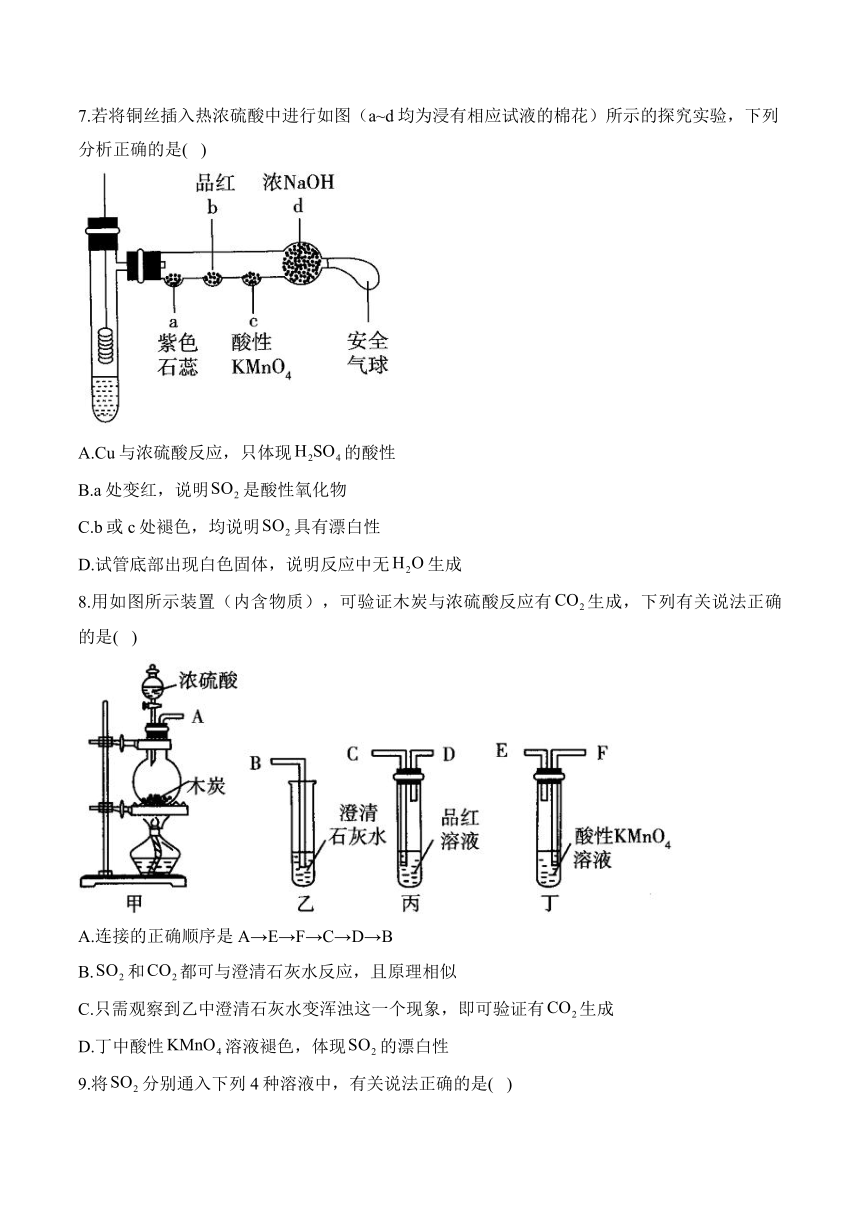
7.若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现的酸性
B.a处变红,说明是酸性氧化物
C.b或c处褪色,均说明具有漂白性
D.试管底部出现白色固体,说明反应中无生成
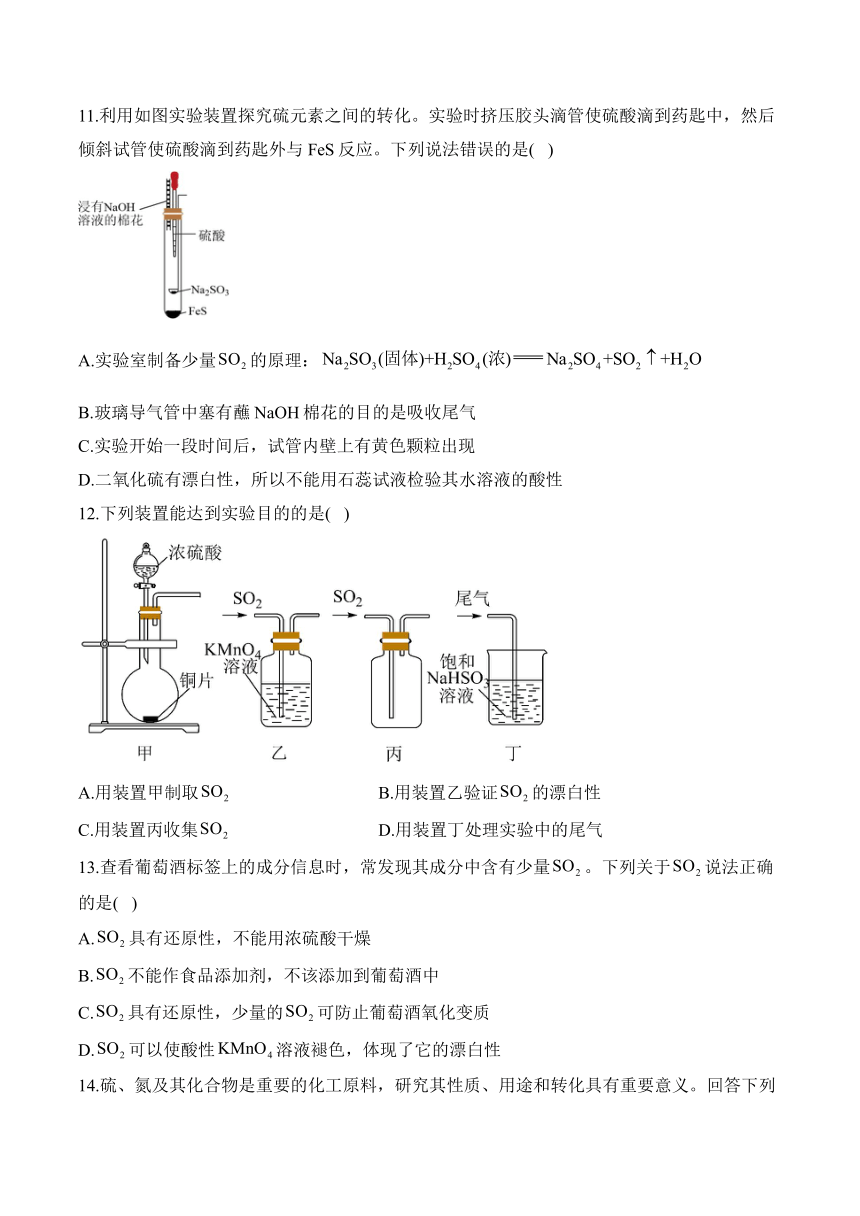
8.用如图所示装置(内含物质),可验证木炭与浓硫酸反应有生成,下列有关说法正确的是( )
A.连接的正确顺序是A→E→F→C→D→B
B.和都可与澄清石灰水反应,且原理相似
C.只需观察到乙中澄清石灰水变浑浊这一个现象,即可验证有生成
D.丁中酸性溶液褪色,体现的漂白性
9.将分别通入下列4种溶液中,有关说法正确的是( )
A.试管a中实验可以证明具有漂白性
B.试管b中溶液褪色,说明具有强氧化性
C.试管c中能产生白色沉淀,说明具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
10.根据下列实验目的,实验操作、现象和结论均正确的是( )
实验目的 实验操作 现象 结论
A 探究与碱性强弱 向溶液中逐滴加入稀氨水至过量 产生白色沉淀,后慢慢溶解 碱性:
B 探究溶液中的金属离子 取待测液进行焰色试验,观察火焰颜色 火焰呈黄色 该溶液为钠盐溶液
C 探究HCl与反应的产物 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨气与氯化氢反应生成固体物质
D 探究的漂白性 向酸性高锰酸钾溶液中通入 溶液褪色 具有漂白性
A.A B.B C.C D.D
11.利用如图实验装置探究硫元素之间的转化。实验时挤压胶头滴管使硫酸滴到药匙中,然后倾斜试管使硫酸滴到药匙外与FeS反应。下列说法错误的是( )
A.实验室制备少量的原理:
B.玻璃导气管中塞有蘸NaOH棉花的目的是吸收尾气
C.实验开始一段时间后,试管内壁上有黄色颗粒出现
D.二氧化硫有漂白性,所以不能用石蕊试液检验其水溶液的酸性
12.下列装置能达到实验目的的是( )
A.用装置甲制取 B.用装置乙验证的漂白性
C.用装置丙收集 D.用装置丁处理实验中的尾气
13.查看葡萄酒标签上的成分信息时,常发现其成分中含有少量。下列关于说法正确的是( )
A.具有还原性,不能用浓硫酸干燥
B.不能作食品添加剂,不该添加到葡萄酒中
C.具有还原性,少量的可防止葡萄酒氧化变质
D.可以使酸性溶液褪色,体现了它的漂白性
14.硫、氮及其化合物是重要的化工原料,研究其性质、用途和转化具有重要意义。回答下列问题:
Ⅰ.氮及其化合物
(1)物质(肼)可作为火箭发动机的燃料,其电子式为_________。
(2)实验室收集X用_________(填“向上”或“向下”)排空气法;常温下,为_________(填颜色)气体。
(3)农业上常用物质R作氮肥,实验室检验物质R中阳离子的方法为_________(写出操作过程和现象)。
(4)氮的氧化物()是常见的大气污染物之一,催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质Y与的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为_________。
Ⅱ.硫及其化合物
以黄铁矿(主要成分为,其中S的化合价为-1价)生产发烟硫酸的工艺流程如图。
(5)黄铁矿进入“沸腾炉”之前一般都会进行粉碎处理,其目的为________。
(6)“接触室”中发生反应的化学方程式为________。
(7)煤和石油在燃烧过程中通常会产生,下列关于的说法正确的是________(填字母)。
A.是一种酸性氧化物
B.能使紫色石蕊试液先变红后褪色
C.过度排放到空气中会引起酸雨
15.利用物质的类别及元素的化合价推测物质的性质是同学们学习化学的重要方法。硫元素的常见化合价与部分物质类别的对应关系如图所示:
(1)X的化学式为_______,X的浓溶液与碳在一定条件下可以发生反应,这一性质体现了X的_______性(填“氧化”或“还原”)。
(2)从硫元素化合价变化的角度分析,图中所含物质中,只表现还原性的有_______和_______(填化学式)。
(3)将与混合可生成淡黄色固体,该反应中氧化产物与还原产物的物质的量之比为_______。
(4)某学习小组用下图所示实验装置制备二氧化硫并研究其性质,用注射器加入浓硫酸,反应一段时间后,观察实验现象。
已知:浓硫酸与亚硫酸钠反应方程式为。下列说法错误的是_______(填字母)。
A.③品红溶液褪色,表现二氧化硫的漂白性
B.④硫化钠溶液中出现淡黄色沉淀,表现二氧化硫的还原性
C.⑤蘸有紫色石蕊试液的棉花变成红色,说明二氧化硫与水反应生成酸
D.⑥蘸有酸性溶液的棉花紫红色褪去,表现二氧化硫的漂白性
(5)溶液在空气中放置一段时间后,部分被氧气氧化,其被氧化后的产物为________(写化学式),检验部分被氧气的实验操作为_______。
答案以及解析
1.答案:B
解析:硫酸根离子的检验原理:,先加入稀盐酸酸化,没有沉淀产生,然后加入溶液,产生白色沉淀,则证明有硫酸根离子,加稀盐酸酸化可以排除碳酸根离子的干扰,因为也是一种不溶于水但能够与稀盐酸反应的白色沉淀;氢氧化钠溶液与三种阴离子都不会反应,加稀硫酸会引入硫酸根,硝酸银与三种阴离子均产生白色沉淀,故ACD都不合题意;故选B。
2.答案:A
解析:A.石碱是十水合碳酸钠,久置于干燥空气中失去结晶水变为碳酸钠,发生了化学变化,质量减轻,A正确;
B.烧碱吸收空气中的二氧化碳,质量增重,B错误;
C.浓硫酸久置于干燥的空气中,质量基本不变,C错误;
D.粗盐久置于干燥的空气中,质量基本不变,D错误;
故选A。
3.答案:C
解析:硫磺、过氧化钠、溴化银固体均为淡黄色,氧化亚铁为黑色,与其他三种物质的颜色不相似也不接近的是氧化亚铁
故选C。
4.答案:D
解析:A.工业制硫酸过程中,一般将硫磺或黄铁矿(主要成分:)为原料在氧气中焙烧生成,A错误:
B.硫磺或黄铁矿和氧气反应生成,不能直接得到,B错误;
C.工业制硫酸过程中,用浓硫酸吸收,可提高吸收效率,避免产生酸雾,C错误;
D.二氧化硫废气经回收后也可用于制备硫酸,避免污染且综合利用,D正确;
故选D。
5.答案:C
解析:A项,先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,溶液中也可能含有或;B项,先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,溶液中也可能含有或;D项,先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,溶液中也可能含有。
6.答案:B
解析:A.过程I中,铁元素的化合价由+3价降低到+2价,故A正确;
B.过程II硫元素和铁元素化合价都升高,都被氧化,故B错误;
C.通过过程I和II,被氧化为S单质除去,故C正确;
D.通过图示得出被循环利用,故D正确;
答案选B。
7.答案:B
解析:Cu与浓硫酸反应生成,体现了硫酸的氧化性,A错误;能使紫色石蕊试液变红说明有酸性物质生成,可以说明是酸性氧化物,B正确;c处褪色,体现了的还原性,C错误;反应后混合液中硫酸浓度很高,浓硫酸吸水,导致生成的不能形成蓝矾,D错误。
8.答案:答案:B
解析:甲中进行浓硫酸和木炭的反应,生成和,本实验要利用澄清石灰水检验二氧化碳,而二氧化硫会影响对二氧化碳的检验,所以需要先用酸性高锰酸钾溶液将二氧化硫除去,然后用品红溶液检验二氧化硫是否除尽,之后再用澄清石灰水检验二氧化碳。根据上述分析可知,正确的连接顺序为A→E→C→D→B,A项错误;二氧化硫、二氧化碳均为酸性氧化物,分别与澄清石灰水反应生成难溶于水的,原理相似,B项正确;二氧化硫会影响对二氧化碳的检验,所以需要先确定二氧化硫是否除尽,当观察到品红溶液不褪色且澄清石灰水变浑浊时证明有生成,C项错误;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化从而使溶液褪色,D项错误。
9.答案:C
解析:A、二氧化硫使酸性高锰酸钾溶液褪色,表现了还原性,选项A错误;
B、品红褪色,说明二氧化硫有漂白性,选项B错误;
C、二氧化硫被硝酸根氧化成硫酸根,生成硫酸钡沉淀,说明二氧化硫有还原性,选项C正确;
D、二氧化硫在碱性条件下反应生成亚硫酸钡,与硝酸反应转化为硫酸钡沉淀,沉淀不溶解,选项D错误;
答案选C。
10.答案:C
解析:A.与氨水不反应,故溶液中加入稀氨水至过量,产生白色沉淀并逐渐增多,沉淀不会溶解;故A错误
B.取某待测液进行焰色试验,若火焰呈黄色,说明其中含有Na元素,但不一定是钠盐溶液,也可能是NaOH溶液;故B错误
C.氨气与氯化氢反应生成氯化铵固体小颗粒,产生白烟;故C正确;
D.高锰酸钾和二氧化硫反应,生成无色的,是二氧化硫发生氧化还原反应,不体现二氧化硫的漂白性,故D错误。
答案选C。
11.答案:D
解析:A.实验室制备少量的原理:,故A正确;
B.和都有毒,且和都能与氢氧化钠反应,玻璃导气管中塞有蘸NaOH溶液的棉花的目的是吸收尾气,防止污染,故B正确;
C.实验开始一段时间后,和在试管内发生归中反应生成S单质和水,所以试管内壁上有黄色颗粒出现,故C正确;
D.二氧化硫的漂白性不会让石蕊试液褪色,故D错误;
故选D。
12.答案:C
解析:A.铜和浓硫酸加热制备二氧化硫,A错误;
B.二氧化硫与高锰酸钾反应体现还原性,B错误;
C.二氧化硫密度比空气大,用向上排空气法收集,C正确;
D.饱和亚硫酸氢钠溶液不能吸收二氧化硫,应选饱和亚硫酸钠溶液或氢氧化钠溶液,D错误;
故选C。
13.答案:C
解析:A.中硫元素显+4价,中硫元素显+6价,同种元素相邻价态之间不发生氧化还原反应,故可以用浓硫酸干燥,故A错误;B.国际食品添加剂联合专家委员会(JECFA)制定的二氧化硫安全摄入限是每天每公斤体重0.7mg。“安全摄入限”的意思是,不超过这个含量的二氧化硫,即使长期食用,也不会带来可见的危害。葡萄酒中添加了少量的用于保鲜,故B错误;C.葡萄酒中加入少量的作用是防止葡萄酒在陈酿和贮藏的过程中被氧化,抑制葡萄汁中微生物的活动,故C正确;D.能与酸性高锰酸钾溶液发生氧化还原反应使酸性高锰酸钾溶液褪色,体现了的还原性,而不是漂白性,故D错误。故选:C。
14.答案:(1)
(2)向下;红棕色
(3)取少量物质R于试管中,加入适量NaOH浓溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝
(4)
(5)增大反应物的接触面积,加快反应速率
(6)
(7)AC
解析:(1)物质N2H4(肼)电子式为;
(2)根据价类二维图知X为,密度比空气小,用向下排空气法;为红棕色气体;
(3)物质R中含有铵根,检验铵根:取少量物质R于试管中,加入适量NaOH浓溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝;
(4)物质Y为NO,Y与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质为氮气和水,该反应的化学方程式为;
(5)黄铁矿进入“沸腾炉”之前一般都会进行粉碎处理,其目的为块状变为粉末状,接触面积增大,反应速率增大;
(6)“接触室”中发生反应的化学方程式为;
(7)A.是酸性氧化物,A项正确;
B.不能漂白紫色石蕊试液,仅能使紫色石蕊试液变红,B项错误;
C.过度排放会引起硫酸型酸雨,C项正确;
故选AC。
15.答案:(1);氧化
(2);
(3)2∶1
(4)BD
(5);取少量该溶液于试管中,先滴加过量稀盐酸,产生能使品红溶液褪色的气体,再滴加溶液,产生白色沉淀
解析:(1)X是S元素形成的+6价的酸,则X是;
浓具有强氧化性,与C在加热时反应产生,在该反应中S元素化合价降低,得到电子,表现强氧化性;
(2)在图示含有S元素的物质中,中的S元素为-2价,处于最低化合价,只能失去电子表现还原性;
(3)将与混合可生成淡黄色固体,反应方程式为:。在该反应中,失去电子被氧化为S单质,得到电子被还原为S单质,所以S既是氧化产物,又是还原产物,在该反应中氧化产物与还原产物的物质的量之比为2:1;
(4)A.二氧化硫具有漂白性,可以使品红溶液褪色,故③中品红溶液褪色,表现二氧化硫的漂白性,A正确;
B.与在溶液中反应产生S单质,使溶液变浑浊,在该反应中表现氧化性,B错误;
C.与石蕊试液中的水反应产生,该物质具有酸性,可以使石蕊试液变为红色,这说明二氧化硫与水反应生成酸,C正确;
D.具有还原性,可以被酸性溶液氧化变为硫酸,酸性溶液被还原为无色,这说明具有还原性,而不是漂白性,D错误;
故合理选项是BD;
(5)溶液在空气中放置一段时间后,部分被氧气氧化,,故其被氧化后的产物为。
可根据是白色既不溶于水,也不溶于酸的物质检验。操作是取少量该溶液于试管中,先滴加过量稀盐酸,产生能使品红溶液褪色的气体,再滴加溶液,若反应产生白色沉淀证明溶液中含有,从而证明被氧气氧化为。
1.某溶液中可能含有的阴离子有、、等,为了检验其中是否含有,除了溶液外,还需要的试剂是( )
A.氢氧化钠溶液 B.盐酸 C.稀硫酸 D.硝酸银溶液
2.下列物质久置在干燥的空气中,会因化学变化而质量减轻的是( )
A.石碱 B.烧碱 C.浓硫酸 D.粗盐
3.下列一种物质与其他三种物质的颜色不相似也不接近的是( )
A.硫磺 B.过氧化钠 C.氧化亚铁 D.溴化银固体
4.下列有关工业制硫酸的说法正确的是( )
A.一般以硫磺或黄铁矿(主要成分:)为原料
B.鼓入足量的空气,原料可直接转化为
C.用水吸收,可提高吸收效率
D.含的废气经回收可用于制备硫酸
5.在检验的过程中,下列操作正确的是( )
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡溶液,产生白色沉淀,证明有存在
B.先加入硝酸钡溶液,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡溶液,产生白色沉淀,证明有存在
D.先加入氯化钡溶液,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有存在
6.铁基脱硫剂常用于水泥、石化领域中硫化物的脱除,其转化关系如下图所示。
下列说法中,不正确的是( )
A.过程I中,铁元素的化合价降低 B.过程II中,只有硫元素被氧化
C.通过过程I和II,硫元素被脱除 D.可以循环利用
7.若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列分析正确的是( )
A.Cu与浓硫酸反应,只体现的酸性
B.a处变红,说明是酸性氧化物
C.b或c处褪色,均说明具有漂白性
D.试管底部出现白色固体,说明反应中无生成
8.用如图所示装置(内含物质),可验证木炭与浓硫酸反应有生成,下列有关说法正确的是( )
A.连接的正确顺序是A→E→F→C→D→B
B.和都可与澄清石灰水反应,且原理相似
C.只需观察到乙中澄清石灰水变浑浊这一个现象,即可验证有生成
D.丁中酸性溶液褪色,体现的漂白性
9.将分别通入下列4种溶液中,有关说法正确的是( )
A.试管a中实验可以证明具有漂白性
B.试管b中溶液褪色,说明具有强氧化性
C.试管c中能产生白色沉淀,说明具有还原性
D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸
10.根据下列实验目的,实验操作、现象和结论均正确的是( )
实验目的 实验操作 现象 结论
A 探究与碱性强弱 向溶液中逐滴加入稀氨水至过量 产生白色沉淀,后慢慢溶解 碱性:
B 探究溶液中的金属离子 取待测液进行焰色试验,观察火焰颜色 火焰呈黄色 该溶液为钠盐溶液
C 探究HCl与反应的产物 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 产生大量白烟 氨气与氯化氢反应生成固体物质
D 探究的漂白性 向酸性高锰酸钾溶液中通入 溶液褪色 具有漂白性
A.A B.B C.C D.D
11.利用如图实验装置探究硫元素之间的转化。实验时挤压胶头滴管使硫酸滴到药匙中,然后倾斜试管使硫酸滴到药匙外与FeS反应。下列说法错误的是( )
A.实验室制备少量的原理:
B.玻璃导气管中塞有蘸NaOH棉花的目的是吸收尾气
C.实验开始一段时间后,试管内壁上有黄色颗粒出现
D.二氧化硫有漂白性,所以不能用石蕊试液检验其水溶液的酸性
12.下列装置能达到实验目的的是( )
A.用装置甲制取 B.用装置乙验证的漂白性
C.用装置丙收集 D.用装置丁处理实验中的尾气
13.查看葡萄酒标签上的成分信息时,常发现其成分中含有少量。下列关于说法正确的是( )
A.具有还原性,不能用浓硫酸干燥
B.不能作食品添加剂,不该添加到葡萄酒中
C.具有还原性,少量的可防止葡萄酒氧化变质
D.可以使酸性溶液褪色,体现了它的漂白性
14.硫、氮及其化合物是重要的化工原料,研究其性质、用途和转化具有重要意义。回答下列问题:
Ⅰ.氮及其化合物
(1)物质(肼)可作为火箭发动机的燃料,其电子式为_________。
(2)实验室收集X用_________(填“向上”或“向下”)排空气法;常温下,为_________(填颜色)气体。
(3)农业上常用物质R作氮肥,实验室检验物质R中阳离子的方法为_________(写出操作过程和现象)。
(4)氮的氧化物()是常见的大气污染物之一,催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质Y与的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为_________。
Ⅱ.硫及其化合物
以黄铁矿(主要成分为,其中S的化合价为-1价)生产发烟硫酸的工艺流程如图。
(5)黄铁矿进入“沸腾炉”之前一般都会进行粉碎处理,其目的为________。
(6)“接触室”中发生反应的化学方程式为________。
(7)煤和石油在燃烧过程中通常会产生,下列关于的说法正确的是________(填字母)。
A.是一种酸性氧化物
B.能使紫色石蕊试液先变红后褪色
C.过度排放到空气中会引起酸雨
15.利用物质的类别及元素的化合价推测物质的性质是同学们学习化学的重要方法。硫元素的常见化合价与部分物质类别的对应关系如图所示:
(1)X的化学式为_______,X的浓溶液与碳在一定条件下可以发生反应,这一性质体现了X的_______性(填“氧化”或“还原”)。
(2)从硫元素化合价变化的角度分析,图中所含物质中,只表现还原性的有_______和_______(填化学式)。
(3)将与混合可生成淡黄色固体,该反应中氧化产物与还原产物的物质的量之比为_______。
(4)某学习小组用下图所示实验装置制备二氧化硫并研究其性质,用注射器加入浓硫酸,反应一段时间后,观察实验现象。
已知:浓硫酸与亚硫酸钠反应方程式为。下列说法错误的是_______(填字母)。
A.③品红溶液褪色,表现二氧化硫的漂白性
B.④硫化钠溶液中出现淡黄色沉淀,表现二氧化硫的还原性
C.⑤蘸有紫色石蕊试液的棉花变成红色,说明二氧化硫与水反应生成酸
D.⑥蘸有酸性溶液的棉花紫红色褪去,表现二氧化硫的漂白性
(5)溶液在空气中放置一段时间后,部分被氧气氧化,其被氧化后的产物为________(写化学式),检验部分被氧气的实验操作为_______。
答案以及解析
1.答案:B
解析:硫酸根离子的检验原理:,先加入稀盐酸酸化,没有沉淀产生,然后加入溶液,产生白色沉淀,则证明有硫酸根离子,加稀盐酸酸化可以排除碳酸根离子的干扰,因为也是一种不溶于水但能够与稀盐酸反应的白色沉淀;氢氧化钠溶液与三种阴离子都不会反应,加稀硫酸会引入硫酸根,硝酸银与三种阴离子均产生白色沉淀,故ACD都不合题意;故选B。
2.答案:A
解析:A.石碱是十水合碳酸钠,久置于干燥空气中失去结晶水变为碳酸钠,发生了化学变化,质量减轻,A正确;
B.烧碱吸收空气中的二氧化碳,质量增重,B错误;
C.浓硫酸久置于干燥的空气中,质量基本不变,C错误;
D.粗盐久置于干燥的空气中,质量基本不变,D错误;
故选A。
3.答案:C
解析:硫磺、过氧化钠、溴化银固体均为淡黄色,氧化亚铁为黑色,与其他三种物质的颜色不相似也不接近的是氧化亚铁
故选C。
4.答案:D
解析:A.工业制硫酸过程中,一般将硫磺或黄铁矿(主要成分:)为原料在氧气中焙烧生成,A错误:
B.硫磺或黄铁矿和氧气反应生成,不能直接得到,B错误;
C.工业制硫酸过程中,用浓硫酸吸收,可提高吸收效率,避免产生酸雾,C错误;
D.二氧化硫废气经回收后也可用于制备硫酸,避免污染且综合利用,D正确;
故选D。
5.答案:C
解析:A项,先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,溶液中也可能含有或;B项,先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,溶液中也可能含有或;D项,先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,溶液中也可能含有。
6.答案:B
解析:A.过程I中,铁元素的化合价由+3价降低到+2价,故A正确;
B.过程II硫元素和铁元素化合价都升高,都被氧化,故B错误;
C.通过过程I和II,被氧化为S单质除去,故C正确;
D.通过图示得出被循环利用,故D正确;
答案选B。
7.答案:B
解析:Cu与浓硫酸反应生成,体现了硫酸的氧化性,A错误;能使紫色石蕊试液变红说明有酸性物质生成,可以说明是酸性氧化物,B正确;c处褪色,体现了的还原性,C错误;反应后混合液中硫酸浓度很高,浓硫酸吸水,导致生成的不能形成蓝矾,D错误。
8.答案:答案:B
解析:甲中进行浓硫酸和木炭的反应,生成和,本实验要利用澄清石灰水检验二氧化碳,而二氧化硫会影响对二氧化碳的检验,所以需要先用酸性高锰酸钾溶液将二氧化硫除去,然后用品红溶液检验二氧化硫是否除尽,之后再用澄清石灰水检验二氧化碳。根据上述分析可知,正确的连接顺序为A→E→C→D→B,A项错误;二氧化硫、二氧化碳均为酸性氧化物,分别与澄清石灰水反应生成难溶于水的,原理相似,B项正确;二氧化硫会影响对二氧化碳的检验,所以需要先确定二氧化硫是否除尽,当观察到品红溶液不褪色且澄清石灰水变浑浊时证明有生成,C项错误;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化从而使溶液褪色,D项错误。
9.答案:C
解析:A、二氧化硫使酸性高锰酸钾溶液褪色,表现了还原性,选项A错误;
B、品红褪色,说明二氧化硫有漂白性,选项B错误;
C、二氧化硫被硝酸根氧化成硫酸根,生成硫酸钡沉淀,说明二氧化硫有还原性,选项C正确;
D、二氧化硫在碱性条件下反应生成亚硫酸钡,与硝酸反应转化为硫酸钡沉淀,沉淀不溶解,选项D错误;
答案选C。
10.答案:C
解析:A.与氨水不反应,故溶液中加入稀氨水至过量,产生白色沉淀并逐渐增多,沉淀不会溶解;故A错误
B.取某待测液进行焰色试验,若火焰呈黄色,说明其中含有Na元素,但不一定是钠盐溶液,也可能是NaOH溶液;故B错误
C.氨气与氯化氢反应生成氯化铵固体小颗粒,产生白烟;故C正确;
D.高锰酸钾和二氧化硫反应,生成无色的,是二氧化硫发生氧化还原反应,不体现二氧化硫的漂白性,故D错误。
答案选C。
11.答案:D
解析:A.实验室制备少量的原理:,故A正确;
B.和都有毒,且和都能与氢氧化钠反应,玻璃导气管中塞有蘸NaOH溶液的棉花的目的是吸收尾气,防止污染,故B正确;
C.实验开始一段时间后,和在试管内发生归中反应生成S单质和水,所以试管内壁上有黄色颗粒出现,故C正确;
D.二氧化硫的漂白性不会让石蕊试液褪色,故D错误;
故选D。
12.答案:C
解析:A.铜和浓硫酸加热制备二氧化硫,A错误;
B.二氧化硫与高锰酸钾反应体现还原性,B错误;
C.二氧化硫密度比空气大,用向上排空气法收集,C正确;
D.饱和亚硫酸氢钠溶液不能吸收二氧化硫,应选饱和亚硫酸钠溶液或氢氧化钠溶液,D错误;
故选C。
13.答案:C
解析:A.中硫元素显+4价,中硫元素显+6价,同种元素相邻价态之间不发生氧化还原反应,故可以用浓硫酸干燥,故A错误;B.国际食品添加剂联合专家委员会(JECFA)制定的二氧化硫安全摄入限是每天每公斤体重0.7mg。“安全摄入限”的意思是,不超过这个含量的二氧化硫,即使长期食用,也不会带来可见的危害。葡萄酒中添加了少量的用于保鲜,故B错误;C.葡萄酒中加入少量的作用是防止葡萄酒在陈酿和贮藏的过程中被氧化,抑制葡萄汁中微生物的活动,故C正确;D.能与酸性高锰酸钾溶液发生氧化还原反应使酸性高锰酸钾溶液褪色,体现了的还原性,而不是漂白性,故D错误。故选:C。
14.答案:(1)
(2)向下;红棕色
(3)取少量物质R于试管中,加入适量NaOH浓溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝
(4)
(5)增大反应物的接触面积,加快反应速率
(6)
(7)AC
解析:(1)物质N2H4(肼)电子式为;
(2)根据价类二维图知X为,密度比空气小,用向下排空气法;为红棕色气体;
(3)物质R中含有铵根,检验铵根:取少量物质R于试管中,加入适量NaOH浓溶液并加热,用镊子夹住一片湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝;
(4)物质Y为NO,Y与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质为氮气和水,该反应的化学方程式为;
(5)黄铁矿进入“沸腾炉”之前一般都会进行粉碎处理,其目的为块状变为粉末状,接触面积增大,反应速率增大;
(6)“接触室”中发生反应的化学方程式为;
(7)A.是酸性氧化物,A项正确;
B.不能漂白紫色石蕊试液,仅能使紫色石蕊试液变红,B项错误;
C.过度排放会引起硫酸型酸雨,C项正确;
故选AC。
15.答案:(1);氧化
(2);
(3)2∶1
(4)BD
(5);取少量该溶液于试管中,先滴加过量稀盐酸,产生能使品红溶液褪色的气体,再滴加溶液,产生白色沉淀
解析:(1)X是S元素形成的+6价的酸,则X是;
浓具有强氧化性,与C在加热时反应产生,在该反应中S元素化合价降低,得到电子,表现强氧化性;
(2)在图示含有S元素的物质中,中的S元素为-2价,处于最低化合价,只能失去电子表现还原性;
(3)将与混合可生成淡黄色固体,反应方程式为:。在该反应中,失去电子被氧化为S单质,得到电子被还原为S单质,所以S既是氧化产物,又是还原产物,在该反应中氧化产物与还原产物的物质的量之比为2:1;
(4)A.二氧化硫具有漂白性,可以使品红溶液褪色,故③中品红溶液褪色,表现二氧化硫的漂白性,A正确;
B.与在溶液中反应产生S单质,使溶液变浑浊,在该反应中表现氧化性,B错误;
C.与石蕊试液中的水反应产生,该物质具有酸性,可以使石蕊试液变为红色,这说明二氧化硫与水反应生成酸,C正确;
D.具有还原性,可以被酸性溶液氧化变为硫酸,酸性溶液被还原为无色,这说明具有还原性,而不是漂白性,D错误;
故合理选项是BD;
(5)溶液在空气中放置一段时间后,部分被氧气氧化,,故其被氧化后的产物为。
可根据是白色既不溶于水,也不溶于酸的物质检验。操作是取少量该溶液于试管中,先滴加过量稀盐酸,产生能使品红溶液褪色的气体,再滴加溶液,若反应产生白色沉淀证明溶液中含有,从而证明被氧气氧化为。
同课章节目录
