(3)化学能与电能的转化——高一化学苏教版(2019)暑假作业(含答案)
文档属性
| 名称 | (3)化学能与电能的转化——高一化学苏教版(2019)暑假作业(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 576.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 19:22:18 | ||
图片预览


文档简介
(3)化学能与电能的转化——高一化学苏教版(2019)暑假作业
1.在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述中正确的是( )
A.铜片上有逸出
B.电子通过导线由铜片流向铁片
C.溶液中的向铁片附近定向迁移
D.铁片发生的反应是
2.“盐水动力”玩具车的电池以镁片,活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为。下列关于该电池的说法中,错误的是( )
A.镁片作为正极
B.食盐水作为电解质溶液
C.电池工作时镁片逐渐被消耗
D.电池工作时实现了化学能向电能的转化
3.将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列关于该装置的说法中,正确的是( )
A.将电能转换为化学能 B.电子由铜片流出
C.锌片是负极 D.铜片逐渐被腐蚀
4.银锌纽扣电池放电时的反应为,下列有关说法中错误的是( )
A.Zn是电池的负极
B.为正极反应物,发生还原反应
C.电解质溶液可能是稀盐酸
D.银锌电池具有体积小,质量轻的优点
5.下列说法中正确的是( )。
A.在原电池中,电子由正极通过导线流向负极
B.在原电池中,还原剂在负极发生氧化反应
C.在电解池中,与电源正极相连的电极是阴极
D.在电解池中,还原剂在阴极发生氧化反应
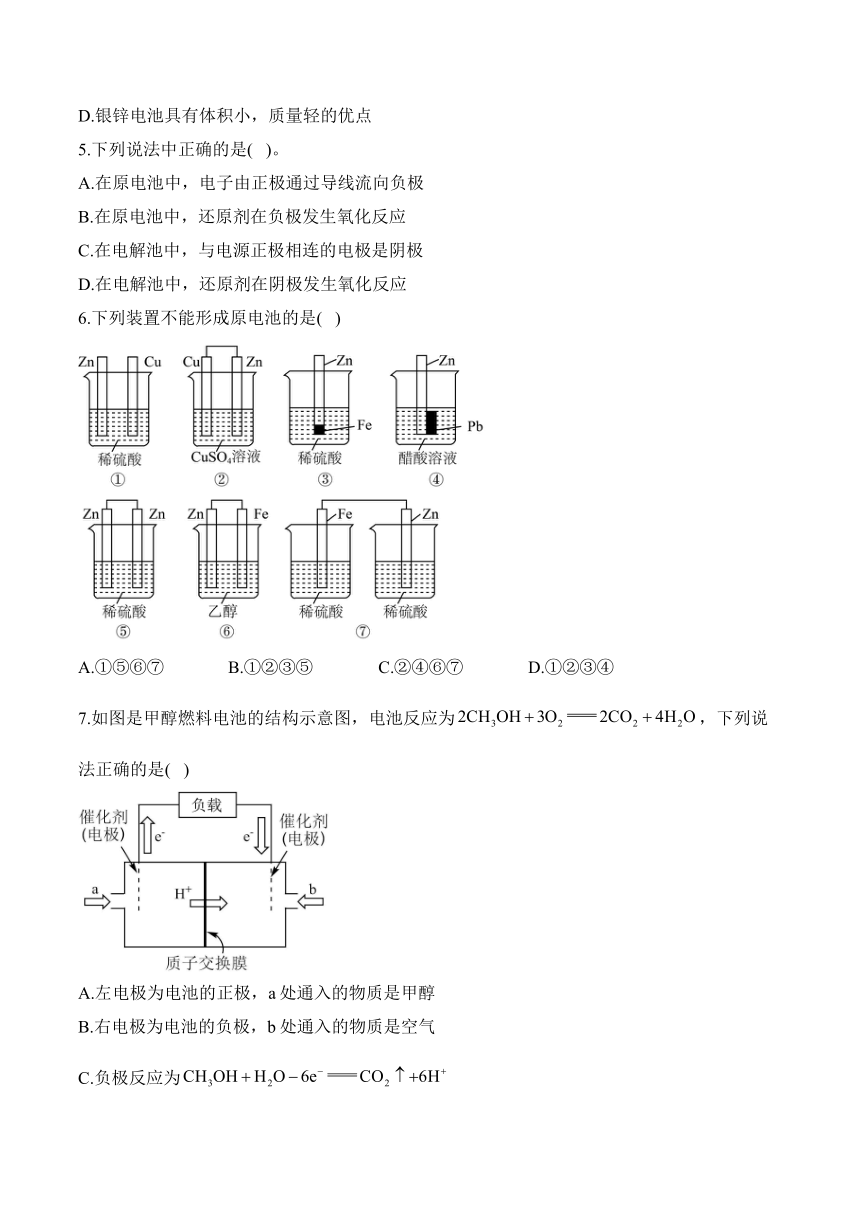
6.下列装置不能形成原电池的是( )
A.①⑤⑥⑦ B.①②③⑤ C.②④⑥⑦ D.①②③④
7.如图是甲醇燃料电池的结构示意图,电池反应为,下列说法正确的是( )
A.左电极为电池的正极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应为
D.正极反应为
8.如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为正极,其附近的溶液变蓝,溶液中有产生
D.如果将稀硫酸换成苹果汁,LED灯将不会发光
9.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在溶液中,铜片质量增加
C.把锌粒放入盛有盐酸的试管中,加入几滴溶液,产生气泡的速率加快
D.把铜片插入溶液中,在铜片表面出现一层铁
10.分析下图所示的四个原电池装置,下列结论中正确的是( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,其电极反应式为
C.③中Fe作负极,电极反应式为
D.④中Cu作正极,电极反应式为
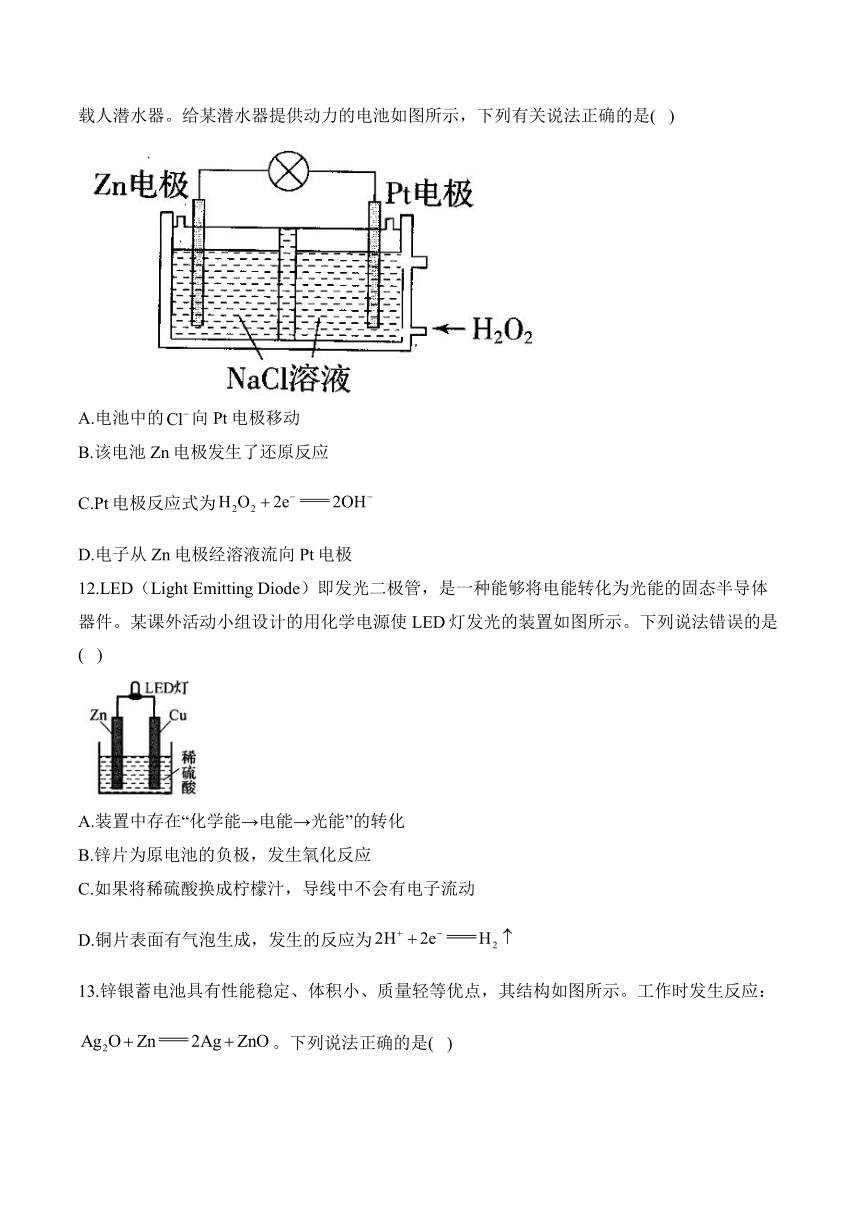
11.蛟龙号载人潜水器由我国自行设计、自主集成研制,是目前世界上下潜能力最深的作业型载人潜水器。给某潜水器提供动力的电池如图所示,下列有关说法正确的是( )
A.电池中的向Pt电极移动
B.该电池Zn电极发生了还原反应
C.Pt电极反应式为
D.电子从Zn电极经溶液流向Pt电极
12.LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。某课外活动小组设计的用化学电源使LED灯发光的装置如图所示。下列说法错误的是( )
A.装置中存在“化学能→电能→光能”的转化
B.锌片为原电池的负极,发生氧化反应
C.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D.铜片表面有气泡生成,发生的反应为
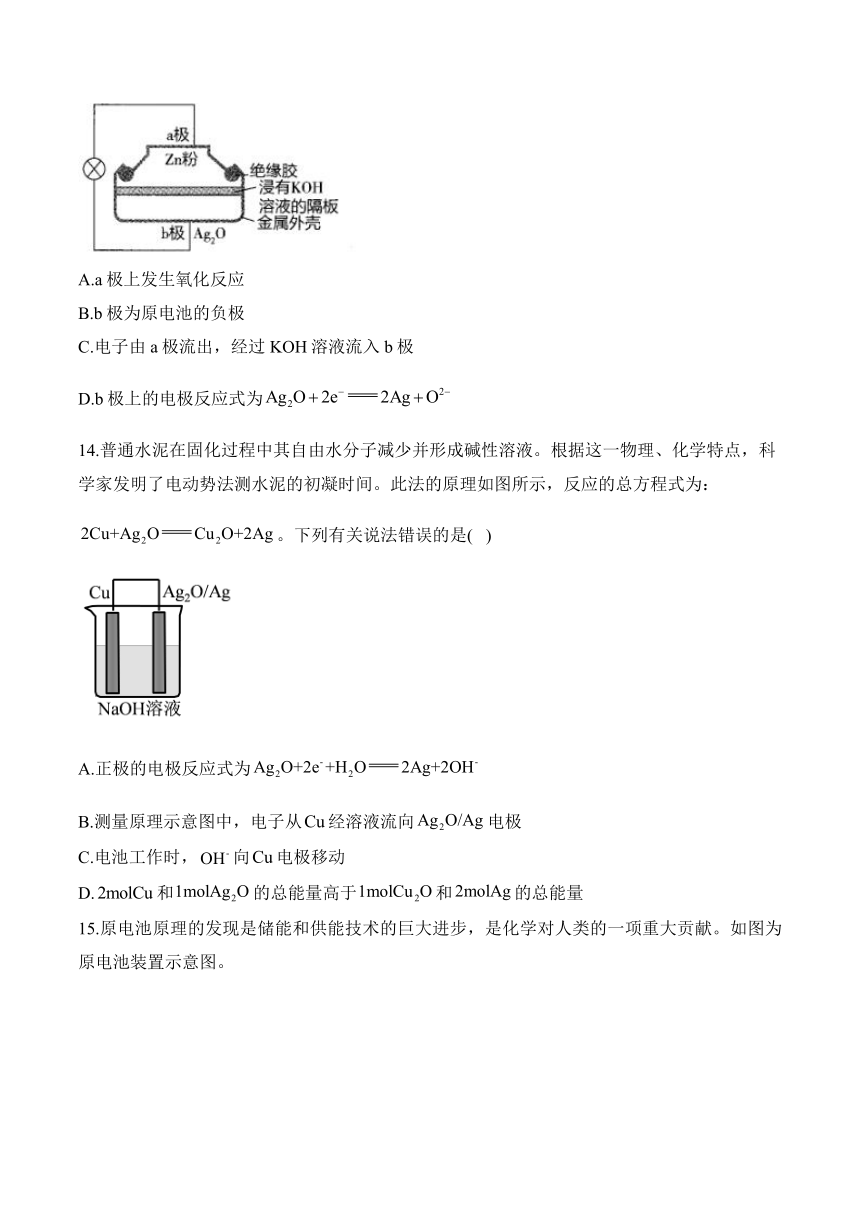
13.锌银蓄电池具有性能稳定、体积小、质量轻等优点,其结构如图所示。工作时发生反应:。下列说法正确的是( )
A.a极上发生氧化反应
B.b极为原电池的负极
C.电子由a极流出,经过KOH溶液流入b极
D.b极上的电极反应式为
14.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:。下列有关说法错误的是( )
A.正极的电极反应式为
B.测量原理示意图中,电子从经溶液流向电极
C.电池工作时,向电极移动
D.和的总能量高于和的总能量
15.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。如图为原电池装置示意图。
(1)若A为Pb,B为,电解质溶液为溶液,放电时电池的总反应为。则该电池在工作时,A电极的质量将________(填“增加”“减小”或“不变”);负极反应式为________。若该电池反应消耗了0.1mol ,则转移电子的数目为________(设为阿伏加德罗常数的值)。
(2)若A、B均为铂片,电解质溶液为KOH溶液,分别从A、B两极通入和,该电池即为甲烷燃料电池,写出A电极反应式:________;该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
答案以及解析
1.答案:A
解析:铜为正极,发生反应,A项正确;铁为负极,铜为正极,电子由负极经外电路流向正极,B项错误;向正极移动,C项错误;负极反应为,D项错误。
2.答案:A
解析:Mg的化合价升高,为负极,A项错误。
3.答案:C
解析:原电池将化学能转化为电能,A项错误;负极为锌,正极为铜,电子由负极流向正极,B项错误,C项正确;正极为得到电子产生,铜不参加反应,D项错误。
4.答案:C
解析:Zn的化合价升高,发生氧化反应,作负极,A项正确;Ag元素化合价降低,则作正极,发生还原反应,B项正确;产物为,则电解质溶液不可能显酸性,C项错误;纽扣电池的质量轻,体积小,D项正确。
5.答案:B
解析:在原电池中,电子由负极通过导线流向正极,还原剂在负极发生氧化反应,A项错误,B项正确;在电解池中,与电源正极相连的电极是阳极,还原剂在阳极发生氧化反应,C、D项错误。
6.答案:A
解析:没有形成闭合回路,不能形成原电池,①选;
Zn比Cu活泼,Zn和硫酸铜能自发进行氧化还原反应,有闭合回路,能形成原电池,②不选;
Zn与Fe、稀硫酸构成闭合回路,Zn与Fe活泼性不同,Zn与能自发进行氧化还原反应,能形成原电池,③不选;
Zn和醋酸能自发进行氧化还原反应,Zn和Pb活泼性不同,有闭合回路,能形成原电池,④不选;
两个电极都是Zn,没有活泼性差异,不能形成原电池,⑤选;
乙醇不能导电,不能形成原电池,⑥选;
未形成闭合回路,不能形成原电池,⑦选;选A。
7.答案:C
解析:根据电子移动方向可知,该装置左侧为负极,燃料甲醇在a通入,发生氧化反应,右侧为正极,氧气在b处发生还原反应。
A.根据分析可知,左电极为电池的负极,a处通入的物质是甲醇,A错误;
B.根据分析可知,右电极为电池的正极,b处通入的物质是空气,B错误;
C.左电极为电池的负极,燃料甲醇在a通入发生氧化反应:,C正确;
D.右侧为正极,氧气在b处发生还原反应:,D错误;
答案选C。
8.答案:A
解析:A.原电池的能量变化为化学能→电能,所以电路中能量转化的形式主要是“化学能→电能→光能”,A正确;
B.稀硫酸原电池中,如果将锌片换成铁片,Cu仍为正极,即电流方向不变,B错误;
C.稀硫酸原电池中,Cu片为正极,C错误;
D.苹果汁呈弱酸性,则与仍然形成原电池,D错误;
9.答案:D
解析:铜片、铁片和稀硫酸构成原电池,铜片作正极,表面发生得电子的还原反应,A正确;铜片作正极,其电极反应式为,生成的Cu在铜片上析出,使其质量增加,B正确;锌粒和溶液发生反应,置换出的Cu与剩余的Zn和盐酸构成原电池,使反应加速,C正确;铜片和溶液发生反应,无铁析出,D错误。
10.答案:B
解析:①中电解质溶液是稀硫酸,由于Mg的金属活泼性比Al强,且可与稀硫酸反应,则Mg作负极;②中电解质溶液是氢氧化钠溶液,Mg不与NaOH反应,Al和NaOH发生氧化还原反应,则Al作负极;③中Cu和浓硝酸反应,Cu作负极;④中Fe失电子作负极,通入的空气中的氧气发生还原反应,Cu作正极。②中Al作负极,③中Cu作负极,A错误;②中Mg作正极,其电极反应式为,B正确;③中Cu作负极,C错误;④中Cu作正极,空气中的氧气在正极上发生还原反应,电极反应式为,D错误。
11.答案:C
解析:A.Pt电极为正极,电池中向负极移动,即向锌电极方向移动,A错误;B.Zn电极发生了氧化反应,B错误;C.Pt电极发生还原反应,反应式为,C正确;D.电子从Zn电极沿导线流向Pt电极,不进入溶液,溶液中为离子的转移,D错误。
12.答案:C
解析:原电池中,化学能转化为电能,LED灯发光时,电能转化为光能,A正确;锌比铜活泼,构成原电池时,锌片为原电池的负极,发生氧化反应,B正确;柠檬汁显酸性,有自由移动的离子存在,也能作电解质溶液,故将稀硫酸换成柠檬汁,仍然可以构成原电池,导线中仍有电子流动,C错误;铜锌原电池中,Cu作正极,溶液中的在正极上得电子生成,正极的电极反应式为,D正确。
13.答案:A
解析:中Zn失电子,所以电子流向为。
A(√)a极为负极,发生氧化反应。
B(×)b极为正极。
C(×)电子不下水,离子不上岸,a极为负极,b极为正极,故电子由a极流出,经过导线流入b极。
D(×)第一步,一剂一产物,由总反应可知,b极反应物为,生成物为Ag,可得→2Ag。
第二步,电子平,→2Ag得,可得。
第三步,电荷平,根据题图中“浸有KOH溶液的隔板”,用调平电荷,可得。
第四步,原子平,用配平H、O,得。
14.答案:B
解析:A.由总反应知得电子变为,则正极的电极反应式为,A正确;
B.失去电子,为负极,则为正极,电子从经外电路流向电极,电子不能通过溶液,B错误;
C.阴离子向负极移动,故向电极移动,C正确;
D.此装置能量转化为化学能转化为电能,即反应物总能量高于生成物总能量,故和的总能量高于和的总能量,D正确;
故答案为B。
15.答案:答案:(1)增加;;
(2);减弱
解析:(1)A为Pb,失去电子后结合溶液中的生成难溶的,故质量会增加,Pb为负极,负极反应式为;由总反应可知消耗2mol时,转移2mol电子,故消耗0.1mol时转移电子的数目为。
(2)碱性条件下电极反应式中不能出现,只能出现;因为电池反应消耗了,生成了水和,故溶液的碱性将减弱。
1.在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述中正确的是( )
A.铜片上有逸出
B.电子通过导线由铜片流向铁片
C.溶液中的向铁片附近定向迁移
D.铁片发生的反应是
2.“盐水动力”玩具车的电池以镁片,活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为。下列关于该电池的说法中,错误的是( )
A.镁片作为正极
B.食盐水作为电解质溶液
C.电池工作时镁片逐渐被消耗
D.电池工作时实现了化学能向电能的转化
3.将锌片和铜片按图示方式插入柠檬中,电流计指针发生偏转。下列关于该装置的说法中,正确的是( )
A.将电能转换为化学能 B.电子由铜片流出
C.锌片是负极 D.铜片逐渐被腐蚀
4.银锌纽扣电池放电时的反应为,下列有关说法中错误的是( )
A.Zn是电池的负极
B.为正极反应物,发生还原反应
C.电解质溶液可能是稀盐酸
D.银锌电池具有体积小,质量轻的优点
5.下列说法中正确的是( )。
A.在原电池中,电子由正极通过导线流向负极
B.在原电池中,还原剂在负极发生氧化反应
C.在电解池中,与电源正极相连的电极是阴极
D.在电解池中,还原剂在阴极发生氧化反应
6.下列装置不能形成原电池的是( )
A.①⑤⑥⑦ B.①②③⑤ C.②④⑥⑦ D.①②③④
7.如图是甲醇燃料电池的结构示意图,电池反应为,下列说法正确的是( )
A.左电极为电池的正极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应为
D.正极反应为
8.如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )
A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为正极,其附近的溶液变蓝,溶液中有产生
D.如果将稀硫酸换成苹果汁,LED灯将不会发光
9.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在溶液中,铜片质量增加
C.把锌粒放入盛有盐酸的试管中,加入几滴溶液,产生气泡的速率加快
D.把铜片插入溶液中,在铜片表面出现一层铁
10.分析下图所示的四个原电池装置,下列结论中正确的是( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,其电极反应式为
C.③中Fe作负极,电极反应式为
D.④中Cu作正极,电极反应式为
11.蛟龙号载人潜水器由我国自行设计、自主集成研制,是目前世界上下潜能力最深的作业型载人潜水器。给某潜水器提供动力的电池如图所示,下列有关说法正确的是( )
A.电池中的向Pt电极移动
B.该电池Zn电极发生了还原反应
C.Pt电极反应式为
D.电子从Zn电极经溶液流向Pt电极
12.LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。某课外活动小组设计的用化学电源使LED灯发光的装置如图所示。下列说法错误的是( )
A.装置中存在“化学能→电能→光能”的转化
B.锌片为原电池的负极,发生氧化反应
C.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D.铜片表面有气泡生成,发生的反应为
13.锌银蓄电池具有性能稳定、体积小、质量轻等优点,其结构如图所示。工作时发生反应:。下列说法正确的是( )
A.a极上发生氧化反应
B.b极为原电池的负极
C.电子由a极流出,经过KOH溶液流入b极
D.b极上的电极反应式为
14.普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:。下列有关说法错误的是( )
A.正极的电极反应式为
B.测量原理示意图中,电子从经溶液流向电极
C.电池工作时,向电极移动
D.和的总能量高于和的总能量
15.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。如图为原电池装置示意图。
(1)若A为Pb,B为,电解质溶液为溶液,放电时电池的总反应为。则该电池在工作时,A电极的质量将________(填“增加”“减小”或“不变”);负极反应式为________。若该电池反应消耗了0.1mol ,则转移电子的数目为________(设为阿伏加德罗常数的值)。
(2)若A、B均为铂片,电解质溶液为KOH溶液,分别从A、B两极通入和,该电池即为甲烷燃料电池,写出A电极反应式:________;该电池在工作一段时间后,溶液的碱性将________(填“增强”“减弱”或“不变”)。
答案以及解析
1.答案:A
解析:铜为正极,发生反应,A项正确;铁为负极,铜为正极,电子由负极经外电路流向正极,B项错误;向正极移动,C项错误;负极反应为,D项错误。
2.答案:A
解析:Mg的化合价升高,为负极,A项错误。
3.答案:C
解析:原电池将化学能转化为电能,A项错误;负极为锌,正极为铜,电子由负极流向正极,B项错误,C项正确;正极为得到电子产生,铜不参加反应,D项错误。
4.答案:C
解析:Zn的化合价升高,发生氧化反应,作负极,A项正确;Ag元素化合价降低,则作正极,发生还原反应,B项正确;产物为,则电解质溶液不可能显酸性,C项错误;纽扣电池的质量轻,体积小,D项正确。
5.答案:B
解析:在原电池中,电子由负极通过导线流向正极,还原剂在负极发生氧化反应,A项错误,B项正确;在电解池中,与电源正极相连的电极是阳极,还原剂在阳极发生氧化反应,C、D项错误。
6.答案:A
解析:没有形成闭合回路,不能形成原电池,①选;
Zn比Cu活泼,Zn和硫酸铜能自发进行氧化还原反应,有闭合回路,能形成原电池,②不选;
Zn与Fe、稀硫酸构成闭合回路,Zn与Fe活泼性不同,Zn与能自发进行氧化还原反应,能形成原电池,③不选;
Zn和醋酸能自发进行氧化还原反应,Zn和Pb活泼性不同,有闭合回路,能形成原电池,④不选;
两个电极都是Zn,没有活泼性差异,不能形成原电池,⑤选;
乙醇不能导电,不能形成原电池,⑥选;
未形成闭合回路,不能形成原电池,⑦选;选A。
7.答案:C
解析:根据电子移动方向可知,该装置左侧为负极,燃料甲醇在a通入,发生氧化反应,右侧为正极,氧气在b处发生还原反应。
A.根据分析可知,左电极为电池的负极,a处通入的物质是甲醇,A错误;
B.根据分析可知,右电极为电池的正极,b处通入的物质是空气,B错误;
C.左电极为电池的负极,燃料甲醇在a通入发生氧化反应:,C正确;
D.右侧为正极,氧气在b处发生还原反应:,D错误;
答案选C。
8.答案:A
解析:A.原电池的能量变化为化学能→电能,所以电路中能量转化的形式主要是“化学能→电能→光能”,A正确;
B.稀硫酸原电池中,如果将锌片换成铁片,Cu仍为正极,即电流方向不变,B错误;
C.稀硫酸原电池中,Cu片为正极,C错误;
D.苹果汁呈弱酸性,则与仍然形成原电池,D错误;
9.答案:D
解析:铜片、铁片和稀硫酸构成原电池,铜片作正极,表面发生得电子的还原反应,A正确;铜片作正极,其电极反应式为,生成的Cu在铜片上析出,使其质量增加,B正确;锌粒和溶液发生反应,置换出的Cu与剩余的Zn和盐酸构成原电池,使反应加速,C正确;铜片和溶液发生反应,无铁析出,D错误。
10.答案:B
解析:①中电解质溶液是稀硫酸,由于Mg的金属活泼性比Al强,且可与稀硫酸反应,则Mg作负极;②中电解质溶液是氢氧化钠溶液,Mg不与NaOH反应,Al和NaOH发生氧化还原反应,则Al作负极;③中Cu和浓硝酸反应,Cu作负极;④中Fe失电子作负极,通入的空气中的氧气发生还原反应,Cu作正极。②中Al作负极,③中Cu作负极,A错误;②中Mg作正极,其电极反应式为,B正确;③中Cu作负极,C错误;④中Cu作正极,空气中的氧气在正极上发生还原反应,电极反应式为,D错误。
11.答案:C
解析:A.Pt电极为正极,电池中向负极移动,即向锌电极方向移动,A错误;B.Zn电极发生了氧化反应,B错误;C.Pt电极发生还原反应,反应式为,C正确;D.电子从Zn电极沿导线流向Pt电极,不进入溶液,溶液中为离子的转移,D错误。
12.答案:C
解析:原电池中,化学能转化为电能,LED灯发光时,电能转化为光能,A正确;锌比铜活泼,构成原电池时,锌片为原电池的负极,发生氧化反应,B正确;柠檬汁显酸性,有自由移动的离子存在,也能作电解质溶液,故将稀硫酸换成柠檬汁,仍然可以构成原电池,导线中仍有电子流动,C错误;铜锌原电池中,Cu作正极,溶液中的在正极上得电子生成,正极的电极反应式为,D正确。
13.答案:A
解析:中Zn失电子,所以电子流向为。
A(√)a极为负极,发生氧化反应。
B(×)b极为正极。
C(×)电子不下水,离子不上岸,a极为负极,b极为正极,故电子由a极流出,经过导线流入b极。
D(×)第一步,一剂一产物,由总反应可知,b极反应物为,生成物为Ag,可得→2Ag。
第二步,电子平,→2Ag得,可得。
第三步,电荷平,根据题图中“浸有KOH溶液的隔板”,用调平电荷,可得。
第四步,原子平,用配平H、O,得。
14.答案:B
解析:A.由总反应知得电子变为,则正极的电极反应式为,A正确;
B.失去电子,为负极,则为正极,电子从经外电路流向电极,电子不能通过溶液,B错误;
C.阴离子向负极移动,故向电极移动,C正确;
D.此装置能量转化为化学能转化为电能,即反应物总能量高于生成物总能量,故和的总能量高于和的总能量,D正确;
故答案为B。
15.答案:答案:(1)增加;;
(2);减弱
解析:(1)A为Pb,失去电子后结合溶液中的生成难溶的,故质量会增加,Pb为负极,负极反应式为;由总反应可知消耗2mol时,转移2mol电子,故消耗0.1mol时转移电子的数目为。
(2)碱性条件下电极反应式中不能出现,只能出现;因为电池反应消耗了,生成了水和,故溶液的碱性将减弱。
同课章节目录
