(3)铁 金属材料——高二化学人教版(2019)暑假作业(含答案)
文档属性
| 名称 | (3)铁 金属材料——高二化学人教版(2019)暑假作业(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 830.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-11 19:27:07 | ||
图片预览



文档简介
(3)铁 金属材料——高二化学人教版(2019)暑假作业
1.下列金属材料中,最适合用于制造飞机部件的是( )
A.镁铝合金 B.铜合金 C.不锈钢 D.铅锡合金
2.下列溶液中,滴加KSCN溶液不变红色的是( )
A.过量的Fe与稀硝酸充分反应后的溶液
B.Fe与过量的稀硝酸充分反应后的溶液
C.FeO溶解于稀硝酸后的溶液
D.敞口放置一段时间的溶液
3.2024年4月,中国空间站迎来两件事情,其中一件事情就是神舟十八号飞船的发射,另一件事情就是神舟十七号飞船返回舱的返航。下列涉及的系列材料中,主要成分为金属的是( )
A.返回舱与推进舱分离时使用的推进剂——液氧和液氢
B.返回舱侧壁壳体——高强度铝合金
C.返回舱减速伞材料——高强度锦纶纤维
D.航天员返回途中穿着的航天服——合成纤维及尼龙膜
4.近年来,我国科技成果显著。下列成果所涉及的材料不属于金属材料的是( )
A. 神舟十九号的耐高温材料——铼合金
B. 超导量子计算机“本源悟空”的芯片材料——铝、铜和铌等
C. 国产大飞机C919发动机的涂层材料——氮化硅
D. 首艘大型邮轮“爱达·魔都号”上层建筑材料——铝合金
5.我国C919大型客机使用了第三代铝锂合金,具有密度低、强度高、耐腐蚀等特点。下列说法不正确的是( )
A.铝锂合金硬度比纯铝大
B.铝锂合金熔点比纯铝低
C.铝为惰性金属,比较耐腐蚀
D.铝有较好的导电性和导热性
6.探究铝的性质实验
Ⅰ Ⅱ
现象:立即产生气泡 现象:开始没气泡一段时间后产生气泡
下列说法不正确的( )
A.从元素化合价角度看,产生的气体只能是
B.实验Ⅰ证明NaOH是氧化剂
C.实验Ⅱ说明具有酸性氧化物的性质
D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同
7.下列有关铁、铁矿石与铁的氧化物的说法正确的是( )
A.在自然界中,不可能有游离态的铁存在
B.赤铁矿的主要成分是,磁铁矿的主要成分是,俗称铁红
C.不稳定,在空气中加热迅速被氧化成
D.铁的氧化物能与酸反应生成盐和水,因此、、都是碱性氧化物
8.下列实验操作能达到实验目的是( )
A.图甲可用于制备氢氧化亚铁
B.图乙可用于制备
C.在托盘天平的左盘上垫上一张洁净的滤纸,准确称量固体置于100mL丙容器中,加水至刻度线,配制的溶液
D.图丁可用于证明能溶于水或与NaOH溶液反应
9.实验室用Fe粉、试剂X、NaOH溶液配制能较长时间内稳定存在的,制备装置如图所示。下列说法正确的是( )
A.NaOH溶液应置于装置I中
B.实验后期要打开止水夹
C.装置II中发生的反应有
D.试剂X可以是稀硫酸或溶液
10.苹果汁是人们喜爱的饮料。由于饮料中含离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使转变为离子。若榨苹果汁时加入维生素C,可有效防止这种现象的发生。下列说法不正确的是( )
A.维生素C起到了抗氧化作用,作还原剂
B.具有还原性能被空气中氧气氧化
C.在维生素C还原的过程中是氧化产物
D.具有氧化性能将维生素C氧化
11.铁黄是一种优质颜料。制备铁黄晶种时,向精制溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至时,开始通入空气,溶液随时间的变化曲线如图。下列分析不正确的是( )
A.产生白色沉淀的离子方程式为
B.发生的主要反应为
C.发生的主要反应为
D.后仅发生反应
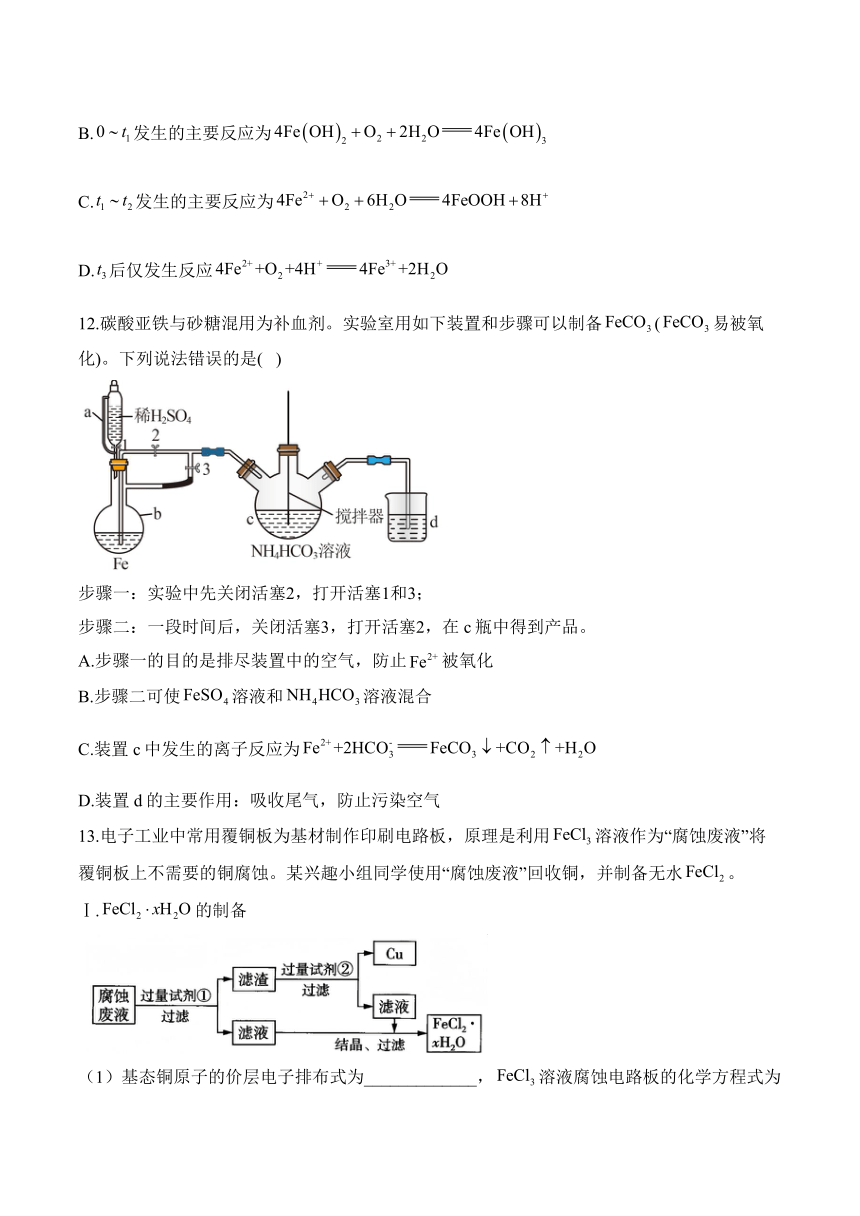
12.碳酸亚铁与砂糖混用为补血剂。实验室用如下装置和步骤可以制备(易被氧化)。下列说法错误的是( )
步骤一:实验中先关闭活塞2,打开活塞1和3;
步骤二:一段时间后,关闭活塞3,打开活塞2,在c瓶中得到产品。
A.步骤一的目的是排尽装置中的空气,防止被氧化
B.步骤二可使溶液和溶液混合
C.装置c中发生的离子反应为
D.装置d的主要作用:吸收尾气,防止污染空气
13.电子工业中常用覆铜板为基材制作印刷电路板,原理是利用溶液作为“腐蚀废液”将覆铜板上不需要的铜腐蚀。某兴趣小组同学使用“腐蚀废液”回收铜,并制备无水。
Ⅰ.的制备
(1)基态铜原子的价层电子排布式为_____________,溶液腐蚀电路板的化学方程式为__________。
(2)试剂①与试剂②依次为__________(填试剂名称)。
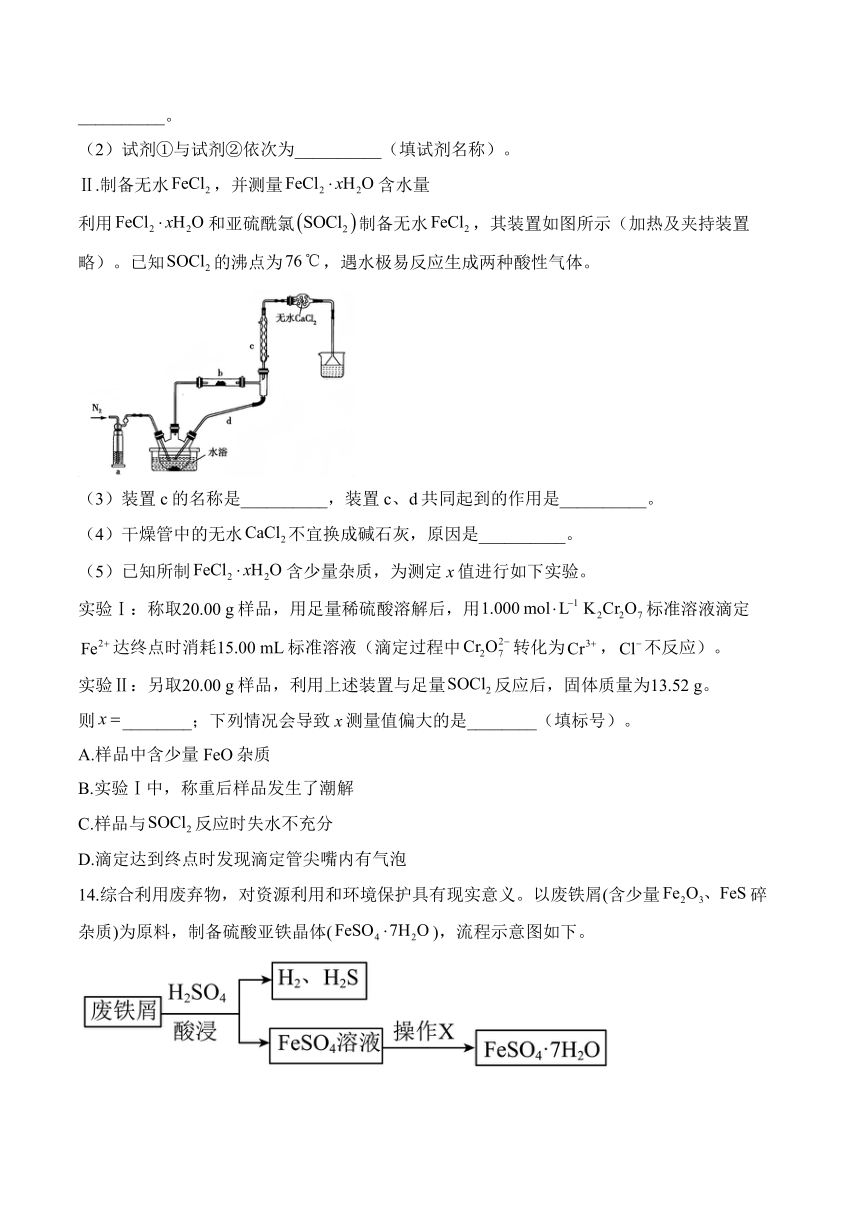
Ⅱ.制备无水,并测量含水量
利用和亚硫酰氯制备无水,其装置如图所示(加热及夹持装置略)。已知的沸点为,遇水极易反应生成两种酸性气体。
(3)装置c的名称是__________,装置c、d共同起到的作用是__________。
(4)干燥管中的无水不宜换成碱石灰,原因是__________。
(5)已知所制含少量杂质,为测定x值进行如下实验。
实验Ⅰ:称取20.00 g样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗15.00 mL标准溶液(滴定过程中转化为,不反应)。
实验Ⅱ:另取20.00 g样品,利用上述装置与足量反应后,固体质量为13.52 g。
则________;下列情况会导致x测量值偏大的是________(填标号)。
A.样品中含少量FeO杂质
B.实验Ⅰ中,称重后样品发生了潮解
C.样品与反应时失水不充分
D.滴定达到终点时发现滴定管尖嘴内有气泡
14.综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量碎杂质)为原料,制备硫酸亚铁晶体(),流程示意图如下。
(1)酸浸过程中,的作用是、、________(用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
酸浸时间 1min 30min 120min
用KSCN溶液检验 变红 未变红 变红
①lmin时检验,溶液变红,说明所得溶液中含有________。
②30min时检验,用离子方程式表示溶液未变红的原因________。
③120min时检验,溶液复又变红,用文字说明原因________。
(3)已知:受热易失水。操作X为:蒸发浓缩、冷却结晶、________。
(4)工业废水中含有的重铬酸根离子()有毒,必须处理达标后才能排放。工业上常用硫酸亚铁晶体做处理剂,反应的离子方程式如下:。在该反应中,氧化剂是________(填离子符号,下同),被氧化的是________。
(5)测定所得硫酸亚铁晶体中的含量,步骤如下:
Ⅰ:称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ:取出10mL溶液,加入适量稀硫酸,滴入bmol/L的溶液,至反应完全共消耗溶液cmL。
①写出氧化的离子方程式________。
②计算硫酸亚铁晶体样品中Fe的质量分数________。
15.作为长沙的传统小吃,臭豆腐深受人们喜爱,而用硫酸亚铁着色是长沙臭豆腐制作的传统工艺。在发酵过程中硫酸亚铁发生自然反应,从而使臭豆腐变成黑色,按照国家标准使用并无危害。某化学兴趣小组利用某工业废铁屑制备食品添加剂,流程图如下:
请回答下列问题:
(1)溶液C中的溶质为_______(填化学式)。
(2)“酸浸”时需加入的试剂为____________,请写出该过程中属于非氧化还原反应的离子方程式:______________。
(3)“灼烧”时需选用的仪器是_______(填序号)。
(4)清设计实验方案证明溶液B中含有:______________。
(5)如图为某浓度溶液放置在空气中时的色度随时间变化的图像(溶液的颜色越深,色度越大),其中在300 s时加入了一定量的维生素C。维生素C使溶液色度减小的原因是______________。
(6)该实验需要用到溶液240 mL,现用NaOH固体进行配制。
①配制时需用托盘天平称量_______gNaOH固体。
②下列说法正确的是_______(填序号)。
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室中可用于长期存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有杂质,会导致所配溶液的浓度偏高
答案以及解析
1.答案:A
解析:镁铝合金密度小、硬度大、耐腐蚀性强,符合制造飞机部件的要求,A正确;铜合金中铜属于重金属、且易生成铜绿,不符合制造飞机部件的要求,B错误;不锈钢属于铁合金,不符合制造飞机部件的要求,C错误;铅锡合金不符合制造飞机部件的要求,D错误。
2.答案:A
解析:过量的铁与稀硝酸反应,,滴加KSCN溶液不变色,A正确;铁与过量的稀硝酸充分反应,,滴加KSCN溶液变血红色,B错误;FeO溶解于稀硝酸,反应的化学方程式为,滴加KSCN溶液变血红色,C错误;敞口放置一段时间的溶液发生反应,滴加KSCN溶液变血红色,D错误。
3.答案:B
解析:返回舱与推进舱分离时使用的推进剂为液氧和液氢,均属于非金属单质,A项不符合题意。返回舱侧壁壳体是高强度铝合金,主要成分铝为金属单质,B项符合题意。返回舱减速伞材料成分为高强度锦纶纤维,属于有机高分子,C项不符合题意。航天员返回途中穿着的航天服主要成分为合成纤维及尼龙膜,属于有机高分子,D项不符合题意。
4.答案: C
解析:A.铼合金是合金材料,属于金属材料,故A不选;
B.铝、铜和铌都属于金属材料,故B不选;
C.氮化硅属于无机非金属材料,不是金属材料故C选;
D.铝合金是合金材料,属于金属材料,故D不选,
答案选C。
5.答案:C
解析:铝为活泼金属,比较耐腐蚀是由于铝与氧气反应生成一层致密的氧化铝薄膜,这层膜起到保护内部金属的作用,C错误:
6.答案:B
解析:A.由图可知,实验Ⅰ和Ⅱ生成气泡的反应都为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,则从元素化合价角度看,产生的气体只能是氢气,故A正确;
B.由图可知,实验Ⅰ中发生的反应为铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,氢氧化钠既不是反应的氧化剂也不是还原剂,故B错误;
C.由图可知,实验Ⅱ中氧化铝发生的反应为氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应中氧化铝表现酸性氧化物的性质,故C正确;
D.由图可知,实验Ⅰ中发生的反应为铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,实验Ⅱ中氧化铝发生的反应为氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水、铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,则实验Ⅰ和Ⅱ反应后所得溶液都是偏铝酸钠溶液,溶液中微粒种类完全相同,故D正确;
故选B。
7.答案:B
解析:A.在地球上,没有游离态的铁存在,但星球爆炸产生的陨铁中,含有游离态的铁,A不正确;
B.磁铁矿的主要成分是磁性氧化铁,化学式为,赤铁矿俗称铁红,其主要成分是,可用于生产红色颜料和红色油漆,B正确;
C.中具有还原性,性质不稳定,在空气中加热易被氧化成,C不正确;
D.、与酸反应都生成盐和水,二者都是碱性氧化物,但与酸反应生成两种盐,不属于碱性氧化物,D不正确;
故选B。
8.答案:D
解析:A.甲装置左边试管可以制备,同时产生,可以将装置中的空气赶出装置,但是应在试管左侧的橡胶管加一个止水夹,而且导管应插入液面以下,才能利用压强差将压入右边的具支试管中与NaOH混合,A错误;
B.制备应先通入使溶液显碱性,再通入,B错误;
C.配制溶液溶解过程应该在小烧杯中进行,不能在容量瓶中溶解,C错误;
D.若能溶于水或与NaOH溶液反应,则烧瓶中压强减小,气球会膨胀,D正确;
故选D。
9.答案:C
解析:A.NaOH溶液应置于Ⅱ中,铁粉和稀置于Ⅰ中,A错误;
B.实验开始要先打开止水夹,用Fe与生成的氢气排装置中的空气,后关闭止水夹,继续生成的使Ⅰ中压强增大,将压入Ⅱ中,B错误;
C.由B知,Ⅱ中发生反应,C正确;
D.可以是稀,不能是,因为,无法生成还原性气体,不能排除装置内的空气,D错误;
故选C。
10.答案:C
解析:该反应中Fe元素化合价由+2价变为+3价,失电子作还原剂,在反应中被氧化;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生,说明维生素C能防止亚铁离子被氧化,则维生素C和亚铁离子的性质相同,都具有还原性。
A.维生素C能防止亚铁离子被氧化,起到了抗氧化作用,作还原剂,故A正确;
B.由于饮料中含离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,说明具有还原性能被空气中氧气氧化,故B正确;
C.在维生素C还原的过程中是还原产物,故C错误;
D.具有氧化性,作氧化剂,维生素C具有还原性,能将维生素C氧化,故D正确;
故选C。
11.答案:D
解析:A.亚铁离子和碱反应生成氢氧化亚铁,产生白色沉淀的离子方程式为,A正确;
B.段,溶液pH随氧气通入基本保持不变,则发生的氧化反应,反应为,B正确;
C.段,溶液pH随氧气通入明显变小,则发生的氧化反应,发生的反应为,C正确;
D.后溶液中pH较小,同时存在两个氧化反应和,D错误;
故选D。
12.答案:D
解析:A.步骤一实验中先关闭活塞2,打开活塞1和3,使产生的氢气通入c装置,的目的是排尽装置中的空气,防止被氧化,故A正确;
B.步骤二反应一段时间后,关闭活塞3,打开活塞2,产生的氢气使b装置内压强增大,将产生的溶液压入c,和溶液混合,故B正确;
C.装置c中发生的离子反应为,故C正确;
D.装置d的主要作用是液封,防止空气进入c装置,将产物氧化,故D错误;
故答案为D
13.答案:(1);
(2)铁;盐酸
(3)球形冷凝管;冷凝回流
(4)碱石灰与气体反应,失去干燥作用
(5)4;D
解析:(1)铜是29号元素,根据构造原理知,基态铜原子的价层电子排布式为。能将Cu氧化为,自身被还原为,根据得失电子守恒、原子守恒配平化学方程式。
(2)腐蚀废液中含有和,根据从滤渣中得到Cu知,加入的试剂①为Fe,过量的Fe将分别转化为,故滤渣中含有Cu和Fe,滤液中含有,向滤渣中加入过量盐酸,Fe溶解生成,过滤得到Cu,滤液结晶、过滤后得到。
(3)装置c是球形冷凝管;由的沸点较低知,球形冷凝管与d相连,可以起到冷凝回流的作用。
(4)遇水生成的酸性气体、HCl均可与碱石灰反应,使碱石灰失去干燥作用。
(5)滴定过程中将氧化成,自身被还原成,结合得失电子守恒、原子守恒、电荷守恒可得反应的离子方程式为,则20.00 g样品中,样品中结晶水的质量为,物质的量为,,则。样品中含少量FeO杂质,则测得的样品中的的量偏大,会导致x的测量值偏小,A项不符合题意;实验Ⅰ样品称重后发生潮解,对消耗的溶液的量无影响,则测得的x的值不变,B项不符合题意;样品与反应时失水不充分,则剩余固体质量偏大,使x的测量值偏小,C项不符合题意;达到滴定终点时发现滴定管尖嘴内有气泡,则读取的溶液的体积较实际体积偏小,测得的的量偏小,故x的测量值偏大,D项符合题意。
14.答案:(1)
(2);;空气中氧气具有氧化性,能把亚铁离子氧化为铁离子
(3)过滤
(4);
(5);或
解析:(1)酸浸过程中,氧化铁和稀硫酸反应生成硫酸铁和水,反应的离子方程式为;
(2)①铁离子会和KSCN溶液反应变红色;1min时检验,溶液变红,说明所得溶液中含有;
②铁离子会和铁单质反应生成亚铁离子,故30min时检验,溶液未变红的原因为:;
③空气中氧气具有氧化性,能把亚铁离子氧化为铁离子,故120min时检验,溶液复又变红;
(3)由于受热易失水,故操作X:蒸发浓缩、冷却结晶、过滤;
(4))在中,Fe的化合价由+2升高到+3,Cr的化合价由+6降低到+3,故该反应中,氧化剂是,被氧化的是;
(5)①亚铁离子和高锰酸根离子生成铁离子、锰离子和水,反应为;
②由方程式体现的关系可知,硫酸亚铁晶体样品中的质量分数。
15.答案:(1)
(2)稀硫酸;
(3)B
(4)取少量溶液B于试管中,滴加少量酸性高锰酸钾溶液,溶液紫色褪去,说明溶液B中含
(5)维生素C具有还原性,被维生素C还原为
(6)①5.0
②AE
解析:(1)由上述分析可知,溶液C中的溶质为、NaOH。
(2)“酸浸”时需加入的试剂是稀硫酸,该过程中与的反应()不属于氧化还原反应。
(3)“灼烧”时应选用坩埚。
(4)具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应而使之褪色,可据此证明溶液B中含有。因溶液B中还存在,故不可先加KSCN溶液再加少量氯水来检验溶液B中的。
(5)由图知,300 s前空气中的氧气将氧化成而使色度增大,在300 s时加入维生素C,溶液色度减小,则可推知是维生素C将还原为。
(6)①配制时需选用250 mL容量瓶,则需用托盘天平称量NaOH固体的质量为。
②配制过程中还需注入蒸馏水,故容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用,A项正确;容量瓶只能配制溶液,在实验室中不可用于长期存放试剂,B项错误;配制时,NaOH固体溶解后,应冷却到室温,再进行后续操作,C项错误;定容时若俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高,D项错误;等质量的NaOH、所含Na元素的量:NaOH<,和水反应生成NaOH,可推知称取的NaOH固体中若含有杂质,会导致溶质的物质的量偏大,从而使所配溶液的浓度偏高,E项正确。
1.下列金属材料中,最适合用于制造飞机部件的是( )
A.镁铝合金 B.铜合金 C.不锈钢 D.铅锡合金
2.下列溶液中,滴加KSCN溶液不变红色的是( )
A.过量的Fe与稀硝酸充分反应后的溶液
B.Fe与过量的稀硝酸充分反应后的溶液
C.FeO溶解于稀硝酸后的溶液
D.敞口放置一段时间的溶液
3.2024年4月,中国空间站迎来两件事情,其中一件事情就是神舟十八号飞船的发射,另一件事情就是神舟十七号飞船返回舱的返航。下列涉及的系列材料中,主要成分为金属的是( )
A.返回舱与推进舱分离时使用的推进剂——液氧和液氢
B.返回舱侧壁壳体——高强度铝合金
C.返回舱减速伞材料——高强度锦纶纤维
D.航天员返回途中穿着的航天服——合成纤维及尼龙膜
4.近年来,我国科技成果显著。下列成果所涉及的材料不属于金属材料的是( )
A. 神舟十九号的耐高温材料——铼合金
B. 超导量子计算机“本源悟空”的芯片材料——铝、铜和铌等
C. 国产大飞机C919发动机的涂层材料——氮化硅
D. 首艘大型邮轮“爱达·魔都号”上层建筑材料——铝合金
5.我国C919大型客机使用了第三代铝锂合金,具有密度低、强度高、耐腐蚀等特点。下列说法不正确的是( )
A.铝锂合金硬度比纯铝大
B.铝锂合金熔点比纯铝低
C.铝为惰性金属,比较耐腐蚀
D.铝有较好的导电性和导热性
6.探究铝的性质实验
Ⅰ Ⅱ
现象:立即产生气泡 现象:开始没气泡一段时间后产生气泡
下列说法不正确的( )
A.从元素化合价角度看,产生的气体只能是
B.实验Ⅰ证明NaOH是氧化剂
C.实验Ⅱ说明具有酸性氧化物的性质
D.实验Ⅰ和Ⅱ反应后的溶液中微粒种类完全相同
7.下列有关铁、铁矿石与铁的氧化物的说法正确的是( )
A.在自然界中,不可能有游离态的铁存在
B.赤铁矿的主要成分是,磁铁矿的主要成分是,俗称铁红
C.不稳定,在空气中加热迅速被氧化成
D.铁的氧化物能与酸反应生成盐和水,因此、、都是碱性氧化物
8.下列实验操作能达到实验目的是( )
A.图甲可用于制备氢氧化亚铁
B.图乙可用于制备
C.在托盘天平的左盘上垫上一张洁净的滤纸,准确称量固体置于100mL丙容器中,加水至刻度线,配制的溶液
D.图丁可用于证明能溶于水或与NaOH溶液反应
9.实验室用Fe粉、试剂X、NaOH溶液配制能较长时间内稳定存在的,制备装置如图所示。下列说法正确的是( )
A.NaOH溶液应置于装置I中
B.实验后期要打开止水夹
C.装置II中发生的反应有
D.试剂X可以是稀硫酸或溶液
10.苹果汁是人们喜爱的饮料。由于饮料中含离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,使转变为离子。若榨苹果汁时加入维生素C,可有效防止这种现象的发生。下列说法不正确的是( )
A.维生素C起到了抗氧化作用,作还原剂
B.具有还原性能被空气中氧气氧化
C.在维生素C还原的过程中是氧化产物
D.具有氧化性能将维生素C氧化
11.铁黄是一种优质颜料。制备铁黄晶种时,向精制溶液中滴加氨水(弱碱),先出现白色沉淀,后变为灰绿色。加氨水至时,开始通入空气,溶液随时间的变化曲线如图。下列分析不正确的是( )
A.产生白色沉淀的离子方程式为
B.发生的主要反应为
C.发生的主要反应为
D.后仅发生反应
12.碳酸亚铁与砂糖混用为补血剂。实验室用如下装置和步骤可以制备(易被氧化)。下列说法错误的是( )
步骤一:实验中先关闭活塞2,打开活塞1和3;
步骤二:一段时间后,关闭活塞3,打开活塞2,在c瓶中得到产品。
A.步骤一的目的是排尽装置中的空气,防止被氧化
B.步骤二可使溶液和溶液混合
C.装置c中发生的离子反应为
D.装置d的主要作用:吸收尾气,防止污染空气
13.电子工业中常用覆铜板为基材制作印刷电路板,原理是利用溶液作为“腐蚀废液”将覆铜板上不需要的铜腐蚀。某兴趣小组同学使用“腐蚀废液”回收铜,并制备无水。
Ⅰ.的制备
(1)基态铜原子的价层电子排布式为_____________,溶液腐蚀电路板的化学方程式为__________。
(2)试剂①与试剂②依次为__________(填试剂名称)。
Ⅱ.制备无水,并测量含水量
利用和亚硫酰氯制备无水,其装置如图所示(加热及夹持装置略)。已知的沸点为,遇水极易反应生成两种酸性气体。
(3)装置c的名称是__________,装置c、d共同起到的作用是__________。
(4)干燥管中的无水不宜换成碱石灰,原因是__________。
(5)已知所制含少量杂质,为测定x值进行如下实验。
实验Ⅰ:称取20.00 g样品,用足量稀硫酸溶解后,用标准溶液滴定达终点时消耗15.00 mL标准溶液(滴定过程中转化为,不反应)。
实验Ⅱ:另取20.00 g样品,利用上述装置与足量反应后,固体质量为13.52 g。
则________;下列情况会导致x测量值偏大的是________(填标号)。
A.样品中含少量FeO杂质
B.实验Ⅰ中,称重后样品发生了潮解
C.样品与反应时失水不充分
D.滴定达到终点时发现滴定管尖嘴内有气泡
14.综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量碎杂质)为原料,制备硫酸亚铁晶体(),流程示意图如下。
(1)酸浸过程中,的作用是、、________(用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
酸浸时间 1min 30min 120min
用KSCN溶液检验 变红 未变红 变红
①lmin时检验,溶液变红,说明所得溶液中含有________。
②30min时检验,用离子方程式表示溶液未变红的原因________。
③120min时检验,溶液复又变红,用文字说明原因________。
(3)已知:受热易失水。操作X为:蒸发浓缩、冷却结晶、________。
(4)工业废水中含有的重铬酸根离子()有毒,必须处理达标后才能排放。工业上常用硫酸亚铁晶体做处理剂,反应的离子方程式如下:。在该反应中,氧化剂是________(填离子符号,下同),被氧化的是________。
(5)测定所得硫酸亚铁晶体中的含量,步骤如下:
Ⅰ:称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ:取出10mL溶液,加入适量稀硫酸,滴入bmol/L的溶液,至反应完全共消耗溶液cmL。
①写出氧化的离子方程式________。
②计算硫酸亚铁晶体样品中Fe的质量分数________。
15.作为长沙的传统小吃,臭豆腐深受人们喜爱,而用硫酸亚铁着色是长沙臭豆腐制作的传统工艺。在发酵过程中硫酸亚铁发生自然反应,从而使臭豆腐变成黑色,按照国家标准使用并无危害。某化学兴趣小组利用某工业废铁屑制备食品添加剂,流程图如下:
请回答下列问题:
(1)溶液C中的溶质为_______(填化学式)。
(2)“酸浸”时需加入的试剂为____________,请写出该过程中属于非氧化还原反应的离子方程式:______________。
(3)“灼烧”时需选用的仪器是_______(填序号)。
(4)清设计实验方案证明溶液B中含有:______________。
(5)如图为某浓度溶液放置在空气中时的色度随时间变化的图像(溶液的颜色越深,色度越大),其中在300 s时加入了一定量的维生素C。维生素C使溶液色度减小的原因是______________。
(6)该实验需要用到溶液240 mL,现用NaOH固体进行配制。
①配制时需用托盘天平称量_______gNaOH固体。
②下列说法正确的是_______(填序号)。
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室中可用于长期存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有杂质,会导致所配溶液的浓度偏高
答案以及解析
1.答案:A
解析:镁铝合金密度小、硬度大、耐腐蚀性强,符合制造飞机部件的要求,A正确;铜合金中铜属于重金属、且易生成铜绿,不符合制造飞机部件的要求,B错误;不锈钢属于铁合金,不符合制造飞机部件的要求,C错误;铅锡合金不符合制造飞机部件的要求,D错误。
2.答案:A
解析:过量的铁与稀硝酸反应,,滴加KSCN溶液不变色,A正确;铁与过量的稀硝酸充分反应,,滴加KSCN溶液变血红色,B错误;FeO溶解于稀硝酸,反应的化学方程式为,滴加KSCN溶液变血红色,C错误;敞口放置一段时间的溶液发生反应,滴加KSCN溶液变血红色,D错误。
3.答案:B
解析:返回舱与推进舱分离时使用的推进剂为液氧和液氢,均属于非金属单质,A项不符合题意。返回舱侧壁壳体是高强度铝合金,主要成分铝为金属单质,B项符合题意。返回舱减速伞材料成分为高强度锦纶纤维,属于有机高分子,C项不符合题意。航天员返回途中穿着的航天服主要成分为合成纤维及尼龙膜,属于有机高分子,D项不符合题意。
4.答案: C
解析:A.铼合金是合金材料,属于金属材料,故A不选;
B.铝、铜和铌都属于金属材料,故B不选;
C.氮化硅属于无机非金属材料,不是金属材料故C选;
D.铝合金是合金材料,属于金属材料,故D不选,
答案选C。
5.答案:C
解析:铝为活泼金属,比较耐腐蚀是由于铝与氧气反应生成一层致密的氧化铝薄膜,这层膜起到保护内部金属的作用,C错误:
6.答案:B
解析:A.由图可知,实验Ⅰ和Ⅱ生成气泡的反应都为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,则从元素化合价角度看,产生的气体只能是氢气,故A正确;
B.由图可知,实验Ⅰ中发生的反应为铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,氢氧化钠既不是反应的氧化剂也不是还原剂,故B错误;
C.由图可知,实验Ⅱ中氧化铝发生的反应为氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应中氧化铝表现酸性氧化物的性质,故C正确;
D.由图可知,实验Ⅰ中发生的反应为铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,实验Ⅱ中氧化铝发生的反应为氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水、铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,则实验Ⅰ和Ⅱ反应后所得溶液都是偏铝酸钠溶液,溶液中微粒种类完全相同,故D正确;
故选B。
7.答案:B
解析:A.在地球上,没有游离态的铁存在,但星球爆炸产生的陨铁中,含有游离态的铁,A不正确;
B.磁铁矿的主要成分是磁性氧化铁,化学式为,赤铁矿俗称铁红,其主要成分是,可用于生产红色颜料和红色油漆,B正确;
C.中具有还原性,性质不稳定,在空气中加热易被氧化成,C不正确;
D.、与酸反应都生成盐和水,二者都是碱性氧化物,但与酸反应生成两种盐,不属于碱性氧化物,D不正确;
故选B。
8.答案:D
解析:A.甲装置左边试管可以制备,同时产生,可以将装置中的空气赶出装置,但是应在试管左侧的橡胶管加一个止水夹,而且导管应插入液面以下,才能利用压强差将压入右边的具支试管中与NaOH混合,A错误;
B.制备应先通入使溶液显碱性,再通入,B错误;
C.配制溶液溶解过程应该在小烧杯中进行,不能在容量瓶中溶解,C错误;
D.若能溶于水或与NaOH溶液反应,则烧瓶中压强减小,气球会膨胀,D正确;
故选D。
9.答案:C
解析:A.NaOH溶液应置于Ⅱ中,铁粉和稀置于Ⅰ中,A错误;
B.实验开始要先打开止水夹,用Fe与生成的氢气排装置中的空气,后关闭止水夹,继续生成的使Ⅰ中压强增大,将压入Ⅱ中,B错误;
C.由B知,Ⅱ中发生反应,C正确;
D.可以是稀,不能是,因为,无法生成还原性气体,不能排除装置内的空气,D错误;
故选C。
10.答案:C
解析:该反应中Fe元素化合价由+2价变为+3价,失电子作还原剂,在反应中被氧化;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生,说明维生素C能防止亚铁离子被氧化,则维生素C和亚铁离子的性质相同,都具有还原性。
A.维生素C能防止亚铁离子被氧化,起到了抗氧化作用,作还原剂,故A正确;
B.由于饮料中含离子,现榨的苹果汁在空气中会由淡绿色变为棕黄色,说明具有还原性能被空气中氧气氧化,故B正确;
C.在维生素C还原的过程中是还原产物,故C错误;
D.具有氧化性,作氧化剂,维生素C具有还原性,能将维生素C氧化,故D正确;
故选C。
11.答案:D
解析:A.亚铁离子和碱反应生成氢氧化亚铁,产生白色沉淀的离子方程式为,A正确;
B.段,溶液pH随氧气通入基本保持不变,则发生的氧化反应,反应为,B正确;
C.段,溶液pH随氧气通入明显变小,则发生的氧化反应,发生的反应为,C正确;
D.后溶液中pH较小,同时存在两个氧化反应和,D错误;
故选D。
12.答案:D
解析:A.步骤一实验中先关闭活塞2,打开活塞1和3,使产生的氢气通入c装置,的目的是排尽装置中的空气,防止被氧化,故A正确;
B.步骤二反应一段时间后,关闭活塞3,打开活塞2,产生的氢气使b装置内压强增大,将产生的溶液压入c,和溶液混合,故B正确;
C.装置c中发生的离子反应为,故C正确;
D.装置d的主要作用是液封,防止空气进入c装置,将产物氧化,故D错误;
故答案为D
13.答案:(1);
(2)铁;盐酸
(3)球形冷凝管;冷凝回流
(4)碱石灰与气体反应,失去干燥作用
(5)4;D
解析:(1)铜是29号元素,根据构造原理知,基态铜原子的价层电子排布式为。能将Cu氧化为,自身被还原为,根据得失电子守恒、原子守恒配平化学方程式。
(2)腐蚀废液中含有和,根据从滤渣中得到Cu知,加入的试剂①为Fe,过量的Fe将分别转化为,故滤渣中含有Cu和Fe,滤液中含有,向滤渣中加入过量盐酸,Fe溶解生成,过滤得到Cu,滤液结晶、过滤后得到。
(3)装置c是球形冷凝管;由的沸点较低知,球形冷凝管与d相连,可以起到冷凝回流的作用。
(4)遇水生成的酸性气体、HCl均可与碱石灰反应,使碱石灰失去干燥作用。
(5)滴定过程中将氧化成,自身被还原成,结合得失电子守恒、原子守恒、电荷守恒可得反应的离子方程式为,则20.00 g样品中,样品中结晶水的质量为,物质的量为,,则。样品中含少量FeO杂质,则测得的样品中的的量偏大,会导致x的测量值偏小,A项不符合题意;实验Ⅰ样品称重后发生潮解,对消耗的溶液的量无影响,则测得的x的值不变,B项不符合题意;样品与反应时失水不充分,则剩余固体质量偏大,使x的测量值偏小,C项不符合题意;达到滴定终点时发现滴定管尖嘴内有气泡,则读取的溶液的体积较实际体积偏小,测得的的量偏小,故x的测量值偏大,D项符合题意。
14.答案:(1)
(2);;空气中氧气具有氧化性,能把亚铁离子氧化为铁离子
(3)过滤
(4);
(5);或
解析:(1)酸浸过程中,氧化铁和稀硫酸反应生成硫酸铁和水,反应的离子方程式为;
(2)①铁离子会和KSCN溶液反应变红色;1min时检验,溶液变红,说明所得溶液中含有;
②铁离子会和铁单质反应生成亚铁离子,故30min时检验,溶液未变红的原因为:;
③空气中氧气具有氧化性,能把亚铁离子氧化为铁离子,故120min时检验,溶液复又变红;
(3)由于受热易失水,故操作X:蒸发浓缩、冷却结晶、过滤;
(4))在中,Fe的化合价由+2升高到+3,Cr的化合价由+6降低到+3,故该反应中,氧化剂是,被氧化的是;
(5)①亚铁离子和高锰酸根离子生成铁离子、锰离子和水,反应为;
②由方程式体现的关系可知,硫酸亚铁晶体样品中的质量分数。
15.答案:(1)
(2)稀硫酸;
(3)B
(4)取少量溶液B于试管中,滴加少量酸性高锰酸钾溶液,溶液紫色褪去,说明溶液B中含
(5)维生素C具有还原性,被维生素C还原为
(6)①5.0
②AE
解析:(1)由上述分析可知,溶液C中的溶质为、NaOH。
(2)“酸浸”时需加入的试剂是稀硫酸,该过程中与的反应()不属于氧化还原反应。
(3)“灼烧”时应选用坩埚。
(4)具有还原性,能与酸性高锰酸钾溶液发生氧化还原反应而使之褪色,可据此证明溶液B中含有。因溶液B中还存在,故不可先加KSCN溶液再加少量氯水来检验溶液B中的。
(5)由图知,300 s前空气中的氧气将氧化成而使色度增大,在300 s时加入维生素C,溶液色度减小,则可推知是维生素C将还原为。
(6)①配制时需选用250 mL容量瓶,则需用托盘天平称量NaOH固体的质量为。
②配制过程中还需注入蒸馏水,故容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用,A项正确;容量瓶只能配制溶液,在实验室中不可用于长期存放试剂,B项错误;配制时,NaOH固体溶解后,应冷却到室温,再进行后续操作,C项错误;定容时若俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高,D项错误;等质量的NaOH、所含Na元素的量:NaOH<,和水反应生成NaOH,可推知称取的NaOH固体中若含有杂质,会导致溶质的物质的量偏大,从而使所配溶液的浓度偏高,E项正确。
同课章节目录
