(1)物质及其变化——高二化学人教版(2019)暑假作业(含答案)
文档属性
| 名称 | (1)物质及其变化——高二化学人教版(2019)暑假作业(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 805.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-13 09:08:12 | ||
图片预览


文档简介
(1)物质及其变化——高二化学人教版(2019)暑假作业
1.下列有关胶体的叙述正确的是( )
A.分散剂只能是液体
B.分散质粒子直径大于100nm
C.可利用丁达尔效应区分溶液和胶体
D.煮沸饱和溶液可以制得胶体
2.下列反应中,不能用离子方程式表示的是( )
A.稀硫酸与硝酸钡溶液反应 B.硫酸钾溶液与氯化钡溶液反应
C.稀硫酸与氢氧化钡溶液反应 D.硫酸钠溶液与硝酸钡溶液反应
3.离子方程式中的代表的物质可以是( )
A. B. C. D.
4.下列事实中,与胶体有关的是( )
A.将植物油倒入水中,用力搅拌形成油水混合物
B.一束可见光射入鸡蛋清液体里,从侧面可以看到一条光亮的“通路”
C.向石灰水中通入二氧化碳产生白色浑浊
D.利用活性炭净水
5.朱自清先生在其名篇《荷塘月色》中对月光下的荷塘有着极其唯美的描写“月光如流水一般,静静地泻在这一片叶子和花上。薄薄的轻雾浮起在荷塘里”。从化学角度分析,“月光”照射在“薄雾”上产生如此美景的本质原因是( )
A.荷塘上的小水滴分散在空气中形成雾,雾属于胶体
B.月光透过薄雾产生了丁达尔效应
C.雾中小水滴的直径是1~100nm
D.月光在小水滴表面发生了散射现象
6.下列各组离子在水溶液中能大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
7.下表中关于物质的分类正确的是( )
酸 碱 盐 碱性氧化物 酸性氧化物 混合物
A 波尔多液
B 冰水混合物
C 氢氧化铁胶体
D. 石墨和金刚石
A.A B.B C.C D.D
8.实验室为测定镁铝合金中镁、铝含量,设计如下流程:
下列说法错误的是( )
A.所加盐酸体积不少于100mL
B.沉淀1的质量为g
C.沉淀1加足量NaOH溶液反应的离子方程式为
D.镁铝合金中镁、铝质量之比为
9.汽车剧烈碰撞时,安全气囊中发生反应。对于该反应,下列判断正确的是( )
A.中氮元素的化合价为-3价
B.氧化剂和还原剂是同一物质
C.氧化产物与还原产物分子数之比为15:1
D.反应过程中转移10个电子,则产生10个分子
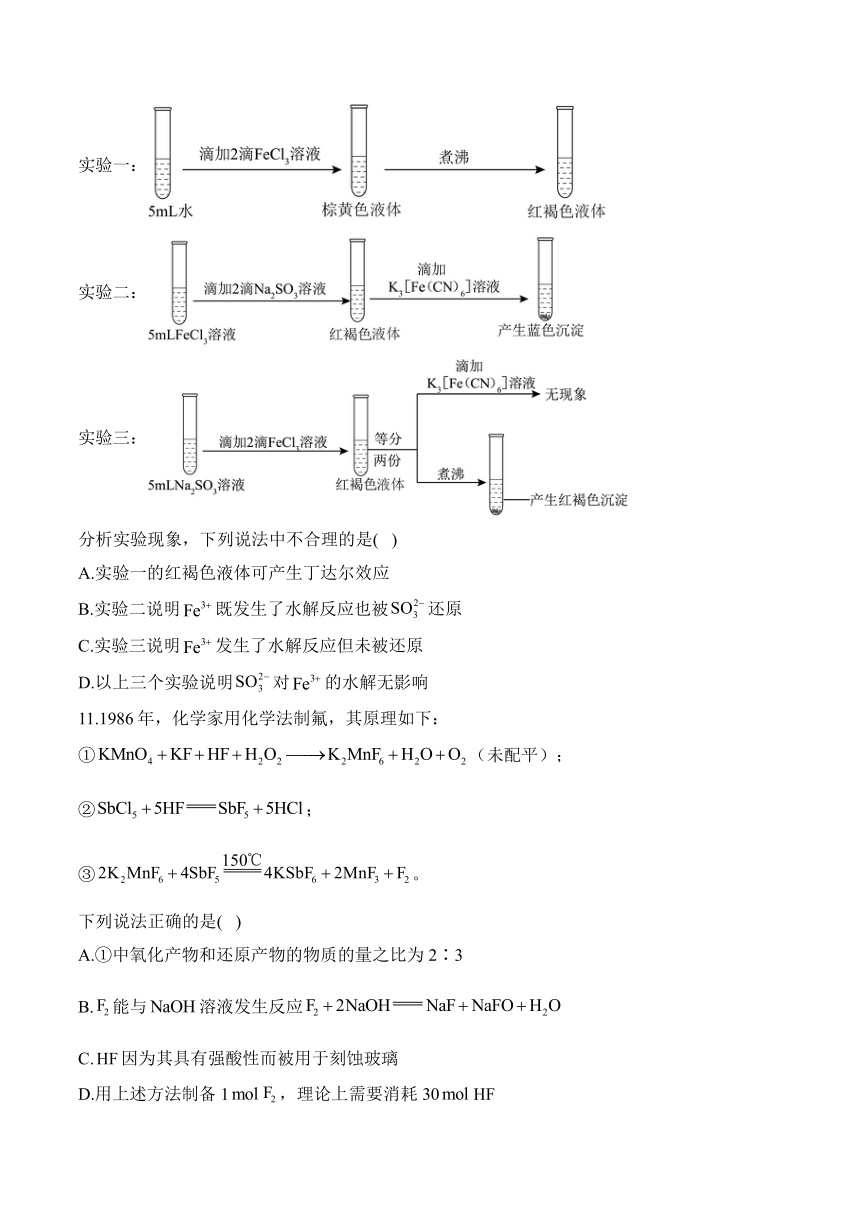
10.某课题组为探究0.1的与溶液反应,进行了如下三个实验:
实验一:
实验二:
实验三:
分析实验现象,下列说法中不合理的是( )
A.实验一的红褐色液体可产生丁达尔效应
B.实验二说明既发生了水解反应也被还原
C.实验三说明发生了水解反应但未被还原
D.以上三个实验说明对的水解无影响
11.1986年,化学家用化学法制氟,其原理如下:
①(未配平);
②;
③。
下列说法正确的是( )
A.①中氧化产物和还原产物的物质的量之比为2∶3
B.能与溶液发生反应
C.因为其具有强酸性而被用于刻蚀玻璃
D.用上述方法制备1,理论上需要消耗30
12.“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知中铁元素是+2价,则其中铬元素是_______价。
(2)明胶的水溶液和溶液共同具备的性质是_______(填序号)。
a.都不稳定,密封放置沉淀
b.分散质粒子可通过滤纸
c.丁达尔效应
(3)制备胶体的离子方程式_______。
(4)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的方法是_______,装置是下列中的_______(填序号)。
(5)现有10mL明胶的水溶液与5mL溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明能够透过半透膜:_______。
13.利用分类法研究化学物质可系统、全面认识物质的性质。
回答下列问题:
I.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、、、CuO
②HCl、、、
③NaOH、、KOH、
(1)三种物质依次是(填化学式):①__________________;②________________;③_______________。
(2)这三种物质相互作用可生成一种新物质,该反应___(填“是”或“不是”)氧化还原反应。
(3)写出与足量稀硫酸反应的离子方程式:__________________。
(4)与、在溶液中都不能大量共存,试用离子方程式说明:________________、_________________。
Ⅱ.现有以下物质:①NaCl晶体、②液态HCl、③固体、④熔融KCl、⑤蔗糖、⑥铜、⑦、⑧、⑨KOH固体。
(1)以上物质中能导电的是_________________(填序号,下同)。
(2)以上物质中属于电解质的是_________________,属于非电解质的是____________。
(3)以上物质中,溶于水能导电的物质是__________。
14.是一种常用化学试剂,在实验和工农业生产领域有着重要的用途。
(1)实验室常用饱和溶液来制备胶体。
已知:常温下,溶解度为90g。
实验Ⅰ:配制20.0g饱和溶液
①该实验需称量固体_______g(保留两位有效数字)。
实验Ⅱ:制备胶体
甲同学取一小烧杯,加入25 mL蒸馏水,加热至沸腾,向沸水中逐滴加入1~2 mL饱和氯化铁溶液,继续煮沸至产生透明的红褐色液体,停止加热。
②写出此过程中的化学方程式:____________________________________。
③乙同学提议用自来水(自来水因用消毒常含有)代替蒸馏水,请回答乙同学的方案是否正确_______(“是”或“否”),原因为_____________________________________。
④除去氢氧化铁胶体中的氯化铁溶液采用的方法是________(填序号)。
A.过滤 B.渗析 C.蒸发
(2)工业上制印刷电路板时常用溶液作“腐蚀液”,原理为用溶液将Cu溶解。高一化学学生兴趣小组根据此原理在覆铜板上制作“我爱化学”字样的图案。
实验Ⅲ:利用覆铜板制作图案
实验原理 用溶液作“腐蚀液”,将覆铜板上不需要的铜腐蚀
实验操作 1.取一小块覆铜板,用油性笔在覆铜板上画出设计好的“化学”图案; 2.将覆铜板浸入盛有溶液的小烧杯中; 3.一段时间后,取出覆铜板并用水清洗干净; 4.观察实验现象,并展示制作的图案
实验现象 用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的“化学”图案
离子方程式 ___________________________________________
实验结论 铜可以被溶液腐蚀
①请写出该反应的离子方程式:____________________________________。
②使用过的“腐蚀液”会失效,但还可以回收利用,其中有一步反应需要将转化为,下列试剂能实现该转化的是________(填序号)。
A.氯气 B.铁 C.铜 D.稀硫酸
答案以及解析
1.答案:C
解析:A.分散剂除了液体,还可以是固体、气体;B.胶体的分散质粒子直径大小在1~100nm;D.制取胶体的正确的操作为向沸水中逐滴加入5~6滴饱和溶液,继续煮沸至液体呈红褐色,停止加热。
2.答案:C
解析:稀硫酸与氢氧化钡溶液反应的离子方程式为,C项符合题意。
3.答案:C
解析:题中代表易溶碳酸盐中的离子,C项正确。
4.答案:B
解析:A项,形成的油水混合物属于乳浊液,与胶体性质无关:B项,是胶体的丁达尔效应:C项,向石灰水中通入二氧化碳气体,得到的是悬浊液,与胶体性质无关:D项,活性炭净水利用的是活性炭的吸附性,与胶体性质无关。
5.答案:C
解析:薄雾是一种胶体,“月光”照射在“薄雾”上,形成丁达尔效应;这是胶体的性质,区分胶体和其他分散系的本质是分散质粒子的直径,胶体分散质粒子的直径是1~100nm,答案选C。
6.答案:B
解析:A.与会反应产生水,不能大量共存,故A错误;
B.离子之间不发生反应,可以大量共存,故B正确;
C.与会发生反应产生硫酸钡沉淀,不能大量共存,故C错误;
D.与会发生反应产生二氧化碳和水,不能大量共存,故D错误;
故答案选B。
7.答案:A
解析:A.HClO为弱酸,NaOH为强碱,为难溶性盐,CaO是对应的碱性氧化物,是碳酸对应的酸性氧化物,波尔多液是将胆矾、石灰乳混合制得的混合物,A正确;
B.虽然是金属氧化物,但它属于酸性氧化物,冰水混合物都是由水分子构成,属于纯净物,B不正确;
C.虽然的俗名叫纯碱,但它属于盐,C不正确;
D.属于盐,NO不能与碱反应,不属于酸性氧化物,D不正确;故选A。
8.答案:B
解析:A.由分析可知,镁铝合金中镁、铝的物质的量都为0.1mol,则溶解合金加入5mol/L盐酸的体积不少于,故A正确;B.由分析可知,镁铝合金中镁、铝的物质的量都为0.1mol,则氢氧化镁、氢氧化铝沉淀的质量之和为,故B错误;C.由分析可知,沉淀1加足量氢氧化钠溶液发生的反应为氢氧化铝与足量氢氧化钠溶液反应生成四羟基合铝酸钠,反应的离子方程式为,故C正确;D.由分析可知,合金中镁、铝质量之比为48:54=8:9,故D正确;故选B。
9.答案:C
解析:根据化合物中各元素正、负化合价的代数和为0知,中N元素的化合价不是-3价,A错误;
中N元素化合价升高,作还原剂,中N元素化合价降低,作氧化剂,氧化剂和还原剂不是同一物质,B错误;
根据化学方程式,10个被氧化,生成的分子数为15,2个被还原,生成的分子数为1,氧化产物与还原产物分子数之比为15:1,C正确;
根据化学方程式,反应过程中转移10个电子,产生16个分子,D错误。
10.答案:D
解析:A.由实验1知,加热溶液,水解生成氢氧化铁的胶体,故可产生丁达尔效应,A正确;
B.实验②过量溶液中滴加少量溶液,溶液变红褐色,说明水解生成氢氧化铁胶体,再滴加铁氰化钾溶液产生蓝色沉淀,说明与发生氧化还原反应生成,B正确;
C.实验③过量溶液中滴加少量溶液,溶液变红褐色说明水解生成氢氧化铁胶体;一份滴加铁氰化钾溶液,无蓝色沉淀生成,说明与没有发生氧化还原反应生成;另一份煮沸产生红褐色沉淀,说明发生了胶体的聚沉;整个过程说明发生了水解反应,但没有发生还原反应,C正确;
D.由BC分析可知,均水解生成氢氧化铁胶体,说明对的水解反应有促进作用,D错误;
故选D。
11.答案:D
解析:A.①中氧化产物为、还原产物为,根据分析可知氧化产物和还原产物的物质的量之比为3∶2,故A错误;
B.会与水反应,,故B错误;
C.HF因为其具有腐蚀性而被用于刻蚀玻璃,反应为:,故C错误;
D.根据分析可知关系式为:、,制备1需要消耗2mol,4mol,而产生2mol需要消耗10molHF,产生4mol需要消耗20molHF,可知制备1,理论上需要消耗30,故D正确;
故答案选D。
12.答案:(1)+3
(2)b
(3)
(4)渗析;E
(5)取烧杯中的少量液体,向其中滴加盐酸,无明显变化,滴加 BaCl2溶液,有白色沉淀产生
解析:(1)根据化合物中元素化合价的代数和等于零计算出铁元素的化合价为+2价。
(2)明胶是水溶性蛋白质混合物,溶于水形成胶体,溶液属于溶液。a.溶液很稳定,a项错误;b.胶体和溶液中的分散质都能透过滤纸,b项正确;c.胶体具有丁达尔效应而溶液没有,c项错误;故选b。
(3)往沸水中滴加饱和溶液可制得胶体,离子方程式:。
(4)明胶是水溶性蛋白质混合物,溶于水形成胶体,提纯明胶的方法是利用胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜的原理,即渗析法;符合题意的操作是图E。
(5)根据题意,若能够透过半透膜,则水溶液中含有,故证明能够透过半透膜的实验方法:取烧杯中的少量液体,向其中滴加盐酸,无明显变化,然后再滴加溶液,有白色沉淀产生。
13.答案:I.(1);;
(2)不是
(3)
(4);
Ⅱ.(1)④⑥
(2)①②③④⑧⑨;⑤⑦
(3)①②④⑦⑧⑨
解析:1.(1)①中是非金属氧化物,其他都是金属氧化物;②中不是酸,其他都是酸;③中是盐,其他都是碱。
(2)化学反应式为,反应中元素没有价态变化,不是氧化还原反应。
(3)是可溶性盐,硫酸是强酸,离子反应中均能拆,所以与足量稀硫酸反应的离子方程式为。
(4)是弱酸的酸式酸根,能与、反应,其离子方程式为、。
Ⅱ.(1)能导电的物质是金属材料、半导体和电解质溶液或熔融状态的电解质,因此以上物质中熔融KCl、铜能导电。
(2)电解质是在水溶液或熔融状态下能导电的化合物,以上物质中①NaCl晶体、②液态HC1、③固体、④熔融KCl、⑧、⑨KOH固体属于电解质;③蔗糖、⑦属于非电解质。
(3)溶于水能电离出自由移动的离子,溶液才能导电,以上物质中①NaCl晶体、②液态HCl、④熔融KCl、⑦、⑧、②KOH固体溶于水后都能导电。
14.答案:(1)①9.5
②
③否;自来水含有的能使胶体发生聚沉
④B
(2)①
②A
解析:(1)①常温下,溶解度为90 g,饱和氯化铁溶液的质量分数为,故配制饱和溶液需要称量氯化铁固体的质量为20.0×47.37%≈9.5 g。
②制备胶体的化学方程式为。
③自来水含有的能使胶体发生聚沉,乙同学的方案不正确。
④氯化铁溶液可以通过半透膜,而胶体不能透过半透膜,故可用渗析的方法除去氢氧化铁胶体中的氯化铁溶液。
(2)①与Cu反应的离子方程式为。
②将转化为需要加入氧化剂,如氯气,选A。
1.下列有关胶体的叙述正确的是( )
A.分散剂只能是液体
B.分散质粒子直径大于100nm
C.可利用丁达尔效应区分溶液和胶体
D.煮沸饱和溶液可以制得胶体
2.下列反应中,不能用离子方程式表示的是( )
A.稀硫酸与硝酸钡溶液反应 B.硫酸钾溶液与氯化钡溶液反应
C.稀硫酸与氢氧化钡溶液反应 D.硫酸钠溶液与硝酸钡溶液反应
3.离子方程式中的代表的物质可以是( )
A. B. C. D.
4.下列事实中,与胶体有关的是( )
A.将植物油倒入水中,用力搅拌形成油水混合物
B.一束可见光射入鸡蛋清液体里,从侧面可以看到一条光亮的“通路”
C.向石灰水中通入二氧化碳产生白色浑浊
D.利用活性炭净水
5.朱自清先生在其名篇《荷塘月色》中对月光下的荷塘有着极其唯美的描写“月光如流水一般,静静地泻在这一片叶子和花上。薄薄的轻雾浮起在荷塘里”。从化学角度分析,“月光”照射在“薄雾”上产生如此美景的本质原因是( )
A.荷塘上的小水滴分散在空气中形成雾,雾属于胶体
B.月光透过薄雾产生了丁达尔效应
C.雾中小水滴的直径是1~100nm
D.月光在小水滴表面发生了散射现象
6.下列各组离子在水溶液中能大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
7.下表中关于物质的分类正确的是( )
酸 碱 盐 碱性氧化物 酸性氧化物 混合物
A 波尔多液
B 冰水混合物
C 氢氧化铁胶体
D. 石墨和金刚石
A.A B.B C.C D.D
8.实验室为测定镁铝合金中镁、铝含量,设计如下流程:
下列说法错误的是( )
A.所加盐酸体积不少于100mL
B.沉淀1的质量为g
C.沉淀1加足量NaOH溶液反应的离子方程式为
D.镁铝合金中镁、铝质量之比为
9.汽车剧烈碰撞时,安全气囊中发生反应。对于该反应,下列判断正确的是( )
A.中氮元素的化合价为-3价
B.氧化剂和还原剂是同一物质
C.氧化产物与还原产物分子数之比为15:1
D.反应过程中转移10个电子,则产生10个分子
10.某课题组为探究0.1的与溶液反应,进行了如下三个实验:
实验一:
实验二:
实验三:
分析实验现象,下列说法中不合理的是( )
A.实验一的红褐色液体可产生丁达尔效应
B.实验二说明既发生了水解反应也被还原
C.实验三说明发生了水解反应但未被还原
D.以上三个实验说明对的水解无影响
11.1986年,化学家用化学法制氟,其原理如下:
①(未配平);
②;
③。
下列说法正确的是( )
A.①中氧化产物和还原产物的物质的量之比为2∶3
B.能与溶液发生反应
C.因为其具有强酸性而被用于刻蚀玻璃
D.用上述方法制备1,理论上需要消耗30
12.“皮鞋很忙”的恶搞段子曾经风靡网络,揭露了某些行业用烂皮鞋制造酸奶或毒胶囊的不法行为。央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知中铁元素是+2价,则其中铬元素是_______价。
(2)明胶的水溶液和溶液共同具备的性质是_______(填序号)。
a.都不稳定,密封放置沉淀
b.分散质粒子可通过滤纸
c.丁达尔效应
(3)制备胶体的离子方程式_______。
(4)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的方法是_______,装置是下列中的_______(填序号)。
(5)现有10mL明胶的水溶液与5mL溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明能够透过半透膜:_______。
13.利用分类法研究化学物质可系统、全面认识物质的性质。
回答下列问题:
I.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、、、CuO
②HCl、、、
③NaOH、、KOH、
(1)三种物质依次是(填化学式):①__________________;②________________;③_______________。
(2)这三种物质相互作用可生成一种新物质,该反应___(填“是”或“不是”)氧化还原反应。
(3)写出与足量稀硫酸反应的离子方程式:__________________。
(4)与、在溶液中都不能大量共存,试用离子方程式说明:________________、_________________。
Ⅱ.现有以下物质:①NaCl晶体、②液态HCl、③固体、④熔融KCl、⑤蔗糖、⑥铜、⑦、⑧、⑨KOH固体。
(1)以上物质中能导电的是_________________(填序号,下同)。
(2)以上物质中属于电解质的是_________________,属于非电解质的是____________。
(3)以上物质中,溶于水能导电的物质是__________。
14.是一种常用化学试剂,在实验和工农业生产领域有着重要的用途。
(1)实验室常用饱和溶液来制备胶体。
已知:常温下,溶解度为90g。
实验Ⅰ:配制20.0g饱和溶液
①该实验需称量固体_______g(保留两位有效数字)。
实验Ⅱ:制备胶体
甲同学取一小烧杯,加入25 mL蒸馏水,加热至沸腾,向沸水中逐滴加入1~2 mL饱和氯化铁溶液,继续煮沸至产生透明的红褐色液体,停止加热。
②写出此过程中的化学方程式:____________________________________。
③乙同学提议用自来水(自来水因用消毒常含有)代替蒸馏水,请回答乙同学的方案是否正确_______(“是”或“否”),原因为_____________________________________。
④除去氢氧化铁胶体中的氯化铁溶液采用的方法是________(填序号)。
A.过滤 B.渗析 C.蒸发
(2)工业上制印刷电路板时常用溶液作“腐蚀液”,原理为用溶液将Cu溶解。高一化学学生兴趣小组根据此原理在覆铜板上制作“我爱化学”字样的图案。
实验Ⅲ:利用覆铜板制作图案
实验原理 用溶液作“腐蚀液”,将覆铜板上不需要的铜腐蚀
实验操作 1.取一小块覆铜板,用油性笔在覆铜板上画出设计好的“化学”图案; 2.将覆铜板浸入盛有溶液的小烧杯中; 3.一段时间后,取出覆铜板并用水清洗干净; 4.观察实验现象,并展示制作的图案
实验现象 用油性笔画出的图案处不被腐蚀,洗净后板上留下设计的“化学”图案
离子方程式 ___________________________________________
实验结论 铜可以被溶液腐蚀
①请写出该反应的离子方程式:____________________________________。
②使用过的“腐蚀液”会失效,但还可以回收利用,其中有一步反应需要将转化为,下列试剂能实现该转化的是________(填序号)。
A.氯气 B.铁 C.铜 D.稀硫酸
答案以及解析
1.答案:C
解析:A.分散剂除了液体,还可以是固体、气体;B.胶体的分散质粒子直径大小在1~100nm;D.制取胶体的正确的操作为向沸水中逐滴加入5~6滴饱和溶液,继续煮沸至液体呈红褐色,停止加热。
2.答案:C
解析:稀硫酸与氢氧化钡溶液反应的离子方程式为,C项符合题意。
3.答案:C
解析:题中代表易溶碳酸盐中的离子,C项正确。
4.答案:B
解析:A项,形成的油水混合物属于乳浊液,与胶体性质无关:B项,是胶体的丁达尔效应:C项,向石灰水中通入二氧化碳气体,得到的是悬浊液,与胶体性质无关:D项,活性炭净水利用的是活性炭的吸附性,与胶体性质无关。
5.答案:C
解析:薄雾是一种胶体,“月光”照射在“薄雾”上,形成丁达尔效应;这是胶体的性质,区分胶体和其他分散系的本质是分散质粒子的直径,胶体分散质粒子的直径是1~100nm,答案选C。
6.答案:B
解析:A.与会反应产生水,不能大量共存,故A错误;
B.离子之间不发生反应,可以大量共存,故B正确;
C.与会发生反应产生硫酸钡沉淀,不能大量共存,故C错误;
D.与会发生反应产生二氧化碳和水,不能大量共存,故D错误;
故答案选B。
7.答案:A
解析:A.HClO为弱酸,NaOH为强碱,为难溶性盐,CaO是对应的碱性氧化物,是碳酸对应的酸性氧化物,波尔多液是将胆矾、石灰乳混合制得的混合物,A正确;
B.虽然是金属氧化物,但它属于酸性氧化物,冰水混合物都是由水分子构成,属于纯净物,B不正确;
C.虽然的俗名叫纯碱,但它属于盐,C不正确;
D.属于盐,NO不能与碱反应,不属于酸性氧化物,D不正确;故选A。
8.答案:B
解析:A.由分析可知,镁铝合金中镁、铝的物质的量都为0.1mol,则溶解合金加入5mol/L盐酸的体积不少于,故A正确;B.由分析可知,镁铝合金中镁、铝的物质的量都为0.1mol,则氢氧化镁、氢氧化铝沉淀的质量之和为,故B错误;C.由分析可知,沉淀1加足量氢氧化钠溶液发生的反应为氢氧化铝与足量氢氧化钠溶液反应生成四羟基合铝酸钠,反应的离子方程式为,故C正确;D.由分析可知,合金中镁、铝质量之比为48:54=8:9,故D正确;故选B。
9.答案:C
解析:根据化合物中各元素正、负化合价的代数和为0知,中N元素的化合价不是-3价,A错误;
中N元素化合价升高,作还原剂,中N元素化合价降低,作氧化剂,氧化剂和还原剂不是同一物质,B错误;
根据化学方程式,10个被氧化,生成的分子数为15,2个被还原,生成的分子数为1,氧化产物与还原产物分子数之比为15:1,C正确;
根据化学方程式,反应过程中转移10个电子,产生16个分子,D错误。
10.答案:D
解析:A.由实验1知,加热溶液,水解生成氢氧化铁的胶体,故可产生丁达尔效应,A正确;
B.实验②过量溶液中滴加少量溶液,溶液变红褐色,说明水解生成氢氧化铁胶体,再滴加铁氰化钾溶液产生蓝色沉淀,说明与发生氧化还原反应生成,B正确;
C.实验③过量溶液中滴加少量溶液,溶液变红褐色说明水解生成氢氧化铁胶体;一份滴加铁氰化钾溶液,无蓝色沉淀生成,说明与没有发生氧化还原反应生成;另一份煮沸产生红褐色沉淀,说明发生了胶体的聚沉;整个过程说明发生了水解反应,但没有发生还原反应,C正确;
D.由BC分析可知,均水解生成氢氧化铁胶体,说明对的水解反应有促进作用,D错误;
故选D。
11.答案:D
解析:A.①中氧化产物为、还原产物为,根据分析可知氧化产物和还原产物的物质的量之比为3∶2,故A错误;
B.会与水反应,,故B错误;
C.HF因为其具有腐蚀性而被用于刻蚀玻璃,反应为:,故C错误;
D.根据分析可知关系式为:、,制备1需要消耗2mol,4mol,而产生2mol需要消耗10molHF,产生4mol需要消耗20molHF,可知制备1,理论上需要消耗30,故D正确;
故答案选D。
12.答案:(1)+3
(2)b
(3)
(4)渗析;E
(5)取烧杯中的少量液体,向其中滴加盐酸,无明显变化,滴加 BaCl2溶液,有白色沉淀产生
解析:(1)根据化合物中元素化合价的代数和等于零计算出铁元素的化合价为+2价。
(2)明胶是水溶性蛋白质混合物,溶于水形成胶体,溶液属于溶液。a.溶液很稳定,a项错误;b.胶体和溶液中的分散质都能透过滤纸,b项正确;c.胶体具有丁达尔效应而溶液没有,c项错误;故选b。
(3)往沸水中滴加饱和溶液可制得胶体,离子方程式:。
(4)明胶是水溶性蛋白质混合物,溶于水形成胶体,提纯明胶的方法是利用胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜的原理,即渗析法;符合题意的操作是图E。
(5)根据题意,若能够透过半透膜,则水溶液中含有,故证明能够透过半透膜的实验方法:取烧杯中的少量液体,向其中滴加盐酸,无明显变化,然后再滴加溶液,有白色沉淀产生。
13.答案:I.(1);;
(2)不是
(3)
(4);
Ⅱ.(1)④⑥
(2)①②③④⑧⑨;⑤⑦
(3)①②④⑦⑧⑨
解析:1.(1)①中是非金属氧化物,其他都是金属氧化物;②中不是酸,其他都是酸;③中是盐,其他都是碱。
(2)化学反应式为,反应中元素没有价态变化,不是氧化还原反应。
(3)是可溶性盐,硫酸是强酸,离子反应中均能拆,所以与足量稀硫酸反应的离子方程式为。
(4)是弱酸的酸式酸根,能与、反应,其离子方程式为、。
Ⅱ.(1)能导电的物质是金属材料、半导体和电解质溶液或熔融状态的电解质,因此以上物质中熔融KCl、铜能导电。
(2)电解质是在水溶液或熔融状态下能导电的化合物,以上物质中①NaCl晶体、②液态HC1、③固体、④熔融KCl、⑧、⑨KOH固体属于电解质;③蔗糖、⑦属于非电解质。
(3)溶于水能电离出自由移动的离子,溶液才能导电,以上物质中①NaCl晶体、②液态HCl、④熔融KCl、⑦、⑧、②KOH固体溶于水后都能导电。
14.答案:(1)①9.5
②
③否;自来水含有的能使胶体发生聚沉
④B
(2)①
②A
解析:(1)①常温下,溶解度为90 g,饱和氯化铁溶液的质量分数为,故配制饱和溶液需要称量氯化铁固体的质量为20.0×47.37%≈9.5 g。
②制备胶体的化学方程式为。
③自来水含有的能使胶体发生聚沉,乙同学的方案不正确。
④氯化铁溶液可以通过半透膜,而胶体不能透过半透膜,故可用渗析的方法除去氢氧化铁胶体中的氯化铁溶液。
(2)①与Cu反应的离子方程式为。
②将转化为需要加入氧化剂,如氯气,选A。
同课章节目录
