福建省福州第三中学2023-2024学年高二下学期7月期末考试化学试卷(含答案)
文档属性
| 名称 | 福建省福州第三中学2023-2024学年高二下学期7月期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 640.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-12 20:56:46 | ||
图片预览




文档简介
福建省福州第三中学2023-2024学年高二下学期7月期末考试化学试题
一、单选题
1.下列化学用语表示正确的是
A.乙酸的分子式:CH3COOH B.羟基的电子式:
C.乙烯的结构简式:CH2CH2 D.丙烷的空间充填模型:
2.下列物质的沸点由高到低排列的顺序是
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.④②①③ C.②④①③ D.②④③①
3.为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
选项 A B C D
被提纯物质 酒精(水) 乙醇(乙酸) 乙烷(乙烯) 溴苯(溴)
除杂试剂 生石灰 氢氧化 钠溶液 酸性高锰 酸钾溶液 KI溶液
分离方法 蒸馏 分液 洗气 分液
A.A B.B C.C D.D
4.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是
A.2﹣甲基﹣2﹣丁烯
B.2,3﹣二甲基﹣1﹣丁烯
C.3﹣甲基﹣1﹣丁烯
D.2﹣甲基﹣1,3﹣丁二烯
5.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是
A. B.
C. D.
6.有机物A是一种重要的化工原料,其结构简式为,下列检验A中官能团的试剂和顺序正确的是
A.先加酸性KMnO4溶液,再加银氨溶液,微热
B.先加溴水,再加酸性KMnO4溶液
C.先加银氨溶液,微热,再加溴水
D.先加入足量新制的Cu(OH)2,微热,酸化后再加溴水
7.某化合物(结构如图所示)可用作酿造酵母的培养剂、强化剂、膨松剂、发酵助剂。已知X、Y、Z、W为元素周期表中前20号元素且位于不同周期,原子序数依次增大,Y为地壳中含量最高的元素。下列有关说法正确的是
A.X分别和Y、W形成的化合物中,所含化学键类型相同
B.同周期中第一电离能比Z小的元素只有4种
C.电负性:Y>Z>W
D.X与Z形成的最简单化合物比X与Y形成的最简单化合物稳定
8.下列方法或操作正确且能达到实验目的的是
实验目的 方法或操作
A 检验溴乙烷中的溴元素 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液
B 欲证明CH2=CHCHO中含有碳碳双键 滴入酸性KMnO4溶液,看紫红色是否褪去
C 证明蛋白质在某些无机盐溶液的作用下发生变性 向鸡蛋清中加入饱和硫酸铜溶液,有沉淀析出:再把沉淀加入蒸馏水中,观察沉淀是否溶解
D 检验淀粉在稀硫酸催化下能否水解 向淀粉溶液中加入少量稀硫酸,加热:再加入银氨溶液,加热;看是否出现银镜
A.A B.B C.C D.D
9.某有机物的结构简式如下图,下列有关叙述正确的是
A.该有机物分子中一定有16个碳原子共平面
B.该有机物最多与发生反应
C.该有机物可以与发生反应
D.可与和溶液发生反应
10.对氨基苯甲酸可用甲苯为原料合成,已知 产物苯胺还原性强,易被氧化,且羧基是间位定位基(即对苯环间位的H有活化作用),则由甲苯合成对氨基苯甲酸的步骤合理的是
A.甲苯XY对氨基苯甲酸
B.甲苯XY对氨基苯甲酸
C.甲苯XY对氨基苯甲酸
D.甲苯XY对氨基苯甲酸
11.和均可发生水解反应,其中的水解机理示意图如下:
下列说法正确的是
A.和均为极性分子 B.和中的均为杂化
C.和的水解反应机理相同 D.和均能与形成氢键
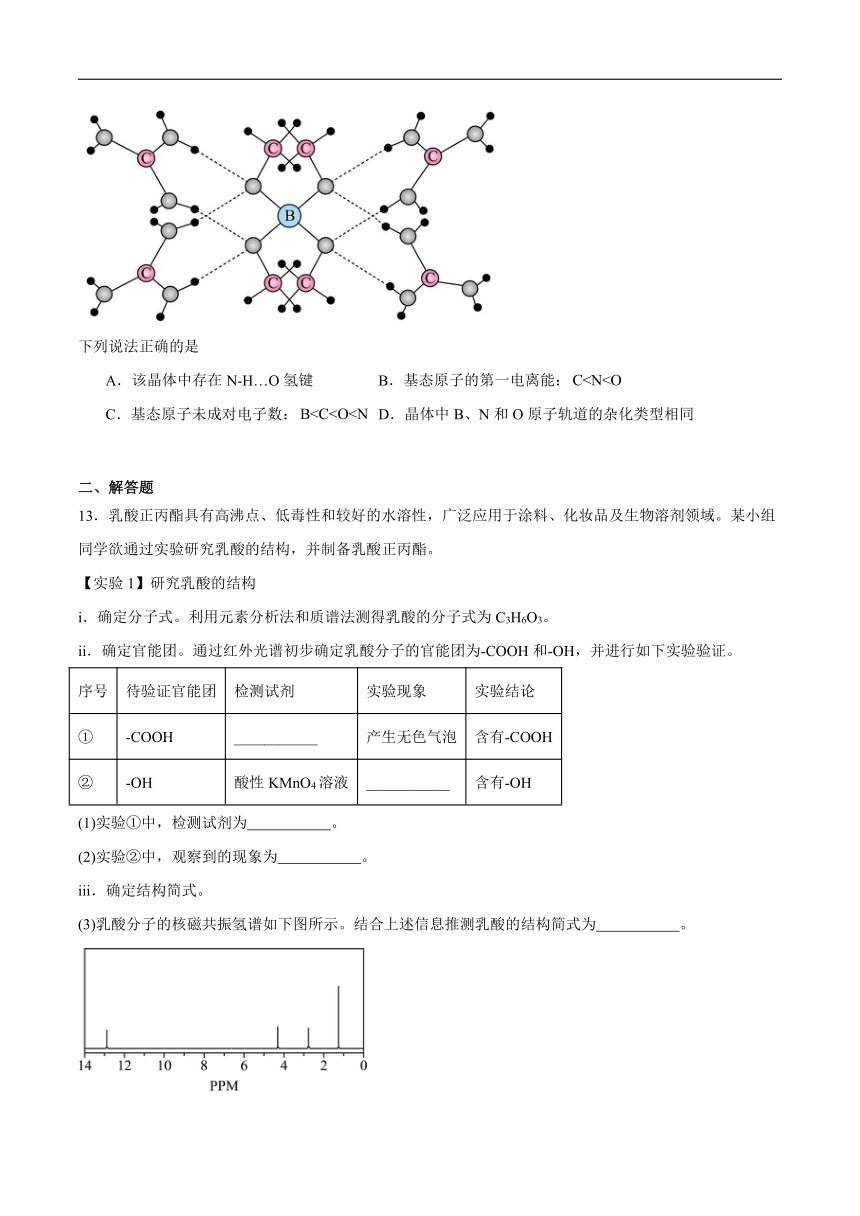
12.一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。
下列说法正确的是
A.该晶体中存在N-H…O氢键 B.基态原子的第一电离能:
C.基态原子未成对电子数: D.晶体中B、N和O原子轨道的杂化类型相同
二、解答题
13.乳酸正丙酯具有高沸点、低毒性和较好的水溶性,广泛应用于涂料、化妆品及生物溶剂领域。某小组同学欲通过实验研究乳酸的结构,并制备乳酸正丙酯。
【实验1】研究乳酸的结构
i.确定分子式。利用元素分析法和质谱法测得乳酸的分子式为C3H6O3。
ii.确定官能团。通过红外光谱初步确定乳酸分子的官能团为-COOH和-OH,并进行如下实验验证。
序号 待验证官能团 检测试剂 实验现象 实验结论
① -COOH ___________ 产生无色气泡 含有-COOH
② -OH 酸性KMnO4溶液 ___________ 含有-OH
(1)实验①中,检测试剂为 。
(2)实验②中,观察到的现象为 。
iii.确定结构简式。
(3)乳酸分子的核磁共振氢谱如下图所示。结合上述信息推测乳酸的结构简式为 。
【实验2】制备乳酸正丙酯
实验室制备乳酸正丙酯的步骤如下:
i.将乳酸、正丙醇(物质的量之比为1:3)和浓硫酸投入三口瓶中(装置如图,加热、夹持、搅拌装置已略去),加热至102~105℃,反应6h。
ii.酯化结束后,降温至60℃以下,加入与硫酸等物质的量的纯碱。
iii.常压蒸馏至110℃左右,收集到的馏分经处理后循环使用。
iv.当温度高于110℃时,停止加热,冷却,当温度降至40℃以下时,接好减压装置,进行减压蒸馏,收集120℃左右的馏分,获得乳酸正丙酯。资料:相关物质的沸点如下表。
物质 乳酸 正丙醇 乳酸正丙酯
沸点/℃ 227.6 97.2 168
(4)步骤i中,乳酸与正丙醇发生酯化反应的化学方程式为 。
(5)步骤iii中,收集到的可循环使用的物质主要是 。
(6)步骤iv中,减压蒸馏的目的之一是防止温度过高乳酸分子间生成交酯(六元环状酯),该交酯的结构简式为 。
14.镍是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,用镍制造不锈钢和各种合金钢被广泛地用于飞机、舰艇、雷达、导弹、陶瓷颜料、永磁材料、电子遥控等领域。回答下列问题:
(1)基态镍原子的价电子轨道表示式为 。
(2)硝酸肼镍是一种配合物,空间构型是 ;配体中氮原子杂化轨道类型为 ;沸点(113.5℃)比乙烷沸点(℃)高得多,其主要原因是 。
(3)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将还原为氨的反应的催化剂。贵金属钼的氮化物的立方晶胞如图所示。已知晶胞参数为a nm,则该晶体的化学式为 ,晶体的密度为 (列出计算式)。
15.高品质可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料,采用“两矿一步浸出法”制备高品质的工艺流程如下图所示。
已知:①软锰矿与黄铁矿的主要成分分别为、,还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下表。
金属离子
开始沉淀的pH 6.9 1.9 6.6 9.1 3.4
沉淀完全的pH 8.3 3.2 10.1 10.9 4.7
回答下列问题:
(1)“酸浸”操作中需先后分批加入、。已知滤渣1的主要成分为S、、等。加入后发生反应生成单质S的离子方程式为 。加入后反应的生成物会附着在矿粉颗粒表面,使上述反应受阻,此时加入,利用其迅速分解产生的大量气泡可破除该不利影响。导致迅速分解的因素是 。
(2)“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为 (填化学式)。
(3)“除杂”时,溶液体系中的和形成氟化物沉淀。若沉淀后上层清液中,则 [已知,]。
(4)“沉锰”步骤发生主要反应的离子方程式为 。
(5)利用惰性电极电解体系可获得,电解过程的机理(部分)如图甲所示,当硫酸浓度与电流效率的关系如图乙所示。当硫酸浓度超过时,电流效率降低的原因是 。
16.下列是合成一种用于治疗消化不良和胃痉挛等胃肠道疾病药物Ⅰ的路线。回答下列问题:
已知:
(1)A的名称是 。
(2)I中含氧官能团的名称为 。
(3)F的结构简式是 。
(4)写出B+C→D的化学方程式 。
(5)参照上述信息,利用对二甲苯及必要的无机试剂制备化合物Z的路线如下:
①物质X的结构简式为 。
②已知X→Y过程中,C—C—C键角变小,则Y→Z的反应类型为 。
(6)化合物G的同分异构体满足以下条件,任写其中一种的结构简式 。
ⅰ.能与发生显色反应
ⅱ.能与反应
ⅲ.核磁共振氢谱有4组峰,且峰面积比
参考答案
1.B
2.C
3.A
4.B
5.B
6.D
7.C
8.C
9.B
10.B
11.D
12.A
13.(1)Na2CO3溶液
(2)溶液的紫色褪色
(3)
(4)+CH3CH2CH2OH +H2O
(5)CH3CH2CH2OH
(6)
14.(1)
(2) 平面三角形 分子间可形成氢键,而乙烷分子间不能形成氢键
(3)
15.(1) 、和等都是双氧水分解的催化剂
(2)和
(3)50
(4)
(5)硫酸浓度高,被消耗,效率降低
16.(1)对甲基苯酚(或对甲苯酚)
(2)醚键、酰胺基
(3)
(4)
(5) 取代反应
(6)或
一、单选题
1.下列化学用语表示正确的是
A.乙酸的分子式:CH3COOH B.羟基的电子式:
C.乙烯的结构简式:CH2CH2 D.丙烷的空间充填模型:
2.下列物质的沸点由高到低排列的顺序是
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.④②①③ C.②④①③ D.②④③①
3.为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
选项 A B C D
被提纯物质 酒精(水) 乙醇(乙酸) 乙烷(乙烯) 溴苯(溴)
除杂试剂 生石灰 氢氧化 钠溶液 酸性高锰 酸钾溶液 KI溶液
分离方法 蒸馏 分液 洗气 分液
A.A B.B C.C D.D
4.某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是
A.2﹣甲基﹣2﹣丁烯
B.2,3﹣二甲基﹣1﹣丁烯
C.3﹣甲基﹣1﹣丁烯
D.2﹣甲基﹣1,3﹣丁二烯
5.下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是
A. B.
C. D.
6.有机物A是一种重要的化工原料,其结构简式为,下列检验A中官能团的试剂和顺序正确的是
A.先加酸性KMnO4溶液,再加银氨溶液,微热
B.先加溴水,再加酸性KMnO4溶液
C.先加银氨溶液,微热,再加溴水
D.先加入足量新制的Cu(OH)2,微热,酸化后再加溴水
7.某化合物(结构如图所示)可用作酿造酵母的培养剂、强化剂、膨松剂、发酵助剂。已知X、Y、Z、W为元素周期表中前20号元素且位于不同周期,原子序数依次增大,Y为地壳中含量最高的元素。下列有关说法正确的是
A.X分别和Y、W形成的化合物中,所含化学键类型相同
B.同周期中第一电离能比Z小的元素只有4种
C.电负性:Y>Z>W
D.X与Z形成的最简单化合物比X与Y形成的最简单化合物稳定
8.下列方法或操作正确且能达到实验目的的是
实验目的 方法或操作
A 检验溴乙烷中的溴元素 将溴乙烷与氢氧化钠溶液共热,冷却,继续滴加硝酸银溶液
B 欲证明CH2=CHCHO中含有碳碳双键 滴入酸性KMnO4溶液,看紫红色是否褪去
C 证明蛋白质在某些无机盐溶液的作用下发生变性 向鸡蛋清中加入饱和硫酸铜溶液,有沉淀析出:再把沉淀加入蒸馏水中,观察沉淀是否溶解
D 检验淀粉在稀硫酸催化下能否水解 向淀粉溶液中加入少量稀硫酸,加热:再加入银氨溶液,加热;看是否出现银镜
A.A B.B C.C D.D
9.某有机物的结构简式如下图,下列有关叙述正确的是
A.该有机物分子中一定有16个碳原子共平面
B.该有机物最多与发生反应
C.该有机物可以与发生反应
D.可与和溶液发生反应
10.对氨基苯甲酸可用甲苯为原料合成,已知 产物苯胺还原性强,易被氧化,且羧基是间位定位基(即对苯环间位的H有活化作用),则由甲苯合成对氨基苯甲酸的步骤合理的是
A.甲苯XY对氨基苯甲酸
B.甲苯XY对氨基苯甲酸
C.甲苯XY对氨基苯甲酸
D.甲苯XY对氨基苯甲酸
11.和均可发生水解反应,其中的水解机理示意图如下:
下列说法正确的是
A.和均为极性分子 B.和中的均为杂化
C.和的水解反应机理相同 D.和均能与形成氢键
12.一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。
下列说法正确的是
A.该晶体中存在N-H…O氢键 B.基态原子的第一电离能:
C.基态原子未成对电子数: D.晶体中B、N和O原子轨道的杂化类型相同
二、解答题
13.乳酸正丙酯具有高沸点、低毒性和较好的水溶性,广泛应用于涂料、化妆品及生物溶剂领域。某小组同学欲通过实验研究乳酸的结构,并制备乳酸正丙酯。
【实验1】研究乳酸的结构
i.确定分子式。利用元素分析法和质谱法测得乳酸的分子式为C3H6O3。
ii.确定官能团。通过红外光谱初步确定乳酸分子的官能团为-COOH和-OH,并进行如下实验验证。
序号 待验证官能团 检测试剂 实验现象 实验结论
① -COOH ___________ 产生无色气泡 含有-COOH
② -OH 酸性KMnO4溶液 ___________ 含有-OH
(1)实验①中,检测试剂为 。
(2)实验②中,观察到的现象为 。
iii.确定结构简式。
(3)乳酸分子的核磁共振氢谱如下图所示。结合上述信息推测乳酸的结构简式为 。
【实验2】制备乳酸正丙酯
实验室制备乳酸正丙酯的步骤如下:
i.将乳酸、正丙醇(物质的量之比为1:3)和浓硫酸投入三口瓶中(装置如图,加热、夹持、搅拌装置已略去),加热至102~105℃,反应6h。
ii.酯化结束后,降温至60℃以下,加入与硫酸等物质的量的纯碱。
iii.常压蒸馏至110℃左右,收集到的馏分经处理后循环使用。
iv.当温度高于110℃时,停止加热,冷却,当温度降至40℃以下时,接好减压装置,进行减压蒸馏,收集120℃左右的馏分,获得乳酸正丙酯。资料:相关物质的沸点如下表。
物质 乳酸 正丙醇 乳酸正丙酯
沸点/℃ 227.6 97.2 168
(4)步骤i中,乳酸与正丙醇发生酯化反应的化学方程式为 。
(5)步骤iii中,收集到的可循环使用的物质主要是 。
(6)步骤iv中,减压蒸馏的目的之一是防止温度过高乳酸分子间生成交酯(六元环状酯),该交酯的结构简式为 。
14.镍是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,用镍制造不锈钢和各种合金钢被广泛地用于飞机、舰艇、雷达、导弹、陶瓷颜料、永磁材料、电子遥控等领域。回答下列问题:
(1)基态镍原子的价电子轨道表示式为 。
(2)硝酸肼镍是一种配合物,空间构型是 ;配体中氮原子杂化轨道类型为 ;沸点(113.5℃)比乙烷沸点(℃)高得多,其主要原因是 。
(3)过渡金属氮化物因其优异的催化性能(加氢处理、光和电化学催化等)受到了广泛关注。贵金属钼(Mo)的氮化物可作将还原为氨的反应的催化剂。贵金属钼的氮化物的立方晶胞如图所示。已知晶胞参数为a nm,则该晶体的化学式为 ,晶体的密度为 (列出计算式)。
15.高品质可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料,采用“两矿一步浸出法”制备高品质的工艺流程如下图所示。
已知:①软锰矿与黄铁矿的主要成分分别为、,还含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下表。
金属离子
开始沉淀的pH 6.9 1.9 6.6 9.1 3.4
沉淀完全的pH 8.3 3.2 10.1 10.9 4.7
回答下列问题:
(1)“酸浸”操作中需先后分批加入、。已知滤渣1的主要成分为S、、等。加入后发生反应生成单质S的离子方程式为 。加入后反应的生成物会附着在矿粉颗粒表面,使上述反应受阻,此时加入,利用其迅速分解产生的大量气泡可破除该不利影响。导致迅速分解的因素是 。
(2)“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为 (填化学式)。
(3)“除杂”时,溶液体系中的和形成氟化物沉淀。若沉淀后上层清液中,则 [已知,]。
(4)“沉锰”步骤发生主要反应的离子方程式为 。
(5)利用惰性电极电解体系可获得,电解过程的机理(部分)如图甲所示,当硫酸浓度与电流效率的关系如图乙所示。当硫酸浓度超过时,电流效率降低的原因是 。
16.下列是合成一种用于治疗消化不良和胃痉挛等胃肠道疾病药物Ⅰ的路线。回答下列问题:
已知:
(1)A的名称是 。
(2)I中含氧官能团的名称为 。
(3)F的结构简式是 。
(4)写出B+C→D的化学方程式 。
(5)参照上述信息,利用对二甲苯及必要的无机试剂制备化合物Z的路线如下:
①物质X的结构简式为 。
②已知X→Y过程中,C—C—C键角变小,则Y→Z的反应类型为 。
(6)化合物G的同分异构体满足以下条件,任写其中一种的结构简式 。
ⅰ.能与发生显色反应
ⅱ.能与反应
ⅲ.核磁共振氢谱有4组峰,且峰面积比
参考答案
1.B
2.C
3.A
4.B
5.B
6.D
7.C
8.C
9.B
10.B
11.D
12.A
13.(1)Na2CO3溶液
(2)溶液的紫色褪色
(3)
(4)+CH3CH2CH2OH +H2O
(5)CH3CH2CH2OH
(6)
14.(1)
(2) 平面三角形 分子间可形成氢键,而乙烷分子间不能形成氢键
(3)
15.(1) 、和等都是双氧水分解的催化剂
(2)和
(3)50
(4)
(5)硫酸浓度高,被消耗,效率降低
16.(1)对甲基苯酚(或对甲苯酚)
(2)醚键、酰胺基
(3)
(4)
(5) 取代反应
(6)或
同课章节目录
