2025年江苏省南通市启东市中考二模化学试卷(含答案)
文档属性
| 名称 | 2025年江苏省南通市启东市中考二模化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 494.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-06-12 15:25:01 | ||
图片预览



文档简介
2025年江苏省南通市启东市二模物理·化学试题-初中化学
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.化学元素与人体健康密切相关。青少年缺乏某种元素将导致佝偻病,该元素是
A.钙 B.铁 C.碘 D.钠
2.我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合加热至800℃,得到一种外形似金子的锌铜合金(俗称黄铜)。下列说法正确的是
A.ZnCO3属于酸 B.可用稀盐酸鉴别真假黄金
C.合金至少含两种金属元素 D.黄铜熔点比铜与锌的熔点都高
3.学习小组利用氧化铜、稀硫酸和氢氧化钠溶液制备氢氧化铜,下列操作正确的是
A.取氧化铜粉末 B.倾倒稀硫酸
C.滴氢氧化钠溶液 D.过滤氢氧化铜
4.下列物质的性质和用途对应关系正确的是
A.金刚石无色透明,可用于切割玻璃 B.石墨具有导电性,可用于制作铅笔芯
C.浓盐酸具有挥发性,可用作除锈剂 D.无水硫酸铜遇水变蓝,可用于检验水的存在
阅读下列材料,回答下列小题。
氢气的主要来源有化石燃料制氢(CH4+CO2=2CO+2H2)和电解水制氢等。气态储氢是将氢气压缩存储在高压罐中。固态储氢是将氢气和金属反应生成固态氢化物,如氢化钙(CaH2)。CaH2遇水能剧烈反应生成氢氧化钙和氢气。
5.下列有关说法正确是
A.化石燃料属于可再生资源 B.CH4和CO2都是温室效应气体
C.CH4和CO2都属于有机物 D.电解水时正负两极产生气体质量比为1:8
6.下列有关说法正确的是
A.气态储氢时氢气分子变小 B.CaH2中H的化合价为-1价
C.CaH2与水反应所得溶液呈酸性 D.CaH2可以敞口保存
7.某氯化钠固体中含有少量氯化钙,学习小组通过如下实验进行提纯。
实验一:将固体溶于水,测得溶液的pH=6
实验二:向实验一所得溶液中加入稍过量的碳酸钠溶液,充分反应后过滤,用蒸馏水洗涤,将洗涤液并入滤液中
实验三:向实验二所得的合并滤液中加入过量的稀盐酸充分反应,然后转移至蒸发皿中用酒精灯加热,最后获得氯化钠固体
下列有关说法不正确的是
A.由实验一可知所得溶液为酸性
B.实验二所得滤液中的溶质为NaCl和Na2CO3
C.实验三需将蒸发皿中液体全部蒸干才能停止加热
D.经过提纯后实际获得的氯化钠的质量比理论值要高
8.氯化钠和碳酸钠的溶解度如表所示。下列有关说法正确的是
温度/℃ 0 10 20 30 40 50 60
溶解度/g 氯化钠 35.7 35.8 36 36.3 36.6 37.0 37.3
碳酸钠 7.1 12.5 21.5 39.7 49.0 48.7 46.5
A.碳酸钠的溶解度随温度升高而增大
B.30℃时配制两种物质的饱和溶液,所需碳酸钠大于氯化钠
C.将50℃时100g氯化钠的饱和溶液降温至20℃,析出1g氯化钠
D.40℃时将25.0g碳酸钠加入50.0g水中,所得溶液中溶质质量分数约为32.9%
9.下列实验方案能达到实验目的的是
A.鉴别N2和CO2:将燃着的木条分别伸入集气瓶中观察木条是否熄灭
B.检验NaOH溶液是否变质:取样,滴加酚酞溶液,观察溶液颜色是否变红
C.探究蜡烛中是否含有氢元素:点燃蜡烛并将内壁干燥的烧杯罩在火焰上方
D.除去KNO3溶液中混有的CuSO4:加入过量的Ba(OH)2溶液,过滤
10.Fe3O4是合成氨催化剂的主要成分。合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”,在一定温度下可用O2将其“再生”,原理如图1所示。一定质量的失效催化剂进行“再生”时固体中氧元素的质量随温度变化如图2所示。下列说法正确的是
A.“失效”时固体中铁元素的质量分数减小
B.21.6gFeO“再生”,理论上需消耗3.2gO2
C.“再生”的最佳温度范围为t3~t4℃
D.a点对应的数值为7.2
二、填空与简答
11.氧是地球上常见的元素,也是生物体内最重要的元素之一。
(1)氧原子的结构示意图为。臭氧(O3)和O2是由氧元素组成的不同单质。
①x的数值为 。
②从微观角度分析O3和O2化学性质不同的原因为 。
(2)电晕法制取臭氧的原理如图1所示。
①写出O2转变为O3的化学方程式 。
②O2的沸点比O3的 (填“高”或“低”)。
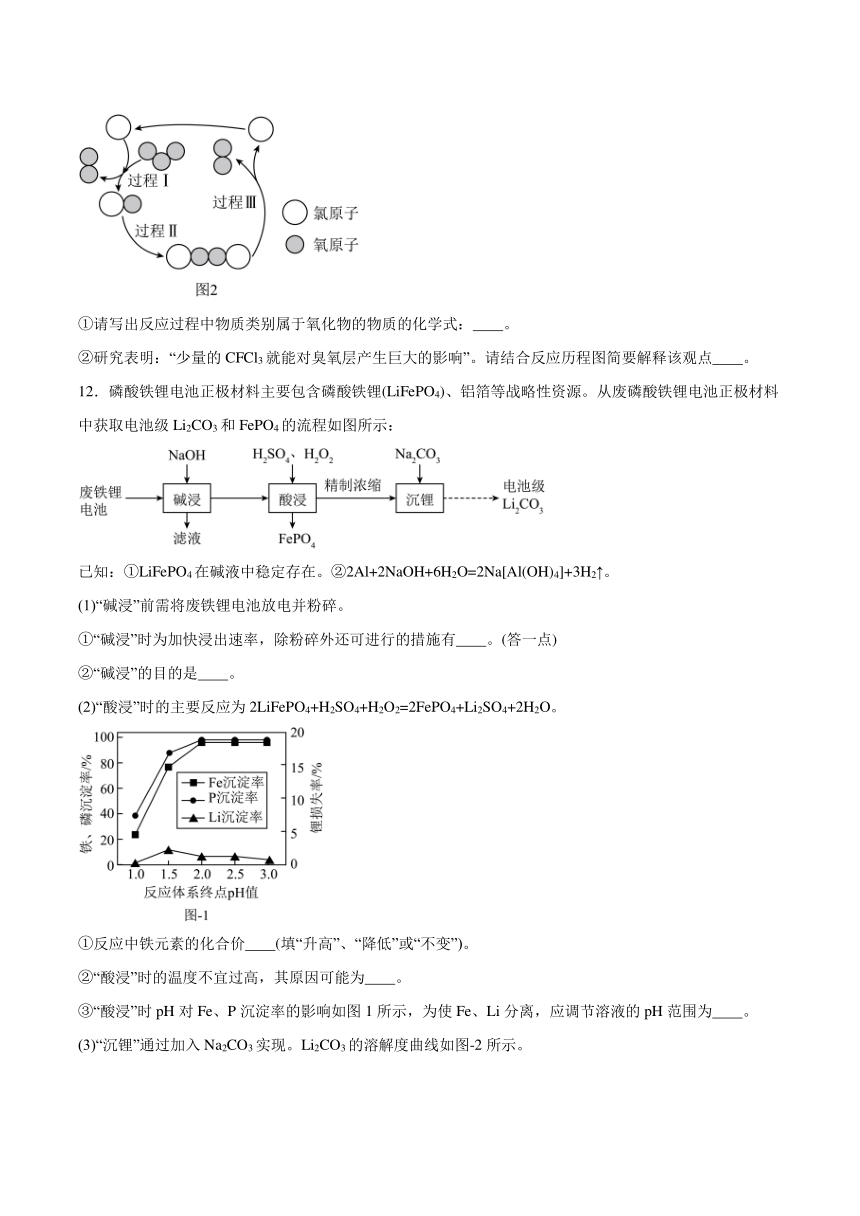
(3)制冷剂氟利昂(CFCl3)进入大气层后,在紫外线照射下所分解出的氯原子破坏臭氧层的反应历程如图2所示。
①请写出反应过程中物质类别属于氧化物的物质的化学式: 。
②研究表明:“少量的CFCl3就能对臭氧层产生巨大的影响”。请结合反应历程图简要解释该观点 。
12.磷酸铁锂电池正极材料主要包含磷酸铁锂(LiFePO4)、铝箔等战略性资源。从废磷酸铁锂电池正极材料中获取电池级Li2CO3和FePO4的流程如图所示:
已知:①LiFePO4在碱液中稳定存在。②2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑。
(1)“碱浸”前需将废铁锂电池放电并粉碎。
①“碱浸”时为加快浸出速率,除粉碎外还可进行的措施有 。(答一点)
②“碱浸”的目的是 。
(2)“酸浸”时的主要反应为2LiFePO4+H2SO4+H2O2=2FePO4+Li2SO4+2H2O。
①反应中铁元素的化合价 (填“升高”、“降低”或“不变”)。
②“酸浸”时的温度不宜过高,其原因可能为 。
③“酸浸”时pH对Fe、P沉淀率的影响如图1所示,为使Fe、Li分离,应调节溶液的pH范围为 。
(3)“沉锂”通过加入Na2CO3实现。Li2CO3的溶解度曲线如图-2所示。
①生成Li2CO3沉淀的化学方程式为 。
②反应时将温度升高至90℃的目的是 。(答一点)
13.CO2捕集包括CO2的吸收和解吸两个过程。将解吸所得的CO2转化为炭黑有助于实现碳中和。
(1)水、KOH溶液、CaO等都可作为CO2的捕集剂。以CaO为捕集剂的一种工艺如图1所示。
①写出以水为捕集剂时所得产物的化学式 。
②以CaO为捕集剂时捕捉室的温度一般控制在650℃,写出捕捉室发生的化学方程式 。
③将解吸室所得CaO投入捕捉室循环使用,其优点是 。
④选择捕集剂时需综合考虑吸收的效率和解吸的效率。因此衡量捕集剂的优劣,不仅需要比较捕集剂的成本、对环境的影响及捕集剂吸收CO2的快慢和多少外,还需要进行比较的因素为 。
(2)CO2转化为炭黑回收利用的反应机理如图2所示,其总反应方程式为CO2C+O2。
①总反应中的催化剂是 。
②过程I中CO2发生 (填“氧化”或“还原”)反应。
三、综合应用题
14.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可通过下列反应制备:FeSO4+Na2CO3=FeCO3+Na2SO4、FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O。
学习小组根据该原理,模拟制备柠檬酸亚铁。
(1)配制碳酸钠溶液。实验时需要100g溶质质量分数为10.6%的Na2CO3溶液。
①称量Na2CO3时出现了右盘低的现象,则接下来的操作是 。
②实验时量取蒸馏水所用量筒的规格为 (填“25”“50”或“100”)mL。
③配制过程中玻璃棒的作用是 。
(2)探究碳酸钠溶液的性质。
①实验一:蘸取Na2CO3溶液,点在pH试纸上, ,读出pH=11。
②实验二:取少量稀盐酸于试管中,滴加Na2CO3溶液,立即有大量气泡产生,写出反应的化学方程式: 。
③实验三:在密闭容器中,向一定量Na2CO3溶液中缓缓滴加稀盐酸,不断搅拌,利用pH传感器和CO2传感器,测得溶液的pH、容器中CO2气体的浓度随时间变化的曲线合并如图所示。则图中表示CO2浓度随时间变化的曲线是 (填“曲线1”或“曲线2”)。
(3)配制硫酸亚铁溶液。取少量FeSO4固体溶于水,加入少量铁粉,振荡。
【查阅资料】Fe2+易与氧气反应生成Fe3+;Fe2+遇KSCN溶液不显红色,Fe3+遇KSCN溶液显红色。
①溶解FeSO4固体所用的水在使用前必须要加热煮沸的目的是 。
②取少量新配制的FeSO4溶液于试管中,滴加几滴KSCN溶液,未变红色,说明溶液中不含 (填化学式)。
(4)制备柠檬酸亚铁晶体。
已知:①当溶液pH大于8.8时,Fe2+会完全生成Fe(OH)2沉淀。
②柠檬酸亚铁能溶于水,不溶于乙醇。
请补充完整制备柠檬酸亚铁的方案: ,待沉淀不再增加后过滤,将滤渣溶于足量的柠檬酸溶液中,充分反应后浓缩, ,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(实验中须使用的试剂:Na2CO3溶液、FeSO4溶液、无水乙醇)。
四、计算题
15.《周礼·考工记》中记载,古人曾在草木灰(含有K2CO3)的水溶液中加入贝壳烧成的灰(主要成分为CaO),利用生成物中能够去污的成分来洗涤丝帛。
(1)上述过程未涉及到的基本反应类型为 (填字母)。
a.化合反应 b.置换反应 c.复分解反应
(2)请你推测生成物中能够去污的成分,并说明理由 。
(3)反应K2CO3+H2SO4=K2SO4+H2O+CO2↑可用于测定草木灰样品中K2CO3的含量。取10.00g某草木灰样品加入烧杯中,缓慢加入足量稀硫酸,待反应结束后,共收集到0.88gCO2,求该草木灰样品中K2CO3的质量分数。 (请将计算过程写到答题纸上)
《2025年江苏省南通市启东市二模物理·化学试题-初中化学》参考答案
1.A
2.B
3.A
4.D
5.B 6.B
7.C
8.D
9.C
10.D
11.(1) 8 分子构成不同
(2) 3O22O3 低
(3) ClO、Cl2O2 反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响
12.(1) 适当提高浸出温度(或使用电动搅拌器、适当提高氢氧化钠的浓度等) 除去铝(或实现磷酸铁锂和铝的分离)
(2) 升高 温度过高使H2O2分解 2.0~3.0
(3) 提升沉淀反应速率/减小Li2CO3的溶解量,提高产率
13.(1) H2CO3 CaO+CO2CaCO3 降低成本,提高原料的利用率 捕集剂解吸CO2的效率(释放CO2的速率和程度)
(2) FeO 还原
14.(1) 向左盘中继续添加少量Na2CO3至天平平衡 100 搅拌
(2) 把试纸显示的颜色与标准比色卡比较 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 曲线1
(3) 除去溶解的氧气,防止Fe2+被氧化 Fe2(SO4)3
(4) 将Na2CO3溶液缓慢加入盛有FeSO4溶液的烧杯中 加入适量的无水乙醇
15.(1)b
(2)成分是KOH,氢氧化钙和碳酸钾发生复分解反应生成碳酸钙沉淀和KOH,KOH溶液是碱溶液,可以和油污反应
(3)解:设碳酸钾的质量为x。
解得:x=2.76g
该草木灰样品中K2CO3的质量分数是:
答: 该草木灰样品中K2CO3的质量分数为27.6%。
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.化学元素与人体健康密切相关。青少年缺乏某种元素将导致佝偻病,该元素是
A.钙 B.铁 C.碘 D.钠
2.我国古代将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭混合加热至800℃,得到一种外形似金子的锌铜合金(俗称黄铜)。下列说法正确的是
A.ZnCO3属于酸 B.可用稀盐酸鉴别真假黄金
C.合金至少含两种金属元素 D.黄铜熔点比铜与锌的熔点都高
3.学习小组利用氧化铜、稀硫酸和氢氧化钠溶液制备氢氧化铜,下列操作正确的是
A.取氧化铜粉末 B.倾倒稀硫酸
C.滴氢氧化钠溶液 D.过滤氢氧化铜
4.下列物质的性质和用途对应关系正确的是
A.金刚石无色透明,可用于切割玻璃 B.石墨具有导电性,可用于制作铅笔芯
C.浓盐酸具有挥发性,可用作除锈剂 D.无水硫酸铜遇水变蓝,可用于检验水的存在
阅读下列材料,回答下列小题。
氢气的主要来源有化石燃料制氢(CH4+CO2=2CO+2H2)和电解水制氢等。气态储氢是将氢气压缩存储在高压罐中。固态储氢是将氢气和金属反应生成固态氢化物,如氢化钙(CaH2)。CaH2遇水能剧烈反应生成氢氧化钙和氢气。
5.下列有关说法正确是
A.化石燃料属于可再生资源 B.CH4和CO2都是温室效应气体
C.CH4和CO2都属于有机物 D.电解水时正负两极产生气体质量比为1:8
6.下列有关说法正确的是
A.气态储氢时氢气分子变小 B.CaH2中H的化合价为-1价
C.CaH2与水反应所得溶液呈酸性 D.CaH2可以敞口保存
7.某氯化钠固体中含有少量氯化钙,学习小组通过如下实验进行提纯。
实验一:将固体溶于水,测得溶液的pH=6
实验二:向实验一所得溶液中加入稍过量的碳酸钠溶液,充分反应后过滤,用蒸馏水洗涤,将洗涤液并入滤液中
实验三:向实验二所得的合并滤液中加入过量的稀盐酸充分反应,然后转移至蒸发皿中用酒精灯加热,最后获得氯化钠固体
下列有关说法不正确的是
A.由实验一可知所得溶液为酸性
B.实验二所得滤液中的溶质为NaCl和Na2CO3
C.实验三需将蒸发皿中液体全部蒸干才能停止加热
D.经过提纯后实际获得的氯化钠的质量比理论值要高
8.氯化钠和碳酸钠的溶解度如表所示。下列有关说法正确的是
温度/℃ 0 10 20 30 40 50 60
溶解度/g 氯化钠 35.7 35.8 36 36.3 36.6 37.0 37.3
碳酸钠 7.1 12.5 21.5 39.7 49.0 48.7 46.5
A.碳酸钠的溶解度随温度升高而增大
B.30℃时配制两种物质的饱和溶液,所需碳酸钠大于氯化钠
C.将50℃时100g氯化钠的饱和溶液降温至20℃,析出1g氯化钠
D.40℃时将25.0g碳酸钠加入50.0g水中,所得溶液中溶质质量分数约为32.9%
9.下列实验方案能达到实验目的的是
A.鉴别N2和CO2:将燃着的木条分别伸入集气瓶中观察木条是否熄灭
B.检验NaOH溶液是否变质:取样,滴加酚酞溶液,观察溶液颜色是否变红
C.探究蜡烛中是否含有氢元素:点燃蜡烛并将内壁干燥的烧杯罩在火焰上方
D.除去KNO3溶液中混有的CuSO4:加入过量的Ba(OH)2溶液,过滤
10.Fe3O4是合成氨催化剂的主要成分。合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”,在一定温度下可用O2将其“再生”,原理如图1所示。一定质量的失效催化剂进行“再生”时固体中氧元素的质量随温度变化如图2所示。下列说法正确的是
A.“失效”时固体中铁元素的质量分数减小
B.21.6gFeO“再生”,理论上需消耗3.2gO2
C.“再生”的最佳温度范围为t3~t4℃
D.a点对应的数值为7.2
二、填空与简答
11.氧是地球上常见的元素,也是生物体内最重要的元素之一。
(1)氧原子的结构示意图为。臭氧(O3)和O2是由氧元素组成的不同单质。
①x的数值为 。
②从微观角度分析O3和O2化学性质不同的原因为 。
(2)电晕法制取臭氧的原理如图1所示。
①写出O2转变为O3的化学方程式 。
②O2的沸点比O3的 (填“高”或“低”)。
(3)制冷剂氟利昂(CFCl3)进入大气层后,在紫外线照射下所分解出的氯原子破坏臭氧层的反应历程如图2所示。
①请写出反应过程中物质类别属于氧化物的物质的化学式: 。
②研究表明:“少量的CFCl3就能对臭氧层产生巨大的影响”。请结合反应历程图简要解释该观点 。
12.磷酸铁锂电池正极材料主要包含磷酸铁锂(LiFePO4)、铝箔等战略性资源。从废磷酸铁锂电池正极材料中获取电池级Li2CO3和FePO4的流程如图所示:
已知:①LiFePO4在碱液中稳定存在。②2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑。
(1)“碱浸”前需将废铁锂电池放电并粉碎。
①“碱浸”时为加快浸出速率,除粉碎外还可进行的措施有 。(答一点)
②“碱浸”的目的是 。
(2)“酸浸”时的主要反应为2LiFePO4+H2SO4+H2O2=2FePO4+Li2SO4+2H2O。
①反应中铁元素的化合价 (填“升高”、“降低”或“不变”)。
②“酸浸”时的温度不宜过高,其原因可能为 。
③“酸浸”时pH对Fe、P沉淀率的影响如图1所示,为使Fe、Li分离,应调节溶液的pH范围为 。
(3)“沉锂”通过加入Na2CO3实现。Li2CO3的溶解度曲线如图-2所示。
①生成Li2CO3沉淀的化学方程式为 。
②反应时将温度升高至90℃的目的是 。(答一点)
13.CO2捕集包括CO2的吸收和解吸两个过程。将解吸所得的CO2转化为炭黑有助于实现碳中和。
(1)水、KOH溶液、CaO等都可作为CO2的捕集剂。以CaO为捕集剂的一种工艺如图1所示。
①写出以水为捕集剂时所得产物的化学式 。
②以CaO为捕集剂时捕捉室的温度一般控制在650℃,写出捕捉室发生的化学方程式 。
③将解吸室所得CaO投入捕捉室循环使用,其优点是 。
④选择捕集剂时需综合考虑吸收的效率和解吸的效率。因此衡量捕集剂的优劣,不仅需要比较捕集剂的成本、对环境的影响及捕集剂吸收CO2的快慢和多少外,还需要进行比较的因素为 。
(2)CO2转化为炭黑回收利用的反应机理如图2所示,其总反应方程式为CO2C+O2。
①总反应中的催化剂是 。
②过程I中CO2发生 (填“氧化”或“还原”)反应。
三、综合应用题
14.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可通过下列反应制备:FeSO4+Na2CO3=FeCO3+Na2SO4、FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O。
学习小组根据该原理,模拟制备柠檬酸亚铁。
(1)配制碳酸钠溶液。实验时需要100g溶质质量分数为10.6%的Na2CO3溶液。
①称量Na2CO3时出现了右盘低的现象,则接下来的操作是 。
②实验时量取蒸馏水所用量筒的规格为 (填“25”“50”或“100”)mL。
③配制过程中玻璃棒的作用是 。
(2)探究碳酸钠溶液的性质。
①实验一:蘸取Na2CO3溶液,点在pH试纸上, ,读出pH=11。
②实验二:取少量稀盐酸于试管中,滴加Na2CO3溶液,立即有大量气泡产生,写出反应的化学方程式: 。
③实验三:在密闭容器中,向一定量Na2CO3溶液中缓缓滴加稀盐酸,不断搅拌,利用pH传感器和CO2传感器,测得溶液的pH、容器中CO2气体的浓度随时间变化的曲线合并如图所示。则图中表示CO2浓度随时间变化的曲线是 (填“曲线1”或“曲线2”)。
(3)配制硫酸亚铁溶液。取少量FeSO4固体溶于水,加入少量铁粉,振荡。
【查阅资料】Fe2+易与氧气反应生成Fe3+;Fe2+遇KSCN溶液不显红色,Fe3+遇KSCN溶液显红色。
①溶解FeSO4固体所用的水在使用前必须要加热煮沸的目的是 。
②取少量新配制的FeSO4溶液于试管中,滴加几滴KSCN溶液,未变红色,说明溶液中不含 (填化学式)。
(4)制备柠檬酸亚铁晶体。
已知:①当溶液pH大于8.8时,Fe2+会完全生成Fe(OH)2沉淀。
②柠檬酸亚铁能溶于水,不溶于乙醇。
请补充完整制备柠檬酸亚铁的方案: ,待沉淀不再增加后过滤,将滤渣溶于足量的柠檬酸溶液中,充分反应后浓缩, ,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(实验中须使用的试剂:Na2CO3溶液、FeSO4溶液、无水乙醇)。
四、计算题
15.《周礼·考工记》中记载,古人曾在草木灰(含有K2CO3)的水溶液中加入贝壳烧成的灰(主要成分为CaO),利用生成物中能够去污的成分来洗涤丝帛。
(1)上述过程未涉及到的基本反应类型为 (填字母)。
a.化合反应 b.置换反应 c.复分解反应
(2)请你推测生成物中能够去污的成分,并说明理由 。
(3)反应K2CO3+H2SO4=K2SO4+H2O+CO2↑可用于测定草木灰样品中K2CO3的含量。取10.00g某草木灰样品加入烧杯中,缓慢加入足量稀硫酸,待反应结束后,共收集到0.88gCO2,求该草木灰样品中K2CO3的质量分数。 (请将计算过程写到答题纸上)
《2025年江苏省南通市启东市二模物理·化学试题-初中化学》参考答案
1.A
2.B
3.A
4.D
5.B 6.B
7.C
8.D
9.C
10.D
11.(1) 8 分子构成不同
(2) 3O22O3 低
(3) ClO、Cl2O2 反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响
12.(1) 适当提高浸出温度(或使用电动搅拌器、适当提高氢氧化钠的浓度等) 除去铝(或实现磷酸铁锂和铝的分离)
(2) 升高 温度过高使H2O2分解 2.0~3.0
(3) 提升沉淀反应速率/减小Li2CO3的溶解量,提高产率
13.(1) H2CO3 CaO+CO2CaCO3 降低成本,提高原料的利用率 捕集剂解吸CO2的效率(释放CO2的速率和程度)
(2) FeO 还原
14.(1) 向左盘中继续添加少量Na2CO3至天平平衡 100 搅拌
(2) 把试纸显示的颜色与标准比色卡比较 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 曲线1
(3) 除去溶解的氧气,防止Fe2+被氧化 Fe2(SO4)3
(4) 将Na2CO3溶液缓慢加入盛有FeSO4溶液的烧杯中 加入适量的无水乙醇
15.(1)b
(2)成分是KOH,氢氧化钙和碳酸钾发生复分解反应生成碳酸钙沉淀和KOH,KOH溶液是碱溶液,可以和油污反应
(3)解:设碳酸钾的质量为x。
解得:x=2.76g
该草木灰样品中K2CO3的质量分数是:
答: 该草木灰样品中K2CO3的质量分数为27.6%。
同课章节目录
